滇池浮游植物群落时空变化特征及影响因子分析
王东秀,李娅萍,王红梅,杨小珊
(云南省生态环境厅驻昆明市生态环境监测站,昆明 650228)
前 言
浮游植物是水环境监测的重要生物指示物种,对不同水环境具有特异适应性和敏感响应性,能对生态环境做出快速直接的响应[1~3],水温、光照、营养盐、水位等环境因子的变化也会直接或间接地影响浮游植物的群落结构和数量[4],研究浮游植物的群落特征及其与水环境因子的关系,能更全面地了解水生态系统状况。
滇池是云南省重要的淡水资源,也是昆明市沿湖地区唯一的纳污水体[5],1992年滇池首次暴发蓝藻水华并持续至今,水华已成为滇池污染的一大特征[6-7]。滇池是全国重点治理的“三湖”(巢湖、太湖、滇池)之一[8],近年来有很多关于太湖和巢湖浮游植物的研究报道[9~12],但针对滇池浮游植物群落结构的研究甚少。滇池属于宽浅型半封闭高原湖泊[13],与位于东部平原的太湖、巢湖在水华严重程度和治理难易程度有显著差异,已有研究表明滇池蓝藻细胞浓度常年高于太湖和巢湖,且复苏期和衰退期更短,而暴发期更长[14],暴发的水华规模和时空异质性大[15-16]。应用软件CANOCO分析物种变量和环境变量之间的关系是国内外研究的热点,但针对滇池水体浮游植物和环境因子的关系研究较匮乏。因此本研究在滇池全湖选择10个水质国控监测断面,于水华暴发期3~10月进行监测,并应用软件CANOCO 4.5对浮游植物数据和环境因子进行排序分析,旨在掌握滇池浮游植物的群落特征,揭示影响其演变的关键驱动因子,以期为治理滇池蓝藻水华提供新的思路。
1 材料与方法
1.1 研究区域与采样方法
滇池位于昆明主城下游,地处流域最低点,由北部的草海和南部的外海两个子湖组成,湖面面积分别占总面积的2.7%和97.3%,二者无水量流通。滇池海拔1 887.5 m,总面积311.338 km2,最大湖深11.3 m,湖泊所在区域属于典型的高原亚热带高原季风气候,常年主导西南风,干、湿季分明,雨季主要集中在5~10月,年无霜期为278 d。本研究根据滇池特殊的地理位置及地表水监测断面的布设原则[17],在滇池选取10个水质国控监测断面,分别是草海2个:断桥(D1)和草海中心(D2);外海8个:晖湾中(D3)、罗家营(D4)、观音山西(D5)、观音山中(D6)、观音山东(D7)、白鱼口(D8)、海口西(D9)与滇池南(D10),其中D3、D4位于滇池北岸,D5、D6、D7和D8位于湖央,D9和D10位于南岸(图1)。采样时间为2020年3、5、7及10月,每月月初各采集1次。

图1 滇池采样点示意图Fig.1 Sampling sites in Dianchi Lake
1.2 样品的采集及分析
浮游植物定性样品、定量样品的采集参照2002年《水和废水监测分析方法》(第四版,增补版)[18]。定性样品使用 25号浮游生物网采集;定量标本在水面下0.5 m水处采集,每升水样加入15mL鲁哥氏试剂固定,带回实验室经沉淀、浓缩或稀释、摇匀、超声打散处理后,在10×40倍光学显微镜下进行鉴定,记录浮游植物的种类和个数,并计算浮游植物细胞密度[19~21]。
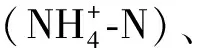
1.3 数据分析
1.3.1 浮游植物优势度和多样性指数计算
根据优势度指数(Y)判定浮游植物优势种[23],采用Shannon-Wiener指数(H)评价浮游植物群落的多样性[24]。
(1)
(2)
式(1)中ni为单个湖泊i物种的细胞数,N为单个湖泊所有物种的总细胞数,fi为i物种在单个湖泊出现的频率(本研究中fi= 1),物种优势度 Y≥0.02 定为优势种;式(2)中Pi为i物种在样品中的丰度概率,S为样品中浮游植物的种属总数。
1.3.2 统计分析
采用OriginPro9.0作图软件分析浮游植物群落结构、浮游植物细胞密度和Shannon-Wiener多样性指数的时空变化,采用SPSS17.0对浮游植物密度与环境因子之间进行Pearson相关性分析。
利用CANOCO 4.5软件对浮游植物、采样点与环境因子进行排序分析前,先对浮游植物数据进行去趋势对应分析(Detrended correspondence analysis,DCA),根据梯度长度的大小选择排序类型。如果四个轴中梯度最大值大于4,选择典范对应分析(Canonical correspondence analysis,CCA);如果小于3,选择冗余分析(Redundancy analysis,RDA);介于3~4 之间,可选择CCA或RDA进行分析[25]。
2 结果与分析
2.1 环境因子的时空变化
2020年滇池水体的主要环境因子在各季度的均值见表1。从总体上看,各项环境指标基本稳定,未发生大幅度变化。3月滇池的平均水温最低,为14.42℃,其余月份为20℃左右;滇池水质的pH常年较稳定,均显碱性。CODCr和BOD5均在5月最高,而DO、SD在5月最低,其余月份波动较小;滇池各监测点的TN、TP浓度分别为0.67~3.96mg/L、0.06~0.18 mg/L,显著高于国际认可的湖泊富营养化的临界值(TN:0.2mg/L;TP:0.02mg/L)[26],这表明滇池暴发全湖性水华具备充足的营养物质基础。
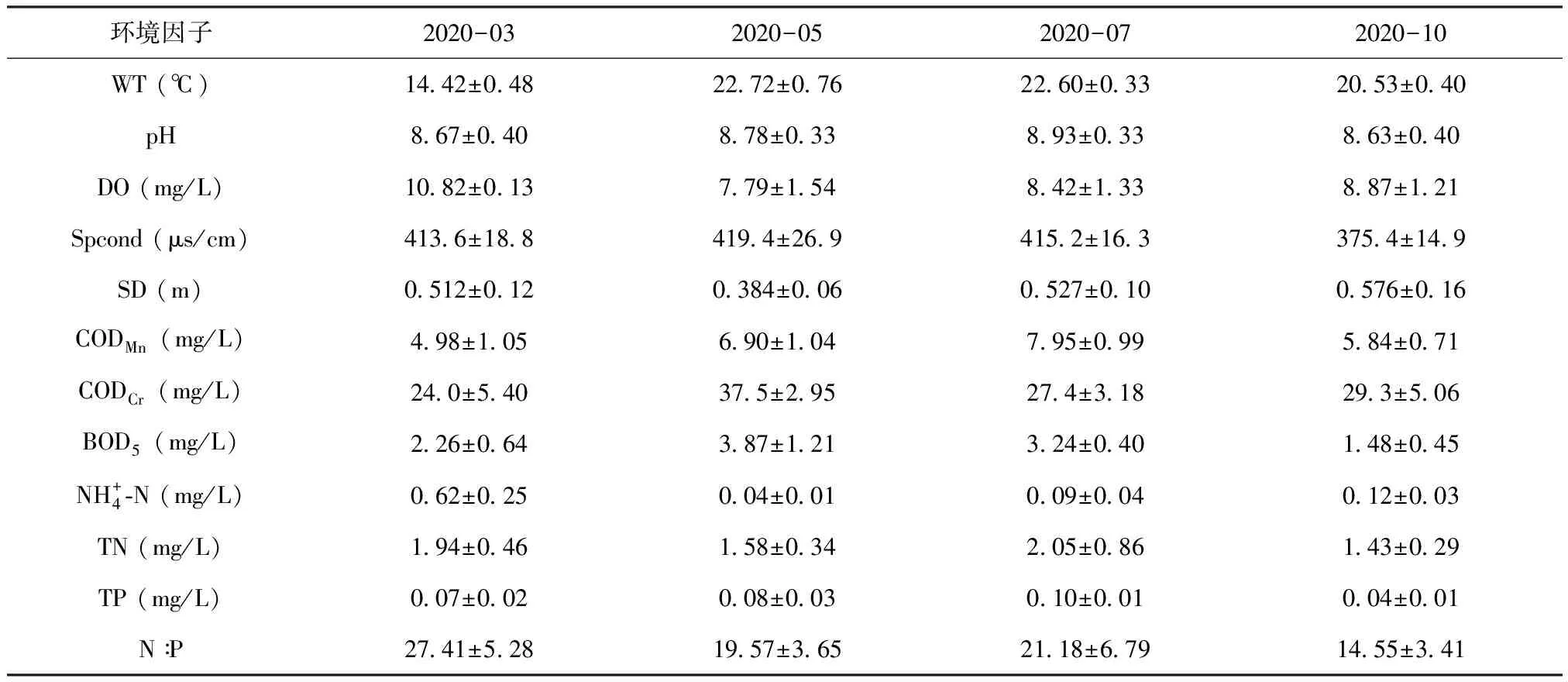
表1 滇池各环境因子在不同季度的均值Tab.1 Environmental factors in different seasons in Dianchi Lake
2.2 浮游植物群落结构的时空变化
2.2.1 浮游植物群落组成
采集的4批滇池藻类样品经显微观察及鉴定,共检出浮游植物8门42属,种类数排序为3月(7门36属)>5月(7门30属)>7月(5门25属)>10月(5门21属),详见图2。3月种类数最多说明滇池的大多数藻类在春季处于繁殖状态,随着气温的逐渐升高,具有竞争优势的藻类大量繁殖掩盖了其他藻类。物种丰富度上,绿藻门种类数最多,共有20属,占全部种属的47.62%;其次是蓝藻门,有9属,占21.43%;硅藻门7属,占16.67%;甲藻2属,占4.76%,金藻、裸藻、黄藻和隐藻各1属,各占2.38%。
图2 滇池浮游植物群落组成Fig.2 Phytoplankton community composition in Dianchi Lake
2.2.2 浮游植物优势种组成
各季度浮游植物的优势度指数(Y)排序为3月:微囊藻>色球藻>小环藻>隐藻;5月:微囊藻>色球藻>鱼腥藻>栅藻;7月:微囊藻>色球藻>假鱼腥藻>栅藻;10月:微囊藻>色球藻>栅藻>直链硅藻,见表2。可见,2020年滇池浮游植物优势种分布较稳定,微囊藻、色球藻、鱼腥藻、假鱼腥藻、栅藻、小环藻、隐藻占据较大优势。相比于之前的调查结果,浮游植物优势种类群无明显改变,以蓝藻门、绿藻门、隐藻门和硅藻门为优势种类群[27~29],但微囊藻占绝对优势的时间增加。王华等[30]于2013年对滇池浮游植物进行调查,结果显示3月滇池是栅藻占绝对优势,其余季节是微囊藻;冯秋园等[31]调查了滇池2015年全年和2016年春季的浮游植物,发现蓝藻门中的隐球藻在春季为优势种,其余季节是微囊藻占绝对优势。
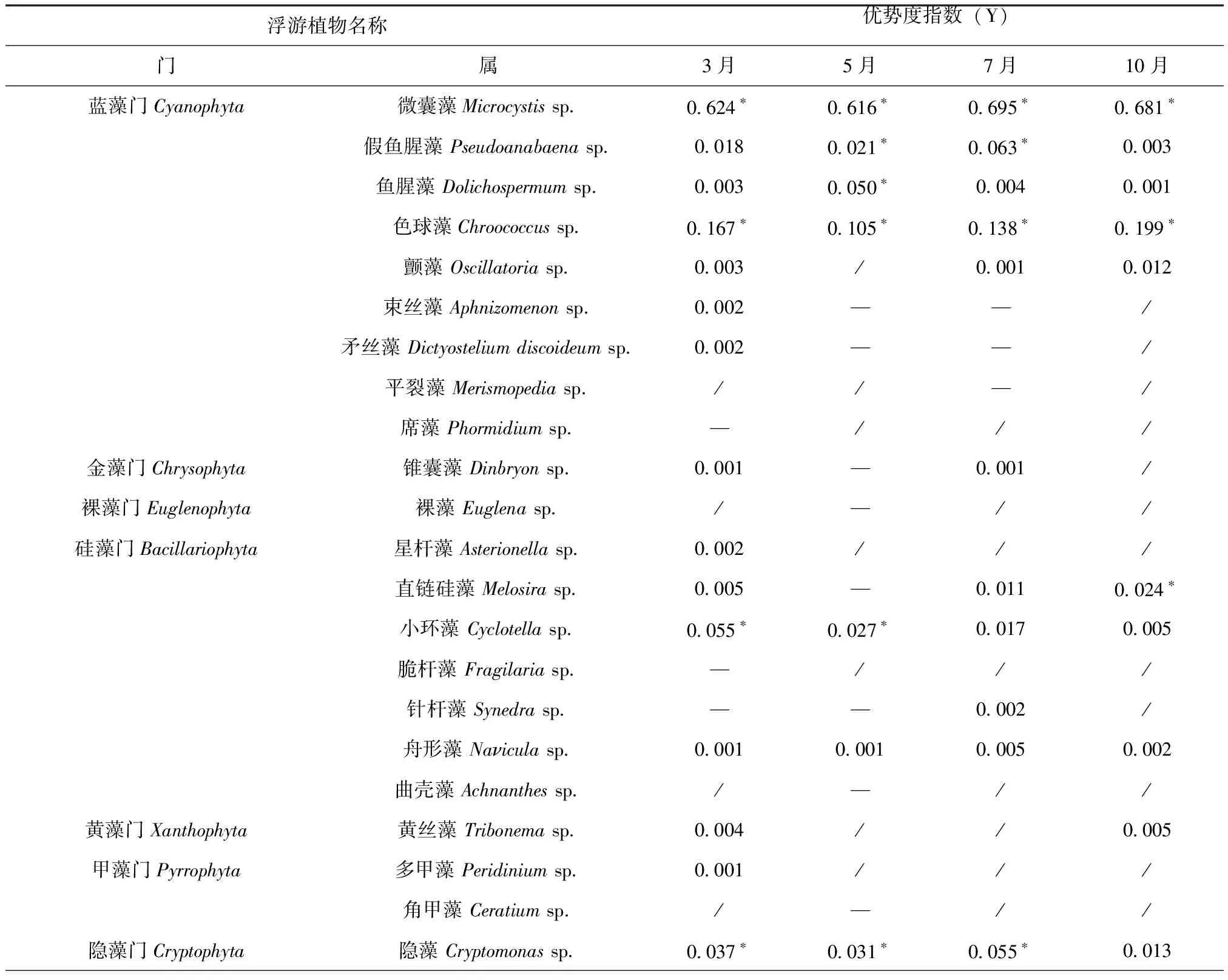
表2 滇池浮游植物优势种组成和优势度Tab.2 Composition and dominance of phytoplankton dominant species in Dianchi Lake

续表2
2.2.3 浮游植物细胞密度和物种多样性的时空变化
2020年滇池全湖浮游植物细胞密度年均值为8.57×107cells/L,范围在1.01×107~2.92×108cells/L之间,均属于中密度(106~107cells/L)或高密度(108cells/L及以上)样品[32]。在数量上,蓝藻门占绝对优势,年均值为7.31×107cells/L,占总细胞数的85.34%;其次是绿藻,年均值为6.18×106cells/L(占7.22%),然后是硅藻和隐藻,年均值分别为3.34×106cells/L(占3.90%)和2.83×106cells/L(占3.31%),金藻、甲藻、黄藻和裸藻的数量均较低,合计仅占总细胞数的0.23%,详见图3。可见滇池浮游植物群落结构的
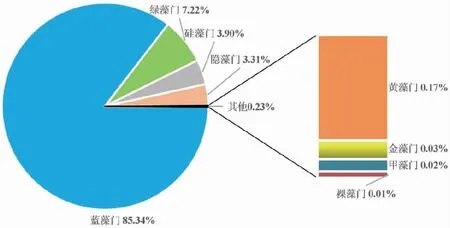
图3 滇池浮游植物各门类密度占比图Fig.3 Density ratios of phytoplankton in Dianchi Lake
特点为蓝藻数量多,甲藻、黄藻和金藻量少;绿藻门种类最多,但蓝藻门在数量上占绝对优势,根据优势种群法[33]可判断滇池的生态系统现状仍非常严峻。
从时间上看,浮游植物细胞密度排序为7月(1.47×108cells/L)>3月(8.80×107cells/L)>10月(5.60×107cells/L)>5月(5.12×107cells/L),详见图4。细胞密度峰值出现在7月,这与崔松云等[34]的研究结论一致。7月的降雨量较大,陆域的营养盐随雨水径流流入滇池,使滇池营养盐浓度升高,为浮游植物的生长提供了良好的营养物质基础,这是滇池水华暴发常出现于7月的重要原因之一。微囊藻密度在各季度的占比依次为61.21%、61.59%、69.40%、68.06%,可见在数量上微囊藻全年占绝对优势。就Shannon-Wiener 指数(H)而言,全年波动较小,最高的是3月,最低的是10月,其值分别为2.04和1.61。张梅等[35]对2001-2002年滇池浮游植物调查分析中发现,滇池浮游植物的Shannon-Wiener 指数(H)在0.789~2.097之间波动,峰值也是出现在3月。
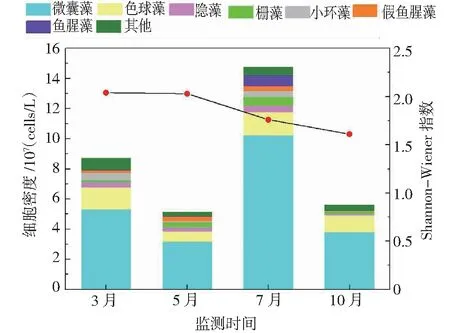
图4 浮游植物密度和Shannon-Wiener 多样性指数的时间变化Fig.4 Temporal variation of phytoplankton density and Shannon-Wiener diversity index
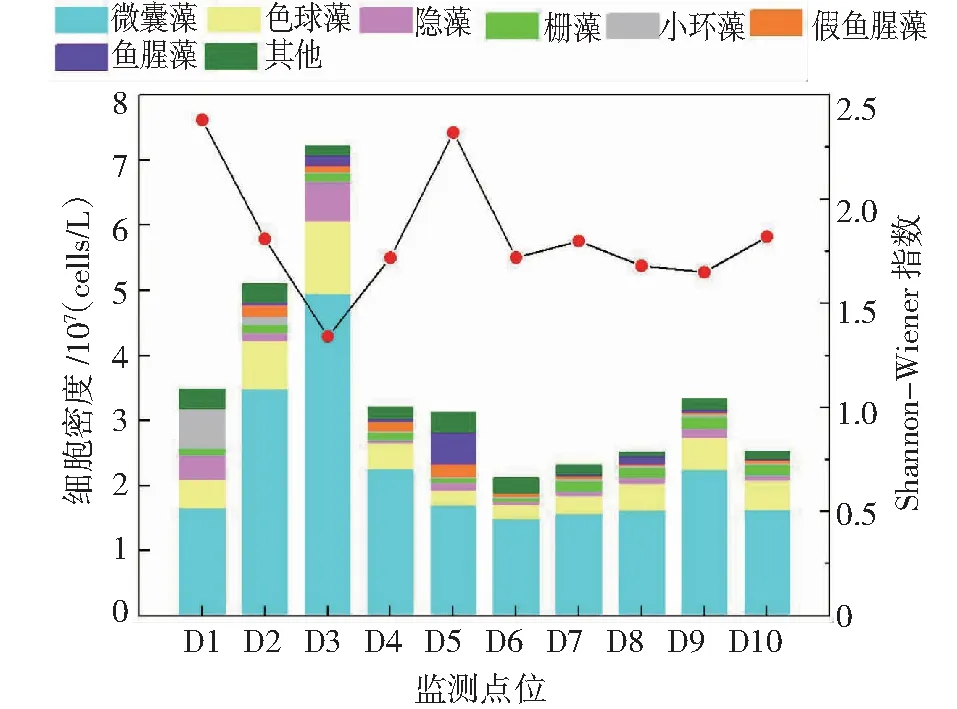
图5 浮游植物密度和Shannon-Wiener 多样性指数的空间变化Fig.5 Spatial variation of phytoplankton density and Shannon-Wiener diversity index
从空间尺度上分析,从北往南各监测点浮游植物密度呈先增加后降低,再增加再降低的“M”型变化趋势,浮游植物密度排序为北部>草海>南部>中部,见图5。草海和滇池北岸浮游植物密度较高,这主要与滇池北岸、草海毗邻昆明城区,富营养化程度高有关;此外滇池全年主导西南风,聚集于水体表层的藻类易随风向西南部漂移。物种数最多的是位于草海的D2监测点(7门29属),最少的是位于湖央的D6监测点(4门15属),从北往南各监测点的物种数呈显先降后升的波动性变化,且微囊藻密度在各监测点均最高,占比47.90%~74.30%。D6监测点位于湖中央,远离村庄及入湖口,污染程度低,所以浮游植物细胞密度最低、物种数最少。10个监测点的Shannon-Wiener 指数(H)在1.34~2.38之间,D1监测点多样性指数最高,为2.38;D3最低,为1.34。D3监测点位于西山脚下,风动力不足,藻类易富集于该区域,且该监测点临近大清河、海河、六甲宝象河、小清河的入湖口,入滇河道中丰富的有机物质为藻类的繁殖提供了丰富的营养基础,耐污藻类易大量繁殖,因此多样性较低。
2.3 浮游植物群落结构与环境因子的关系
2.3.1 Pearson 相关分析

表3 滇池环境因子与浮游植物密度的 Pearson 相关分析Tab.3 Pearson correlation analysis between environmental factors and phytoplankton density in Dianchi Lake
2.3.2 RDA排序分析

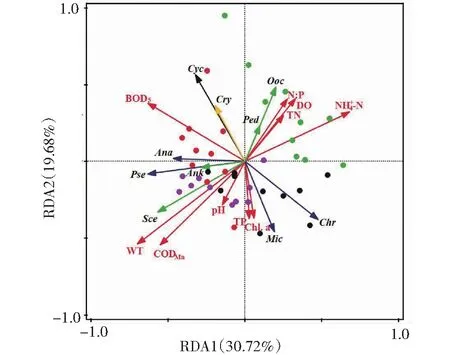
蓝藻门: Mic-微囊藻,Chr-色球藻,Pse-假鱼腥藻,Ana-鱼腥藻;绿藻门:Sce-栅藻,Ank-纤维藻,Ooc-卵囊藻,Ped-盘星藻;隐藻门:Cry-隐藻;硅藻门:Cyc-小环藻。圆点为不同时间的采样站点(绿色表示2020-03,红色表示2020-05, 紫色表示2020-07,黑色表示2020-10)。红色箭头表示环境因子,蓝色箭头表示蓝藻门藻类,绿色箭头表示绿藻门藻类,黑色箭头表示硅藻门藻类,黄色箭头表示隐藻门。图6 滇池浮游植物各物种的密度与 环境因子的RDA排序图Fig.6 RDA ordination diagram of phytoplankton density and environmental factors in Dianchi Lake
3 结 论
3.1 2020年,滇池共发现浮游植物8门42属,绿藻门种类数最多,蓝藻门细胞密度最高,是典型的蓝藻占绝对优势的蓝藻-绿藻型水体,主要优势种有微囊藻、色球藻、鱼腥藻、假鱼腥藻、栅藻、小环藻、隐藻,其中微囊藻在各季度的优势度指数最大。
3.2 2020年滇池浮游植物密度范围为1.01×107~2.92×108cells/L,其中7月最高,5月最低;空间上,草海和滇池北岸的藻密度高于其他湖区。各测点的物种多样性指数(H)也存在时空差异,时间上3月最高,10月最低;空间上,草海的断桥最高,滇池北岸的晖湾中最低。
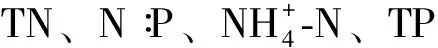
3.4 鉴于滇池浮游植物群落的显著时空异质性,建议对滇池分时间、分区域管理,对不同的生态区、不同的季节采取针对性的治理措施。氮、磷浓度对滇池浮游植物群落结构起决定性作用,因此需加大对滇池流域氮、磷负荷的削减,使湖体氮、磷浓度降低到能显著影响蓝藻生长的水平,以控制滇池蓝藻水华。

