早产小鼠肠道微生物群变化对外周血CD4+T 细胞协同刺激分子表达的影响①
陶雪花 秦道建 岳梦琦 方 玢 张士发 (皖南医学院第一附属医院儿科,芜湖 241001)
全球每年约有1 500 万早产儿出生,其中约有100 万死亡,其出生时免疫系统发育不成熟、适应性免疫“无经验”[1]。新生儿期存在肠道微生物失衡和免疫功能低下,此“窗口期”宿主和共栖微生物间适宜的交互作用遭到破坏可能导致持续性,甚至不可逆的T 淋巴细胞亚群发育缺陷[2-4]。研究表明,益生菌是活的非致病性微生物,给予一定数量的益生菌可有效调节早产儿肠道微生物平衡适应性免疫应答[5-6]。在适应性免疫应答中,识别抗原后的T、B 淋巴细胞在协同刺激分子的参与下发生活化、增殖和分化,从而产生相应的效应细胞、效应分子和记忆细胞,其中T 淋巴细胞介导的免疫应答在免疫系统的调节中具有重要作用[7]。正性共刺激分子CD28和可诱导的协同刺激分子(inducible co-stimulator,ICOS,CD278)为T 细胞提供强烈的共刺激信号;负性共刺激分子B、T 淋巴细胞衰减分子(B and T lymphocyte attenuator,BTLA,CD272)、细胞毒性 T 淋巴细胞相关蛋白-4(cytotoxic T lymphocyte associated protein 4,CTLA-4,CD152)、程序性细胞死亡-1(programmed death-1,PD-1,CD279)通过抑制细胞因子介导的增殖、限制T 细胞存活、促进程序性T 细胞死亡或诱导适应性调节性T 细胞来下调T 细胞反应,它们都属于CD28 受体基因家族[8]。课题组的既往研究发现,早期补充酪酸菌和双歧杆菌复合剂可有效促进晚期早产儿新生儿期外周血CD4+T 细胞的增殖、分化,且 CD4+T 细胞表面 CD272 表达增高[9]。T 细胞表面表达 CD152、CD279、CD28 和 CD278,CD28 以较高浓度存在于T 细胞表面,CD152 和CD279 多在活化后的 T 细胞上表达[10-11]。CD272 中的免疫受体氨基酸抑制基序表明了CD272 抑制性受体的功能[12]。这些正信号和负信号间的平衡决定了T 细胞反应的幅度和水平,刺激和抑制信号的失衡可导致异常免疫应答[13]。在早产儿免疫系统发育和成熟过程中,CD4+T 细胞表面表达何种协同刺激分子可能受肠道定植微生物群的影响,现阶段尚不明确,本研究拟通过建立早产小鼠模型,应用酪酸菌和双歧杆菌复合剂调节早产小鼠肠道微生物群的定植,初步探讨早产小鼠肠道定植微生物群的丰富度、多样性及物种丰度改变对外周血CD4+T细胞协同刺激因子 CD28、CD278、CD152、CD279、CD272表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄健康成年SPF级BALB/c雌、雄小鼠,体质量18~22 g,由江苏常州卡文斯实验动物有限公司提供,许可证号:SCXK(苏)2016-0010,合格证编号:202016816。饲养于皖南医学院第一附属医院中心实验室SPF 级动物房,IVC 系统,自由进食、饮水。
1.1.2 主要试剂 米菲司酮(RU486,北京紫竹药业有限公司);常乐康(酪酸梭菌活菌数1.0×107CFU/ml、双歧杆菌 1.0×106CFU/ml,山东科兴生物制品公司);小鼠红细胞裂解液(BL503A,Biosharp公司);FITC Hamster Anti-mouse CD3e、PE-CYTM5Rat Anti-Mouse CD4、PE-CYTM7Rat Anti-Mouse CD8a 及PE Hamster Anti-mouse CD28、CD278、CD279(美国BD PharmingenTM公司);PE Anti-Mouse CD152、CD272(美国eBioscience公司)。
1.2 方法
1.2.1 动物模型的建立及分组 参照文献[14],随机选择雌、雄小鼠采用2∶1 配对饲养,傍晚合笼,次晨分笼,随机选择孕18 d 的小鼠,腹腔一次性注射米非司酮(剂量0.15 mg/kg,提前溶于蓖麻油中)诱导早产,获得胎龄小于20 d 的崽鼠为早产新生小鼠,随机分为早产组和实验组,每组6 只;其余孕鼠不进行干预,待其自然分娩,获得胎龄大于20 d 的仔鼠为足月新生小鼠,随机选取6 只为足月组。各组新生小鼠返回母鼠身边常规饲养,仅实验组于出生后第 1 天(postnatal day 1,P1)口服给予常乐康,2次/d,每次10 ml/kg,连用21 d[15]。
1.2.2 标本制备 按照实验设计,各组小鼠于P7、P14 分别取外周血 0.1 ml,EDTA-K2抗凝备用;至P21,各组小鼠取外周血后,于75%乙醇中浸泡20 min,无菌剖腹,提取空肠、回肠及结肠内粪便(主要以结肠内粪便为主)于5 ml 灭菌EP 管中,石蜡封口膜封口,迅速转移至液氮瓶中速冻,24 h 后取出,放入-80 ℃冰箱中保存。以上所有操作均在无菌通风橱及酒精灯旁完成,所有器械均进行灭菌处理。
1.2.3 检测指标 ①肠道微生物分类、丰度和多样性:采用高通量测序系统(BGISEQ-500),粪便标本提取细菌总DNA 后,对细菌的16S rRNA 基因进行高通量测序,将测序结果进行生物信息学分析。通过 Illumina 平台(Hiseq 或者 Miseq)进行 Pairedend测序,去除低质量reads,获得Clean Data,使用软件 FLASH[2](Fast Length Adjustment of Short reads,v1.2.11)进行序列拼接,得到高变区的Tags。利用软件 USEARCH(v7.0.1090)将拼接好的Tags 聚类为OTU,得到OTU 代表序列后,通过RDP classifer(v2.2)软件将OTU 代表序列与数据库比对进行物种注释,置信度阈值设置为0.8(武汉华大基因科技有限公司高通量测序实验室协助完成);②协同刺激因子:采用Beckman Coulter FC500 型流式细胞仪及 Epics Software 检测 CD28、CD278、CD152、CD279及CD272 阳性辅助性T 淋巴细胞(T helper lympho-cyte,Th;CD3+CD4+)百分比及其在CD3+CD4+T 细胞表面表达的平均荧光强度(MFI)。所有实验严格按照操作说明进行。
1.3 统计学分析 所有实验除非另外注明,否则都进行3 次独立实验。使用SPSS10.0 软件对数据进行统计学分析,正态分布的计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用SNK 检验。Alpha 多样性指数和不同物种所占的比例均以均数和标准差表示,三组间比较采用Kruskal-Wallis检验。P<0.05表示差异有统计学意义。
2 结果
2.1 三组新生小鼠P21肠道菌群Alpha多样性 实验组和足月组小鼠肠道菌群Alpha 多样性Sobs、Chao、Ace、Ahannon 指数均高于早产组,Simpson 指数明显低于早产组,且在三组间比较差异均有统计学意义(P<0.05);表明足月组和实验组肠道菌群的丰富度和多样性高于早产组(表1)。
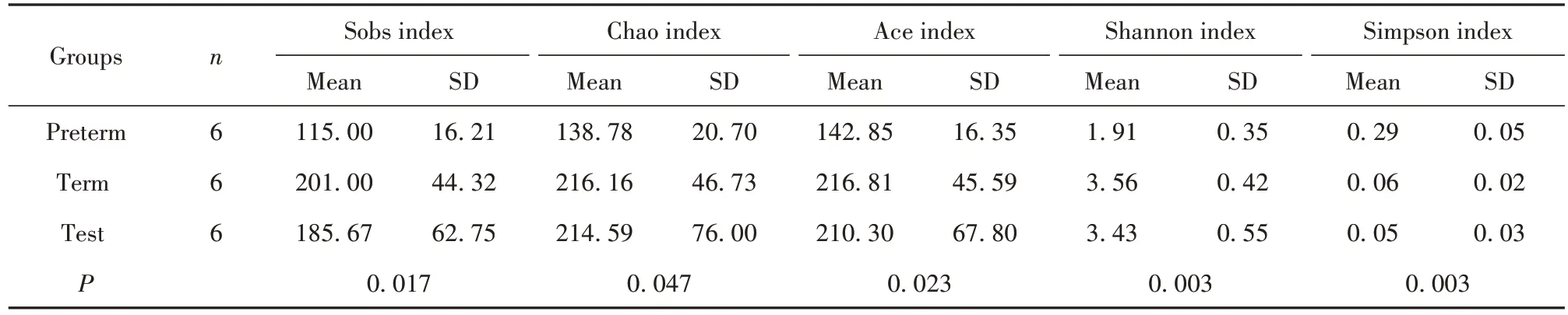
表1 新生小鼠P21肠道菌群Alpha多样性分析Tab.1 Alpha diversity analysis of intestinal flora of newborn mice P21
2.2 三组新生小鼠P21 肠道物种分类学属水平P21,三组间属水平差异有统计学意义(P<0.05)的菌属共24属(图1)。
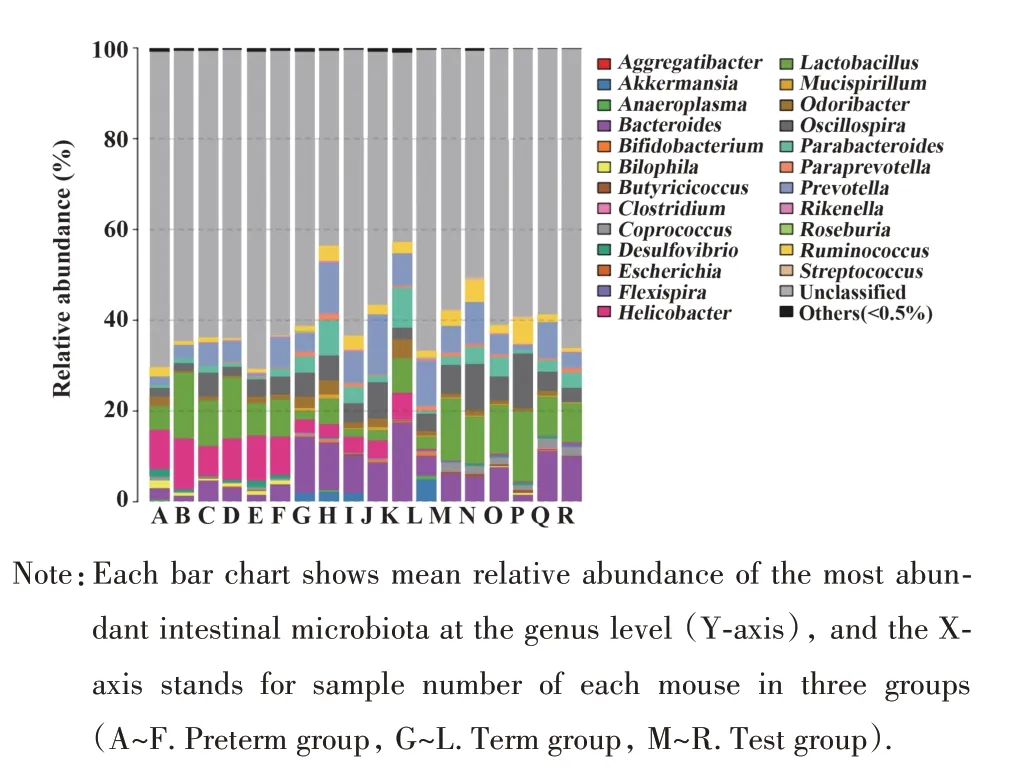
图1 三组新生小鼠在P21肠道菌群属水平的丰度Fig.1 Abundance of P21 intestinal flora among three groups of newborn mice
2.3 各组新生小鼠外周血CD4+T 细胞共刺激分子表达 P7,实验组CD4+CD28+T 细胞百分比明显低于早产组,差异有统计学意义(P<0.05),和足月组比较差异无统计学意义(P>0.05);CD4+CD278+T 细胞百分比明显高于早产组,差异有统计学意义(P<0.05),和足月组比较差异无统计学意义(P>0.05);CD4+CD152+及CD4+CD272+T 细胞百分比低于早产组和足月组,CD4+CD279+T 细胞百分比明显高于早产组和足月组,差异均有统计学意义(P<0.05);CD4+T 细胞表达的 CD28、CD278、CD152、CD279 及CD272 MFI 在三组间比较差异均无统计学意义(P>0.05)。P14,实验组 CD4+CD28+T 细胞百分比显著高于早产组和足月组,差异均有统计学意义(P<0.05);CD4+CD278+T 细胞百分比低于足月组,差异有统计学意义(P<0.05),和早产组比较差异无统计学意义(P>0.05);CD4+CD152+及CD4+CD279+T 细胞百分比显著高于早产组和足月组,而CD4+CD272+T细胞百分比低于早产组和足月组,差异均有统计学意义(P<0.05);CD4+T 细胞表达的 CD28、CD279 MFI 显著高于早产组和足月组,差异均有统计学意义(P<0.05),CD272 MFI 低于早产组,差异均有统计学意义(P<0.05)。而CD278、CD152 MFI 在三组间比较差异均无统计学意义(P>0.05)。P21,实验组CD4+CD28+T 细胞百分比显著高于早产组,差异有统计学意义(P<0.05),同足月组比较差异无统计学意义(P>0.05);CD4+CD278+T 细胞百分比在三组间比较差异无统计学意义(P>0.05);CD4+CD152+T细胞百分比和早产组比较差异无统计意义(P>0.05),但均高于足月组,差异有统计学意义(P<0.05);CD4+CD279+T细胞的百分比低于早产组和足月组,差异有统计学意义(P<0.05);CD4+CD272+T细胞百分比高于早产组,差异有统计学意义(P<0.05)。CD4+T 细胞表达的 CD28、CD272 MFI 高于早产组和足月组,差异均有统计学意义(P<0.05),CD279 MFI 低于早产组和足月组,差异均有统计学意义(P<0.05);CD152 MFI 和早产组比较差异无统计意义(P>0.05),但高于足月组,差异有统计学意义(P<0.05),CD278 MFI 在三组间比较差异均无统计学意义(P>0.05)。表明酪酸梭菌、双歧杆菌二联活菌对早产鼠外周血CD4+T细胞共刺激分子表达的影响和益生菌使用的时间密切相关(图2)。
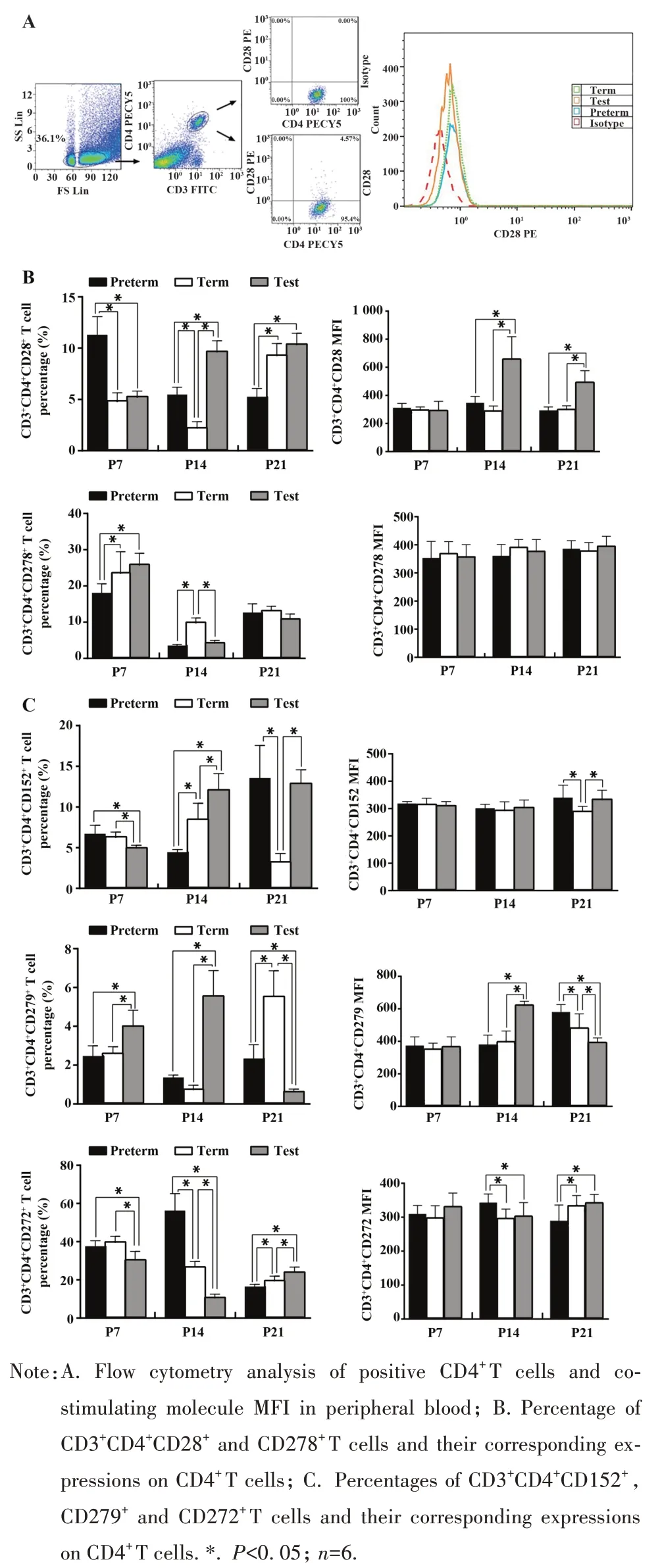
图2 各组小鼠外周血CD4+T细胞共刺激分子表达Fig.2 Expressions of co-stimulating molecules in CD4+T cells in peripheral blood of mice in each group
3 讨论
新生儿出生后肠道最初定植的第一种微生物是由其所暴露环境中细菌机会性定植产生的,而早产儿受出生后时间、胎龄、出生体重、环境和营养等因素影响,早期肠道定植共栖微生物不稳定,肠球菌属和双歧杆菌属等厌氧菌的定植被延迟,且定植物中的数量、丰度和多样性等明显低于足月儿,如此异常肠道定植可能影响早产儿近期和远期的免疫功能[16-19]。长双歧杆菌可有效促进健康足月新生儿肠道菌群的建立,补充长双歧杆菌可有效提高健康新生儿肠道双歧杆菌数及与肠杆菌的比值[19]。本研究结果也证实:补充酪酸梭菌、双歧杆菌二联活菌可有效改善早产小鼠肠道定植微生物群的丰富度、多样性及物种丰度,尤其增加肠道益生菌的定植。
多项研究表明,肠道定植的共栖微生物群强烈影响宿主的免疫系统,出生后第1 年肠道微生物群的成熟程度是决定宿主后期是否发生免疫介导性疾病的关键因素[2,4,20]。T 淋巴细胞,尤其是 CD4+T细胞,不仅参与适应性免疫应答(包括体液和细胞介导的)的调节,其在固有免疫应答的调控中也发挥至关重要的作用,因此通常作为总体免疫功能的标记。新生儿,特别是早产儿出生后CD4+T 细胞活化能力较低且持续时间较长[7]。T 细胞活化依赖于双信号,第一信号源于T 细胞受体(TCR)和主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ、Ⅱ类分子提呈抗原肽的特异性结合,其中抗原递呈细胞(antigen-presenting cell,APC)与 T 细胞表面多对协同刺激分子相互作用产生T细胞活化的第二信号在适应性免疫应答中具有重要作用,可有效调节T细胞适度的免疫应答[13]。
本研究结果发现,早产小鼠连续使用酪酸梭菌、双歧杆菌二联活菌可导致多种共刺激因子表达水平的改变。外周血CD3+CD4+CD28+T 细胞百分比在7 d 时显著低于早产组(P<0.05),在14 d 和21 d时显著高于早产组(P<0.05),均高于足月组(仅14 d 时P<0.05);CD3+CD4+T 细胞表面 CD28 的表达在7 d 时差异无统计学意义,在14 d 和21 d 时显著高于早产组和实验组(P<0.05)。外周血CD3+CD4+CD278+T 细胞百分比在7 d 时高于早产组和足月组(P<0.05),14 d 时低于足月组(P<0.05),但与早产组相比差异无统计学意义,21 d 时三组间比较差异无统计学意义;CD3+CD4+T 细胞表面CD278 的表达在7 d、14 d 和21 d 时三组间差异均无统计学意义。外周血CD3+CD4+CD152+T 细胞百分比在7 d 时低于早产组和足月组(P<0.05),14 d 时高于早产组和实验组(P<0.05),21 d 时显著高于足月组(P<0.05),但与早产组相比差异无统计学意义;CD3+CD4+T 细胞表面CD152 的表达在7 d 和14 d 时三组间差异均无统计学意义,21 d 时高于足月组(P<0.05)。外周血 CD3+CD4+CD279+T 细胞百分比在 7 d 和 14 d 时高于早产组和足月组(P<0.05),21 d 时显著低于早产组和足月组(P<0.05);CD3+CD4+T 细胞表面CD279的表达在7 d时三组间差异无统计学意义,14 d时高于早产组和足月组(P<0.05),21 d 低于早产组和足月组(P<0.05)。外周血CD3+CD4+CD272+T 细胞百分比在7 d 和14 d 时均低于早产组和足月组(P<0.05),21 d 时高于早产组和足月组(P<0.05);CD3+CD4+T 细胞表面CD272 的表达在7 d 时三组间差异无统计学意义,14 d 时低于早产组(P<0.05),21 d 时高于早产组(P<0.05)。表明早产小鼠肠道定植微生物群丰富度、多样性及物种丰度的改变在早期主要通过上调CD4+T 细胞共刺激分子CD28、CD279 和下调CD272 表达,在晚期主要通过上调CD4+T 细胞共刺激分子 CD28、CD272 和下调 CD272表达发挥免疫调控作用。
正性共刺激分子CD28 是免疫球蛋白超家族成员,表达于啮齿动物所有T细胞,在人类外周血绝大多数CD4+T 和半数CD8+T 表面均有表达,是T 细胞介导的适应性免疫应答中至关重要的共刺激分子。CD28 和 APC 表面 CD80(B7-1)、CD86(B7-2)配体相互作用产生的共刺激信号可有效防止异常(抗自身)免疫,触发必要的(抗菌)免疫应答,缺乏该信号可能导致 T 细胞无能[21]。此外,CD28 促进 IL-2 基因转录、增强IL-2 mRNA 的稳定性,促进IL-2 的合成、分泌以诱导T 细胞增殖和分化及IFN-γ 的产生,避免发生 Th2 免疫应答偏移[22]。KUMAR 等[23]应用动物模型研究发现,支气管肺发育不良(bronchopulmonary dysplasia,BPD)早产小鼠肺组织CD3+CD4+T 细胞表面CD28 表达显著下调。PD-1(CD279)是CD28家族成员,主要表达于活化的CD3+CD4+、CD8+T 细胞表面、B 细胞、NK 细胞、单核细胞及一些树突状细胞(dendritic cell,DC)亚群,与其相应配体 PD-L1(B7-H1,CD274)、PD-L2(B7-DC,CD273)相互作用产生抑制信号维持免疫耐受、抑制自身免疫应答(防止T 细胞极度活化)[24]。现阶段研究发现,脓毒性休克早产儿表达PD-1 的单核细胞的百分比和绝对计数显著增高,调节和/或暂时抑制PD-1 受体可能会为治疗严重感染性疾病如新生儿败血症提供新的治疗方法[25]。BTLA(CD272)是一种含糖蛋白结构域的免疫球蛋白,属免疫球蛋白超家族成员,在T 细胞、静息的B 细胞、巨噬细胞、DC 及少数NK细胞均有表达。T细胞表达的BTLA 和APCs表面的疱疹病毒进入中介体(herpes virus entry mediator,HVEM)相互作用产生抑制信号,抑制T 细胞增殖和细胞因子产生,和正性共刺激分子共同作用可有效调节适度的免疫应答。BTLA 缺陷可导致自身免疫性疾病,高表达时导致免疫耐受[13,26]。BTLA 在固有和适应性免疫应答中发挥不同功能,研究发现,败血症早期阶段低CD3+CD4+CD272+T 细胞百分比与败血症严重程度和死亡率密切相关[27]。BTLA-/-小鼠易发生自身免疫性疾病,如实验性自身免疫性脑脊髓炎[28]。
总之,本研究初步表明酪酸梭菌、双歧杆菌二联活菌可有效改善早产小鼠肠道定植微生物群丰富度、多样性及物种丰度;肠道定植微生物群丰富度、多样性及物种丰度的改变在不同时期可能通过上调/下调 CD4+T 细胞共刺激分子 CD28、CD272 和CD279 表达,在早产小鼠免疫系统的发育和成熟中发挥重要作用。

