不同扫描方式对CCTA人工智能重建与分析的影响
耿纪刚,李笑石,朱寅虎,金大永,李馨,张巍琪,秦越
1.西安大兴医院 影像科,陕西 西安 710016;2.空军军医大学附属西京医院 影像科,陕西 西安 710032
引言
冠状动脉CT 血管成像(Coronary Computed Tomography Angiography,CCTA)是螺旋CT技术领域最主要的研究方向之一,随着宽体探测器的问世,容积扫描心动周期冻结技术在CCTA领域得以应用[1-2]。大量研究表明,容积扫描可以在更低剂量的条件下获得相同质量的图像,并且在实际临床应用中装备了宽体探测器的CT在进行CCTA时也首选容积扫描模式[3-5]。
随着医学人工智能(Artificial Intelligence,AI)影像学的发展,深度学习卷积神经网络和数字原始图像识别等技术得以应用于复杂且数据量较大的CCTA后处理中,AI借助大数据平台工具成为影像科医生进行CCTA辅助诊断和图像分析的重要助手[6]。而应用AI技术提升图像质量、降低误判率和提高诊断时间的研究也有越来越多[7]。但是影响AI进行心血管处理结果准确性的因素较多,各大软件厂商的处理平台与重建算法的差异也较大[8],目前业内比较主流的观点是,CCTA检查中AI重建图像质量会因运动伪影(包括心律和呼吸)、底层数据采集方式和重建算法不同而存在差异[9-10]。本研究通过对比容积扫描与螺旋扫描两种方式下不同心率组CCTA检查的AI重建图像质量,旨在探究不同扫描方式对于AI重建质量的影响。
1 材料与方法
1.1 临床资料
选取2020年11月至2021年11月在我院进行CCTA检查的患者100例作为研究对象,其中男性55例(61.11%),女性35例(38.89%);年龄37~72岁,平均年龄(51.30±5.61)岁;体质指数(Body Mass Index,BMI)21.12~30.51 kg/m2,平均BMI(2.11±4.21)kg/m2,患者按扫描方式不同分为两组,将容积扫描纳入A组,螺旋扫描纳入B组,每组50例。A组和B组再按照心率将每组分为两个亚组:心率≤75次/min为A1组(33例)、B1组(35例),心率>75次/min为A2组(17例)、B2组(15例)。其中A组中男性22例(73.30%),女性8例(16.70%);年龄39~78岁,平均年龄(53.91±5.10)岁;BMI 21.31~27.61 kg/m2,平均BMI(21.39±3.21)kg/m2。B组男性20例(66.70%),女性10例(33.30%);年龄42~79岁,平均年龄(57.32±4.55)岁;BMI 22.01~30.51 kg/m2,平均BMI(23.32±3.31)kg/m2。所有患者扫描前均自愿签署造影剂知情同意书。纳入标准:符合CTA检查标准的患者;无CT检查禁忌证的患者;对碘造影剂无过敏反应的患者;双手可举过头顶的患者。排除标准:严重心、肺、肾功能不全的患者;意识不清、无法进行呼吸配合的患者;进行过冠状动脉搭桥手术后复查或心律波动较大的患者。
1.2 方法
两组均采用佳能医疗系统320排宽体探测器CT(Aquilion ONE,Canon Medical System,日本),患者取仰卧位,双上肢上举交叉,头先进,扫描范围从胸廓入口处至膈肌下1.0 cm处,扫描方向从头至足侧,采用100 kV管电压,管电流采用智能毫安由系统自动设置,调节范围120~900 mA,重建技术采用3D自适应迭代重建技术(Adaptive Iterative Dose Reduction 3D,AIDR 3D),重建迭代比例为ARDR 3D(Adaptive Iterative Dose Reduction 3D,AIDR 3D)50%,造影剂采用GE制药公司的350 mg/L碘克沙醇,流速5.0 mL/s,对比剂使用量50~80 mL,两组图像扫描后将层厚0.625 mm的薄层数据至数坤人工后处理工作站进行分析。
(1)A组采用容积扫描。足先进,扫描范围从气管分叉处至膈肌下1.0 cm处,扫描方向从头至足侧,降主动脉设置兴趣区(Region of Interest,ROI)进行监测,触发阈值为220 HU,呼吸指令根据心率调整,范围为13~15 s,达到阈值后延迟即刻开始扫描,设置前瞻性心电门控,SD=28,球管转速 0.275 s/圈,层厚 0.5 mm,层间距 0.35 mm。
(2)B组采用螺旋扫描。足先进,扫描范围从气管分叉处至膈肌下1.0 cm处,扫描方向从头至足侧,在升主动脉设置兴趣区进行监测,触发阈值为120 HU,达到阈值后延迟5 s开始扫描,前瞻性心电门控,固定螺距比1.49/14.9,SD=28,球管转速0.275 s/圈,探测器组合设置0.5 mm×100 mm,层厚0.5 mm,层间距0.35 mm。
1.3 图像后处理
所有原始数据传送至数坤Coronary Doc(版本1711.1711)AI工作站进行后处理,采用基于深度学习的卷积神经网络算法,用复合的2D与3D模型提取血管不同特征,运用模型进行动静脉分离、血管断裂连接进行pixel level精确提取及分隔结果优化,生成冠状动脉容积再现成像(Volume Rendering,VR)、多平面重建图像(Multi-Planner Reformation,MPR)、曲面重建图像(Curved Plannar Reconstruction,CPR)以及最大密度投影图像(Maximal Intensity Projection,MIP)。
1.4 图像质量评价
1.4.1 主观图像质量评价
(1)VR主观图像质量评价。AI后处理工作站会自动重建出正中位置心脏与冠状动脉的VR三维模型,心脏血池用红色(标号ff0033),冠状动脉用黄色(标号ffcc00)进行重建,重建完成后的VR模型可以自由旋转、放大和调整颜色。
(2)CPR主观图像质量评价。AI冠状动脉工作站会自动识别冠状动脉分支并给予命名与分段,根据美国心脏病协会(American Heart Association,AHA)推荐的 18 段分段法[11],将每组患者冠状动脉按照相同协议进行分段,其中血管闭塞及远端不计入统计。
VR与CPR图像质量均采用Likert4评分法[12]进行打分,由两名高年资影像科医师采用双盲法对所有节段的图像质量进行分级评价,如果出现分歧则由第3名医师进行判断。具体评价标准如下:1级:血管无伪影和中断,边界清晰;2级:血管有轻度伪影,边界轻微模糊;3级:血管有中度伪影,节段连续;4级:血管管腔及管壁显示不清,走行连续性中断,出现阶梯状伪影。1~3级的图像可以满足临床诊断需求,4级为无法完成临床诊断。
1.4.2 客观图像质量评价
选取冠状动脉右冠近段距离开口1 cm处、右冠中段、前降支左主干距离血管开口1 cm处、前降支中段、前降支远段,回旋支近段6个ROI,每个ROI直径5 mm,测量以下数值:CT值、同层面肌肉标准差(Standard Deviation,SD),并计算信噪比(Signal Noise Ratio,SNR)。
1.5 辐射剂量统计
记录两组患者检查时所接受的容积剂量指数(Volume Computed Tomography Dose Index,CTDIvol)和剂量长度乘积(Dose Length Product,DLP),根据结果计算有效剂量(Effective Dose,ED)。
1.6 统计学分析
所有数据采用SPSS 26.0软件包进行统计分析。所有测量数据均采用±s表示。主观统计评价一致性采用Kappa检验。符合正态分布的连续变量采用t检验,不符合正态分布的连续变量比较采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 VR图像主观评价
在冠状动脉VR三维模型中,A组与B组图像主观质量评价无显著差异,见图1~2。A组能满足临床诊断(1~3级)的有46例(A1组32例,A2组14例),B组能满足临床诊断(1~3级)的有47例全(B1组34例,B2组13例)。A组和B组及高、低心率亚组VR图像主观评价比较无统计学差异(P>0.05),见表1。
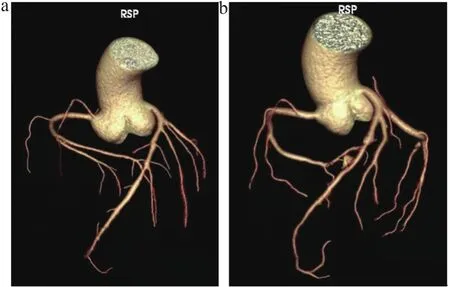
图1 A1组和B1组冠状动脉VR图像

图2 A2组和B2组冠状动脉VR图像
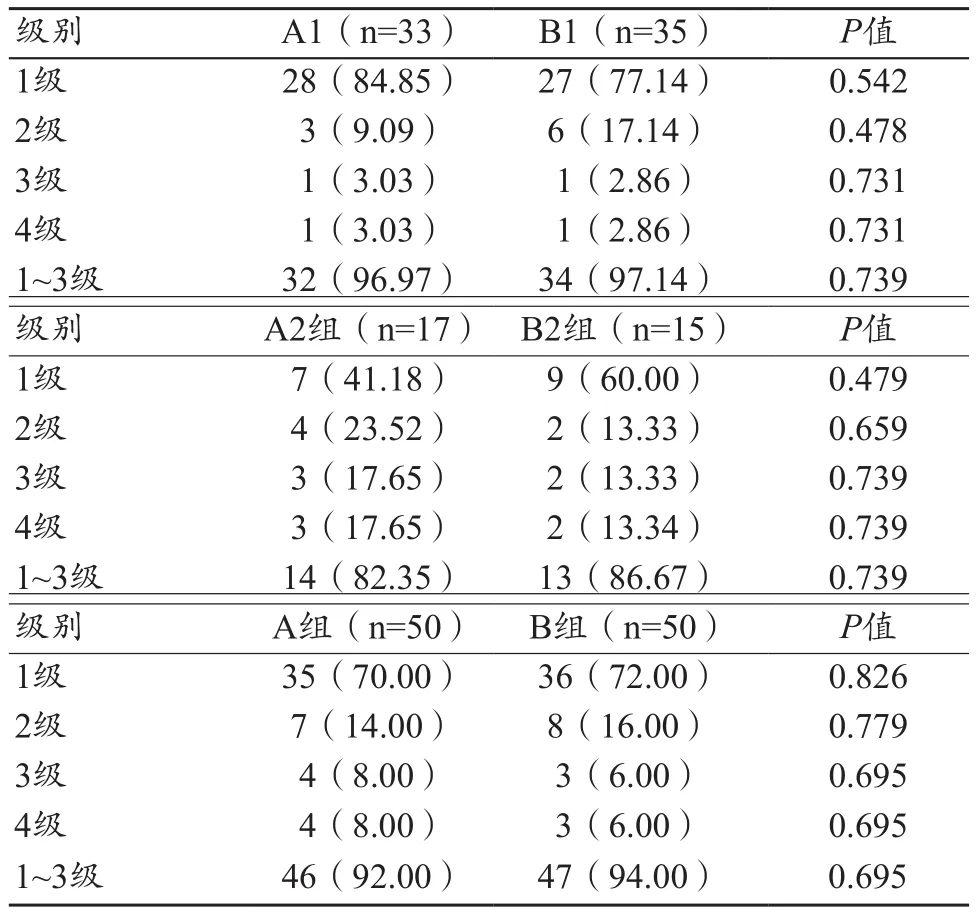
表1 VR主观图像质量评价[n(%)]
2.2 CPR图像主观质量评价
A组和B组共识别出1800段冠状动脉血管,其中A1组594段,A2组306段,B1组630段,B2组270段。A组和B组图像中,可以满足诊断需求(1~3级)的冠状动脉数量分别为818根(92.00%)与813根(90.33%),两组主观图像质量无统计学差异(P<0.05)。在不同心率亚组的对比中,A1组与B1组可以满足诊断需求(1~3级)的图像比较无统计学差异(P>0.05),见图3~4和表2。
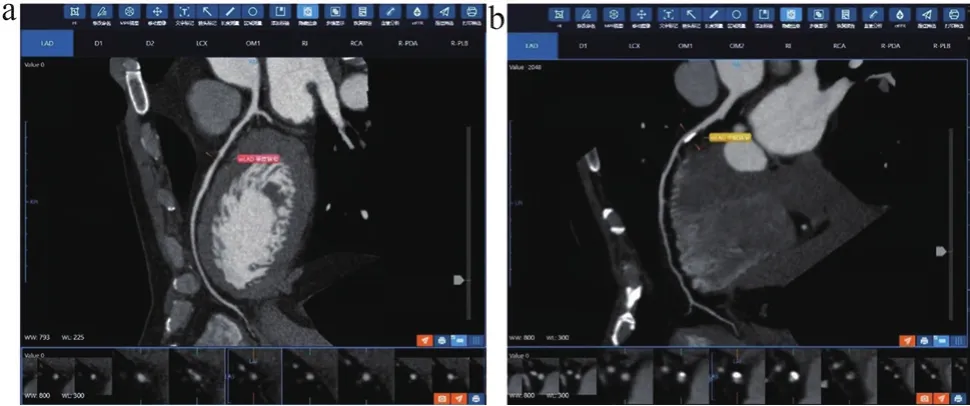
图3 A1组和B1组冠状动脉CPR图像

图4 A2组和B2组冠状动脉CPR图像
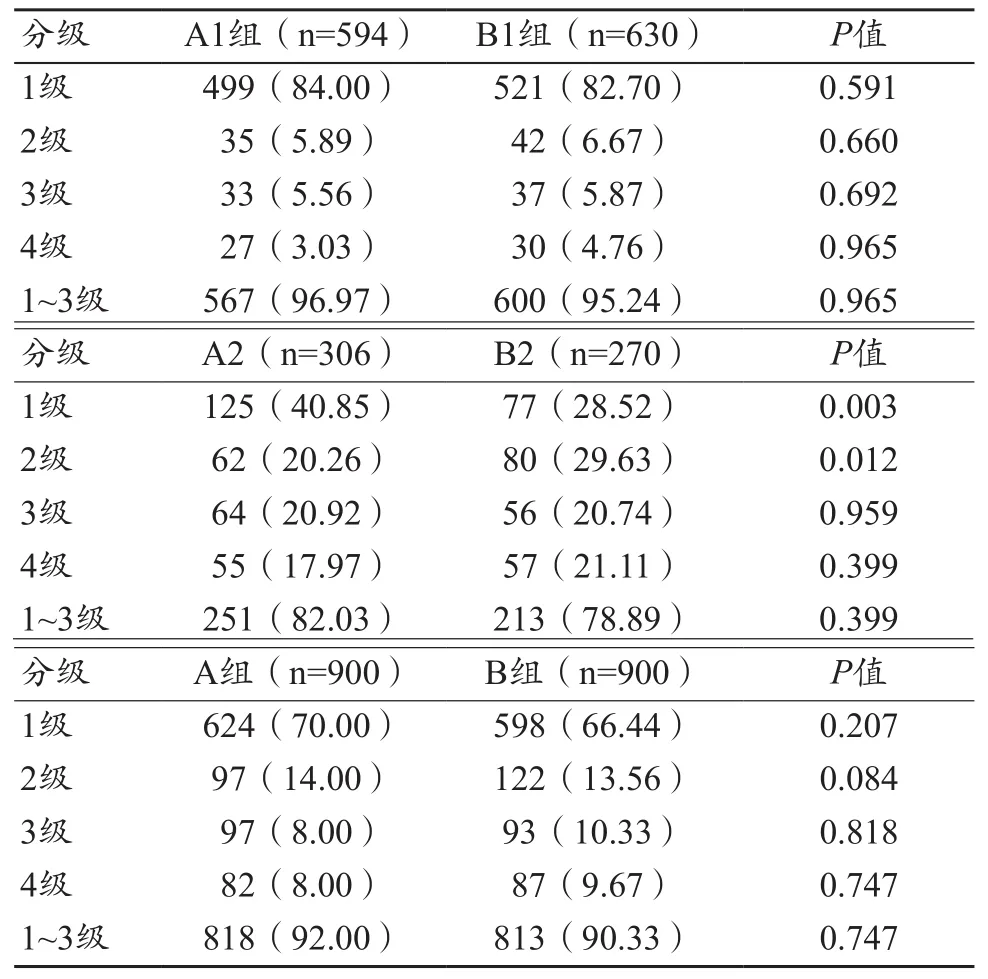
表2 CPR图像主观质量评级[n(%)]
2.3 图像质量客观评价
A组和B组图像在低心率亚组前降支远段的SNR值比较差异无统计学意义(P=0.8091),其余所有节段的SNR值B1组均显著高于A1组(P<0.0001);而高心率亚组中,远段节段的SNR值B2组均小于A2组,近中段节段的SNR值则表现为B2组均大于A2组(P<0.0001),见表3~4。
表3 低心率亚组冠状动脉客观质量评价表(±s,n=200)

表3 低心率亚组冠状动脉客观质量评价表(±s,n=200)
部位 CT值 SD值 SNR值A1右冠近段 375.58±21.35 21.25±7.21 17.67±2.33 B1右冠近段 379.24±20.89 17.10±6.56 21.94±3.98 P值 0.0839 <0.0001 <0.0001 A1右冠远段 346.50±20.99 15.47±5.12 22.40±3.21 B1右冠远段 353.64±19.99 14.69±2.19 24.07±3.31 P值 0.0007 0.0483 <0.0001 A1左主干 434.50±22.21 17.16±5.12 25.32±3.90 B1左主干 415.31±23.45 9.53±1.90 43.58±5.90 P值 <0.0001 <0.0001 <0.0001 A1前降支中段 421.54±19.03 29.84±7.12 14.13±2.90 B1前降支中段 292.75±11.21 14.11±2.10 20.74±3.11 P值 <0.0001 <0.0001 <0.0001 A1前降支远段 279.41±15.50 23.61±4.12 11.83±2.90 B1前降支远段 256.52±12.23 21.56±5.01 11.90±2.89 P值 <0.0001 <0.0001 0.8091 A1回旋支近段 332.25±21.22 18.23±4.99 18.22±3.01 B1回旋支近段 375.77±20.89 9.19±1.09 40.89±21.23 P值 <0.0001 <0.0001 <0.0001
表4 高心率亚组冠状动脉客观质量评价表(±s,n=200)

表4 高心率亚组冠状动脉客观质量评价表(±s,n=200)
部位 CT值 SD值 SNR值A2右冠近段 359.38±21.23 16.15±4.31 22.25±4.23 B2右冠近段 270.00±19.90 10.30±2.21 26.21±4.12 P值 <0.0001 <0.0001 <0.0001 A2右冠远段 332.20±23.32 12.60±2.98 26.37±3.99 B2右冠远段 265.17±19.89 16.2±3.01 16.37±3.33 P值 <0.0001 <0.0001 <0.0001 A2左主干 341.42±30.31 12.96±2.36 26.34±3.10 B2左主干 301.83±29.93 13.12±1.98 23.01±2.98 P值 <0.0001 0.4631 <0.0001 A2前降支中段 302.22±29.90 22.50±3.97 13.43±2.21 B2前降支中段 289.05±26.79 9.97±1.98 28.98±3.46 P值 <0.0001 <0.0001 <0.0001 A2前降支远段 220.01±19.98 12.52±2.21 17.57±2.98 B2前降支远段 149.40±13.22 11.08±1.99 13.48±3.01 P值 <0.0001 <0.0001 <0.0001 A2回旋支近段 308.64±29.00 15.98±3.31 19.31±3.99 B2回旋支近段 255.75±21.22 9.02±1.02 28.35±6.10 P值 <0.0001 <0.0001 <0.0001
2.4 辐射剂量与对比剂用量比较
A组CTDIvol、DLP、ED均显著低于B组(P<0.0001),A组辐射剂量减低率为70.28%,见表5。
表5 A组和B组辐射剂量与对比剂用量比较(±s)
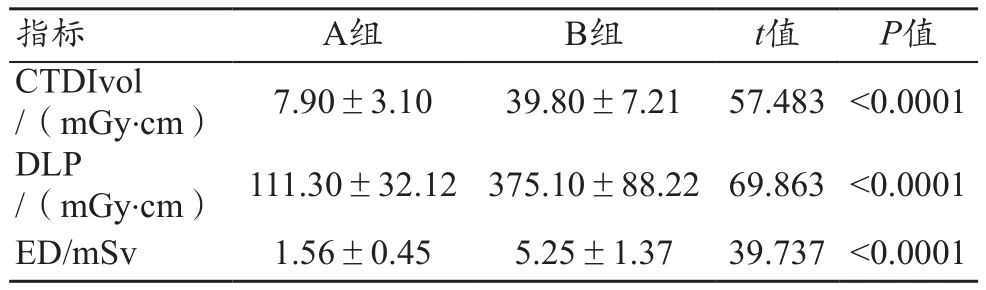
表5 A组和B组辐射剂量与对比剂用量比较(±s)
注:CTDIvol:容积剂量指数;DLP:剂量长度乘积;ED:有效剂量。辐射剂量减低率=(B组ED-A组ED)/B组ED。
指标 A组 B组 t值 P值CTDIvol/(mGy.cm) 7.90±3.10 39.80±7.21 57.483 <0.0001 DLP/(mGy.cm) 111.30±32.12 375.10±88.22 69.863 <0.0001 ED/mSv 1.56±0.45 5.25±1.37 39.737 <0.0001
3 讨论
目前AI影像工具在临床上的应用主要有两大方面,分别为CCTA血管智能提取与诊断为代表的血管AI影像和以肺结节查找判断为代表的微小病变AI影像[13]。其中CCTA AI系统分为两个主工作流程,即冠状动脉标准化后处理与管腔狭窄诊断,本研究主要探究CCTA AI影像中,不同扫描方式对AI后处理VR、MPR图像质量的影响。
国内外研究表明,AI影像在冠状动脉识别的准确率为95%~99%[14]。朱刚明等[6]的研究表明,AI节约了73.73%的重建时间和56.08%的诊断时间,且AI诊断工具可以不受诊断医师主观因素的影响,耗时较为稳定,结果标准统一化、客观化。暴云锋等[15]研究表明,AI工具在统一的扫描模式下,得到的后处理图像质量也与人工处理接近(VR图像AI重建合格率为97.20%,人工重建合格率为99.07%);Van Assen等[16]对比了19000条冠状动脉,结果表明AI重建的CPR图像在冠状动脉节段命名准确率也与人工准确率接近(AI准确率为人工命名的96.88%)。但之前的研究在进行CCTA图像质量对比时仅考虑了运动伪影的影响;Carson等[17]研究中,由于运动伪影造成的冠状动脉重建图像质量不合格,在人工组中依然存在,但人工组可以进行手动重建修订,从而提高了极少数较差图像的合格率。但是随着AI工具的版本迭代,其自动修订能力提高。由于上述研究采用统一的扫描方案或重建算法,图像质量的影响只能说明AI工具对于运动伪影纠错的能力,而无法反映AI工具对于原始数据判断的影响。
Rabbat等[18]研究表明,影响AI重建图像质量除了心脏搏动和呼吸运动伪影之外,还包括底层原始数据的搭建原理,如重建算法、扫描方式选择、曝光剂量、对比剂浓度、注射流率等因素影响。这是由于AI工具的卷积神经网络大数据深度学习能力需要在初级阶段获取不同参数的扫描病例数据,尤其是不合格的数据。如果在训练集上无法匹配此前学习过的重建数据特征,就会产生分割遗漏和噪声,出现过拟合或者欠拟合[19]。
容积扫描是宽体探测器独有的低剂量扫描方式,不同于普通的螺旋扫描,仅曝光一次就可以采集160 mm范围的影像数据,大大减少了辐射剂量。大量的研究[20-22]已经证实,宽体探测器容积扫描与螺旋扫描在图像质量上无显著差异,而辐射剂量却大幅度减低,但根据欧阳中敏等[23]的研究,虽然总体可以满足临床诊断要求,但容积扫描模式在心律越高的患者中运动伪影越高,在大于75次/min时尤为明显。本研究中,为了避免运动伪影影响图像质量判断,排除了严重心律不齐的患者,同时对患者按照高低心律进行了亚组区分,分别评价不同扫描方式下对于低心率组和高心率组的重建效能差别。
本研究结果表明,对于不同心率,AI对于容积扫描与螺旋扫描的VR重建图像质量均无显著差异,而CPR重建图像质量在高心律组中略有差异。结合AI工作原理,VR图像是进行了2D与3D融合并结合pixel level技术精确提取及分隔结果优化生成的图像。对VR图像着色和渲染视觉感较强,即使心律较高的图像组中,也能表现出比较好的局部解剖结构形态,对于原始数据的矫正和整合算法有很好的效果[23-24]。因此在两种扫描方法的VR图像评价中,高、低心率组均无显著差异。容积扫描和螺旋扫描在低心律组CPR图像主观质量中无显著差异,而在高心律组中的图像质量存在差异,主要表现为图像质量优秀的部分。原因为CPR图像是系统依靠分割图像结果进行曲面重建,因而去掉了渲染部分和心肌部分,对于血管内部情况显示地更为清晰,能判断管腔的狭窄率和斑块情况,且无伪彩渲染的差值矫正,因此不同扫描方法的图像质量出现了差异,部分容积扫描的图像在右冠状动脉出现了管壁毛糙,不如螺旋扫描平滑,造成图像评分无法达到优秀[25]。容积扫描和螺旋扫描在客观图像质量上的评价有显著差异,两种扫描方法对于血管内造影剂的显示和填充表现不一致,但并不影响AI进行重建与诊断分析的效能,主要由于两种扫描方式原理的不同。
本研究存在以下不足,首先样本量较少,分成高低心律亚组之后每组的患者数量分流,如增加样本量可能结果会更全面;其次是评价时未进一步分析重建算法在其中的影响,在后续的研究中,将对重建算法进一步区分,以得到更全面的评价。
4 结论
AI在冠状动脉CTA不同扫描方式下,重建的图像质量合格率无显著差异,容积扫描方式获得的CPR后处理图像仅在高心律组中优秀图像比例较螺旋扫描略低,但是辐射剂量却大幅度降低。本研究结果表明,容积扫描在冠状动脉CTA AI后处理方面具有较高的临床意义。

