产地加工炮制一体化与传统何首乌饮片化学成分的比较研究
黄孟秋,孙连娜,董志颖,屠 燕,邱 实
产地加工炮制一体化与传统何首乌饮片化学成分的比较研究
黄孟秋,孙连娜,董志颖,屠 燕,邱 实*
上海中医药大学,上海 201203
全面表征何首乌的化学成分,对产地加工炮制一体化何首乌饮片与传统加工何首乌饮片的化学成分进行比较。采用超高效液相色谱-四极杆飞行时间串联质谱(UPLC-QTOF-MS)技术表征何首乌中的化学成分;运用代谢组学方法比较产地加工炮制一体化何首乌饮片与传统饮片中成分差异。根据对照品的质谱裂解规律、保留时间、色谱峰的精确相对分子质量、碎片离子等信息结合MS-FINDER软件从何首乌中鉴定出了69个化学成分;运用多元统计分析比较产地加工炮制一体化饮片与传统饮片的化学成分,整体化学轮廓存在相似性,但大黄素、二苯乙烯苷、大黄素-8--β--葡萄糖苷等游离蒽醌类成分存在差异。产地加工炮制一体化技术具有简化炮制步骤,提高生产效率等优点,但是在推广产地加工炮制一体化技术的过程中,还应考虑到游离蒽醌类成分的影响。
何首乌;产地加工炮制一体化;超高效液相色谱-四极杆飞行时间串联质谱;化学成分;代谢组学;大黄素;二苯乙烯苷;大黄素-8--β--葡萄糖苷
何首乌为蓼科(Polygonaceae)植物何首乌Thunb. 的干燥块根,具有解毒、消痈、截疟、润肠通便的作用[1]。何首乌中的主要成分包括二苯乙烯苷类、蒽醌类、黄酮类、磷脂等化合物[2-6],具有抗氧化、抗动脉粥样硬化,神经保护等作用[7]。
饮片生产需要经过产地加工和中药炮制2个重要环节,产地加工主要包括净制、修整切制及干燥等步骤制成中药材,部分药材在产地还需要蒸或煮以保存药效[8];中药炮制指将中药材洗净、润透、切制、炮制后干燥的过程,最终得到传统饮片。在产地加工及饮片炮制过程中需要经过回润以及多次干燥的过程,步骤繁琐易造成有效成分的损失。因此,20世纪以来,就不断有专家提出将饮片生产线前移,在产地进行饮片炮制,推广产地加工炮制一体化的概念[9-10]。
目前产地加工炮制一体化技术已经取得一定进展。现代研究发现香薷、天麻、纹党参等药材产地加工炮制一体化饮片对保留药材中有效成分具有积极意义。而何首乌的加工炮制一体化研究也显示产地加工炮制一体化饮片(简称“产地片”)中二苯乙烯苷类、蒽醌类及多糖等成分含量与传统饮片(简称“润切片”)相比无显著差异[11-13]。但是目前对产地片与润切片之间的化学成分差异研究集中在大黄素、大黄素甲醚、二苯乙烯苷等质控指标成分上。采用液质联用技术,能够更全面的比较产地片与润切片中的化学成分,有助于了解产地加工对饮片化学成分的影响,从而为何首乌产地加工炮制一体化技术的实施及推广提供参考。因此本实验运用高效液相色谱-四极杆飞行时间串联质谱(UPLC-QTOF-MS)技术结合代谢组学方法对2种饮片的化学差异进行表征,并对指标性成分含量进行考察,以期更全面地分析产地片与润切片中的化学成分差异,为何首乌产地加工的研究提供参考。
1 仪器与材料
1.1 仪器
Waters Acquity UPLC I-Class超高效液相色谱、Waters Xevo G2-XS QTof高分辨质谱(美国Waters公司),Masslynx V 4.2工作站(美国Thermo Fisher公司);MS-DIAL v 4.20;Agilent 1200液相色谱仪;SK7200H超声波清洗器(上海科导超声仪器有限公司);BSA124S-CW型电子天平(德国Sartorius公司);MiniSpin plus型离心机(德国eppendolf公司);MSE3.6P-0CE-DM型电子天平(德国Sartorius公司)。
1.2 对照品及试剂
反式-2,3,5,4′-四羟基二苯乙烯-2--β--葡萄糖苷(简称“二苯乙烯苷”)为本实验室分离得到(批号200125);大黄素对照品(批号B20240)购于上海源叶生物科技有限公司;大黄素甲醚(批号3987)、原花青素B1(批号7861)、原花青素C1(批号6980)、大黄素-8--β--葡萄糖苷(批号7823)、大黄素甲醚-8--β--葡萄糖苷(批号6658)和芦荟大黄素(批号6530)等对照品购于上海诗丹德生物科技有限公司。各对照品质量分数均在98%以上。甲醇、乙腈(色谱纯,德国Merck公司),甲酸(色谱纯,美国Fisher公司),纯水为自制。
1.3 样品采集及饮片制备
新鲜何首乌于2019年采集于广东德庆市及贵州省丹寨县,市售何首乌饮片(相同批次产地片及润切片)收集于上海地区,饮片产地包括广东、贵州、云南、河南等地,以上样品均经上海中医药大学中药学院孙连娜副教授鉴定为蓼科植物何首乌Thunb.,自制饮片及市售饮片具体样品信息见表1。
饮片制备采收新鲜何首乌,除去泥土,须根,削去两端,切成块后干燥,干燥品为何首乌药材。取何首乌药材,除杂、稍润,切厚片干燥得到传统何首乌饮片。新鲜何首乌,除去泥土,须根,削去两端,稍加干燥后直接切厚片,干燥即得产地片。
2 方法
2.1 溶液的制备
2.1.1 供试品溶液制备 取何首乌粉末(过四号筛)0.5 g,精密称定,置50 mL具塞锥形瓶中,加70%乙醇25 mL,超声处理(50 kHz、功率760 W)1 h,取出,放冷,用70%甲醇补失质量,摇匀,14 000 r/min离心15 min,取上清液即得。
2.1.2 对照品溶液制备 精密称取大黄素、原花青素B1、原花青素C1、大黄素-8--β--葡萄糖苷、大黄素甲醚-8--β--葡萄糖苷、芦荟大黄素,二苯乙烯苷对照品适量,分别加入甲醇溶解制成含大黄素0.22 mg/mL、原花青素B1 0.56 mg/mL、原花青素C1 0.49 mg/mL、大黄素-8-β--葡萄糖苷0.21 mg/mL、大黄素甲醚-8--β--葡萄糖苷0.19 mg/mL、芦荟大黄素0.14 mg/mL和二苯乙烯苷0.55 mg/mL的对照品储备液。分别移取各储备制成对照品溶液,加甲醇稀释成每种对照品质量浓度约为0.05 mg/mL,用于定性分析。
2.2 色谱条件
色谱柱为Acquity UPLC HSS T3 C18(100 mm×2.1 mm,1.8 µm,T3,Waters公司,美国);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),洗脱梯度:0~2 min,5% B;2~15 min,5%~40% B;15~17 min,40%~55% B;17~23 min,55%~95% B;23~30 min,95% B;后运行4 min;柱温40 ℃,进样量1 μL,体积流量0.4 mL/min。
表1 何首乌饮片信息
Table 1 Information of P. multiflorum
润切片产地片产地饮片来源 样品编号批号样品编号批号 S1-1HSW-GD-201901-RS1-2HSW-GD-201901-X广东上海地区购买 S2-1HSW-GD-201902-RS2-2HSW-GD-201902-X广东上海地区购买 S3-1HSW-GD-201903-RS3-2HSW-GD-201903-X广东上海地区购买 S4-1HSW-GD-201904-RS4-2HSW-GD-201904-X广东上海地区购买 S5-1HSW-GZ-201901-RS5-2HSW-GZ-201901-X贵州上海地区购买 S6-1HSW-GZ-201902-RS6-2HSW-GZ-201902-X贵州上海地区购买 S7-1HSW-GZ-201903-RS7-2HSW-GZ-201903-X贵州上海地区购买 S8-1HSW-GZ-201904-RS8-2HSW-GZ-201904-X贵州上海地区购买 S9-1HSW-HN-201901-RS9-2HSW-HN-201901-X河南上海地区购买 S10-1HSW-HN-201902-RS10-2HSW-HN-201902-X河南上海地区购买 S11-1HSW-HN-201903-RS11-2HSW-HN-201903-X河南上海地区购买 S12-1HSW-HN-201904-RS12-2HSW-HN-201904-X河南上海地区购买 S13-1HSW-YN-201901-RS13-2HSW-YN-201901-X云南上海地区购买 S14-1HSW-YN-201902-RS14-2HSW-YN-201902-X云南上海地区购买 S15-1HSW-YN-201903-RS15-2HSW-YN-201903-X云南上海地区购买 S16-1HSW-YN-201904-RS16-2HSW-YN-201904-X云南上海地区购买 S17-1XSWMC19041-RS17-2XSWMC19041-X广东德庆自制 S18-1XSWMC19042-RS18-2XSWMC19042-X广东德庆自制 S19-1XSWMC19043-RS19-2XSWMC19043-X广东德庆自制 S20-1XSWMC19044-RS20-2XSWMC19044-X广东德庆自制 S21-1XSWGZ19011-RS21-2XSWGZ19011-X贵州丹寨自制 S22-1XSWGZ19012-RS22-2XSWGZ19012-X贵州丹寨自制 S23-1XSWGZ19013-RS23-2XSWGZ19013-X贵州丹寨自制 S24-1XSWGZ19014-RS24-2XSWGZ19014-X贵州丹寨自制
2.3 质谱条件
在负模式下采集质谱数据,ESI源参数设置如下:样品锥孔电压30 V;离子源温度150 ℃;去溶剂化气流温度450 ℃;锥形气体流量50 L/h;去溶剂化气体流量600 L/h;毛细管电压2.5 kV。质谱检测质量范围为/100~1500,扫描时间为0.35 s,低能量扫描时传输碰撞能量设定为6 eV,高能量扫描时传输碰撞能量为15~30 eV。
2.4 数据处理与结构鉴定
采集样品质谱数据,在MassLynx作站中得到化合物的保留时间、离子碎片、加和离子、精确相对分子质量等信息,通过对照品及文献报道进行鉴定。文献中未有分离及鉴定报道的成分,用MS-FINDER软件进行鉴定,MS-FINDER软件中使用到的用于结构鉴定的公共数据库包括KNApSAcK、PlantCyc、HMDB、LipidMaps、NANPDB以及UNPD。
将采集到的质谱数据导入MS-DIAL软件进行峰对齐、峰提取及归一化等数据处理。处理后数据可导入SIMCA-P 14.1 软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),根据PCA模型、OPLS-DA模型以及VIP值等信息找出产地片和润切片中的主要差异成分;还可以直接用于半定量分析,结合SPSS 22.0软件采用单因素方差分析法考察产地炮制方式对饮片中有效成分含量的影响情况。
3 结果
3.1 何首乌化学成分分析
采用UPLC-QTOF-MS技术,在负离子模式下采集不同批次何首乌饮片的总离子流图进行比较分析,发现无论是自制饮片还是市售饮片,其同一批次的产地片与润切片在特征峰响应强度方面均存在差异(以色谱峰强度较高的市售饮片S13和自制饮片S22为例,见图1)。结合文献报道及公共数据库查找的方式对总离子流图进行分析,共鉴定了69个可以代表何首乌质谱指纹图谱轮廓的成分(表2),其中以二苯乙烯苷类、游离蒽醌类以及结合蒽醌类为主。在69个成分中,有54个鉴定来源于文献报道,15个来源于公共数据库,其中何首乌中特征性的化合物用对照品进行了确认。分别对主要类型举例说明鉴定过程。
3.1.1 二苯乙烯苷类 化合物31分子离子峰为/405.119 9 [M-H]−,与对照品的出峰时间及离子裂解规律(图2-a)判断该成分为二苯乙烯苷,在二级碎片离子中31丢失1分子葡萄糖生成碎片离子/243.065 3 [M-H-glu]−。25与31号化合物裂解规律一致仅出峰时间不同,为该成分的同分异构体。34分子离子峰为/375.108 6 [M-H]−,丢失1分子木糖苷生成/243.065 3 [M-H-xyl]−,后续裂解过程与31一致结合文献报道判断该成分为2,3,5,4′-四羟基二苯乙烯-2--β--木糖苷。33、36、41分子离子峰相同,且裂解规律相近,/557.13 [M-H]−。丢失1分子没食子酰基后生成/405.11 [M-H-C7H4O4]−,后续裂解规律与31一致,判断3个化合物均为31号化合物在不同部位连接乙酰基形成同分异构体。同理可知37、46和47分别为31号连接了乙酰基,香豆酰基以及阿魏酰基。28及35分子离子峰为/693.18 [M-H]−,裂解规律相近为同分异构体,丢失1分子葡萄糖形成/531.12 [M-H-glu]−,丢失C15H12O6形成/405.11 [M-H-C15H12O6]−,丢失C20H22O9形成/289.06 [M-H-C20H22O9]−,结合文献报道判断2个成分分别为polygonflavanol A和polygonflavanol B。

图1 负离子模式下何首乌饮片的总离子流图
表2 负离子模式下何首乌中成分鉴定结果
Table 2 Identification results of P. multiflorum in negative ion mode
序号tR/min化合物分子式离子理论值(m/z)测定值(m/z)碎片离子 (m/z)误差(×10−6) 10.82蔗糖C12H22O11[M-H]−341.108 4341.108 9262.056 5, 179.055 41.30 20.87柠檬酸C6H8O7[M-H]−191.019 5191.020 1128.034 4, 111.008 03.26 31.55没食子酸[14]C7H6O5[M-H]−169.013 7169.014 5125.023 4, 107.012 71.40 41.64(2S,2′S)-pyrosaccharopineC11H18N2O5[M-H]−257.114 3257.114 6239.102 8, 213.123 62.30 51.74未知C19H26O14[M-H]−477.125 0477.124 7439.124 0, 329.134 21.80 62.26gamma-L-glutamyl-L-pipecolic-acidC11H18N2O5[M-H]−257.114 3257.114 8213.123 2, 195.112 82.30 72.43isomer gamma-L-glutamyl-L-pipecolic-acidC11H18N2O5[M-H]−257.114 3257.114 8213.123 5, 195.112 13.08 83.16(−)-表没食子儿茶素[15]C15H14O7[M-H]−305.066 2305.066 8179.033 9, 125.023 90.40 93.93gamma-glutamylisoleucineC11H20N2O5[M-H]−259.129 9259.130 4241.118 6, 197.128 41.70 104.433-羟基苯甲酸[16]C7H6O3[M-H]−137.023 9137.024 7108.020 92.00 114.83原花青素B1*[2]C30H26O12[M-H]−577.134 6577.135 0425.080 6, 407.076 8, 289.070 8−0.30 124.972-vinyl-1H-indole-3-carboxylic acid[17]C11H9NO2[M-H]−186.055 5186.056 4142.065 51.90 134.97刺桐碱[17]C14H18N2O2[M-H]−245.129 0245.128 6142.065 30.90 145.11原花青素B2[2]C30H26O12[M-H]−577.134 6577.134 2425.086 7, 407.075 6, 289.071 9−1.70 155.37儿茶素[15]C15H14O6[M-H]−289.071 2289.072 2245.080 5, 203.070 01.40 165.59原花青素C1*[18]C45H38O18[M-H]−865.198 5865.196 0577.133 9, 451.102 6, 289.068 3−1.10 175.93对羟基苯甲醛[19]C7H6O2[M-H]−122.037 0121.029 7 1.70 186.04polygonumoside E[20]C19H22O9[M-H]−393.118 6393.119 0231.065 1−0.20 196.04原花青素B1(isomer)[2]C30H26O12[M-H]−577.134 6577.134 2425.086 4, 407.075 9,289.070 3−1.60 206.39isomer polygonimitin C[21]C26H32O14[M-H+HCOO]−567.171 4613.176 9405.112 6, 243.061 8−0.80 216.51表儿茶素[15]C15H14O6[M-H]−289.071 2289.072 0245.080 9, 203.712 00.80 226.703-O-galloyl-procyanidin B[2]C37H30O16[M-H]−729.145 6729.144 9577.128 9, 289.071 8−1.70 237.01isomer 3-O-galloyl-procyanidin B[2]C37H30O16[M-H]−729.145 6729.145 6577.136 4, 407.075 8−0.70 247.00isomer polygonimitin C[21]C26H32O14[M-H+HCOO]−567.171 4613.177 0405.116 7, 243.065 0−0.70 257.23顺式-2,3,5,4′-四羟基二苯乙烯-2-O-β-D-葡萄糖苷[22]C20H22O9[M-H]−405.118 6405.119 6243.066 5, 225.053 71.20 267.54(+)-lyoniresinol-3α-O-β-D-glucopyranoside[14]C28H38O13[M-H+HCOO]−581.223 4627.228 8521.211 5, 289.068 3−1.00 277.72polygonimitin C[21]C26H32O14[M-H]−567.171 4567.171 6405.115 2, 243.064 4−0.60 287.96polygonflavanol A[23-24]C35H34O15[M-H]−693.182 5693.181 1541.136 3, 405.118 9, 289.068 3, 243.065 0, 169.014 11.28 298.053,3′-di-O-galloyl-procyanidin B2[2]C44H34O20[M-H]−881.156 5881.154 4729.139 6, 591.113 6, 289.068 3−3.00 308.13polydatin[3]C20H22O8[M-H+HCOO]−389.123 7435.129 4227.070 2−0.50 318.38二苯乙烯苷*[2]C20H22O9[M-H]−405.118 6405.119 9243.065 32.00 328.63未知C42H38O19[M-H]−845.193 5845.190 4804.153 80.06

续表2
续表2
序号tR/min化合物分子式离子理论值 (m/z)测定值 (m/z)碎片离子 (m/z)误差(×10−6) 6117.95polygonumnolide E[35]C37H34O13[M-H]−685.192 2685.190 9458.123 6, 254.060 9−2.60 6218.22大黄素*[34]C15H10O5[M-H]−269.045 0269.046 2241.045 1, 225.053 82.50 6318.90gingerglycolipid BC33H58O14[M-H+HCOO]−677.347 8723.379 5677.374 0, 397.134 01.26 6419.09未知C35H43N5O2[M-H]−564.334 4564.330 3504.308 46.89 6519.331-palmitoylglycerophosphoinositolC25H49O12P[M-H]−571.288 9571.288 5311.168 53.99 6619.39大黄素二蒽酮[4]C30H22O8[M-H]−509.123 7509.12 4479.059 0, 254.057 5−0.40 6719.82大黄素二蒽酮同分异构体[4]C30H22O8[M-H]−509.124 5509.123 4479.057 9, 254.058 00.60 6819.831-oleoylglycerophosphoinositolC27H51O12P[M-H]−597.304 5597.304 4555.287 3, 325.183 71.06 6921.96pentadecanalC15H30O[M-H+HCOO]−225.221 8271.228 3 1.18
*通过对照品对比确认
*identified by comparing with reference standard
3.1.2 蒽醌类 何首乌中的蒽醌类成分分为游离蒽醌、结合蒽醌及蒽酮类等,游离蒽醌以化合物58为例,准分子离子峰在负离子模式下/269.046 2 [M-H]−,二级质谱中性丢失CO生成/241.045 1 [M-H-CO]−的碎片离子,还可再丢失1个O形成/225.054 4 [M-H-CO2]−的碎片离子,与对照品出峰时间及裂解规律一致(图2-b),判断该化合物分别为大黄素,化合物56二级质谱图与58一致,但出峰时间不同,结合对照品判断为芦荟大黄素。结合蒽醌多为游离蒽醌与糖结合形成的化合物。以化合物49/431.098 8 [M-H]−为例,在二级质谱中母离子丢失葡萄糖生成/269.044 5 [M-H-glu]−,再丢失CO2生成/225.053 7 [M-H-glu-CO2]−,与对照品裂解规律一致(图2-c),判断化合物49为大黄素-8--β--葡萄糖苷。化合物52质谱信号/445.114 5 [M-H]−,在二级碎片中易丢失糖基生成/283.060 7 [M-H-glu]−,再丢失1分子CO及1个甲基形成碎片/240.041 4 [M-H-glu-CO-CH3]−,结合对照品裂解规律判断化合物52为大黄素甲醚-8--β--葡萄糖苷。何首乌中报道的二蒽酮以化合物62、63为例,二级质谱中丢失C15H13O4形成/254.05 [M-H-C15H13O4]−,还可丢失2个甲基形成/479.059 0 [M-H-2CH3]−。
3.1.3 黄酮类 化合物11、14及19的分子离子峰均为/577.13 [M-H]−,二级质谱中易产生RDA裂解丢失C8H8O3形成/425.08 [M-H-C8H8O3]−,再丢失C7H5O3形成/289.07 [M-H-C8H8O3-C7H5O3]−,结合对照品(图2-d)判断11为原花青素B1,14及19为原花青素B1的同分异构体。化合物16丢失C15H13O6形成/577.133 9 [M-H-C15H13O6]−,再丢失C6H6O3形成/451.102 6 [M-H-C21H19O9]−,结合对照品判断该化合物为原花青素C1。化合物15和21为/289.07 [M-H]−,丢失C2H3OH,形成/245.08 [M-H-C2H3OH]−,还可丢失C7H6O3形成/203.07 [M-H-C7H6O3]−,结合文献报道判断2个成分分别为儿茶素及表儿茶素。
3.1.4 其他类 化合物48丢失1分子葡萄糖生成/245.081 2 [M-H-glu]−,再丢失1分子CH3生成/230.058 1 [M-H-glu-CH3]−,结合文献报道判断该成分为决明酮-8--β--吡喃葡萄糖苷,化合物51离子峰为/449.145 5 [M-H]−,二级质谱为/230.058 1、215.032 9。结合文献报道推断该成分为决明酮-8--(6′--乙酰基)-β--吡喃葡萄糖苷。
3.2 产地片与润切片对比
3.2.1 PCA 采用MS-DIAL V 4.20软件对UPLC- QTOF-MS/MS的原始数据进行峰提取和归一化处理,将已鉴定的69个主要成分数据导入SIMCA-P软件建立PCA模型(图3),分别建立了市售饮片及自制饮片的PCA模型(R=0.951,R=0.751),结果显示产地片与润切片分布相近,但具有一定的分离趋势。

a-2,3,5,4′-四羟基二苯乙烯-2-O-β-D-吡喃葡萄糖苷 b-大黄素 c-大黄素-8-O-β-D-葡萄糖苷 d-原花青素B1
3.2.2 OPLS-DA 建立OPLS-DA模型,通过Scores Plot图观察产地片与润切片的分布情况,按照VIP值对差异成分进行初步筛选。OPLS-DA分析中产地片与润切片明显分为2个区域(图4),说明二者化学成分在差异,经过VIP结果筛选出3个主要的差异成分(表3)。
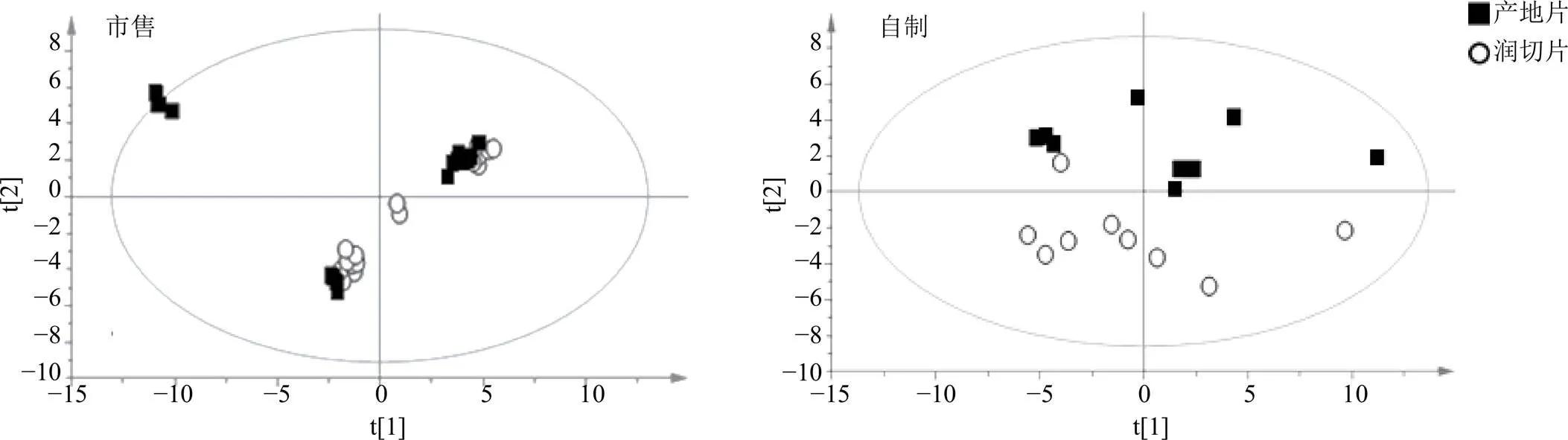
图3 产地片与润切片的PCA得分图

图4 自制饮片与市售饮片的OPLS-DA图 (A)、置换检验(n= 200, B) 和因子载荷图(C)
3.2.3 成分含量比较 采用半定量分析更全面地考察已鉴定成分的含量变化,并将鉴定成分按照结构类型分为结合蒽醌、游离蒽醌、二苯乙烯苷及其他4类,每类化合物的相对含量以该类中各化合物半定量分析结果的加和进行计算,从而进一步考察不同种类化合物在炮制过程中整体含量变化。本实验首先对产地片与润切片中的差异成分进行考察(图5-a、b),润切片中大黄素含量显著高于产地片;再考察不同种类化合物在炮制过程中含量变化情况(图5-c、d),检验结果同样显示润切片中游离蒽醌含量显著高于产地片,其他成分含量无显著性区别;此外还按照产地因素对4类化合物含量进行考察(图5-e、f),并进行单因素方差分析,结果显示产地因素对何首乌中总二苯乙烯苷、结合蒽醌及游离蒽醌类成分均有影响,自制饮片中二苯乙烯苷类及其他类成分含量受产地因素影响;市售饮片中结合蒽醌及游离蒽醌含量受产地影响,均呈现显著性差异。
表3 产地片与润切片的差异化学成分
Table 3 Differential chemical makers of fresh-cut and moisturized-cut slices
序号化合物精确相对分子质量分子式VIP值 62大黄素269.046 2C15H10O54.93 31二苯乙烯苷405.118 6C20H22O93.22 49大黄素-8-O-β-D-葡萄糖苷431.098 8C21H20O103.04

a-自制何首乌差异成分相对含量比较 b-市售何首乌差异成分相对含量比较 c-自制饮片产地片及润切片不同类型化合物相对含量差异 d-市售饮片产地片及润切片不同类型化合物相对含量差异 e-自制饮片不同产地样品化学成分相对含量差异 f-市售饮片不同产地样品化学成分相对含量差异;*P<0.05 **P<0.01
4 讨论
本实验采用UPLC-Q-TOF-MS技术对何首乌中化学成分进行快速表征,共鉴定出了69个成分,其中二苯乙烯苷类成分16个、蒽醌类成分19个、其他成分34个。采用非监督式PCA对产地片与润切片中化学成分进行初步比较,二者具有一定分离趋势。建立OPLS-DA模型进一步考察两种饮片成分差异,发现产地片与润切片中二苯乙烯苷、大黄素- 8-β-葡萄糖苷等指标性成分以及大黄素VIP>2,进一步通过半定量分析及检验确定大黄素为产地片与润切片中的主要差异成分。
本实验在前期工作中按照药典方法对产地片及润切片中二苯乙烯苷,结合蒽醌及游离蒽醌类成分含量进行测定,结果显示产地片中游离蒽醌含量呈现低于润切片的趋势。在本实验中按照化合物种类对产地片与润切片中的不同化合物进行半定量分析,实验结果与含量测定结果相近,进一步证明产地加工可能会对饮片中游离蒽醌含量造成影响。推测润药和干燥过程可能会促进结合蒽醌的水解,使润切片中游离蒽醌含量升高。
图2自制饮品PCA图中产地片与润切片有明显分离趋势,而市售饮片中二者差异不明显,说明产地因素对饮片中成分影响较明显,掩盖了产地片与润切片之间的差异。由图5-d、f可以看到不同产地自制饮片及市售饮片中二苯乙烯苷类成分游离蒽醌及结合蒽醌类成分均有明显区别,进一步说明产地是影响饮片质量的重要因素之一。
《中国药典》2020年版标准对何首乌饮片中二苯乙烯苷和结合蒽醌含量进行控制,没有关注游离蒽醌类成分,但在实验过程中本研究发现产地片与润切片中以大黄素为代表的游离蒽醌类成分可能存在差异。文献报道中游离蒽醌具有抗炎、抗菌等作用[36],可能与生首乌解毒、截疟等作用存在一定关联[37],因此在推广和应用产地片的过程中,建议进一步关注游离蒽醌成分,以保证饮片质量稳定可控。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 183-184.
[2] Lin L F, Ni B R, Lin H M,. Traditional usages, botany, phytochemistry, pharmacology and toxicology ofThunb.: A review [J]., 2015, 159: 158-183.
[3] 罗益远. 何首乌的品质评价研究 [D]. 南京: 南京中医药大学, 2016.
[4] Yang J B, Li L, Dai Z,. Polygonumnolides C1-C4; minor dianthrone glycosides from the roots ofThunb [J]., 2016, 18(9): 813-822.
[5] Yang J B, Yan Z, Ren J,. Polygonumnolides A1-B3, minor dianthrone derivatives from the roots ofThunb. [J]., 2018, 41(6): 617-624.
[6] 白思宇, 陈倩雯, 冯伟红, 等. 超高效液相色谱串联质谱法测定中药何首乌中10种真菌毒素的含量 [J]. 世界中医药, 2021, 16(17): 2533-2541.
[7] 梅雪, 余刘勤, 陈小云, 等. 何首乌化学成分和药理作用的研究进展 [J]. 药物评价研究, 2016, 39(1): 122-131.
[8] 陈林伟, 秦昆明, 朱艳汇, 等. 中药材产地加工的研究现状及展望 [J]. 中国中药杂志, 2015, 40(4): 602-606.
[9] 杨建国. 建立饮片产地加工厂设想 [J]. 中药通报, 1987, 12(4): 22.
[10] 杨冰, 宁汝曦, 秦昆明, 等. 中药材产地加工与炮制一体化技术探讨[J]. 世界中医药, 2020, 15(15): 2205-2209.
[11] 郑英, 李玮, 赵贵, 等. 基于过程控制的何首乌产地加工与炮制一体化方法分析 [J]. 中国实验方剂学杂志, 2018, 24(15): 29-35.
[12] 李帅锋, 丁安伟, 张丽, 等. 何首乌产地加工与饮片炮制一体化工艺研究 [J]. 中草药, 2016, 47(17): 3003-3008.
[13] 林冰, 刘婷婷, 周英, 等. 何首乌产地加工炮制一体化技术研究 [J]. 中药材, 2018, 41(7): 1598-1601.
[14] 肖凯, 宣利江, 徐亚明, 等. 何首乌中新的二苯乙烯甙 [J]. 植物学报(英文版), 2002, 44(12): 1491-1494.
[15] 周利, 李佳兴, 余意, 等. UPLC-MS/MS法测定不同产地何首乌中儿茶素类成分的含量 [J]. 中药材, 2018, 41(7): 1581-1584.
[16] Liang L, Xu J, Zhou W W,. Integrating targeted and untargeted metabolomics to investigate the processing chemistry of[J]., 2018, 9: 934.
[17] Wang L L, Sang M M, Liu E W,. Rapid profiling and pharmacokinetic studies of major compounds in crude extract fromby UHPLC-Q-TOF- MS and UPLC-MS/MS [J]., 2017, 140: 45-61.
[18] Qiu X H, Zhang J, Huang Z H,. Profiling of phenolic constituents inThunb. by combination of ultra-high-pressure liquid chromatography with linear ion trap-Orbitrap mass spectrometry [J]., 2013, 1292: 121-131.
[19] 刘振丽, 李林福, 巢志茂, 等. 何首乌炮制后化学成分的研究 [J]. 天然产物研究与开发, 2009, 21(2): 239-241.
[20] 颜世伦. 制何首乌的化学成分研究 [D]. 天津: 天津大学, 2014.
[21] Li S G, Chen L L, Huang X J,. Five new stilbene glycosides from the roots of[J]., 2013, 15(11): 1145-1151.
[22] Xu M L, Zheng M S, Lee Y K,. A new stilbene glucoside from the roots ofThunb [J]., 2006, 29(11): 946-951.
[23] 谢秋杰, 李硕果, 黄晓君, 等. 何首乌中1个新的黄酮二苯乙烯苷 [J]. 中国中药杂志, 2020, 45(5): 1114-1119.
[24] Chen L L, Huang X J, Li M M,. Polygonflavanol A, a novel flavonostilbene glycoside from the roots of[J]., 2012, 5(4): 756-760.
[25] Kim H K, Choi Y H, Choi J S,. A new stilbene glucoside gallate from the roots of[J]., 2008, 31(10): 1225-1229.
[26] Sun Y N, Cui L, Li W,. Promotion effect of constituents from the root ofon hair growth [J]., 2013, 23(17): 4801-4805.
[27] 陈万生, 杨根金, 张卫东, 等. 制首乌中两个新化合物 [J]. 药学学报, 2000, 35(4): 273-276.
[28] 余意, 李佳兴, 金艳, 等. UPLC-MS/MS 法测定制何首乌中9种二苯乙烯苷类成分含量 [J]. 中药材, 2018, 41(6): 1395-1398.
[29] 袁炜, 高增平, 杨建波, 等. 何首乌化学成分的研究 [J]. 中草药, 2017, 48(4): 631-634.
[30] Yan S L, Su Y F, Chen L,. Polygonumosides A-D, stilbene derivatives from processed roots of[J]., 2014, 77(2): 397-401.
[31] Sun Y N, Li W, Kim J H,. Chemical constituents from the root ofand their soluble epoxide hydrolase inhibitory activity [J]., 2015, 38(6): 998-1004.
[32] Lo Y H, Chen Y J, Chung T Y,. Emoghrelin, a unique emodin derivative in Heshouwu, stimulates growth hormone secretion via activation of the ghrelin receptor [J]., 2015, 159: 1-8.
[33] 张志国, 吕泰省, 姚庆强. 何首乌蒽醌类化学成分研究 [J]. 中草药, 2006, 37(9): 1311-1313.
[34] 张静娴. 何首乌神经保护活性成分研究 [D]. 北京: 北京协和医学院, 2016.
[35] Yang J B, Tian J Y, Dai Z,. A-Glucosidase inhibitors extracted from the roots ofThunb [J]., 2017, 117: 65-70.
[36] 王亦君, 冯舒涵, 程锦堂, 等. 大黄蒽醌类化学成分和药理作用研究进展 [J]. 中国实验方剂学杂志, 2018, 24(13): 227-234.
[37] 李欣, 孟磊, 魏胜利, 等. 不同产地何首乌药材质量及差异研究 [J]. 中国现代中药, 2020, 22(3): 384-390.
Comparative study on chemical components ofbetween integrated processing and traditional processing
HUANG Meng-qiu, SUN Lian-na, DONG Zhi-ying, TU Yan, QIU Shi
Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
To analyze and identify the chemical components from Heshouwu () and compare the differences of chemical components between integrated processed and traditional processed slices by metabolomics.The chemical components ofwere characterized by ultra performance liquid chromatography quadrupole time of flight mass spectrometry (UPLC-QTOF-MS), and the metabolomics approach was used to compare the differences of components between integrated processed and traditional processed slices.A total of 69 components were identified fromby MS-FINDER software based on the information of the reference standards, accurate molecular weight of chromatographic peaks, fragmentation patterns and other information. Multivariate statistical analysis was applied to compare the differences of chemical components between the integrated pieces and the traditional slices. The results showed that no significant differences were observed in the overall chemical profile, whereas there were differences in free anthraquinones such as emodin, stilbene glucoside and emodin-8--β--glucoside.The integrated technology of origin producing and processing is more advantageous than the traditional processing in simplifying processing steps and improving production efficiency. However, in the process of promoting the integrated processing method, the influence of free anthraquinones should be considered.
Thunb.; processing in producing areas; UPLC-QTOF-MS; chemical composition; metabolomics; emodin; stilbene glycoside; emodin-8--β--glucoside
R284.1
A
0253 - 2670(2022)17 - 5293 - 12
10.7501/j.issn.0253-2670.2022.17.005
2021-12-27
国家自然科学基金青年基金项目(81903745);上海市浦江人才计划(19PJ1409300)
黄孟秋(1996—),女,硕士研究生,研究方向为中药传统炮制技术与中药材特性研究。Tel: 19121701397 E-mail: huangmengqiu2020@163.com
邱 实。Tel: 18844160246 E-mail: davidhugh@msn.cn
[责任编辑 王文倩]

