混合微藻替代鱼油对大菱鲆幼鱼生长性能、体组成及肠道部分生化指标的影响*
王成强 曹体宏 李宝山 王际英 郝甜甜 宋志东 王晓艳 孙永智
混合微藻替代鱼油对大菱鲆幼鱼生长性能、体组成及肠道部分生化指标的影响*
王成强 曹体宏 李宝山 王际英①郝甜甜 宋志东 王晓艳 孙永智
(山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 山东 烟台 264006)
本实验以大菱鲆()幼鱼[(39.69±0.25) g]为研究对象,探究由裂壶藻(sp.)和拟微绿球藻(sp)组成的混合微藻替代鱼油对幼鱼生长性能、体组成、肠道消化水平及抗氧化能力的影响,以确定混合微藻替代鱼油的适宜比例。通过在基础饲料中添加不同比例的混合微藻,分别替代0、25%、50%和100%的鱼油,制成4组等氮等脂的实验饲料(分别命名为D1、D2、D3和D4),每组饲料设3个重复,实验周期为12周。结果显示,随替代比例的提高,大菱鲆幼鱼的增重率(WGR)和饲料效率(FE)呈下降趋势,D1、D2和D3组的特定生长率(SGR)和FE无显著性差异,但均显著高于D4组(<0.05);肝体比(HSI)在D1组达到最大值,且显著高于其他各组(<0.05);存活率(SR)和肥满度(CF)在各组之间无显著差异(>0.05)。随着混合微藻替代鱼油比例的升高,全鱼和肌肉粗脂肪含量呈先升高后降低的变化趋势,且D4组显著低于D1组(<0.05);大菱鲆幼鱼鱼体中C20:4n-6和n-6 PUFA含量显著升高,在D4组均达到最大值,且显著高于对照组(<0.05)。而EPA、DHA和n-3 PUFA含量随之显著下降,对照组(D1)含量显著高于其他各组(<0.05);肌肉中C20:4n-6和DHA含量在不同实验组间无显著性差异(>0.05),EPA和n-3 PUFA含量呈显著降低趋势(<0.05)。肠道脂肪酶活力在D3组达到最大值,显著高于对照组(<0.05),肠道胰蛋白酶活力也是在D3组最高,但与对照组无显著性差异(>0.05)。与D1组相比,D3组肠道中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)活力和补体C3含量均显著升高(<0.05)。肠道中超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)和过氧化氢酶(CAT)活力随替代比例的提高呈先升高后降低的趋势,均在D3组达到最大值,显著高于D1组(<0.05),而肠道中丙二醛(MDA)含量在不同实验组间并未表现出显著性差异(>0.05)。综上所述,混合微藻替代50%的鱼油并不会对大菱鲆幼鱼的生长性能产生负面影响,同时可以提高肠道的消化性能、抗氧化能力和非特异性免疫能力。
大菱鲆;裂壶藻;拟微绿球藻;生长性能;肠道生化指标
近年来,受捕捞量等因素的影响,全球鱼油总产量呈显著下滑趋势(FAO, 2019),而水产饲料对鱼油的需求量却与日俱增,因此,探寻可以替代鱼油的合适脂肪源显得尤为重要。鉴于此,很多学者在鱼油替代方面做了大量研究工作,如用豆油、玉米油、亚麻籽油、棕榈油等植物油单一或混合替代鱼油。但由于植物油中饱和脂肪酸较多,缺少n-3高不饱和脂肪酸(n-3 LC-PUFA:如EPA、DHA等),难以满足水生动物的营养需求,同时含有植物甾醇等抗营养因子(Cruz-Garcia, 2011),长期摄食会对机体的生长、抗病力、品质等方面产生不利影响。另外,研究表明,n-3 LC-PUFA在对机体成长、抗炎症、抗病力、繁殖性能及心脑血管健康等方面都表现出积极作用(Tibaldi, 2015; Shahidi, 2018),而大部分海水鱼,除篮子鱼()、鲑鱼()外,均不能合成n-3 LC-PUFA,或合成量难以满足自身需求。
微藻作为海洋食物链的初级生产者,因其自身含有丰富脂类营养,特别是富含n-3 LC-PUFA,在当前鱼油替代资源的开发中备受关注。一方面,微藻脂类中的大部分碳链为中长链的直链分子,且部分微藻中EPA和DHA的含量较高,常见种类如拟微绿球藻(sp.)、新月菱形藻()、三角褐指藻()的EPA为30%左右,牟氏角毛藻()、紫球藻()的EPA为20%左右,裂壶藻(sp.)的DHA含量为30%~45%,金藻()的DHA含量为15%左右(吉红等, 2020);另一方面,同鱼油相比,微藻产量受季节波动较小,稳定性较高,同时,作为初级生产者具有更高的安全性(张继红等, 2016; Roy, 2015)。因拟微绿球藻和裂壶藻分别含有丰富的EPA和DHA,所以当前许多有关微藻替代鱼油的研究集中在这两者上。在宝石鲈() (Hoestenberghe, 2016)、大西洋鲑() (Miller, 2007)和罗非鱼() (Sarker, 2016)等的研究中表明,裂壶藻部分或是完全替代鱼油不会对鱼体的生长性能和存活率产生负面影响,还可以增加肌肉的DHA含量,提高肌肉品质。另外,在欧洲鲈鱼()和牙鲆()的研究中表明,用拟微绿球藻替代50%~100%的饲料鱼油时,实验鱼的生长和饲料利用率无明显变化(Qiao, 2014; Haas, 2016)。在大菱鲆幼鱼的实验中发现,添加5.0%~7.5%的拟微绿球藻粉替代16%~24%的鱼油,可以提高鱼体的抗氧化能力和免疫性能(胡冬雪, 2019)。
然而,在以往的报道中,主要集中在单一微藻对鱼油替代的研究,而单一替代容易造成DHA/EPA比值的变化,难以平衡n-3 HUFA营养,并影响鱼类生理功能(Eryalcin,2013)。另外,肠道作为鱼体的主要消化吸收器官,其功能的变化也是决定微藻能否被利用的关键,而先前在这一方面鲜有研究。本实验以我国北方主要养殖经济鱼类大菱鲆()为研究对象,在课题组前期实验的基础上,将拟微绿球藻和裂壶藻比例混合,评估在大菱鲆饲料中这种混合微藻替代鱼油的可能性,并分析对生长、体组成、肠道抗氧化及免疫能力的影响,以期丰富微藻在鱼油替代中的理论数据。
1 材料与方法
1.1 实验饲料的配制
以鱼粉、大豆浓缩蛋白和酪蛋白为主要蛋白源,鱼油和豆油为主要脂肪源,并补充矿物质、维生素和诱食剂等配制基础饲料。在此基础上,分别用裂壶藻粉和拟微绿球藻的混合物(裂壶藻∶拟微绿球藻=1∶8.60)替代基础饲料中的鱼油,替代比例分别为0、25%、50%和100%,以豆油进行调平,制成4组等氮等脂的实验饲料(表1)。4组实验饲料分别命名为D1、D2、D3和D4,其中D1组为对照组。实验原料及饲料脂肪酸组成情况见表2。所有饲料原料均粉碎过80目筛,依据实验配方,按照配比从小到大逐级均匀混合,随后加入油脂与干粉充分混匀,再加入适量蒸馏水再次混合均匀,挤压制成硬颗粒饲料,50℃左右烘干后,置于通风干燥处备用。
1.2 实验用鱼及实验管理
实验用鱼购买于山东省莱州市海胜苗种有限公司,养殖实验在山东省海洋资源与环境研究院室内循环水养殖实验室进行。将大菱鲆幼鱼先放置于养殖桶中,用对照组饲料暂养10 d,使其适应养殖环境。实验正式开始前,将其饥饿24 h,选取规格均匀、体色健康的大菱鲆幼鱼[平均体重为(39.69±0.25) g],随机放置于12个养殖桶内。每个桶内放置30尾幼鱼,每个实验组3个重复,养殖方式为循环水养殖,养殖实验周期为12周。实验期间每天在07:30和16:30饱食投喂2次,投喂30 min后排残饵并记录。水温控制在(16.5±1.0)℃,溶解氧(DO)>6.2 mg/L,盐度为24.6~27.5,pH为7.6~8.0,氨氮和亚硝酸氮含量均<0.1 mg/L。
1.3 实验样品采集
养殖实验结束后,将鱼禁食24 h,然后计数和称总重。之后,从每个养殖桶中随机取出8尾鱼,测定每尾鱼的体长和体重,其中3尾用于全鱼体成分分析,放置于–20℃冰柜保存。另外5尾鱼,先采用尾部静脉取血法取血,取出血液4℃静置4 h,经离心得到血清,将血清转移到离心管后迅速放入液氮中。之后,将采完血的大菱鲆进行解剖取样,分别分离出肠道和肌肉等组织,均放入离心管中后迅速转移到液氮中,后转移到–80℃超低温冰箱中保存,用于后期实验分析。
表1 实验饲料配方及营养水平(干物质%)
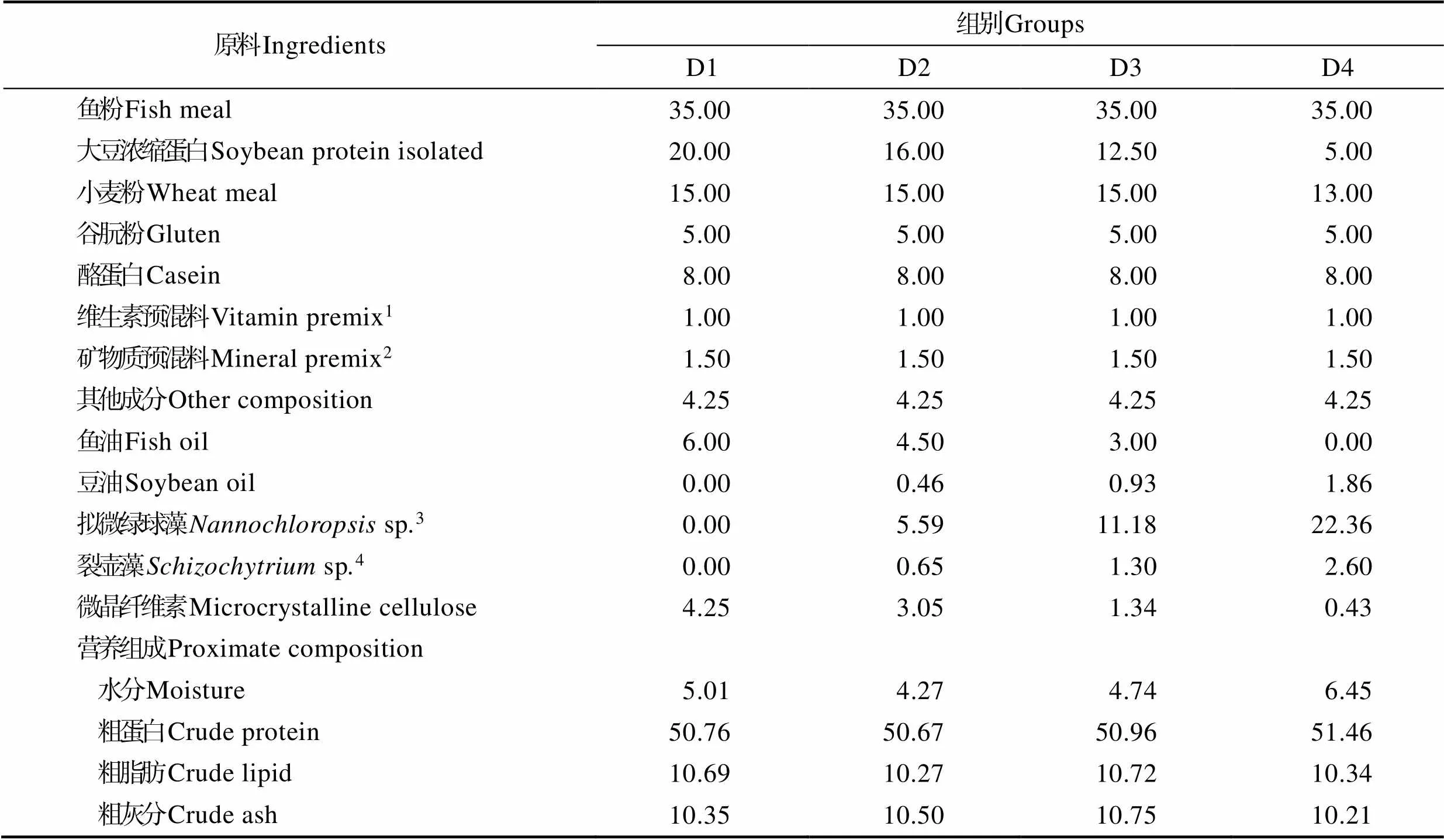
Tab.1 Formulation and proximate composition of experimental diets (dry matter %)
注:1:维生素混合料(mg/kg or IU/kg饲料):维生素A,7500.0 IU;维生素D,1500.0 IU;维生素E,60.0 mg;维生素K3,18.0 mg;维生素B1,12.0 mg;维生素B2,12.0 mg;维生素B6,20.0mg;维生素B12,0.1 mg;泛酸,48.0 mg;烟酰胺,90.0 mg;叶酸,3.7mg;D-生物素,0.2 mg;肌醇,60.0 mg;维生素C,310.0 mg;2:矿物质混合料(mg/kg饲料):锌,35.0 mg;锰,21.0 mg;铜,8.3 mg;铁,23.0 mg;钴,1.2 mg;碘,1.0 mg;硒,0.3 mg;3:拟微绿球藻:粗蛋白,9.55%;粗脂肪,25.46%;青岛越洋进出口有限公司,山东;4:裂壶藻:粗蛋白,44.50%;粗脂肪,18.25%;烟台海荣生物科技有限公司,山东。
Note: 1: Vitamin premix (mg/kg or IU/kg diet): Vitamin A 7500.0 IU, vitamin D 1500.0 IU, vitamin E 60.0 mg, vitamin K318.0 mg, vitamin B112.0 mg; vitamin B212.0 mg, vitamin B620.0 mg, vitamin B120.1 mg, pantothenate acid 48.0 mg, niacin 90 mg, folic acid 3.7 mg, D-biotin 0.2 mg, inositol 60.0 mg, vitamin C 310.0 mg; 2: Mineral premix (mg/kg diet): Zn 35.0 mg, Mn 21.0 mg, Cu 8.3 mg, Fe 23.0 mg, Co 1.2 mg, I 1.0 mg, Se 0.3 mg; 3:sp. (% dry matter basis): Crude protein, 9.55%; Crude lipid, 25.46%; Qingdao Yueyang Import and Export Co. Ltd, Qingdao, China; 4:sp. (% dry matter basis): Crude protein, 44.50%; Crude lipid, 18.25%; Yantai Hairong Biotechnology Co. Ltd., Yantai, China.
1.4 测定指标及方法
1.4.1 生长指标
存活率(survival rate, SR, %)=100×N/0;
增重率(weight gain rate, WGR, %)=100×(W–0)/0;
饲料效率(feed efficiency, FE)=(W–0)/;
蛋白质效率(protein efficiency ratio, PER, %)= 100×(W–0)/(×);
脂肪效率(lipid efficiency ratio, LER, %)= 100×(W–0)/(×);
肝体比(hepatosomatic index, HSI, %)=100×W/t;
肥满度(condition factor, CF)=100×W/3;
式中,N为实验鱼末数量,0为实验鱼初数量,W为实验鱼末重(g),0为实验鱼初重(g),为实验鱼养殖时间,为总投饵量(g),为饲料中蛋白质的含量(%),为饲料中脂肪含量(%),W为实验鱼肝脏重量,为实验鱼末体长(cm)。
表2 实验饲料及原料脂肪酸组成(%总脂肪酸)

Tab.2 Fatty acids composition of the experimental diets and raw materials (% total fatty acids)
注:1:SFA:饱和脂肪酸;2: MUFA:单不饱和脂肪酸;3:n-6 PUFA:n-6系列多不饱和脂肪酸;4: EPA:C20:5n-3;5: DHA:C22:6n-3;6:n-3 PUFA:n-3系列多不饱和脂肪酸;7: PUFA:多不饱和脂肪酸;下同。
Notes: 1:SFA: Saturated fatty acids;2:MUFA: Mono-unsaturated fatty acids;3:n-6 PUFA: n-6 poly-unsaturated fatty acids; 4:EPA: Eicosapentaenoic acid (C20:5n-3); 5:DHA: Docosapentaenoic acid (C22:6n-3); 6:n-3 PUFA: n-3 poly-unsaturated fatty acid; 7:PUFA: Polyunsaturated fatty acids; the same as below.
1.4.2 实验样品及饲料常规营养指标分析 实验样品及饲料水分测定采用105℃烘干恒重法测定(GB/T 6435-2006),粗蛋白采用凯氏定氮法测定(GB/T 6432-2006),粗脂肪采用索氏抽提法测定(GB/T 6433-2006),粗灰分采用马弗炉550℃失重法测定(GB/T 6438-2007),脂肪酸含量测定参考Mourente等(1999)的气相色谱法并稍作修改,利用高效气相色谱仪(SHIMADZU GC-2010, 日本)测得。
1.4.3 肠道生理生化指标分析 肠道中胰蛋白酶(trypsin)、脂肪酶(lipase)、淀粉酶(amylase)、超氧化物歧化酶(superoxide dismutase, SOD)、总抗氧化能力(total antioxidant capacity, T-AOC)、过氧化氢酶(catalase, CAT)、丙二醛(malondialdehyde, MDA)、酸性磷酸酶(acid phosphatase, ACP)、碱性磷酸酶(alkaline phosphatase, AKP)、溶菌酶(lysozyme, LZM)和补体C3 (complement component 3, C3)均利用南京建成生物工程研究所生产的相应试剂盒测得。
1.5 数据统计分析
实验数据用平均值±标准误(Mean±SE)来表示,用SPSS 19.0分析软件对实验数据进行单因素方差分析(one-Way ANOVA),使用Duncan’s检验方法对实验数据进行多重比较,当<0.05时,表示具有显著性差异。
2 结果
2.1 混合微藻替代鱼油对大菱鲆幼鱼生长性能及饲料利用的影响
由表3可知,大菱鲆幼鱼的WGR和FE随着替代比例的升高呈下降趋势,在D1、D2和D3组间无显著性差异(>0.05),而当混合微藻替代鱼油的比例达到100% (D4组)时,实验鱼的WGR和FE显著低于其他各组(<0.05)。不同实验组间的PER和LER呈现与FE相同的变化趋势(<0.05)。各实验组大菱鲆幼鱼的SR均在91.99%~100%之间,不同实验组间无显著性差异(>0.05)。
随着替代比例的升高,大菱鲆幼鱼的HSI呈下降趋势(<0.05),D4组幼鱼的HSI显著低于其他各实验组(<0.05),而D1组幼鱼的HSI显著高于其他各实实验组(<0.05)。另外,各实验组幼鱼的CF在不同处理组间无显著性差异(>0.05)。
2.2 混合微藻替代鱼油对大菱鲆幼鱼鱼体和肌肉化学组成的影响
由表4可知,当混合微藻替代鱼油的比例提高时,鱼体粗脂肪含量呈先升高后降低的变化趋势,当替代比例为25% (D2组)时,鱼体粗脂肪含量最高(9.43%),显著高于D1和D4组鱼体粗脂肪含量(8.71%和8.43%)(<0.05),而与D3组(8.90%)无显著性差异(>0.05)。鱼体粗蛋白含量呈现与粗脂肪含量相反的变化趋势,但不同实验组间无显著差异(>0.05)。同时,全鱼的水分和粗灰分含量在不同实验组间均无显著性差异(>0.05)。
表3 混合微藻替代鱼油对大菱鲆幼鱼生长性能及饲料利用的影响

Tab.3 Effects of fish oil replacement by mixed microalgae on growth performance and feed utilization of juvenile turbot
注:表格中同行肩标相同小写字母或无字母表示差异不显著(>0.05),不同小写字母表示差异显著(<0.05)。下同。
Note: In the same row, values with same small letter superscripts or no letter superscripts mean no significant differences (>0.05), different small letter superscripts mean significant differences (<0.05). The same as below.
表4 混合微藻替代鱼油对大菱鲆幼鱼鱼体化学组成的影响(%干重)

Tab.4 Effects of fish oil replacement by mixed microalgae on body chemical composition of juvenile turbot (% dry weight)
肌肉粗脂肪含量呈现同全鱼粗脂肪含量相同的变化趋势,也是在替代比例为25% (D2组)时达到最大值(1.75%),显著高于D3和D4组(1.49%和1.38%),与D1组(1.64%)无显著性差异(>0.05)。随着饲料中混合微藻比例的升高,大菱鲆幼鱼肌肉中水分、粗蛋白和粗灰分含量均未发生显著性变化(0.05)。
2.3 混合微藻替代鱼油对大菱鲆幼鱼鱼体和肌肉脂肪酸组成的影响
表5、表6分别显示了混合微藻替代鱼油对大菱鲆幼鱼鱼体和肌肉脂肪酸组成的影响。研究表明,随着混合微藻替代鱼油比例的升高,大菱鲆幼鱼鱼体中SFA、MUFA、C20:4n-6和n-6 PUFA含量显著升高,在D4组均达到最大值,且显著高于对照组(<0.05)。而EPA、DHA和n-3PUFA含量随之显著下降,对照组(D1)含量显著高于其他各组(<0.05)。但饱和脂肪酸(C14:0、C16:0)和C18:3n-3含量在不同处理组间无显著性差异(>0.05)。
另外,肌肉脂肪酸组成同鱼体有一些不同的变化,其肌肉中SFA、C20:4n-6和DHA含量在不同实验组间无显著性差异(>0.05)。随着混合微藻替代比例的提高,肌肉中单不饱和脂肪酸(C16:1n-7、C18:1n-9、C18:1n-7、C22:1n-9)、EPA和n-3 PUFA含量呈显著降低趋势(<0.05),而n-6多不饱和脂肪酸(C18:2n-6、C20:3n-6和n-6PUFA)和PUFA含量呈显著升高的趋势(<0.05)。
2.4 混合微藻替代鱼油对大菱鲆幼鱼肠道消化酶活力的影响
由表7可知,随着替代比例的升高,肠道脂肪酶活力呈先升高后降低的变化趋势,在D3组达到最大值,显著高于对照组(<0.05),但与D2组、D4组无显著性差异(>0.05)。肠道胰蛋白酶活力也是在D3组最高,显著高于D2组(<0.05),同D1、D4组无显著性差异(>0.05)。同时,结果显示,大菱鲆幼鱼肠道淀粉酶活力在不同实验组无显著性差异(>0.05)。
表5 混合微藻替代鱼油对大菱鲆幼鱼全鱼脂肪酸组成的影响(%总脂肪酸)

Tab.5 Effects of fish oil replacement by mixed microalgae on whole fish body fatty acid composition of juvenile turbot (% total fatty acids)
表6 混合微藻替代鱼油对大菱鲆幼鱼肌肉脂肪酸组成的影响(%总脂肪酸)
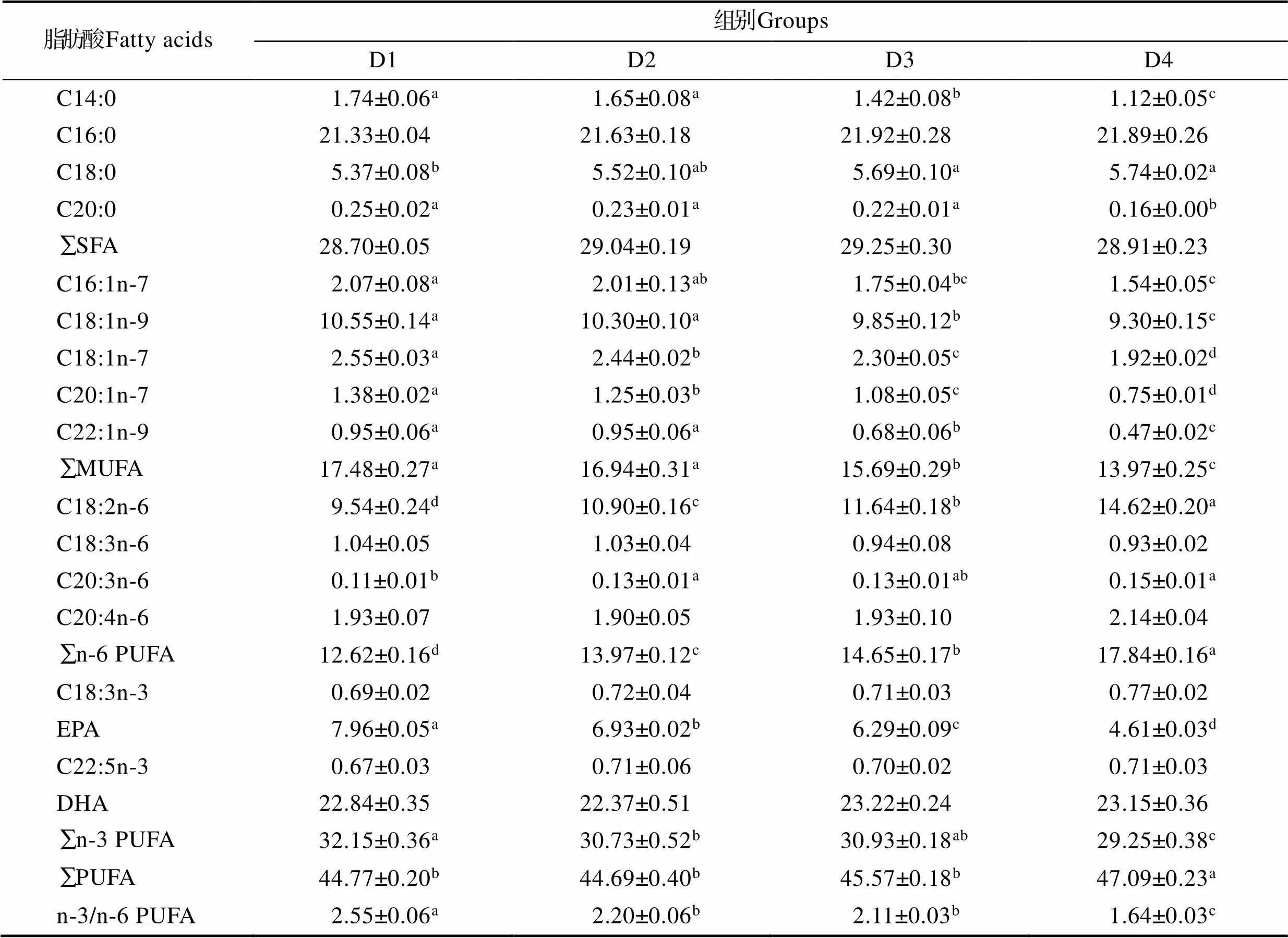
Tab.6 Effects of fish oil replacement by mixed microalgae on muscle fatty acid composition of juvenile turbot (% total fatty acids)
表7 混合微藻替代鱼油对大菱鲆幼鱼肠道消化酶活力的影响
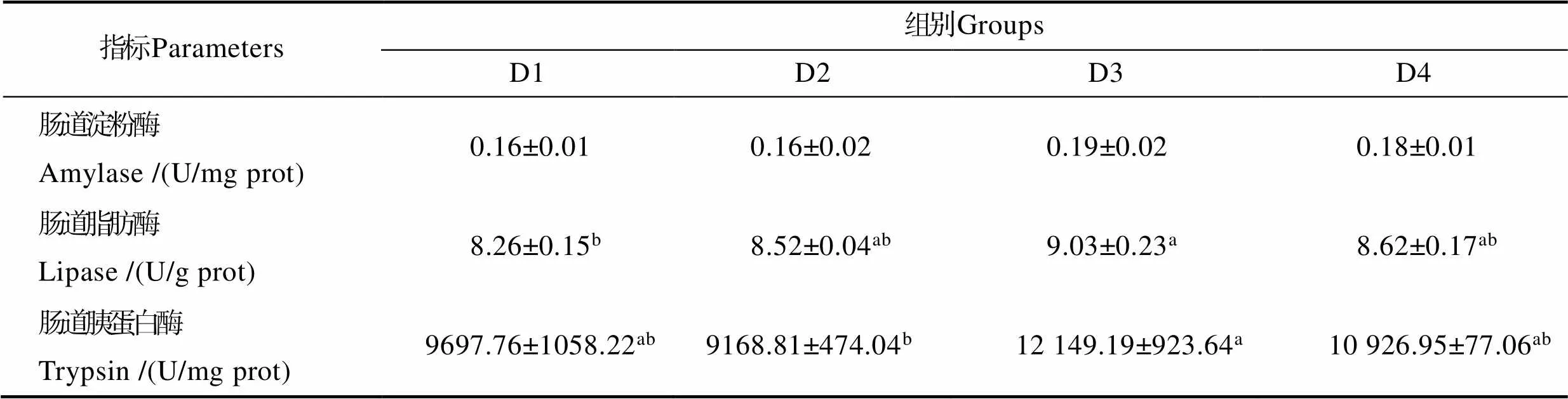
Tab.7 Effects of fish oil replacement by mixed microalgae on digestive enzyme activities in intestinal tract of juvenile turbot
2.5 混合微藻替代鱼油对大菱鲆幼鱼肠道抗氧化能力的影响
表8显示,混合微藻替代鱼油后,大菱鲆幼鱼肠道的抗氧化能力发生了较为显著的变化。肠道中SOD活力随替代比例的提高呈先升高后降低的趋势,在D3组达到最大值,显著高于对照组(<0.05),同D2组和D4组无显著性差异(0.05)。同时,D3组肠道T-AOC和CAT活力显著高于其他各组,D1组和D2组的T-AOC活力无显著性差异,但均显著高于D4组。另外,肠道中MDA含量在不同实验组间并未表现出显著性差异(0.05)。
2.6 混合微藻替代鱼油对大菱鲆幼鱼肠道部分生化指标的影响
由表9可知,混合微藻替代鱼油对大菱鲆幼鱼肠道中ACP、AKP、LZM活力和补体C3含量均产生显著影响(<0.05)。ACP、LZM活力和补体C3含量均在D3组达到最大值,且均显著高于对照组(<0.05)。其中,D3组ACP活力和补体C3含量也显著高于D2组和D4组(<0.05),而D3组LZM活力同D2组和D4组无显著性差异(0.05)。当替代比例达到100%时,肠道AKP活力出于最低值,显著低于其他各实验组(<0.05),而D1组和D3组AKP活力显著高于其他实验组(<0.05),且两组间并无显著性差异(0.05)。
表8 混合微藻替代鱼油对大菱鲆幼鱼肠道抗氧化能力的影响

Tab.8 Effects of fish oil replacement by mixed microalgae on antioxidant capacity in intestinal tract of juvenile turbot
表9 混合微藻替代鱼油对大菱鲆幼鱼肠道部分生化指标的影响

Tab.9 Effects of fish oil replacement by mixed microalgae on activity of ACP, AKP, LZM and C3 in intestinal tract of juvenile turbot
3 讨论
3.1 混合微藻替代鱼油对大菱鲆幼鱼生长性能的影响
裂壶藻和拟微绿球藻因含有较高的n-3 HUFA,且同鱼油的脂肪酸组成大体相似(吉红等, 2020),成为近年来鱼油替代的研究热点。本实验在课题组前期工作的基础上,将裂壶藻和拟微绿球藻进行一定比例的混合,用于替代饲料中不同比例鱼油。需要解释的是,本实验配方中使用大豆浓缩蛋白(5%~20%)进行营养素调平,这一添加量的变化在先前的研究中表明并不会对鱼体生长造成负面影响。如在海鲈()(向芳琴等, 2017)、珍珠龙胆石斑鱼(♀ ×♂) (Wang, 2020)、大黄鱼() (冯建等, 2017)的研究中均表明,饲料中添加不超过20%的大豆浓缩蛋白对鱼体生长性能无显著性影响。本实验结果显示,替代比例在25%和50%时,大菱鲆幼鱼的WGR和FE均与对照组无显著性差异(0.05),这也进一步证实了利用微藻替代一定比例的鱼油是可行的。这一结果与先前的不少研究结果类似,如Haas等(2016)在欧洲鲈鱼中的研究表明,用拟微绿球藻和绿色巴夫藻(Pauloca )替代50%~100%的鱼油时,对实验鱼的生长性能并未产生不良影响。杨帆(2018)在凡纳滨对虾()的研究中发现,饲料中添加3%破壁裂壶藻可以显著提高其SR、末均重和WGR,同时能显著降低饲料系数(<0.05)。Patterson等(2013)用拟微绿球藻和舟形藻饲喂红姑鱼()的研究中也得到了类似的实验结果。同时,刘宏超等(2016)进一步证实了适宜水平裂壶藻(0.8%~1.2%)能够对津新鲤(var.)的生长产生明显的促进作用。这些结果均表明,微藻作为水产动物的油源,在一定程度上可产生同鱼油一样的效果,使动物体获得较好的生长性能。

3.2 混合微藻替代鱼油对大菱鲆幼鱼鱼体和组织化学组成的影响

值得注意的是,本研究中幼鱼鱼体和肌肉中粗脂肪含量在不同实验组间发生了显著性变化,特别是肌肉中粗脂肪含量。与对照组相比,D3和D4组肌肉中粗脂肪含量较低,且D4组要显著低于对照组(<0.05),同时,全鱼中粗脂肪含量也在D4组最低。先前的研究已表明,微藻在促进水产动物脂质代谢方面效果显著。Van等(2016)在鳕鱼()中的研究发现,用40%裂壶藻替代鱼油可以显著降低肌肉中脂肪含量。在大西洋鲑(Sprague, 2017)、星斑川鲽(张燕等, 2017)等研究中也得到了类似结论。产生这一结果的原因,可能是有以下两方面:一方面,微藻中的n-3 HUFA,如裂壶藻中的DHA,相比于鱼油中的n-3 HUFA可以更高效地在鱼体中沉积,进而促进了鱼体中脂质水解,降低了脂肪沉积(Xing, 2020);另一方面,由于D3和D4组中含有较高比例的拟微绿球藻,该藻中色素含量较高,约占干藻类生物量的5%左右,而色素在机体内难以被消化吸收(Lubian, 2002),同时也发现,D3和D4组的LER要显著低于对照组,从而得知这2组中脂肪利用率较低,故脂肪沉积较少,这可能是造成这2组幼鱼脂肪沉积较少的另一原因。
通过分析鱼体和肌肉的脂肪酸组成发现,二者的脂肪酸组成在一定程度上反映饲料脂肪酸的组成特点与Peng等(2014)在关于大菱鲆脂肪酸营养方面的研究结论相似,也与以往微藻相关实验结论相一致,这也进一步表明微藻中的脂肪酸营养可以很好地被大菱鲆幼鱼所利用。本实验结果显示,全鱼中C18:1n-9、C18:1n-7和MUFA含量均呈现与饲料相反的变化趋势,这可能是由单不饱和脂肪酸作为能量的主要供应,在体内更容易被氧化提供能量,从而被优先利用(Karalazos, 2007)。而肌肉中的MUFA呈现与饲料组成相类似的变化趋势,这也暗示,单不饱和脂肪酸在不同组织中被利用的程度不同,也就造成了不同的沉积量。同时,全鱼和肌肉中的C18:2n-6、C20:4n-6以及n-6 PUFA含量变化趋势均呈现同饲料相一致,可能是因为对照组饲料中C18:2n-6含量已经较高,可以满足鱼体的正常生长需求,从而过剩的沉积到组织中,这与在尖吻重牙鲷() (Piedecausa, 2007)的研究相一致。实验还发现,随替代比例的提高,全鱼和肌肉中EPA含量均显著降低,这是由EPA和C20:4n-6存在天然的竞争关系所造成的,ARA可以在一定程度上抑制EPA竞争融入机体组织的能力(王成强等, 2016),从而出现了这一实验结果。肌肉中DHA含量在一定程度上得到了提高,这与全鱼DHA含量变化趋势相反,这也说明大菱鲆具有将C18:3n-3转化成DHA的能力,但不同部位合成能力不同,也就造成了不同组织对DHA沉积量有差异。同时,本实验结果表明,相比于全鱼,大菱鲆肌肉的脂肪酸组成能够更好地反映出饲料的脂肪酸组成。
3.3 混合微藻替代鱼油对大菱鲆幼鱼肠道消化酶指标的影响
肠道中的一系列消化酶(胰蛋白酶、脂肪酶及淀粉酶等)可将摄入的食物进行分解、消化和吸收,保障机体的营养摄取,其酶活力的高低直接反映了机体的消化能力。本研究中,肠道脂肪酶和胰蛋白酶在不同实验组间具有显著的变化趋势,且在替代量为50%和100%时均出现较高活力。这也表明,饲料中添加微藻可在一定程度上促进鱼体肠道消化功能。马季等(2020)研究表明,用微藻和大豆油替代鱼油后,大菱鲆幼鱼的淀粉酶、脂肪酶以及胰蛋白酶均显著高于对照组。而本研究中,当替代量为100%时,虽然消化酶活力也处于较高水平,但与对照组无显著性差异,可能是由于两项实验中微藻的总添加量不同而造成的结果差异。杨帆等(2013)在凡纳滨对虾的研究中证实,3%的破壁裂壶藻或未破壁裂壶藻均会提高肠道胰蛋白酶的mRNA的表达水平,增强肠道的消化能力。微藻可以促进肠道消化酶的活力,可能除了与含有较高比例的n-3 HUFA有关以外,还与本身含有一定比例的蛋白和总糖相关(陈秀丽等, 2016)
3.4 混合微藻替代鱼油对大菱鲆幼鱼肠道抗氧化及非特异性免疫指标的影响
肠道作为水生动物的一种重要器官,不仅是营养物质充分消化和吸收的保证,也在免疫调节、黏膜屏障、信号识别和内源性活性分子产生中也扮演着重要的角色(NRC, 2011),其抗氧化及免疫能力水平可以间接反映水生动物本身的免疫水平。SOD、T-AOC等是反映机体抗氧化系统功能综合水平的主要指标,是生物体内广泛存在的抗氧化酶,可以有效清除活性氧自由基以保护机体组织免受损伤(Pastor, 1988)。MDA是反映机体细胞受自由基攻击的严重程度的主要指标,是脂肪氧化的终产物之一。本研究中,当混合微藻替代鱼油为50%时,肠道SOD和T-AOC活力显著高于对照组(<0.05),这说明微藻可提高肠道的抗氧化能力。这可能主要是因为微藻中含有丰富的色素,特别是类胡萝卜素和叶绿素,这些色素是一种天然的抗氧化剂,可在一定程度上保护细胞免受自由基的侵害,增强机体的抗氧化水平,保障机体健康(苏怡等, 2016)。刘宏超等(2016)在津新鲤中的研究也表明,适量裂壶藻(0.8%~1.2%)在增强鱼体抗氧化能力方面具有显著的作用,还可以显著降低血清中MDA含量,进一步证实裂壶藻具有较强的清除机体自由基和减少脂质过氧化的能力。
AKP及ACP是生物体内重要的代谢调控酶,其本身不仅可以水解入侵的病原体,且可以促进吞噬细胞的吞噬及降解作用,在机体非特异性免疫反应中发挥重要作用(Gisbert, 2018)。本研究中,替代比例为50%时,ACP活力显著升高,AKP活力也处于较高水平,这也说明添加一定水平的微藻,可以增强大菱鲆幼鱼的非特异性免疫能力。这在LZM和补体C3的结果中也得到了验证,LZM和补体C3均在机体非特异性免疫中发挥重要作用,补体C3是体内重要的补体因子,当机体免疫反应被抑制时,其可以作为主要的补体来弥补;LZM是吞噬细胞杀菌的物质基础,能保护机体免受外源微生物的入侵(Saurabh, 2008),从而对机体健康起到保护作用。本研究中,LZM和补体C3同ACP呈现一致的变化趋势,在替代量为50%时达到较高值,这也进一步说明,在此替代水平上,大菱鲆幼鱼获得了较高的非特异性免疫能力。在凡纳滨对虾(杨帆, 2018)、星斑川鲽(张燕等, 2017)的实验均表明,饲料中添加适量的裂壶藻等微藻可以提高体内LZM活力,增强机体的抗病力。产生这一结果可能是因为微藻外层细胞壁含有丰富的多糖,而微藻多糖中的活性物质在抗氧化、抗病毒及提升免疫力方面具有显著作用(李洁琼等, 2016)。
4 结论
综上所述,在本实验条件下,用混合微藻(11.18%拟微绿球藻+1.30%裂壶藻)替代50%鱼油时,(39.69±0.25) g大菱鲆幼鱼可以获得较佳的生长性能,同时可以提高肠道消化酶活力、抗氧化及非特异性免疫能力,增强肠道健康水平。本研究为混合微藻替代鱼油研究提供了一定的理论依据;与此同时,本研究也发现,当单种微藻或混合微藻添加量过多时,会引起鱼体生长、饲料利用以及免疫能力的降低。
CHEN X L, MIN H Y, DENG P Y,. Application of the DHA-enrichedin animal husbandry. Feed Expo, 2016, 6(1): 28–31 [陈秀丽, 闵红艳, 邓蒲媛, 等. 富含DHA的裂殖壶菌作为饲料添加剂在动物生产中的应用. 饲料博览, 2016, 6(1): 28–31]
CRUZ-GARCIA, LS, BOURAOUI L, SAERA-VILA A,. Changesin adipocyte cell size, gene expression of lipid metabolism markers, and lipolytic responses induced by dietary fish oil replacement in gilthead sea bream (L.). Comparative Biochemistry and Physiology, Part A, Molecular and Integrative Physiology, 2011, 158(6): 391–399
ERYALCIN K M, ROO J, SALEH R,. Fish oil replacement by different microalgal products inmicrodiets for early weaning of gilthead sea bream (L.). Aquaculture Research, 2013, 44(2): 819–828
FENG J, WANG P, HE J J,Effect of replacing fish meal with soybean protein concentrate on growth, body composition, serum biochemical indices, and liver histology of juvenile large yellow croaker (). Journal of Fishery Sciences of China, 2017, 24(2): 268–277 [冯建, 王萍, 何娇娇, 等. 大豆浓缩蛋白替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及肝组织学的影响. 中国水产科学, 2017, 24(2): 268–277]
GISBERT E, NOLASCO H, SOLOVYEV M. Towards the standardization of brush border purification and intestinal alkaline phosphatase quantification in fish with notes on other digestive enzymes. Aquaculture, 2018, 487(4): 102–108
HAAS S, BAUER J L, ADAKLI A,. Marine microalgaeandspas n-3 PUFA source in diets for juvenile European sea bass (L). Journal of Applied Phycology, 2016, 28(2): 1011–1021
HU D X, MA J, ZHANG Y,. Effects of green algameal on physiology and body fatty acid composition in juvenile turbotFisheries Science, 2019, 38(1): 1–9 [胡冬雪, 马季, 张燕, 等. 拟微绿球藻粉对大菱鲆幼鱼生理和脂肪酸组成的影响. 水产科学, 2019, 38(1): 1–9]
JI H, XIAO F F, XING J X,. Research progress on the application of microalgae resources in aquatic feed. Feed Industry, 2020, 41(16): 1–12 [吉红, 肖芬芬, 邢君霞, 等. 微藻资源在水产饲料中应用的研究进展. 饲料工业, 2020, 41(16): 1–12]
KARALAZOS V, BENDIKSEN E Å, DICK J R,. Effects of dietary protein, and fat level and rapeseed oil on growth and tissue fatty acid composition and metabolism in Atlantic salmon (L.) reared at low water temperatures. Aquaculture Nutrition, 2007, 13(4): 256–265
KISSINGER K R, GARCÍA-ORTEGA A, TRUSHENSKI J T. Partial fish meal replacement by soy protein concentrate, squid and algal meals in low fish-oil diets containingfor longfin yellowtail. Aquaculture, 2016, 452(5): 37–44
LI J Q, LIU H Q, YUAN S. Research progress of microalgae polysaccharide. Modern Chemical Industry, 2016(6): 60–62 [李洁琼, 刘红全, 袁莎. 微藻多糖的研究进展. 现代化工, 2016(6): 60–62]
LI M H, ROBINSON E H, TUCKER C S,. Effects of dried algaesp. a rich source of docosahexaenoic acid, on growth, fatty acid composition, and sensory quality of channel catfish. Aquaculture, 2009, 292(3/4): 232–236
LI Q, CHEN G Q, FAN K W,Screening and characterization of squalene-producing thraustochytrids from Hongkong mangroves. Journal of Agricultural and Food Chemistry, 2009, 57(10): 4267–4672
LIU H C, CHENG Z Y, ZHAI S L,. Effects of dietaryon the growth performance, serum nonspecific immunity indices, and disease resistance ofvar. Jian. Progress in Fishery Sciences, 2016, 37(6): 42–48 [刘宏超, 程镇燕, 翟胜利, 等. 裂壶藻对津新鲤(var. Jian) 生长、血液非特异性免疫指标及抗病力的影响. 渔业科学进展, 2016, 37(6): 42–48]
LUBIAN L M, MONTERO O, MORENO-GARRIDO I,. Nannochloropsis () as source of commercially valuable pigments. Journal of Applied Phycology, 2002, 12(3/4/5): 249−255
MA J. Screening of attractants in fishmeal-free diet and effects of vegetable oil replacing fish oil on turbot (L.). Master′s Thesis of Shanghai Ocean University, 2020, 52–53 [马季. 无鱼粉饲料中诱食剂的筛选及植物油替代鱼油对大菱鲆的作用效果. 上海海洋大学硕士研究生学位论文, 2020, 52–53]
MILLER M R, NICHOLS P D, CARTER C G. Replacement of fish oil with thraustochytridsp. L oil in Atlantic salmon parr (L) diets. Comparative Biochemistry and Physiology, Part A, Molecular and Integrative Physiology, 2007, 148(2): 382−392
MOURENTE G, TOCHER D R, DIAZ-SALVAGO E,Study of the n-3 highly unsaturated fatty acids requirement and antioxidant status oflarvae at the artemia feeding stage. Aquaculture, 1999, 179(2): 291–307
NRC. Nutrient requirements of fish and shrimp. Washington, D.C.: National Academic Press, 2011
PASTOR A, MEDINA J, RAMO J D,. Determination of lead in treated crayfish: Accumulation in different tissues. Bulletin of Environmental Contamination and Toxicology, 1988, 41(3): 412–418
PATTERSON D, DONOVAN, GATLIN D M,. Valuation of whole and lipid- extracted algae meals in the diets of juvenile red drum (). Aquaculture, 2013, 416-417: 92–98
PENG M, XU W, MAI K,. Growth performance, lipid deposition and hepatic lipid metabolism related gene expression in juvenile turbot (L.) fed diets with various fish oil substitution levels by soybean oil. Aquaculture, 2014, 433 (3): 442–449
PIEDECAUSA M A, MAZÓN M J, GARCÍAGARCÍA B,. Effects of total replacement of fish oil by vegetable oils in the diets of sharpsnout seabream (). Aquaculture, 2007, 263(1/2/3/4): 211–219
QIAO H, WANG H, SONG Z,. Effects of dietary fish oil replacement by microalgae raw materials on growth performance, body composition and fatty acid profile of juvenile olive flounder,. Aquaculture Nutrition, 2014, 20(6): 646–653
ROY S S, PAL R. Microalgae in aquaculture: A review with special references to nutritional value and fish dietetics. Proceedings of the Zoological Society, 2015, 68(1): 1–8
SARKER P K, KAPUSCINSKI A R, LANOIS A J,. Towards sustainable aquafeeds: Complete substitution of fish oil with marine microalgasp. improves growth and fatty acid deposition in juvenile Nile tilapia (). PLoS One, 2016, 11(6): 156684
SAURABH S, SAHOO P K. Lysozyme: An important defence molecule of fish innate immune system. Aquaculture Research, 2008, 39(3): 223–239
SHAHIDI F, AMBIGAIPALAN P. Omega-3 polyunsaturated fatty acids and their health benefits. Annual Review of Food Science and Technology, 2018, 9(1): 345–381
SPRAGUE M, BETANCOR M B, TOCHER D R. Microbial and genetically engineered oils as replacements for fish oil in aquaculture feeds. Biotechnology Letters, 2017, 39(11): 1599–1609
SU Y, GAO B Y, ZHANG C W. An overview: Biomolecules from microalgae for animal feed and aquaculture animals. Breeding and Feed, 2016(2): 17–25 [苏怡, 高保燕, 张成武. 微藻生物分子在动物和水产养殖饲料中的应用. 养殖与饲料, 2016(2): 17–25]
TIBALDI E, CHINI ZITTELLI G, PARISI G,. Growth performance and quality traits of European sea bass () fed diets including increasing levels of freeze-driedsp. (T-ISO) biomass as a source of protein and n-3 long chain PUFA in partial substitution of fish derivatives. Aquaculture, 2015, 440(7): 60–68
VAN H S, FRANSMAN C, LUYTEN T,.as a replacement for fish oil in a fishmeal free diet for jade perch,(McCulloch & Waite). Aquaculture Research, 2016, 47(6): 1747−1760
WANG C Q, LIANG M Q, XU H G,. Requirement of arachidonic acid in adult Japanese sea bass (). Progress in Fishery Sciences, 2016, 37(5): 46–55 [王成强, 梁萌青, 徐后国, 等. 大规格鲈鱼()对饲料中花生四烯酸的需求量. 渔业科学进展, 2016, 37(5): 46–55]
WANG J X, LIANG D Z, YANG Q H,. The effect of partial replacement of fish meal by soy protein concentrate on growth performance, immune responses, gut morphology and intestinal inflammation for juvenile hybrid grouper (♀×). Fish and Shellfish Immunology, 2020, 98: 619–631
XIANG F Q. Effect of sea bass on growth, immune and intestinal flora by soy protein concentrate. Master′s Thesis of Hunan Agricultural University, 2017, 5–7 [向芳琴. 大豆浓缩蛋白对海鲈生长、免疫及肠道菌群的影响. 湖南农业大学硕士研究生学位论文, 2017, 5–7]
XING J, XIAO F, LUO X,. Effect of dietarysp. oil as an n-3 long-chain polyunsaturated fatty acid source on growth performance, lipid metabolism and antioxidant status in juvenile grass carp (): A comparative study with fish oil. Aquaculture Research, 2020, 51: 4551–4564
YANG F. Application of raffinose andsp. in the feed of juvenile Pacific white shrimp,Master′s Thesis of Zhongshan University, 2018, 38–40 [杨帆. 棉籽糖和裂壶藻在凡纳滨对虾饲料中的应用研究. 中山大学硕士研究生学位论文, 2018, 38–40]
ZHANG J H, REN D D, JIANG Y S,. Microalgae in aquaculture: A review to nutritional value and rotifers enrichment. Science and Technology of Food Industry, 2016, 37(20): 371–376 [张继红, 任丹丹, 姜玉声, 等. 微藻营养价值及其在水产生物营养强化中的应用. 食品工业科技, 2016, 37(20): 371–376]
ZHANG Y, QIAO H J, LI B S,. Effects of replacement of fish oil by microalgae meals on growth performance, tissue proximate composition and biochemical indices of juvenile starry flounder,. Journal of Fishery Sciences of China, 2017, 24(6): 1223–1233 [张燕, 乔洪金, 李宝山, 等. 微藻粉替代鱼油对星斑川鲽幼鱼生长、体组成和生理指标的影响. 中国水产科学, 2017, 24(6): 1223–1233]
ZHAO S L, CAI S S, XIA M Y,. Different wall-breaking methods ofChina Oils and Fats, 2017, 42(1): 109–111 [赵书林, 蔡双山, 夏木阳, 等. 裂殖壶菌不同破壁方法的研究. 中国油脂, 2017, 42(1): 109–111]
Effects of Fish Oil Replacement by Mixed Microalgae on Growth Performance, Body Chemical Composition and Intestinal Tract Biochemical Indices of Juvenile Turbot ()
WANG Chengqiang, CAO Tihong, LI Baoshan, WANG Jiying①, HAO Tiantian, SONG Zhidong, WANG Xiaoyan, SUN Yongzhi
(Shandong Marine Resource and Environment Research Institute, Shandong Key Laboratory of Marine Ecological Restoration, Yantai, Shandong 264006, China)
A 12-week feeding experiment was conducted to evaluate the effects of fish oil replacement by mixed microalgae on growth performance, body composition, digestive enzyme activities, and antioxidant indices in the intestinal tract of juvenile turbot () [mean initial weight (39.69±0.25) g]. Four isonitrogenous and isoenergetic diets were formulated with graded contents of dietary fish oil replacement by mixed microalgae, 0, 25%, 50%, and 100%, designated D1, D2, D3, and D4, respectively. The results showed that weight growth rate (WGR) and feed efficiency (FE) decreased with an increasing replacement ratio; no significant differences were found between D1, D2, and D3 groups (>0.05), but all three had significantly higher values than the D4 group (<0.05). The D1 group showed the highest value of the hepatosomatic index (HSI), which was significantly higher than that in other groups (<0.05). With an increasing replacement ratio, the body and muscle crude lipid contents increased at first, and then decreased, being significantly higher in the D4 group than in the D1 group (<0.05). The C20:4n-6 and n-6 PUFA in the whole fish body reached their peaks in the D4 group (<0.05), with significantly higher values than those in the D1 group (<0.05). However, EPA, DHA, and n-3 PUFA significantly decreased in D4 (<0.05). The activities of lipase and trypsin in the intestinal tract reached their peaks in the D3 group. The activities of superoxide dismutase (SOD), total antioxidant capacity (T-AOC), and catalase (CAT) in the intestinal tract of the D3 group were significantly higher than those in the D1 group (<0.05). Additionally, the activities of acid phosphatase (ACP), alkaline phosphatase (AKP) and lysozyme (LZM), as well as the complement component 3 (C3) contents in the intestinal tract, showed the same tendency as SOD. The malondialdehyde (MDA) contents in the intestinal tract were not significantly different across the groups (>0.05). These results indicate that 50% fish oil replacement by mixed microalgae does not influence the growth performance of juvenile turbot, and may increase the digestive enzyme activities and antioxidant ability in the intestinal tract.
;sp.;sp.; Growth performance; Intestinal tract biochemical indices
WANG Jiying, E-mail: ytwjy@126.com
10.19663/j.issn2095-9869.20210526001
S963
A
2095-9869(2022)04-0158-13
*山东省自然科学基金(ZR2019PC061; ZR2020QC205)和烟台市科技计划项目(2020MSGY067)共同资助[This work was supported by Natural Science Foundation of Shandong Province (ZR2019PC061; ZR2020QC205), and Science and Technology Development Plan of Yantai (2020MSGY067)]. 王成强,E-mail: chengqiangwang@126.com
王际英,研究员,E-mail: ytwjy@126.com
2021-05-26,
2021-06-18
http://www.yykxjz.cn/
王成强, 曹体宏, 李宝山, 王际英, 郝甜甜, 宋志东, 王晓艳, 孙永智. 混合微藻替代鱼油对大菱鲆幼鱼生长性能、体组成及肠道部分生化指标的影响. 渔业科学进展, 2022, 43(4): 158–170
WANG C Q, CAO T H, LI B S, WANG J Y, HAO T T, SONG Z D, WANG X Y, SUN Y Z. Effects of fish oil replacement by mixed microalgae on growth performance, body chemical composition and intestinal tract biochemical indices of juvenile turbot (). Progress in Fishery Sciences, 2022, 43(4): 158–170
(编辑 陈 辉)

