不同生物饵料组合对脊尾白虾幼体变态发育的影响*
王林华 沈南南 江海仪 欧阳乐飞 张庆起 胡广伟,2,3 王攀攀,2,3 高 焕,2,3
不同生物饵料组合对脊尾白虾幼体变态发育的影响*
王林华1沈南南1江海仪1欧阳乐飞1张庆起4胡广伟1,2,3王攀攀1,2,3高 焕1,2,3①
(1. 江苏海洋大学海洋科学与水产学院 江苏省海洋生物技术重点实验室 江苏 连云港 222005;2. 江苏省海洋生物产业技术协同创新中心 江苏 连云港 222005;3. 江苏省农业种质资源保护与利用平台 江苏 南京 210014;4. 连云港赣榆佳信水产开发有限公司 江苏 连云港 222100)
本研究以脊尾白虾()幼体为研究对象,研究了牟氏角毛藻()、褶皱臂尾轮虫和卤虫()无节幼体搭配投喂对脊尾白虾幼体的存活率(SR)、变态发育和消化酶的影响。结果显示,单一卤虫组的幼体变态发育速度最快,14 d内全部变态为仔虾,其他3组则需要15 d;单一卤虫组、牟氏角毛藻+卤虫组和轮虫+卤虫组的幼体变态为仔虾时的SR分别为84.33%、84.67%和83.00%,各组间差异不显著(0.05);投喂牟氏角毛藻+轮虫+卤虫混合饵料组的幼体在Z5~P阶段大量死亡,变态为仔虾时的SR为35.67%。单一卤虫组投喂的脊尾白虾幼体的胃蛋白酶(1.94 U/mg prot)、脂肪酶(2.35 U/mg prot)和α-淀粉酶(0.13 U/mg prot)活力在4个组中最高,牟氏角毛藻+轮虫+卤虫组的胃蛋白酶(0.08 U/mg prot)、脂肪酶(0.91 U/mg prot)和α-淀粉酶(0.08 U/mg prot)活力在4个组中最低;牟氏角毛藻+卤虫组和轮虫+卤虫组的α-淀粉酶活力均为0.12 U/mg prot,而轮虫+卤虫组幼体的脂肪酶(1.78 U/mg prot)和胃蛋白酶(0.39 U/mg prot)比牟氏角毛藻+卤虫组分别高0.35和0.04 U/mg prot。研究表明,在脊尾白虾育苗过程中,投喂卤虫无节幼体(3~5 ind./mL),能提高幼体SR和加快变态发育速度,同时,在养殖过程中加入一定的牟氏角毛藻可减缓养殖水体恶化的速度。
脊尾白虾;生物饵料;幼体发育指数;消化酶
虾类养殖是我国渔业产业重要的经济支柱之一(Zhao, 2007)。脊尾白虾()是我国特有的三大养殖经济虾类之一,其在我国大陆沿岸及朝鲜半岛西岸的浅海水域都有分布,其中,以我国黄、渤海地区产量最高(Li, 2003)。由于其味道鲜美、繁殖能力强和适应范围广等特点,已经成为我国池塘单养和其他种类混养的对象之一(马鸿梅等, 2019)。脊尾白虾由于个体较小,相对抱卵量也少,目前,主要依靠自然纳苗、捕捞天然苗或投放亲虾自行繁殖苗种,在一定程度上制约了规模化人工养殖的发展(黄经献等, 2018)。目前,国内外关于脊尾白虾工厂化养殖报道较少,实现脊尾白虾规模化人工养殖必须突破全人工育苗的难关。
饵料是保证对虾幼苗正常生长发育的营养基础(陆开宏等, 2001)。生物饵料是经过筛选的优质饵料生物,经人工培育后,作为鱼、虾、蟹等经济水产动物幼体的饵料(成永旭, 2005)。在南美白对虾() (梁华芳等, 2001)、克氏原螯虾() (夏晓飞等, 2011)、青蟹() (齐计兵, 2014)和中华绒螯蟹()(肖起珍等, 2017)等多种虾、蟹育苗中,都详细地研究了饵料对幼体变态发育的影响。关于饵料对脊尾白虾幼体变态发育影响的研究主要集中在摄食特点、饵料搭配对幼体发育的影响等方面,为脊尾白虾幼体阶段开口饵料的选择奠定一定的基础(黄经献等, 2018; 陆开宏等; 2001; 罗会明等, 1980; 陈建华等, 2017),但是关于生物饵料搭配对脊尾白虾幼体变态发育影响的研究还鲜有报道。牟氏角毛藻()大小适宜、易消化、营养丰富,常用做对虾育苗的开口饵料(成永旭, 2005; 张翠英, 1982)。梁华芳等(2001)研究表明,牟氏角毛藻在南美白对虾溞状幼体时期的饵料效果最好。褶皱臂尾轮虫()和卤虫()由于繁殖能力强、环境适应性广、营养丰富、大小适宜和易培养等优点,成为甲壳动物幼体培育中重要的生物饵料(黄旭雄, 2007; Suprayudi, 2004)。本研究在牟氏角毛藻、轮虫和卤虫3种生物饵料搭配对脊尾白虾生长存活和变态发育的基础上,进一步研究了3种生物饵料搭配对脊尾白虾幼体消化酶的影响,以期丰富脊尾白虾幼体阶段生物饵料搭配的选择,为规模化全人工育苗发展提供参考。
1 材料与方法
1.1 实验材料
脊尾白虾亲虾取自江苏连云港市赣榆养殖池塘,平均体长为(5.33±1.15) cm,平均体重为(2.64±1.4) g,将胚胎发育同步的抱卵虾按每3尾/组分别暂养于5 L的透明养殖箱孵化,挑选趋光性强、活力好的幼体进行实验。实验饵料牟氏角毛藻由江苏海洋大学海洋科学与水产学院藻种室提供,牟氏角毛藻扩培参考王玉(2020)的方法,取指数生长期的藻液用于实验。购买罐装卤虫卵于25℃充气孵化约24 h,静止5 min后取无节幼体用于实验。轮虫由江苏省海洋生物技术重点实验室提供,培养期间,投喂牟氏角毛藻。实验用水为人工配置的海水,盐度为25,pH为8.2。用于培养牟氏角毛藻和褶皱臂尾轮虫的海水经过煮沸,冷却后使用。
1.2 实验方法
1.2.1 脊尾白虾幼体培育及收集 实验在5 L的透明养殖箱中进行,根据预实验,设置4个实验组:A组为卤虫组;B组为牟氏角毛藻+卤虫组;C组为轮虫+卤虫组;D组为牟氏角毛藻+轮虫+卤虫组。每组放100尾幼虾(溞状幼体),设置3个重复。牟氏角毛藻密度设置参考梁华芳等(2001)的方法,轮虫密度设置参考罗会明等(1980)的方法,卤虫密度设置根据
于天基(2014)的方法。培养条件为自然光照,盐度为25,温度为24℃~26℃,每2 d换1/3的水,每天15:00使用便携式pH(型号pH818)测试笔测量pH,采用奥克丹W-I型水产水质分析仪检测水体氨氮(NH4+-N)、亚硝酸盐氮(NO2–-N) (检测试剂为奥克丹W-1型NH4+-N试剂和NO2–-N试剂)。养殖水体中,pH为8.2~8.4,NH4+-N为0.01~0.18 mg/L、NO2–-N为0.002~0.016 mg/L,溶解氧(DO)>5 mg/L,养殖时间为Z1(溞状幼体I期)~P(仔虾)期。每12 h调整1次饵料,使饵料的密度保持为初始密度。每天08:00统计幼体的存活率(survival rate, SR, %),采用体视显微镜(Nikon SME 1500,日本)观察幼体变态发育情况,统计各发育时期幼体的数量。实验结束后(幼体全部变态为仔虾),仔虾饥饿6 h,使用30目网筛收集仔虾,用液氮速冻后,–80℃保存,用于测定消化酶(胃蛋白酶、脂肪酶和α-淀粉酶)活力,试剂盒均购于南京建成生物工程研究所。
1.2.2 幼体发育指数和SR的计算 各发育阶段SR根据Aguirre-Guzmán 等(2001)的计算公式:
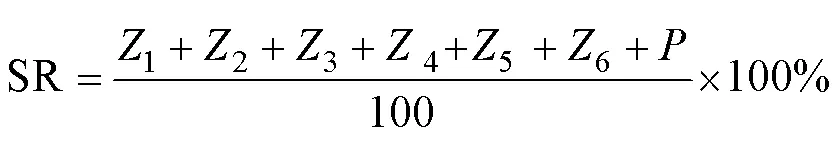
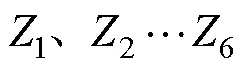
幼体发育指数(larval stage index, LSI)表示幼体发育的快慢,指数越大表示幼体发育速度越快,根据Millamena等(2000)的计算公式:
表1 饵料配方

Tab.1 Bait formula (ind./mL)
1.2.3 消化酶活力的测定 样品解冻后,采用吸水纸擦拭虾体表面多余的水分,分别称取0.1 g的仔虾,迅速置入1.5 mL的离心管中,加入0.9 mL的生理盐水,冰浴条件下,匀浆制成浓度为10%的匀浆液,4000 r/min,离心10 min,取上清液,待测。其中,蛋白总量、脂肪酶和胃蛋白酶均采用浓度为10%的上清液测定,α-淀粉酶用浓度为2%的上清液测定。
1.3 数据分析
采用SPSS 26软件分析数据,使用单因素方差分析(one-way ANOVA)进行比较且差异显著时运用Duncan´s多重比较,<0.05为差异显著,并使用Origin 2018软件进行绘图。
2 结果
2.1 不同饵料搭配对脊尾白虾幼体SR的影响
不同饵料搭配对脊尾白虾幼体SR的影响见表2。从表2可以看出,牟氏角毛藻+轮虫+卤虫组的SR在Z5~P阶段下降的最快,投喂单一卤虫的脊尾白虾幼体在Z1~Z2期SR较其他3组相比更低;轮虫+卤虫组的SR在Z1~Z2期最高,各实验组间相比差异不显著(>0.05)。卤虫组、牟氏角毛藻+卤虫组和轮虫+卤虫组的幼体变态为仔虾的SR分别为84.33%、84.67%和83.00%,各组间相比差异不显著(>0.05);牟氏角毛藻+轮虫+卤虫组幼体在Z5~P阶段大量死亡,变态为仔虾时的SR为35.67%,且和其他3个实验组从第12天开始相比差异显著(<0.05)。
2.2 不同饵料搭配对脊尾白虾LSI的影响
不同饵料搭配对各组LSI的影响见表3。从表3可以看出,从孵化后的第2天开始,不同饵料组之间呈现一定差异。在Z1~Z2期间,牟氏角毛藻+卤虫组幼体发育最快,卤虫组发育最慢。轮虫+卤虫组与卤虫组、牟氏角毛藻+卤虫组LSI相比差异显著(<0.05)。卤虫组在脊尾白虾幼体变态后期LSI最快,幼体全部变为仔虾需要14 d,与其他3组相比差异显著(<0.05);其次分别是牟氏角毛藻+卤虫组、轮虫+卤虫组和牟氏角毛藻+轮虫+卤虫组,幼体变为仔虾需要15 d。
2.3 不同饵料搭配对脊尾白虾幼体消化酶的影响
不同饵料搭配下,各实验组脊尾白虾幼体的α-淀粉酶、脂肪酶和胃蛋白酶活力见表4。从表4可以看出,卤虫组投喂脊尾白虾幼体的胃蛋白酶(1.94 U/mg prot)、脂肪酶(2.35 U/mg prot)和α-淀粉酶(0.13 U/mg prot)活力在4个组中最高,且与其他3组相比显著差异(<0.05)。牟氏角毛藻+轮虫+卤虫组的的胃蛋白酶(0.08 U/mg prot)、脂肪酶(0.91 U/mg prot)和α-淀粉酶(0.08 U/mg prot)活力在4个组中最低;牟氏角毛藻+轮虫组和轮虫+卤虫组的α-淀粉酶活力均为0.12 U/mg prot,而轮虫+卤虫组幼体的脂肪酶(1.78 U/mg prot)和胃蛋白酶(0.39 U/mg prot)比牟氏角毛藻+卤虫组分别高0.35和0.04 U/mg prot。
表2 不同饵料搭配下脊尾白虾幼体存活率
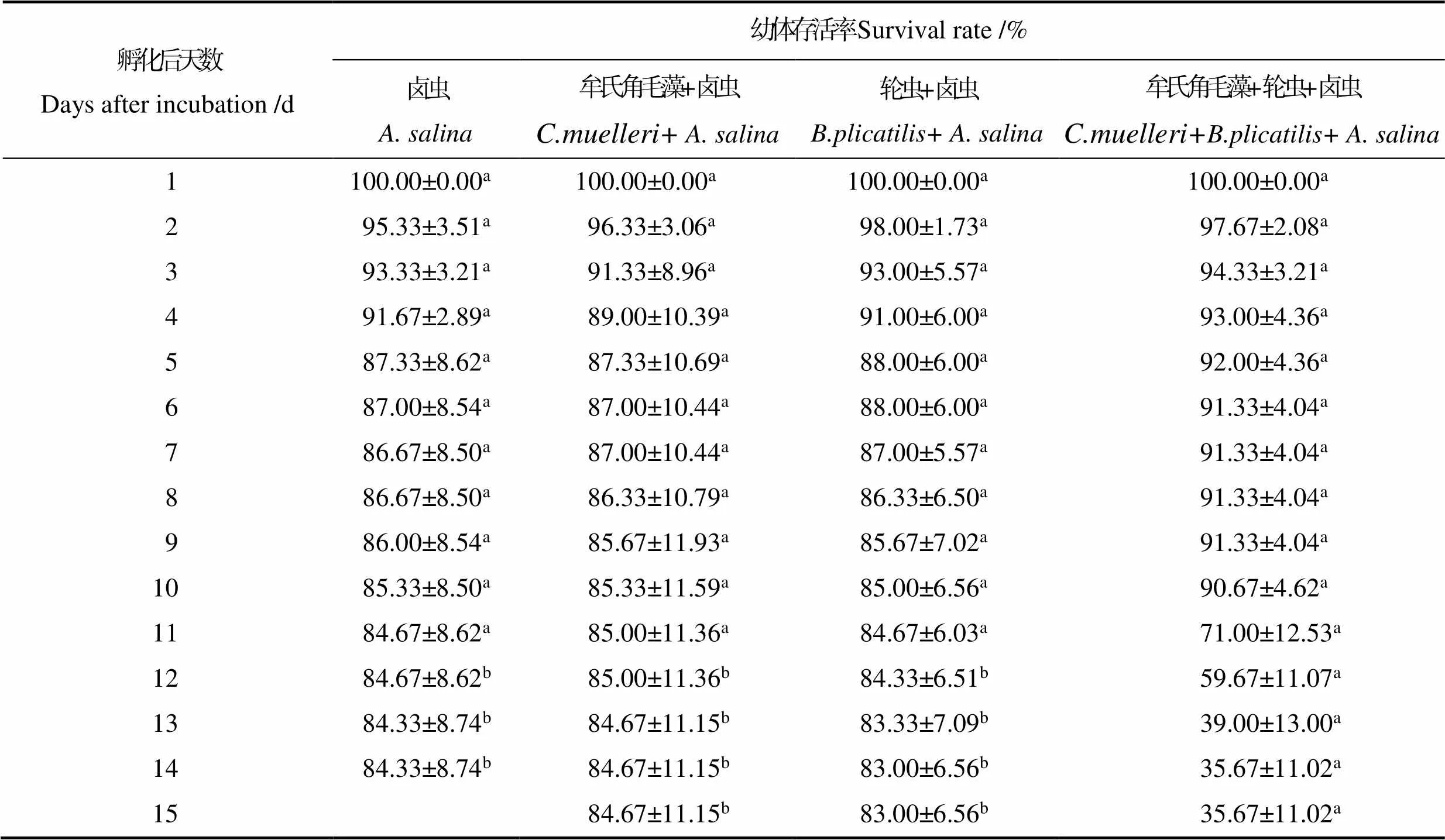
Tab.2 Effects of different diet combinations on the survival rate of E. carinicauda larvae
注:同一行中不同上标的字母表示显著差异(<0.05)。下同。
Note: Data with different superscript letters in the same column indicate significant differences (<0.05). The same as below.
表3 不同饵料搭配下脊尾白虾幼体发育指数
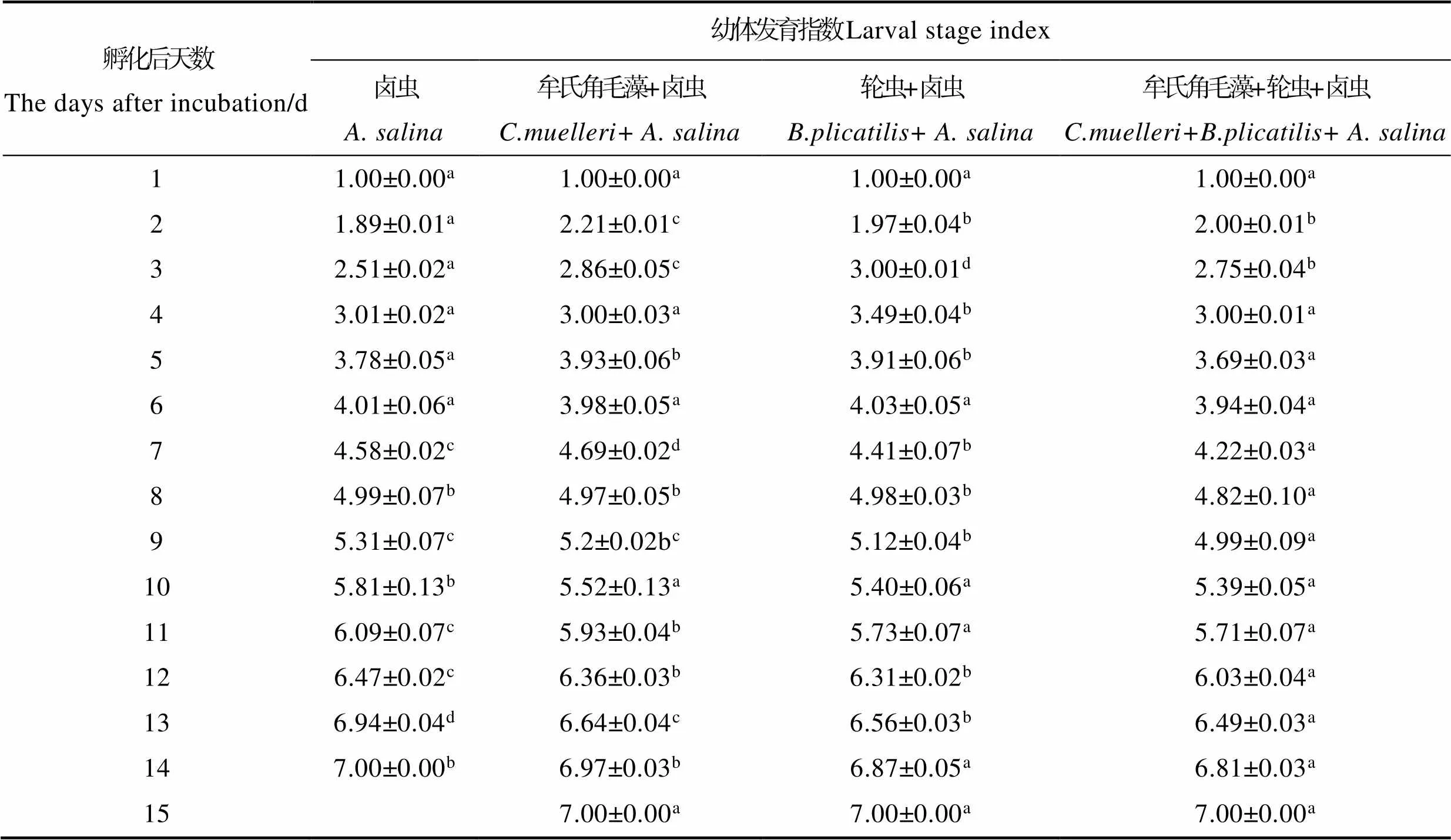
Tab.3 Effects of different diet combinations on the larval stage index of E. carinicauda
表4 不同饵料搭配下脊尾白虾幼体消化酶活性

Tab.4 Effects of different diet combinations on the digestive enzymes activities of E. carinicauda larvae
2.4 不同饵料搭配对脊尾白虾幼体养殖水体的影响
不同饵料搭配对脊尾白虾养殖水体的影响见图1。从图1可以看出,卤虫组和轮虫+卤虫组养殖水体中,NH4+-N浓度比牟氏角毛藻+卤虫组和牟氏角毛藻+轮虫+卤虫组高,卤虫组水体中,NH4+-N浓度在第7天最高,达到0.18 mg/L。从图2可以看出,卤虫组的NO2–-N浓度在第7天和第11天偏高,分别为0.091和0.097 mg/L,轮虫+卤虫组水体中,NO2–-N浓度在第11天达到0.095 mg/L。从图3可以看出,养殖期间,pH在8.20~8.35之间波动。总体而言,牟氏角毛藻+卤虫组和牟氏角毛藻+轮虫+卤虫组水体中NH4+-N和NO2–-N浓度比其他2个组低。
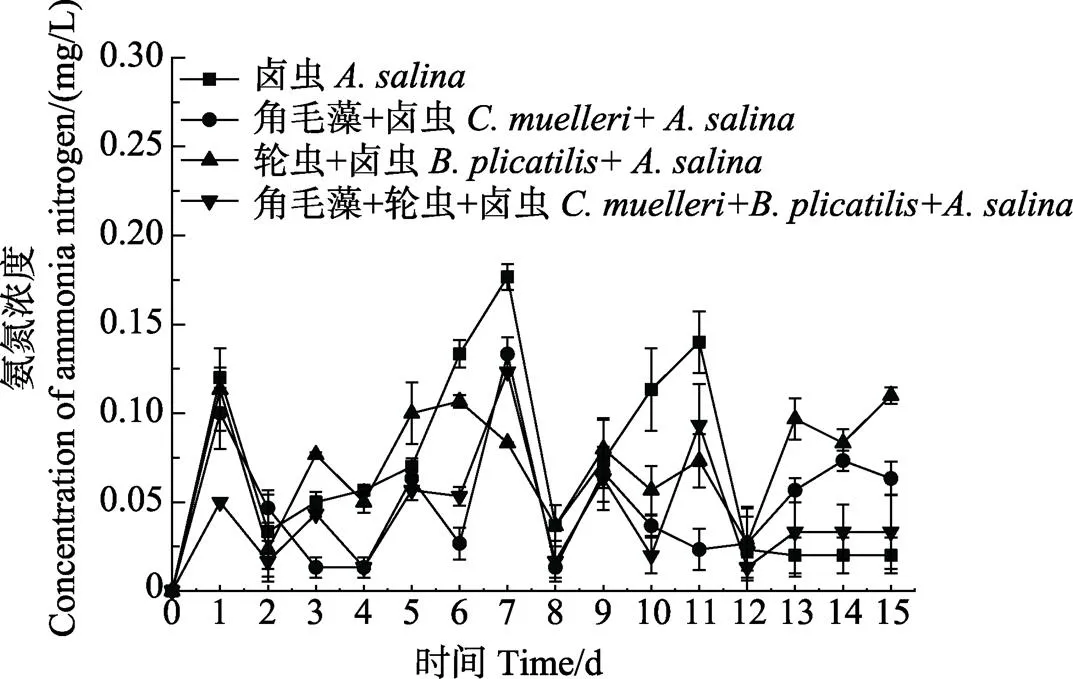
图1 不同饵料搭配下脊尾白虾幼体养殖水体中氨氮浓度

图2 不同饵料搭配下脊尾白虾幼体养殖水体中NO2–-N浓度
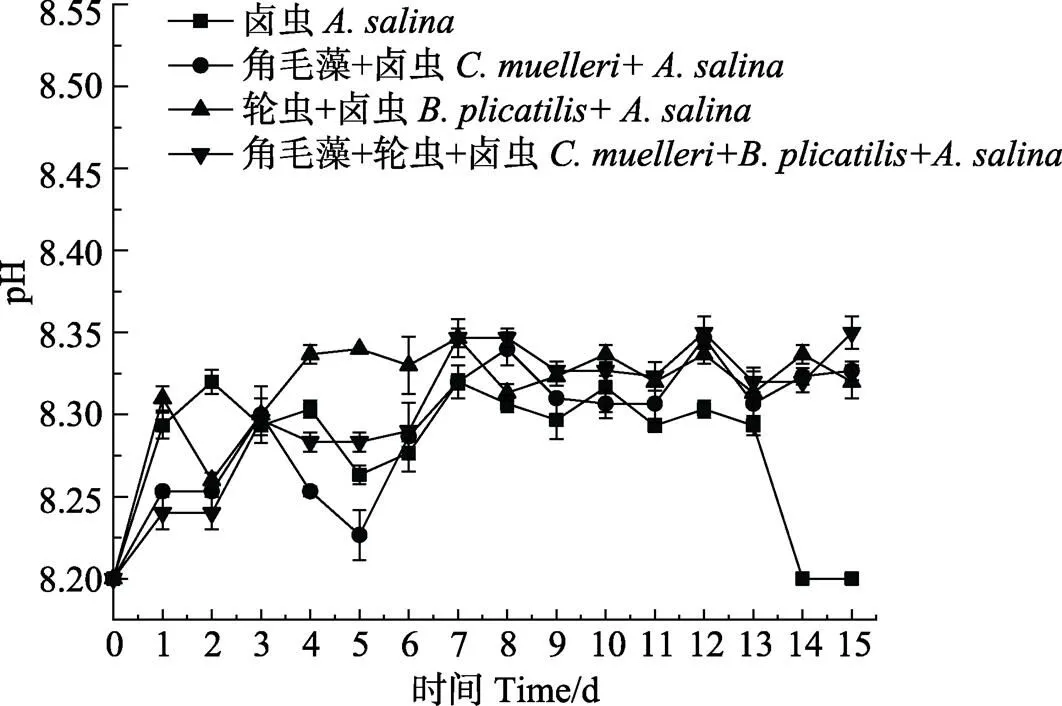
图3 不同饵料搭配组养殖水体中pH值
3 讨论
3.1 不同饵料搭配对脊尾白虾幼体SR的影响
幼体培育是水生动物繁育的重要阶段,而开口饵料是影响其幼体生长和SR的关键因子(夏晓飞等, 2011; 陈建华等, 2017; 王维娜等, 2000)。与黄经献等(2018)使用卤虫无节幼体搭配牟氏角毛藻和配合饲料投喂脊尾白虾幼体SR为22.5%相比,本研究采用卤虫无节幼体搭配牟氏角毛藻投喂脊尾白虾幼体,其幼体变态为仔虾时SR达84.67%。在陆开宏等(2001)研究基础上,本研究中,卤虫无节幼体采用了4种搭配方式投喂脊尾白虾幼体。研究显示,单一卤虫无节幼体的投喂量为3~5 ind./mL,效果最好。在罗会明等(1980)的研究基础上,不仅研究了不同饵料搭配对脊尾白虾幼体SR的影响,进一步比较了不同饵料搭配对脊尾白虾幼体变态发育速度的影响。与陈建华等(2017)研究不同的是本研究选用的3种饵料均为活体饵料,牟氏角毛藻、褶皱臂尾轮虫和卤虫无节幼体3种饵料的相互组合,不仅测定了脊尾白虾溞状幼体阶段的SR和LSI,还测定了脊尾白虾仔虾Ⅰ期的3种消化酶。
本研究结果表明,各实验组脊尾白虾幼体的SR从Z1~P阶段都明显呈阶梯式下降趋势,单一卤虫投喂的幼体在Z1~Z2期的SR与其他3个实验组相比最低,这与罗会明等(1980)研究结果相一致。陆开宏等(2001)研究表明,在脊尾白虾幼体Z1~Z2期投喂单胞藻、轮虫的SR更高。脊尾白虾在Z1前期的大颚只具有少数小齿,第1和第2小颚内密生刚毛,Z1前期适合滤食单细胞藻类,而脊尾白虾幼体发育到Z2期,大颚上的小齿变尖且数量有所增多,已有捕食浮游动物的能力,说明单胞藻已经不适合Z2之后的幼体培育(罗会明等, 1980; 陆开宏等, 2001)。卤虫组、牟氏角毛藻+轮虫组和轮虫+卤虫组的溞状幼体全部变为仔虾时,脊尾白虾幼体的SR分别为84.33%、84.67%和83.00%;投喂牟氏角毛藻+轮虫+卤虫组的幼体在Z5~P阶段大量死亡,变态为仔虾时,SR为35.67%。这与陆开宏等(2001)的研究结果不一致,推测其原因可能是投喂策略不一致。本研究中,牟氏角毛藻+轮虫+卤虫组从Z1~P阶段,3种饵料的投喂数量为单一饵料投喂的1/3,牟氏角毛藻+轮虫+卤虫组是分阶段分别投喂的,即Z1期投喂金藻(),Z2~Z3期投喂褶皱臂尾轮虫,Z4~Z6期投喂卤虫无节幼体。本研究中,牟氏角毛藻+轮虫+卤虫组的脊尾白虾幼体Z5~P阶段的SR下降较多,与其他3组相比差异显著。可能幼体发育到后期时,口器已不适于滤食单细胞藻类,而轮虫和卤虫的数量有限,不能满足后期幼体仔虾发育的营养需求,导致Z5~P阶段的SR较其他3组最低。
3.2 不同饵料搭配对脊尾白虾幼体变态发育的影响
本研究发现,牟氏角毛藻+轮虫组在Z1~Z2期间(孵化后前2 d)脊尾白虾幼体发育最快,卤虫组发育最慢,这与罗会明等(1980)研究结果相一致。在虾、蟹养殖过程中,不同阶段采用不同的饵料和适宜的饵料浓度,来提高虾、蟹的生长速度和SR(王维娜等, 2000)。脊尾白虾在Z1期以植物性饵料为主,而牟氏角毛藻+轮虫组比牟氏角毛藻+轮虫+卤虫组中的植物性饵料更充足,更能满足幼体从Z1期变态为Z2期的营养需求。卤虫组在脊尾白虾幼体变态后期发育速度最快,幼体全部变为仔虾需要14 d,与其他3种饵料组相比差异显著;其次是牟氏角毛藻+轮虫组、轮虫+卤虫组和牟氏角毛藻+轮虫+卤虫组幼体变为仔虾需要15 d。陈建华等(2017)研究表明,单一卤虫投喂组幼体全部变态为仔虾需要12 d,与本研究结果不一致,推测可能是盐度不一致所导致。虾、蟹在蜕皮激素的作用下,通过蜕皮来实现生长发育,而蜕皮激素是胆固醇通过一系列复杂的生化反应合成(陈建华等, 2017; 梁俊平等, 2014)。虾、蟹自身不能合成胆固醇,须从外界获取胆固醇来合成蜕皮激素以完成幼体变态发育(成永旭等, 1998)。陆开宏等(2001)研究表明,卤虫无节幼体是脊尾白虾育苗的最佳饵料。本研究中,卤虫组的变态发育比其他3个组更快,可能是单一卤虫组的卤虫数量比其他3个组更充足,能给脊尾白虾幼体提供更丰富的胆固醇以供幼体变态为仔虾。
3.3 不同饵料搭配对脊尾白虾幼体消化酶的影响
虾类消化酶的活性与其饵料中各营养成分的种类和含量有密切关系(夏晓飞等, 2011)。本研究发现,卤虫组的α-淀粉酶、脂肪酶、胃蛋白酶在4个组中最高,而牟氏角毛藻+轮虫+卤虫组的3种酶在4个组中最低。夏晓飞等(2011)研究了不同开口饵料对克氏原螯虾幼虾消化酶活性的影响,发现投喂卤虫无节幼体组,幼虾的胃蛋白酶在脂肪酶和淀粉酶等4种消化酶中最高,这与本研究结果不一致。本研究中,4个实验组的脂肪酶较其他2种酶含量较高,可能主要是投喂的卤虫中含有较高的胆固醇,卤虫生物量较多的一组生长发育更快,说明脂肪酶在脊尾白虾幼体变态为仔虾时,对卤虫的脂质消化吸收起到了重要作用,从而促进了幼体的变态发育。甲壳动物的消化作用主要通过消化器官分泌胃蛋白酶、脂肪酶、淀粉酶等消化酶来分解蛋白质、脂肪和糖类等物质,从而被吸收和利用,而消化酶的活性与甲壳动物对营养物质的消化吸收、生长发育起着决定性作用(付监贵, 2017)。本研究中,投喂卤虫组的幼体比其他实验组的幼体发育更快,4个组都投喂卤虫无节幼体,而单一卤虫组投喂的卤虫生物量更丰富,推测可能是摄食卤虫无节幼体较多的一组提高了脊尾白虾幼体的α-淀粉酶、脂肪酶、胃蛋白酶活性,从而促进了脊尾白虾幼体的变态发育。淀粉酶的作用主要是分解淀粉和糖原(夏晓飞等, 2011),4个实验组中,仔虾的α-淀粉酶活性较低,可能因为食物组成的淀粉含量在促进脊尾白虾幼虾的生长方面并不起主导作用,这与夏晓飞等(2011)和姜爱兰等(2020)研究结果一致。
3.4 不同饵料搭配对脊尾白虾幼体养殖水体的影响
残饵、排泄物等通过微生物的作用以无机氮(DIN)和无机磷(DIP)的形式进入水体,从而提高水体的富营养化(刘国锋等, 2018; 刘凯, 2016),其中,NH4+-N和NO2–-N是影响水产养殖水体健康的主要含氮污染物(王爱业等, 2008; Hu, 2011; Li, 2011)。微藻可作为虾、蟹育苗的开口饵料,同时,还具有改善水质的作用(黄翔鹄等, 2008)。黄翔鹄等(2008)研究了牟氏角毛藻对对虾育苗水质及抗逆性的影响。结果表明,牟氏角毛藻能降低养殖水体中的NH4+-N和NO2–-N含量,对水体中pH无显著影响,与本研究结果相一致。本研究中,卤虫组和轮虫+卤虫组养殖水体中NH4+-N浓度比角毛藻+卤虫组和角毛藻+轮虫+卤虫组高;卤虫组的NO2–-N浓度在第7天和第11天偏高。牟氏角毛藻能通过光合作用将水体的NH4+-N和NO2–-N等化合物转变为磷脂等有机物,从而去除水体中高浓度的NH4+-N和NO2–-N等(黄翔鹄等, 2008),因此,在脊尾白虾幼体培育过程中,添加角毛藻能减缓养殖水体恶化的速度。
在脊尾白虾育苗过程中,投喂单一卤虫幼体变态发育较快,但容易加速养殖水质的恶化。从每天检测的水质情况来看,在脊尾白虾溞状幼体养殖过程中,添加牟氏角毛藻的组比没有添加的水体中NH4+-N和NO2–-N稍低,而未添加牟氏角毛藻的水体在养殖3~4 d后NH4+-N和NO2–-N易偏高。脊尾白虾幼体在Z1期以植物性饵料为主,而牟氏角毛藻能作为开口饵料有改善养殖水体的作用,因此,建议在脊尾白虾育苗过程中投喂卤虫无节幼体,在Z3期之前卤虫密度为1 ind./mL;在Z3~Z5期间,卤虫密度为3 ind./mL;而Z5期及之后,卤虫密度为5 ind./mL,可提高幼体SR和加快变态发育速度。整个育苗过程中加入一定的牟氏角毛藻能减缓养殖水体恶化的速度。
AGUIRRE-GUZMÁN G, VÁZQUEZ-JUÁREZ R, ASCENCIO F. Differences in the susceptibility of American white shrimp larval substages () to fourspecies. Journal of Invertebrate Pathology, 2001, 78(4): 215–219
CHEN J H, ZHANG Q Q, GAO H,. Effects of different diet combination on larval development of ridgetail white prawn. Fisheries Science, 2017, 36(5): 662–665 [陈建华, 张庆起, 高焕, 等. 不同饵料搭配对脊尾白虾幼体发育的影响. 水产科学, 2017, 36(5): 662–665]
CHENG Y X, DU N S, LAI W. Lipid composition in hepatopancreas of Chinese mitten crabat different stages. Current Zoology, 1998,44(4): 45–54 [成永旭, 堵南山, 赖伟. 不同阶段中华绒螯蟹肝胰腺的脂类及脂肪酸组成. 动物学报, 1998,44(4): 45–54]
CHENG Y X. Biological feed cultivation. Beijiang: China Agriculture Press, 2005 [成永旭. 生物饵料培养学. 北京: 中国农业出版社, 2005]
FU J G. Studies on the feeding ecology of the oriental river prawn () during early developmental stages and the development of larval digestive tract. Master′s Thesis of Soochow University, 2017 [付监贵. 日本沼虾早期发育阶段摄食生态学及其幼体消化道发育的研究. 苏州大学硕士研究生学位论文, 2017]
HU H H, ZHANG J, CHEN W D. Competition of bloom- forming marine phytoplankton at low nutrient concentrations. Journal of Environmental Sciences, 2011, 23(4): 656–663
HUANG J X, ZHAO B R, SUN X S,. Study on feeding strategy of larval stage of. Scientific Fish Farming, 2018(10): 26–27 [黄经献, 赵炳然, 孙祥山, 等. 脊尾白虾幼体阶段饵料投喂策略研究. 科学养鱼, 2018(10): 26–27]
HUANG X H, LI H, LI C L,. Effect ofon water quality and anti-stress ability of larval prawn. Journal of Guangdong Ocean University, 2008, 28(6): 46–50 [黄翔鹄, 李活, 李长玲, 等. 牟氏角毛藻对对虾育苗水质及抗逆性的影响. 广东海洋大学学报, 2008, 28(6): 46–50]
HUANG X X. Nutrition in brine shrimp Artemia. Fisheries Science, 2007, 26(11): 628–631 [黄旭雄. 卤虫的营养. 水产科学, 2007, 26(11): 628–631]
JIANG A L, WANG X H, JIN Q,. Effects of different benthos baits on growth, activities of digestive enzyme, serum biochemical indicators and muscle compositions of. Acta Agriculturae Jiangxi, 2020, 32(1): 97–101 [姜爱兰, 王信海, 金倩, 等. 不同底栖饵料对克氏原螯虾生长、消化酶活性、血清生化指标及肌肉营养成分的影响. 江西农业学报, 2020, 32(1): 97–101]
LI J, GLIBERT P M, ALEXANDER J A,. Growth and competition of several harmful dinoflagellates under different nutrient and light conditions. Harmful Algae, 2011, 13: 112– 125
LI X Z, LIU R Y, LIANG X Q. The zoogeography of Chinese. Biodiversity Science, 2003, 11(5): 393–406
LIANG H F, LONG J Y, LIN X B,. The feeding effect of 5 species of unicellular algae to zoeae of. Marine Sciences, 2001, 25(7): 9–21 [梁华芳, 龙建艺, 林小彬, 等. 5种单胞藻培育南美白对虾溞状幼体的饵料效果. 海洋科学, 2001, 25(7): 9–21]
LIANG J P, LI J, LI J T,. Effects of salinity on spawning and larval development of. Chinese Journal of Applied Ecology, 2014, 25(7): 2105– 2113 [梁俊平, 李健, 李吉涛, 等. 盐度对脊尾白虾亲虾抱卵及其子代生长发育的影响. 应用生态学报, 2014, 25(7): 2105–2113]
LIU G F, XU P, WU T,. Present condition of aquaculture nitrogen and phosphorus environmental pollution and future development strategy. Jiangsu Journal of Agricultural Sciences, 2018, 34(1): 225–233 [刘国锋, 徐跑, 吴霆, 等. 中国水产养殖环境氮磷污染现状及未来发展思路. 江苏农业学报, 2018, 34(1): 225–233]
LIU K, FANG T, FENG Z H,. Research progress on algae treatment to aquaculture wastewater. Journal of Huaihai Institute of Technology (Natural Science), 2016, 25(1): 74–79 [刘凯, 方涛, 冯志华, 等. 藻类处理水产养殖废水的研究进展. 淮海工学院学报(自然科学版), 2016, 25(1): 74–79]
LU K H, HUA J Q, CHEN X L. Studies on basal food for the zoea larva ofduring artificial rearing. Journal of Oeanography of Huanghai Bohai Seas, 2001, 19(4): 63–70 [陆开宏, 华建权, 陈贤龙. 人工培育脊尾白虾蚤状幼体的饵料基础研究. 黄渤海海洋, 2001, 19(4): 63–70]
LUO H M, HUANG H Z. Investigation on the diet ingestion and absorption in the larva of Palaemon () Holthuis. Journal of Xiamen University (Natural Science), 1980, 19(4): 100–107 [罗会明, 黄厚哲. 脊尾白虾幼体对饵料的摄食与吸收. 厦门大学学报(自然科学版), 1980, 19(4): 100–107]
MA H M, WANG X Q, CAO M,. Research progress on culture of., 2019(16): 171–172, 175 [马鸿梅, 王兴强, 曹梅, 等. 脊尾白虾养殖研究进展.现代农业科技, 2019(16): 171–172, 175]
MILLAMENA O M, QUINITIO E. The effects of diets on reproductive performance of eyestalk ablated intact mud card. Aquaculture, 2000, 181(1/2): 81–90
QI J B. The research about application technology of food organism inseed production in ponds. Master′s Thesis of Shanghai Ocean University, 2014 [齐计兵. 饵料生物在青蟹池塘育苗中的应用技术研究. 上海海洋大学硕士研究生学位论文, 2014]
SUPRAYUDI M A, TAKEUCHI T, HAMASAKI K. Effects of Artemia enriched with eicosapentaenoic and docosahexaenoic acid on survival and occurrence of molting failure in megalop larvae of the mud crab. Fisheries Science, 2004, 70(4): 650–658
WANG A Y, JI X Y, CHEN W M,. The effect of the nitrite nitrogen on the growth ofand. Journal of Safety and Environment, 2008, 8(4): 12–15 [王爱业, 吉雪莹, 陈卫民, 等. 亚硝态氮对铜绿微囊藻和四尾栅藻生长的影响. 安全与环境学报, 2008, 8(4): 12–15]
WANG W N, WANG A L, HU J R,. Effect of the species and quantities of aquatic food organisms on the reproductive rate of shrimp and crab. Journal of Hebei University(Natural Science), 2000, 20(4): 405–409 [王维娜, 王安利, 胡俊荣,等. 水中饵料生物的种类和数量对虾蟹繁育率的影响. 河北大学学报(自然科学版), 2000, 20(4): 405–409]
WANG Y. The Optimization ofculture conditions and its application in the cultivation of.Master′s Thesis of Jiangsu Ocean University, 2020 [王玉. 微拟球藻培养条件优化及其在褶皱臂尾轮虫培养中的应用, 江苏海洋大学硕士研究生学位论文, 2020]
XIA X F, ZHENG X J, WANG Y F. The effects of different diets on the growth and development oflarvae. Journal of Aquaculture, 2011, 32(7): 16–21 [夏晓飞, 郑小婧, 王玉凤. 不同开口饵料对克氏原螯虾幼虾发育及消化酶活性的影响. 水产养殖, 2011, 32(7): 16–21]
XIAO Q Z, DU X, LIU Q,. Effects of live bait on the growth and development ofJournal of Biology, 2017, 34(4): 33–37 [肖起珍, 杜雪, 刘青, 等. 不同活饵料对中华绒螯蟹大眼幼体生长发育的影响. 生物学杂志, 2017, 34(4): 33–37]
YU T J. The growth and reproduction characteristics of ridgetail white prawn () cultured in ponds. Master′s Thesis of Dalian Ocean University, 2014 [于天基. 池塘养殖脊尾白虾的生长与繁殖研究. 大连海洋大学硕士研究生学位论文, 2014]
ZHANG C Y. The effect of feedingon the metamorphosis of prawn larvae. Fisheries Science and Technology Information, 1982(5): 18–20 [张翠英. 投喂牟氏牟氏角毛藻对对虾幼体变态的效果. 水产科技情报, 1982(5): 18–20]
ZHAO Z Y, YIN Z X, WENG S P,. Profiling of differentially expressed genes in hepatopancreas of white spot syndrome virus-resistant shrimp () by suppression subtractive hybridisation. Fish and Shellfish Immunology, 2007, 22(5): 520–534
Effects of Live Food Combinations on the Metamorphosis and Larval Development of
WANG Linhua1, SHEN Nannan1, JIANG Haiyi1, OUYANG Lefei1, ZHANG Qingqi4, HU Guangwei1,2,3, WANG Panpan1,2,3, GAO Huan1,2,3①
(1.Jiangsu Key Laboratory of Marine Biotechnology College of Marine Science and Fisheries, Jiangsu Ocean University, Lianyungang Jiangsu 222005, China; 2. Co-Innovation Center of Jiangsu Marine Bio-Industry Technology, Lianyungang Jiangsu 222005, China; 3. Jiangsu Province’s Agricultural Germplasm Resource Protection and Utilization Platform, Nanjing Jiangsu 210014, China; 4. Ganyu -jiaxin Aquaculture Linited Company of Lianyungang, Lianyungang Jiangsu 222100, China)
is one of the special economic shrimp in China, which has become an important object of pond single breeding and mixed breeding in recent years. The ridgetail white prawn has good breeding prospects, however, due to its small size and relatively small spawn, it currently mainly relies on natural seedlings, catching natural seedlings or placing broodstock to propagate their own seed, which severely restricts the development of large-scale artificial aquaculture. To achieve large-scale artificial breeding of white shrimp, we must break through the difficulty of full artificial breeding, and the bait is the nutritional basis to ensure the normal growth and development of seedlings. Biological diet generally refers to various aquatic plants, animals and microorganisms that can be artificially cultivated and suitable for aquatic animals to eat. Compared with traditional feed, biological food has many advantages, such as easy to cultivate, fast reproduction, rich nutrition, and strong palatability, and can effectively enhance the disease resistance ability of breeding objects. At present, the commonly used biological food includes, chlorella, microcytococcus, cyanobacteria, rotifer, Artemia, cladocera, copepod and amphipoda. In this study, we analyzed the survival rate, larval stage index, and digestive enzymes oflarvae (Z1~P) fed live food, including group A (feeding only on), group B (andmixed feeding), group C (andmixed feeding), and group D (,, andmixed feeding). The results showed that group A had the highest metamorphic rate, and all individuals metamorphosed into larvae within 14 days, while the other three groups took 15 days. The survival rates of larvae metamorphosed into larval shrimp were 84.33%, 84.67%, and 83.00% for groups A, B, and C, respectively, and the differences among the three groups were not significant (>0.05). A large number of larvae during the Z5~P stage died in group D, and the survival rate was only 35.67%. Moreover, the activities of pepsin (1.94 U/mg prot), lipase (2.35 U/mg prot) and α-amylase (0.13 U/mg prot) were the highest in group A, while the activities of pepsin (0.08 U/mg prot), lipase (0.91 U/mg prot) and α-amylase (0.08 U/mg prot) were the lowest in group D. The activities of α-amylase in groups B and C were 0.12. The activities of lipase (1.78 U/mg prot) and respectively (0.39 U/mg prot) in group C were 0.35 U/mg prot and 0.04 U/mg prot higher than those in group B. This study suggests that feedinglarvaewith(3~5 ind./mL) is expected to increase the survival rate of larvae and accelerate metamorphosis during the nursery phases and supplementation withcan alleviate the rate of deterioration in aquaculture water.
;Live food; Larval stage index; Digestive enzymes
GAO Huan, E-mail: huanmr@163.com
10.19663/j.issn2095-9869.20210317003
S966
A
2095-9869(2022)04-0171-09
*国家重点研发计划“蓝色粮仓科技创新”(2018YFD0901302)、江苏省优势学科建设工程资助项目和江苏海洋大学江苏省海洋生物资源与环境重点实验室开放课题基金(SH20191203)共同资助[This work was supported by National Key Research and Development Program of China (2018YFD0901302); A Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD), and Supported by Open-End Funds of Jiangsu Key Laboratory of Marine Bioresources and Environment (SH20191203)]. 王林华,E-mail: 15150994028@139.com
高 焕,教授,E-mail: huanmr@163.com
2021-03-17,
2021-05-07
http://www.yykxjz.cn/
王林华, 沈南南, 江海仪, 欧阳乐飞, 张庆起, 胡广伟, 王攀攀, 高焕. 不同生物饵料组合对脊尾白虾幼体变态发育的影响. 渔业科学进展, 2022, 43(4): 171–179
Wang L H, Shen N N, Jiang H Y, OuYang L F, Zhang Q Q, Hu G W, Wang P P, Gao H. Effects of live food combinations on the metamorphosis and larval development of. Progress in Fishery Sciences, 2022, 43(4): 171–179
(编辑 陈 严)

