慢性荨麻疹患者血清IL-31/33的水平变化及其意义
章含奇,徐 远,刘 腾,曹文娟
(池州市人民医院皮肤科,池州 247000)
慢性荨麻疹(chronic urticaria,CU)是各种原因引起的以皮肤瘙痒、风团和(或)血管性水肿为主要临床表现的皮肤黏膜血管变态反应性疾病,奇痒难忍,反复发作,严重影响患者的生活和工作[1]。CU发病机制尚不十分明确,近年来研究发现其与免疫、炎性反应有关,辅助性T细胞2分泌炎性细胞因子促进肥大细胞增殖分化,释放组胺,引发风团,炎性因子大量释放可诱导炎性级联瀑布反应,加重CU发生与发展。白细胞介素(interleukin,IL)-31、IL-33是新发现的具有多种生物学功能的过敏性和免疫性疾病生物学标记物和治疗靶点[2-3],IL-31是T细胞衍生的促炎因子,参与细胞增殖和组织重塑,与特应性皮炎、大疱性类天疱疮、湿疹等瘙痒性皮肤疾病有关[4]。IL-33是IL-1家族成员,通过与其受体ST2L结合发挥作用,可调节特异性和先天性免疫细胞功能,主要诱导Th2型细胞免疫[5]。IL-31、IL-33在CU的发病机制尚未完全阐明,本研究分别检测CU患者血清IL-31、IL-33水平变化,分析其与CU临床参数的关系以及在CU的发病机制。
1 资料与方法
1.1 临床资料
选择2017年1月至2020年12月于池州市人民医院就诊的93例CU患者为观察组,其中男性49例,女性44例,年龄19~46岁,平均年龄(35.12±4.26)岁,病程9 d至12年,平均病程(6.35±3.21)年;特异性免疫球蛋白E(sIgE):阳性48例,阴性45例;过敏源(酶免疫分析法检测):蟑螂和螨虫42例,螃蟹、鱼和大豆51例。纳入标准:1)典型CU临床症状(皮肤不定时风团,伴或不伴红斑,瘙痒),病程≥6周,每周发作次数≥2次,符合《中国荨麻疹诊疗指南(2018版)》中诊断标准[6];2)均行血清IL-31、IL-33检测。排除标准:1)哮喘、过敏性鼻炎、特应性皮炎等其他过敏性疾病,自身免疫疾病,恶性肿瘤,严重心、肺、肝、肾等系统性疾病;2)近1个月未服用抗组胺、糖皮质激素药物;3)近期罹患急慢性感染性疾病。另选择60例同期参加健康体检者为对照组,排除系统性疾病、免疫性疾病、感染性疾病和皮肤病。男性32例,女性28例,年龄21~52岁,平均年龄(35.95±4.61)岁,两组受试者性别、年龄比较差异均无统计学意义(P均>0.05)。
1.2 诊断方法
1.2.1 CU病情评估 根据瘙痒程度评分[7]对患者进行分组,轻度瘙痒组(瘙痒评分1分)13例,中度瘙痒组(瘙痒评分2分)45例,重度瘙痒组(瘙痒评分3分)35例。风团大小:风团直径<5 mm的31例,风团直径5~15 mm的36例,风团直径>15 mm的26例;风团数量:1~6个的24例,7~12个的49例,>12个的20例[8]。
1.2.2 血清IL-31、IL-33水平检测CU患者就诊48 h内未治疗前(对照组不限时间),于清晨采集空腹静脉血2~5 mL,置于L535R低速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司)4℃、3 000 r·min-1离心15 min(离心半径10 cm),取血浆保存于-80℃超低温冰箱(青岛海尔特种电器有限公司)。采用酶联免疫吸附实验测定血清IL-31、IL-33水平,试剂盒购自美国Epitope Diagnostics公司,操作流程严格按照仪器说明书的实验步骤进行。
1.3 观察指标
比较观察组与对照组血清IL-31、IL-33水平,分析患者血清IL-31、IL-33水平与CU临床参数的关系以及血清IL-31水平与IL-33水平的相关性。
1.4 统计学方法
采用SPSS 25.0统计学软件进行数据分析,血清IL-31、IL-33水平等计量资料经Kolmogorov-Smirnov、Levene检验符合正态分布、方差齐性,以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。性别以率(%)表示,组间比较采用χ2检验。Spearman秩相关系数描述IL-31、IL-33与瘙痒程度、风团数量、风团直径之间相关性,Pearson相关系数描述IL-31和IL-33之间相关性。所有统计均采用双侧检验,检验水准α=0.05。
2 结果
2.1 两组血清IL-31、IL-33水平比较
观察组血清IL-31、IL-33水平均高于对照组(P均<0.05),见表1。
表1两组血清IL-31、IL-33水平比较(±s,ng·L-1)

表1两组血清IL-31、IL-33水平比较(±s,ng·L-1)
组别 n IL-31 IL-33对照组 观察组 60 17.95±3.35 30.09±2.69 93 28.75±5.12 45.53±4.32 t值 14.456 24.746 P值 <0.001 <0.001
2.2 不同临床参数间CU患者血清IL-31、IL-33水平比较
CU患者血清IL-31水平在不同瘙痒程度、过敏源、有无血管性水肿方面差异均有统计学意义(P均<0.05)。血清IL-33水平在不同风团直径、风团数量、sIgE、有无血管性水肿方面差异均有统计学意义(P均<0.05),见表2。
表2不同临床参数间CU患者血清IL-31、IL-33水平比较(±s,ng·L-1)
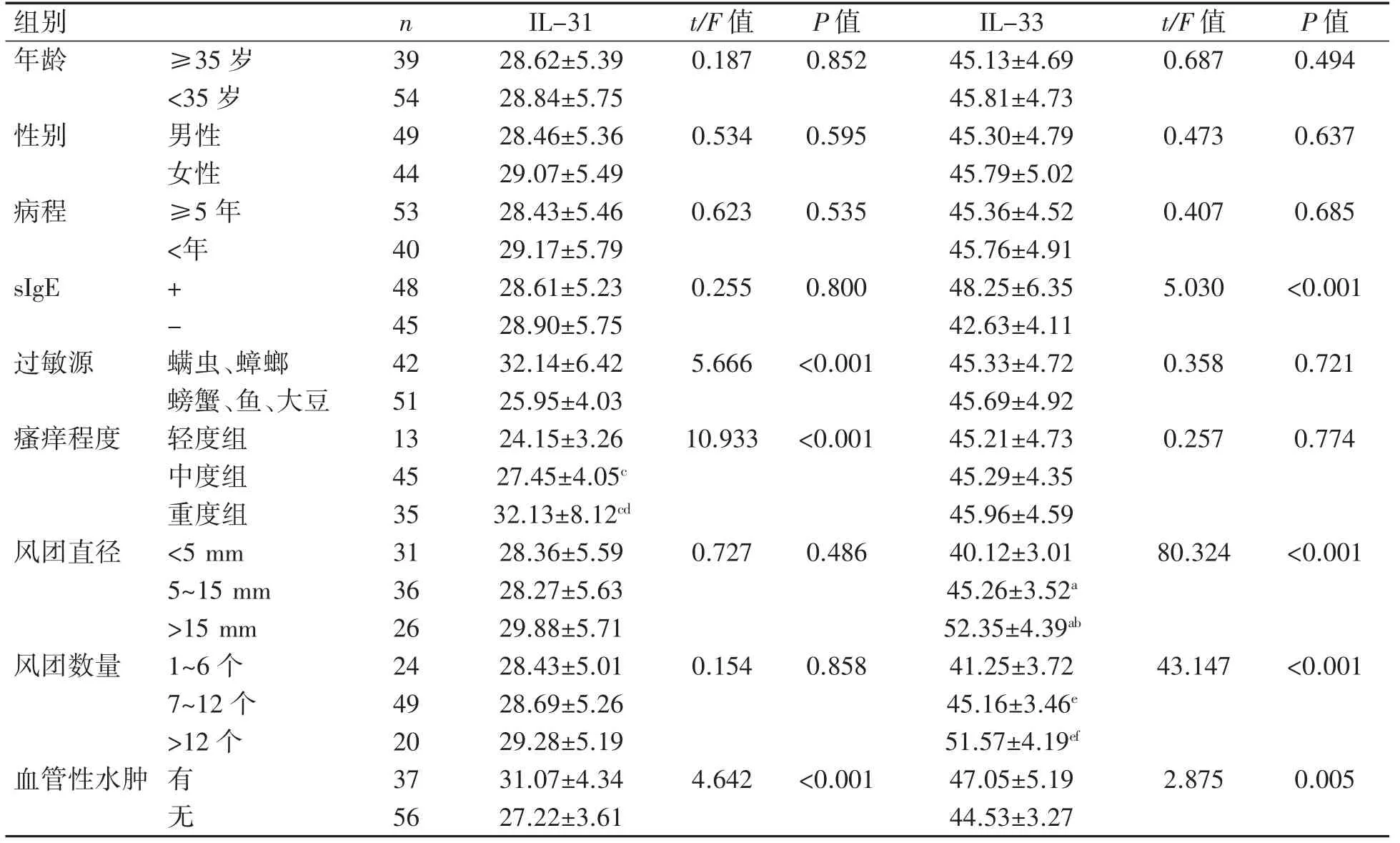
表2不同临床参数间CU患者血清IL-31、IL-33水平比较(±s,ng·L-1)
与风团直径<5 mm比较aP<0.05;与风团直径5~15 mm比较bP<0.05;与瘙痒轻度组比较cP<0.05,与瘙痒中度组比较dP<0.05;与风团数量1~6个比较eP<0.05;与风团数量7~12个比较fP<0.05。
组别 n IL-31 t/F值 P值 IL-33 t/F值 P值年龄 ≥35岁 39 28.62±5.39 0.187 0.852 45.13±4.69 0.687 0.494<35岁 54 28.84±5.75 45.81±4.73性别 男性 49 28.46±5.36 0.534 0.595 45.30±4.79 0.473 0.637女性 44 29.07±5.49 45.79±5.02病程 ≥5年 53 28.43±5.46 0.623 0.535 45.36±4.52 0.407 0.685<年 40 29.17±5.79 45.76±4.91 sIgE + 48 28.61±5.23 0.255 0.800 48.25±6.35 5.030 <0.001-45 28.90±5.75 42.63±4.11过敏源 螨虫、蟑螂 42 32.14±6.42 5.666 <0.001 45.33±4.72 0.358 0.721螃蟹、鱼、大豆 51 25.95±4.03 45.69±4.92瘙痒程度 轻度组 13 24.15±3.26 10.933<0.001 45.21±4.73 0.257 0.774中度组 45 27.45±4.05c 45.29±4.35重度组 35 32.13±8.12cd 45.96±4.59风团直径 <5 mm 31 28.36±5.59 0.727 0.486 40.12±3.01 80.324 <0.001 5~15 mm 36 28.27±5.63 45.26±3.52a>15 mm 26 29.88±5.71 52.35±4.39ab风团数量 1~6个 24 28.43±5.01 0.154 0.858 41.25±3.72 43.147 <0.001 7~12个 49 28.69±5.26 45.16±3.46e>12个 20 29.28±5.19 51.57±4.19ef血管性水肿 有 37 31.07±4.34 4.642 <0.001 47.05±5.19 2.875 0.005无56 27.22±3.61 44.53±3.27
2.3 CU患者血清IL-31、IL-33水平与瘙痒程度、风团数量、风团直径相关性分析
Spearman秩相关分析显示,CU患者IL-31水平与瘙痒程度呈正相关(rs=0.467,P<0.05),IL-33水平与风团数量、风团直径呈正相关(rs=0.569、0.513,P均<0.05),见图1。
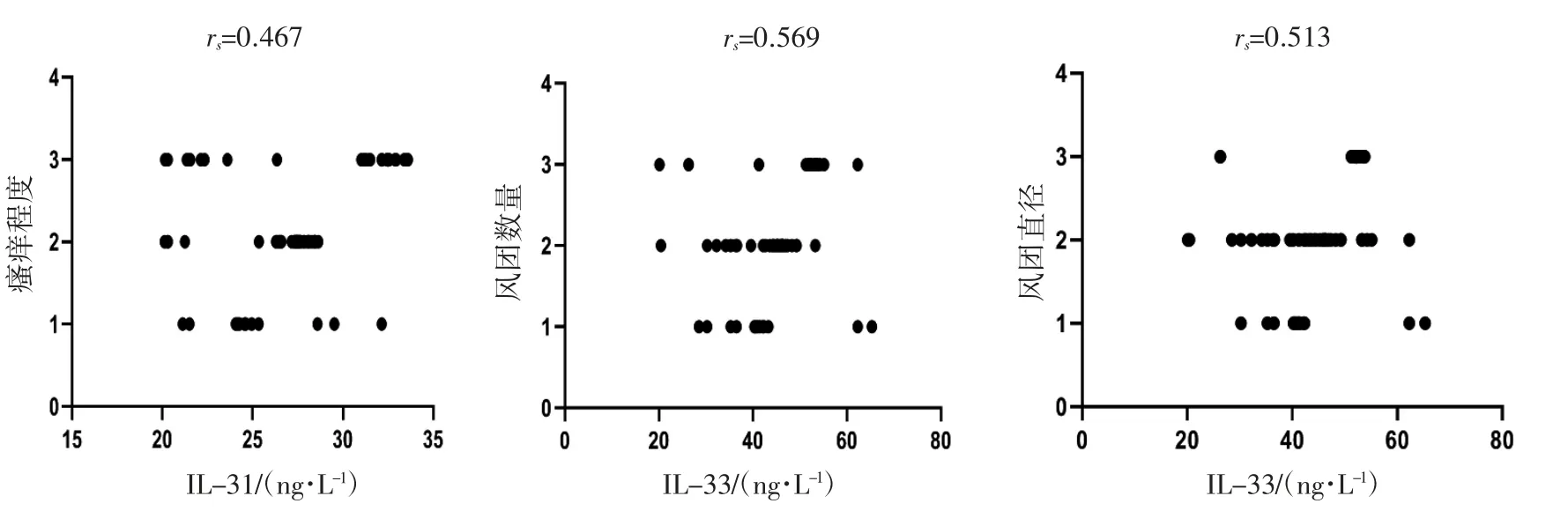
图1 CU患者血清IL-31、IL-33水平与瘙痒程度、风团数量、风团直径相关性散点图
2.4 CU患者血清IL-31与IL-33水平相关性分析
Pearson相关分析显示,血清IL-31与IL-33水平呈正相关(rs=0.361,P<0.05),见图2。
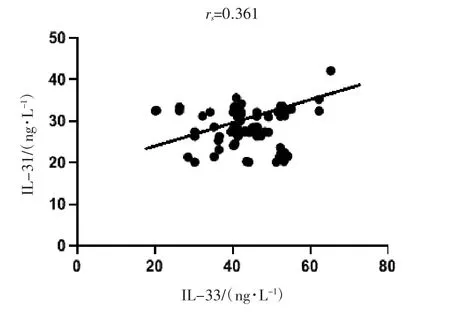
图2 CU患者血清IL-31与IL-33水平相关性散点图
3 讨论
CU是由多种原因引起的皮肤变态性反应,可刺激皮肤肥大细胞脱颗粒释放组胺和其他血管活性介质,引起皮肤瘙痒或血管性水肿。自身抗体、循环介质、细胞因子均参与了CU发病机制。免疫功能异常是CU的主要发病机制之一,且以Th2细胞反应为主,Th2细胞可分泌多种细胞因子,这些细胞因子直接或间接参与变态反应,因此细胞因子和T淋巴细胞亚群间失衡与CU发病有关,其中白细胞介素被证实参与了CU的病理生理过程[9-10]。
IL-31是IL-6家族成员,主要由活化的Th2细胞、肥大细胞、巨噬细胞、树突状细胞和嗜酸性粒细胞产生,通过与受体结合传导信号,并广泛作用于免疫和非免疫细胞,参与免疫调节、炎性反应、过敏反应、神经元生长等多种病理生理过程[11-12]。IL-31在瘙痒性皮肤病患者中表达明显升高,被认为是瘙痒反应的主要驱动因素[4]。本研究CU患者血清IL-31水平高于对照组,且在不同瘙痒程度亚组之间差异有统计学意义,尤其是重度瘙痒患者血清IL-31水平最高,与相关报道[5,8]结果一致,且IL-31水平与瘙痒程度呈正相关,提示IL-31可反映CU患者瘙痒症状轻重。IL-31参与CU瘙痒症状的机制尚不十分清楚,有报道[10]指出,IL-31是T细胞活化和引起皮肤瘙痒症状的细胞因子,IL-31调节皮肤角质细胞形成分化以及聚角蛋白微丝表达,同时角质细胞中IL-31受体活化导致细胞钙离子内流,以及β-内啡肽的产生,进而导致皮肤瘙痒的发生[13]。也有报道[4]指出,CU患者嗜酸性和嗜碱性粒细胞计数升高,直接刺激IL-33释放并导致瘙痒症状和瘙痒程度加重。Siiskonen[14]认为肥大细胞和CU瘙痒症状有关,感觉神经释放神经肽,激活肥大细胞,释放组胺、胰蛋白酶、细胞因子和生长因子等介质,刺激瘙痒相关的感觉神经相应受体释放,其中包括IL-31受体。本研究发现IL-31水平与CU过敏源有关,尤其是螨虫、蟑螂导致的CU患者中IL-31水平高于食物过敏CU患者,提示螨虫、蟑螂过敏源可能通过激活IL-31参与CU的发病,食物过敏源可能通过IL-31以外途径。本研究尚未发现IL-31水平与CU患者风团数量、直径的关系,Lin等[5]也认为,血清IL-31水平在不同CU病情严重程度组差异无统计学意义,说明IL-31与CU皮疹轻重程度似乎关系不甚明显。
IL-33是重要的炎性细胞因子,在Th2细胞、肥大细胞、嗜碱性和嗜酸性细胞上均有表达,在细胞外释放诱导Th2细胞释放IL-5和IL-13等细胞因子,促使sIgE和嗜酸性粒细胞水平升高,引起肥大细胞活化、成熟,参与哮喘、寄生虫感染和特应性皮炎等多种由Th2介导的免疫反应[15-16]。本研究观察组血清IL-33水平高于对照组,提示IL-33参与CU的发病机制。IL-33是先天的免疫应答“放大器”[17]。有研究[18]显示,过敏源、组织损伤、病原菌通过免疫机制识别IL-33激活皮肤或黏膜表面Th2介导的免疫应答,提示IL-33可能通过天然免疫、Th2细胞因子在CU发病机制中发挥关键作用。本研究发现CU患者血清IL-33水平与风团数量和直径有关,Lin等[5]观察到,CU病情重度患者IL-33水平高于轻度组。相关性分析发现IL-33与风团数量、风团直径均呈正相关,提示IL-33参与CU皮肤炎性反应进程,可反映CU病情严重程度。本研究同样发现观察组sIgE阳性患者IL-33水平高于阴性组,可能因为肥大细胞经sIgE激活后产生IL-33,进而激活IL-33/ST2通路,产生IgE依赖性炎性反应,IL-33同时能促进嗜碱性粒细胞脱颗粒和迁移以及细胞因子、趋化因子的产生[19]。上述结果提示,IL-33可能通过促使肥大细胞、嗜碱性粒细胞增加Th2细胞免疫反应参与CU炎性反应进程。本研究相关性分析显示,CU患者血清IL-31和IL-33水平呈正相关,说明IL-31和IL-33在CU发病机制中可能存在协同作用机制和功能联系,相关报道指出IL-33及受体ST2可调控Th2免疫应答[20],Vocca等[21]指出IL-33/ST2可表达于Th2细胞调控IL-31等细胞因子的产生。
综上所述,CU患者血清IL-31、IL-33水平升高,IL-31、IL-33可能参与了CU发病机制,IL-31水平与CU瘙痒程度有关,通过抑制IL-31表达可减轻患者瘙痒症状,IL-33与CU病情严重程度有关,IL-33抑制剂有助于抑制病情进展。本研究创新之处在于阐述IL-31、IL-33与CU发病、病情程度关系,为临床治疗提供了新的思路和理论依据。局限之处在于未设置如过敏性皮炎作为阳性对照组,CU与其他皮肤病患者的血清IL-31和IL-33水平是否有差异尚未探知,另外,CU患者血清和皮肤组织中IL-31、IL-33水平差异尚需纳入更多样本加以探讨。

