碳青霉烯耐药肠杆菌科细菌感染后死亡的风险因素研究
陈敬兰,李胜兰,刘韶,黄勋,汪要望,邓晟*,胡琴,3,4*(.中南大学湘雅医院药学部,长沙 40008;.湘雅医院医院感染控制中心,长沙 40008;3.中南大学医院管理研究所,长沙 40008;4.湘雅卫生与健康发展研究中心,长沙 40008)
碳青霉烯耐药肠杆菌科细菌(carbapenemresistant Enterobacteriaceae,CRE)已成为严重威胁人类健康的病原体之一[1]。CRE是指对任何一种碳青霉烯类抗菌药物耐药(美罗培南、亚胺培南的MIC≥4 mg·L-1,厄他培南的MIC≥2 mg·L-1),或者产碳青霉烯酶的肠杆菌科细菌[2]。
近年来,CRE的感染率逐年上升。2007年浙江省首次报告了产生碳青霉烯耐药肺炎克雷伯菌(carbapenem-resistantK.pneumoniae,CRKP)后,中国几乎所有省份都报告了CRE感染[3-4]。2018年一项流行病学研究显示,我国每10 000例出院病例中就有 4 例曾发生CRE 感染[4]。2021年中国细菌耐药监测网(China Antimicrobial Surveillance Network,CHINET)数据显示,肺炎克雷伯菌对碳青霉烯的耐药率逐年升高,从2005年的2.9%提高到2021年的24.4%,耐药形势十分严峻[5]。
CRE引起的感染尤其是血流感染(blood stream infection,BSI)与高死亡率相关。一项包含62个研究的荟萃分析表明,感染CRKP的死亡率为42.1%,其中BSI为54.3%[6]。有研究表明感染性休克、Pitt 菌血症评分、美罗培南MIC≥8 mg·L-1、不合理抗菌药物治疗等是CRE感染患者死亡的独立影响因素[7-8]。在我国,CRE感染患者死亡相关的风险因素尚不完全清楚,且缺乏抗菌药物方案影响CRE感染患者治疗结局的真实世界研究。
目前常用于治疗CRE感染的药物主要有碳青霉烯类、多黏菌素、替加环素、氨基糖苷类以及新型复方制剂头孢他啶阿维巴坦(ceftazidime/avibactam,CAZ-AVI)等[1,9]。然而,哪种药物具有最好的疗效和安全性,联合用药还是单独用药,如何调整碳青霉烯类的给药方式等,存在不一致的研究结果[10-11]。本研究目的是确定住院患者感染CRE的死亡风险因素,并比较不同抗菌药物治疗方案对感染CRE的住院患者死亡率的影响。
1 方法
1.1 研究设计和患者收集
本研究是单中心回顾性队列研究,于2021年1月至12月份在中南大学湘雅医院收集CRE感染的住院患者信息。有如下情况的患者将不纳入本次研究分析:①年龄小于14岁;② 合并其他致病菌感染;③ 缺失重要的医疗记录;④ 定植CRE菌;⑤ 重复入院的患者,只纳入第一次感染CRE的住院记录;⑥ 反复感染CRE的患者,只有第一次阳性标本培养报告被纳入分析,其他排除。本研究的首要结局是全因死亡率,次要结局是临床治疗失败,包括临床症状和体征恶化或持续,或微生物未清除,感染反复出现。
1.2 数据收集
① 临床特征:患者基本资料(性别、年龄等),临床指标(白细胞计数、降钙素原等),基础疾病(糖尿病、慢性肾病等),侵入性操作(中心静脉置管、气管插管等),医院相关因素(住院时长、是否入住ICU等);② 病原学特征:感染类型,病原体类型,药敏情况等;③ 抗菌治疗方案;④患者结局:首要结局与次要结局。
1.3 细菌分离和微生物学检测
菌株进行初步鉴定和收集后,根据美国临床和实验室标准协会(Standard of Clinical and Laboratory Standards Institute,CLSI)指南要求,采用Mueller-Hinton肉汤稀释法或者稀释琼脂平板法测定了24种抗菌药物的抑菌圈直径(KB)值和最低抑菌浓度(MIC)。根据CLSI指南文件断点规定,碳青霉烯耐药定义为美罗培南、亚胺培南的MIC≥4 mg·L-1或厄他培南的MIC≥2 mg·L-1,而美罗培南、亚胺培南的KB≤19 mm,厄他培南的KB≤18 mm也 于耐药(http://www.clsi.org)。此外,CAZ-AVI的MIC折点参考 CLSI 和EUCAST制定的范围,将MIC≤8 mg·L-1定义为敏感。必要时开展联合药敏试验。替加环素和多黏菌素的折点分别根据美国食品药品监督管理局的标准和欧洲抗菌药物敏感性测试委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)来设定(http://www.eucast.org)。
1.4 研究定义
合并感染指的是在同一部位同时检出CRE和其他致病菌(如鲍曼不动杆菌/铜绿假单胞菌/金黄色葡萄球菌等),或者在无菌部位(如血液)检出致病菌,而非无菌部位检出CRE。抗菌药物暴露定义为在检出CRE前30 d内使用抗菌药物大于72 h(检出CRE前48 h内除外)。敏感药物根据CLSI断点法来确定。经验性治疗定义为在检出CRE前48 h内使用抗菌药物治疗,若使用了敏感药物,则为合理的经验性治疗。目的性治疗定义为在检出CRE之后使用了抗菌药物治疗,若在检出CRE 5 d内使用敏感药物则为合理的目的性治疗,若在检出CRE 48 h内使用敏感药物治疗则为早期合理的目的性治疗。活性药物治疗定义为检出CRE后至少使用一种敏感药物的治疗;单药治疗定义为只使用一种敏感药物治疗[12-13];联合治疗定义为使用两种或两种以上的敏感药物治疗;基于CAZ-AVI的治疗定义为使用CAZ-AVI或联合其他药物的治疗;基于多黏菌素的治疗定义为除了CAZ-AVI的治疗之外,使用多黏菌素或联合其他药物的治疗;基于替加环素的治疗定义为除了CAZ-AVI和多黏菌素的治疗之外,使用替加环素或联合其他药物的治疗[14];基于碳青霉烯的治疗定义为除了CAZ-AVI、多黏菌素和替加环素的治疗之外,使用碳青霉烯或联合其他药物的治疗。而包含某抗菌药物的治疗定义为该患者在治疗期间使用了此抗菌药物。若患者有多个治疗方案,则根据患者的结局和抗菌药物及时长来确定其最终治疗方案。若治疗结局较差,则纳入最后一种方案;若两周内微生物清除,则纳入先前的方案[13]。
1.5 数据分析
使用SPSS statistic 26 软件进行分析。将CRE患者分为生存组和死亡组进行基线特征比较。单样本K-S检验用于验证数据是否符合正态分布。正态分布连续性变量用均值±标准差表示,组间比较用独立样本t检验;非正态分布连续性变量用中位数(四分位间距)表示,组间比较采用非参数Mann-Whitney U检验。分类变量采用卡方检验。本研究患者例数为90,若单元格期望频数均大于5,使用Pearson卡方检验的结果;若存在单元格期望频数小于5,则使用Fisher精确概率法检验的结果。将单变量分析中P<0.1的变量纳入二元Logistic回归分析模型,比较P值,并列出优势比(OR)和相应的95%置信区间(CI),分析CRE感染的死亡风险因素。
1.6 伦理批准
本研究经中南大学湘雅医院医学伦理委员会批准(伦理审批号:202109174),该研究的试验设计和方案充分考虑安全性和公平性,其研究内容和结果不会对研究对象造成伤害和风险,不存在利益冲突。
2 结果
2.1 患者临床特征
本研究总共收集到357例感染CRE的住院患者。通过纳排标准筛选后,最终有90例患者纳入分析(见图1)。表1描述了按人口统计学和临床特征分类的患者的死亡率和生存率。患者中位年龄为62岁(四分位数间距:52.5~71.0岁),90例患者中有61例(67.8%)为男性。大部分患者是医院获得性感染(82.2%,74/90),最常见的基础疾病是实体肿瘤(27.8%,25/90),最常见的侵入性操作是气管插管(30%,27/90)和中心静脉置管(17.8%,16/90),而最常见的感染部位是肺部感染(77.8%,70/90),其次是血流感染(22.2%,20/90)(见表1)。

图1 CRE感染患者的纳排流程图Fig 1 Included patients with CRE infection
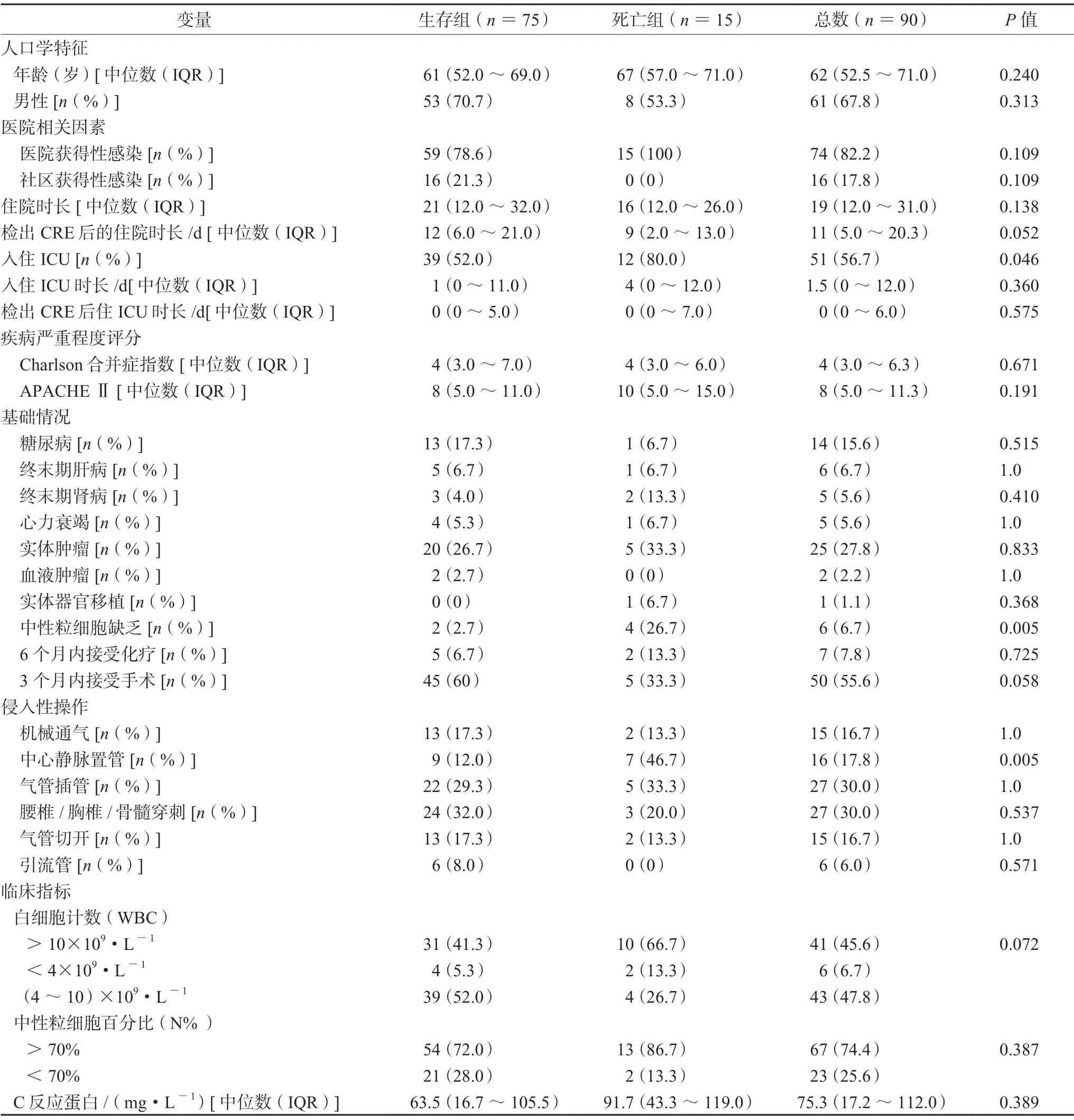
表1 CRE感染患者临床特征的比较Tab 1 Clinical characteristics in patients with CRE infection
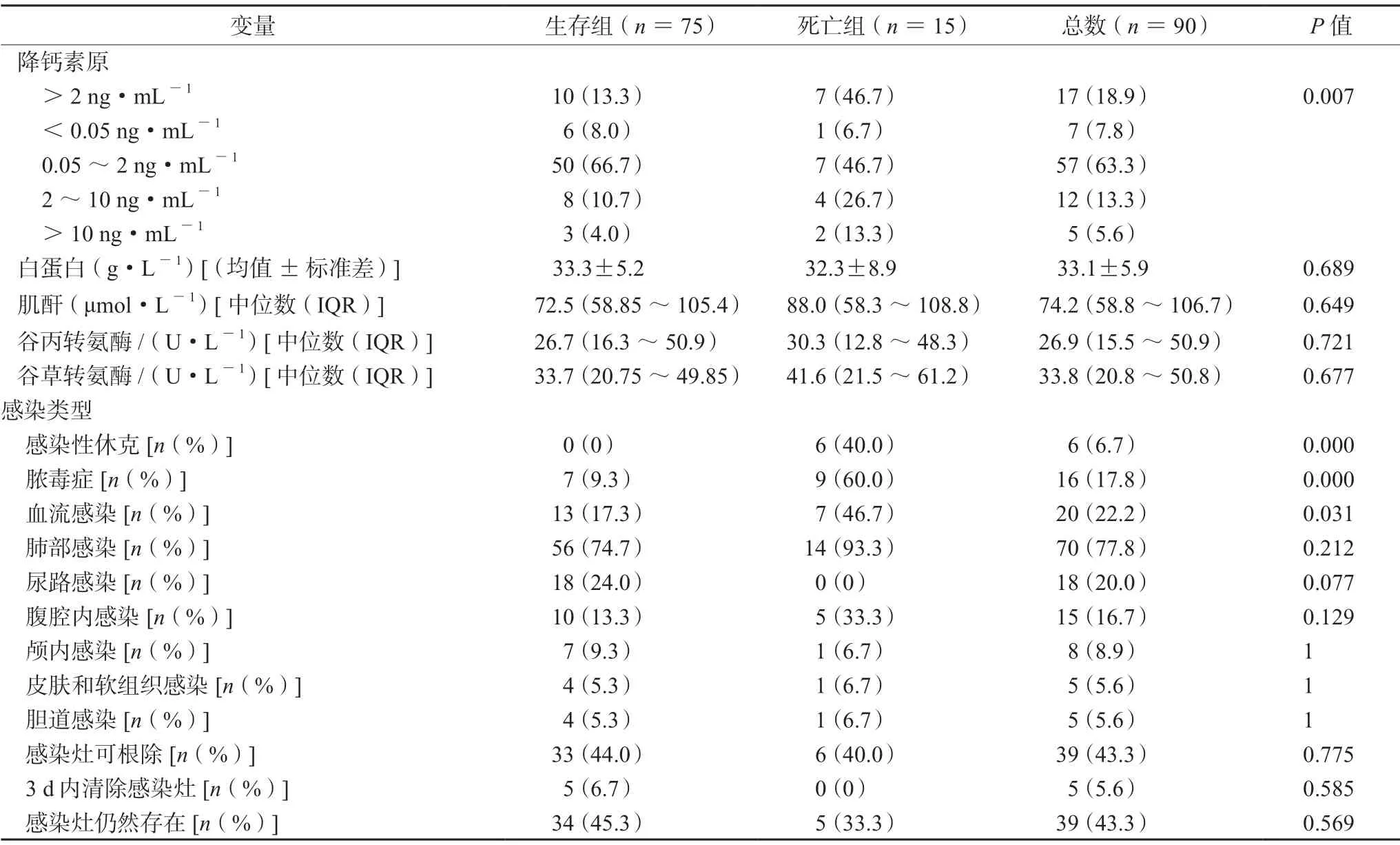
续表1
2.2 CRE菌株的微生物学特征
在90例患者中,分别有67株肺炎克雷伯菌、12株大肠埃希菌、8株阴沟肠杆菌、1株奇异变形杆菌、1株产酸克雷伯菌和1株摩根摩根菌。在这90株菌株中,标本来源占比最高的是痰液(32.2%),其次分别是分泌物(22%),引流液(11.1%),血液(11.1%),尿液(10.0)等。患者的微生物清除都比较低(11.1%),存活患者微生物清除为13.3%,而死亡患者的微生物清除为0.0%(见表2)。

表2 CRE感染患者微生物学体征 [n(%)]Tab 2 Microbiological characteristics of patients with CRE infection [n(%)]
2.3 CRE感染死亡风险因素的分析
患者的总死亡率为16.7%(15/90)。相对于存活的患者,死亡患者表现出更高的白细胞计数(>10×109·L-1,66.7%vs41.3%;P=0.072)和降钙素原(>2 ng·mL-1,47.6%vs13.3%;P=0.007),具有更高的中性粒细胞缺乏症(26.7%vs2.7%;P=0.005)、菌血症(46.7%vs17.3%;P=0.031)、脓毒症(60.0%vs9.3%;P=0.000)及感染性休克发生率(40.0%vs0%;P=0.000),更多入住ICU(80.0%vs52.0%;P=0.046)、中心静脉置管(46.7%vs12.0%;P=0.005)(见表1)和抗菌药物暴露(86.7%vs61.3%;P=0.059);而相对于死亡患者,更多的存活患者接受了早期合理的目的性治疗(44.0%vs13.3%;P=0.026)(见表3)。
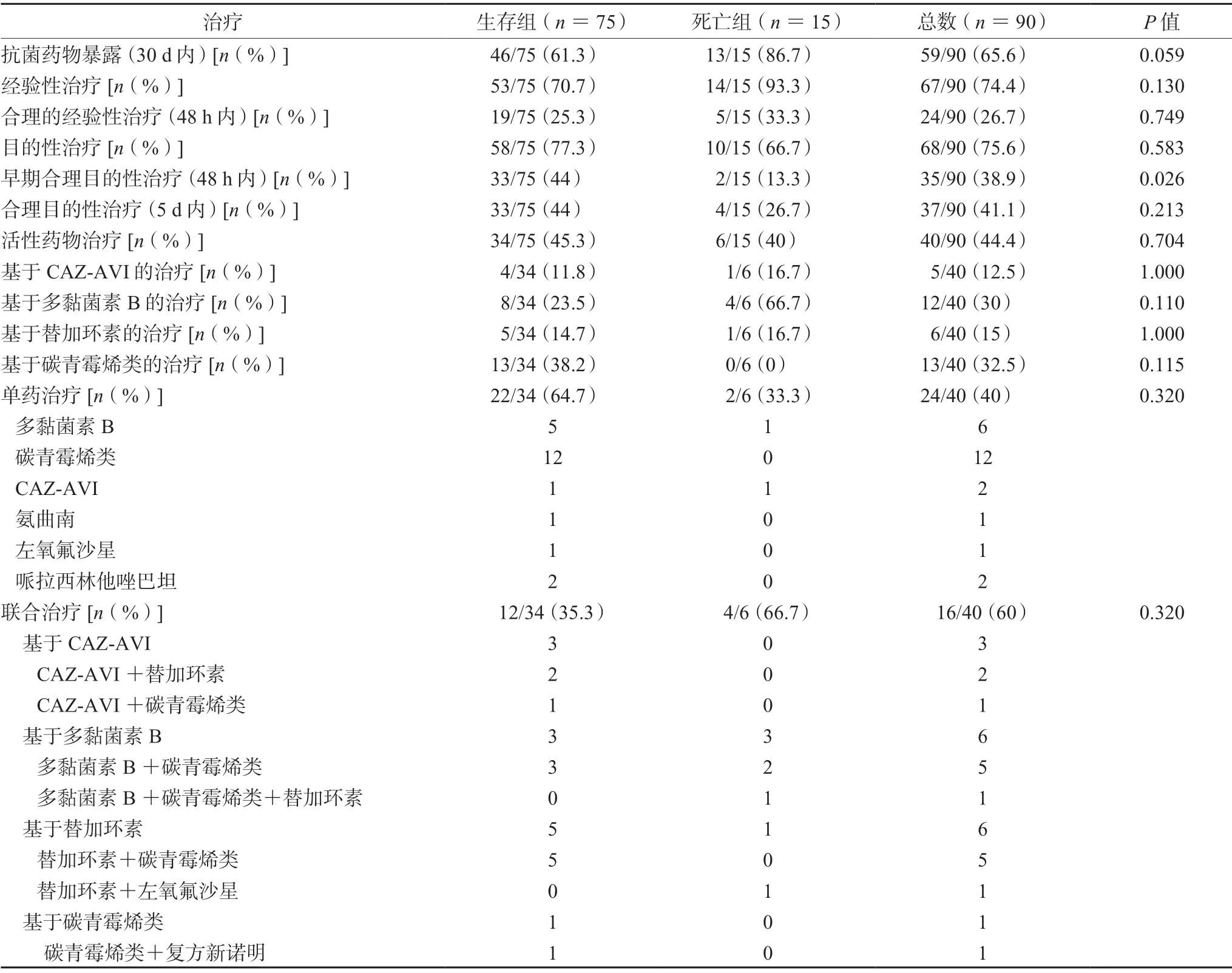
表3 CRE感染患者抗菌药物使用情况Tab 3 Antimicrobial treatments of patients with CRE infection
将单因素分析中P<0.1的13个变量纳入二元Logistic回归模型进行多因素分析。结果显示,中心静脉置管、感染性休克和早期合理的目的性治疗是感染CRE后死亡的独立影响因素。其中,中心静脉置管(OR=6.351;95%CI,1.415~28.502;P=0.016)和感染性休克(OR=57.074;95%CI,3.285~991.775;P=0.005)是CRE感染后死亡的危险因素,而早期合理目的性治疗(OR=0.091;95%CI,0.010~0.842;P=0.035)是CRE感染后死亡的保护因素(见表4)。
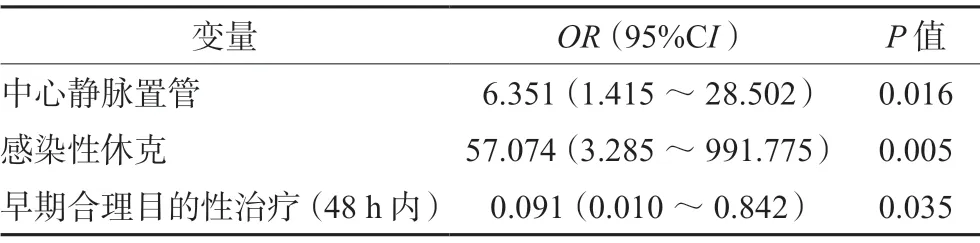
表4 CRE感染患者发生死亡的Logistic多因素分析Tab 4 Multivariate Logistic regression analysis of death in patients with CRE infection
2.4 抗菌药物治疗
表3列出了90例患者的抗菌药物使用情况,单药治疗(8.3%)比联合治疗(25%)的死亡率更低,但差异没有统计学意义(P=0.320)。图2比较了患者治疗死亡率的影响,与没有接受相应治疗的患者相比,接受早期合理目的性治疗的患者具有显著更低的死亡率(P=0.016),接受合理目的性治疗与活性药物治疗的死亡率也更低。对患者治疗过程中包含几种抗菌药物的死亡率进行了一个比较,其中含有CAZ-AVI(20%,1/5)和碳青霉烯(20.7%,6/29)的治疗死亡率较低,而含有多黏菌素B(31.3%,5/16)和替加环素(35.7%,5/14)的治疗死亡率相对较高。

图2 CRE感染患者接受各治疗的病死率比较Fig 2 Mortality rates among patients with CRE infections after treatments
3 讨论
本研究患者的全因死亡率为16.7%,低于此前报道的30%~80%[6,15],因为本研究的感染类型主要是肺部感染,其次是血流感染。与许多研究结果一样[16-17],本研究表明菌血症能显著增加CRE感染患者的死亡率(OR=4.173,P=0.017)。
影响患者预后的因素还有很多,包括病情严重程度、微生物特征、个体危险因素和抗菌治疗效果。几个反映疾病严重程度的评分,如急性生理和慢性健康评分(APACHE Ⅱ)[18-19]、Charlson合并症指数(CCI)[20]、Pitt 菌血症评分[21-22]、序贯器官衰竭估计(SOFA)评分[23]均是CRE感染患者死亡率的独立影响因素。
我国临床分离的CRE 菌株中97.4%为产碳青霉烯酶,包括 KPC-2(51.6%)、NDM(35.7%)和 OXA-48(7.3%),其分布特征总体以KPC酶为主,肺炎克雷伯菌成人分离株主要产KPC酶,大肠埃希菌主要产NDM型金属酶[24]。Tamma等[25]的研究表明产碳青霉烯酶的CRE菌株更具毒性,并且与较差的结果相关。研究表明,美罗培南MIC≤8 mg·L-1的患者接受以美罗培南为基础的治疗效果良好,MIC≤4 mg·L-1的患者预后更好[7]。美罗培南MIC≥8 mg·L-1是影响CRE死亡率的独立危险因素[21],然而本研究部分CRE菌株未检测碳青霉烯酶型,美罗培南是用琼脂稀释法测的KB值,故无法评估碳青霉烯酶和美罗培南MIC对患者预后的影响。此外,有研究表明微生物清除特别是在7 d内清除的患者生存率明显更高[8,17],与本研究一致。
本研究确定了三个CRE感染患者死亡的独立影响因素:中心静脉置管、感染性休克和早期合理目的性治疗。脓毒症及其引起的感染性休克是危重患者的一个重要且常见的问题,与住院时间和死亡率密切相关[26]。本研究中感染性休克的死亡率为100%,且其多因素分析中OR值高达57.074,是影响CRE患者死亡的重大危险因素。危重患者的生命支持干预,如动脉插管、中心静脉置管、机械通气等,可导致黏膜的损伤,大多数细菌通过黏膜屏障进入血流,从而增加血流感染的发生率[27],而本研究表明中心静脉置管是CRE患者死亡的独立危险因素(P=0.016)。此外,中性粒细胞缺乏症患者缺乏对抗细菌感染的能力,其治疗依赖于立即使用抗菌药物,杀死感染细菌。因此,中性粒细胞减少症患者可能需要新的治疗管理方法[28]。
有研究提出应高度重视CRE抗感染的早期治疗,但是开始治疗的时间存在争议[22],抗菌药物的使用天数也存在争议。Gutiérrez-Gutiérrez等[29]的研究认为5 d内使用活性药物治疗能够显著降低患者的30 d死亡率(P<0.0001),而48 h内使用活性药物治疗没有显著的差异。但是一项meta结果分析表明,在检出CRE的48 h内使用活性药物治疗的生存率明显提高[30]。同样,本研究发现在检出CRE后48 h内进行活性药物治疗可显著降低死亡率(5.7%vs26.3%,P=0.026),然而5 d内的使用活性药物治疗患者的死亡率差异没有统计学意义。这提示在48 h内给药并及时进行抗菌药物敏感性检测可改善临床疗效。有研究认为接受短期的抗菌药物治疗的患者预后较差[12,27],而有研究却认为短期抗菌药物治疗是保护因素[31]。但是因为CRE感染的危重患者临床情况频繁变化,抗菌药物治疗方案需要随时调整,所以很难评估抗菌药物的使用天数对患者预后的影响。
同样,关于CRE抗菌药物的治疗方案目前仍有很多争议,关于单独用药还是联合用药,“老”抗菌药物(多黏菌素、替加环素、氨基糖苷类)的疗效如何,如何调整碳青霉烯类药物给药方式,新型复方制剂如CAZ-AVI的疗效和安全性如何,尚未形成一致的结论。
目前的研究证据更支持联合治疗(方案中不包含CAZ-AVI)[22,29],但是基于CAZ-AVI的治疗显示联合治疗和单药治疗的死亡率没有显著差异[32-33]。本次研究中单药治疗(8.3%)比联合治疗(25.0%)的死亡率更低(P=0.320)(使用CAZAVI的患者数量较少),部分原因可能是接受单药治疗的患者症状较轻或感染源容易控制[34]。
研究表明多黏菌素单药治疗CRE感染的疗效不好[35]。Medeiros等[36]的研究纳入89名患者,结果表明多黏菌素单药治疗CRKP-BSI死亡率高,而多黏菌素联合用药特别是联合阿米卡星具有更好的疗效。同样,Balkan等[12]研究表明,与非多黏菌素为基础的方案相比,以多黏菌素为基础的双重联合,最好是三重联合,疗效更好(P<0.001)。Shen等[14]认为基于多黏菌素联合治疗的方案比基于替加环素联合治疗的方案具有更高的生存率。近年来,使用碳青霉烯治疗CRE感染仍具有广泛的争议,研究表明使用高剂量碳青霉烯、延长输注、双碳青霉烯或者与其他抗菌药物联合似乎成为几种可选择的临床方案[37-39]。有研究认为包含碳青霉烯治疗死亡率显著降低[34,39],但也有研究认为包含碳青霉烯的治疗具有较差的治疗结局[21]。当美罗培南MIC较高水平时,可考虑使用高于许可水平的高剂量美罗培南给药方案,进行治疗药物监测(TDM)以取得更好的临床疗效[40]。CAZ-AVI 于 2015年由美国食品药品监督管理局批准用于治疗复杂性腹腔、泌尿系统和医院获得性肺部感染[41]。有几项研究报道了CAZ-AVI和其他抗菌药物相比,具有更低的死亡率[32,42]。虽然初步证据表明 CAZ-AVI 可能是治疗 CRKP 感染的有效手段,但在中国这方面的临床经验仍然有限,特别是缺乏上市后真实世界研究数据来评价其治疗 CRE感染的有效性和安全性[43]。本研究使用多黏菌素、替加环素、碳青霉烯类、CAZ-AVI的死亡率分别为31.3%、35.7%、20.7%、20%,与先前的研究结果基本一致[32,42]。
本研究也存在一些不足:第一,本研究是回顾性设计,因此容易出现选择偏差和回忆偏差;第二,由于数据的缺失,无法将其他的影响死亡的风险因素纳入分析,比如CRE产酶情况、美罗培南MIC、抗菌药物的使用剂量和持续时间等;第三,本研究是单中心研究,且样本量较小。
4 结论
本研究分析了我院CRE感染患者的死亡风险因素,并比较了不同抗菌方案治疗对死亡率的影响。结果表明中心静脉置管,尤其是感染性休克(OR=57.074)能显著增加CRE感染患者的死亡率,在临床上应当引起高度重视。单药治疗和联合治疗死亡率差异没有统计学意义,且治疗CRE的最佳抗菌治疗方案并未确定。但选择合理的抗菌药物并及时进行早期治疗(检出CRE 48 h内)可有效改善患者的临床预后。

