替米沙坦对大鼠胰岛素分泌作用的影响及其机制研究
崔丽娟,杨欢欢,支淋萍,刘 涛,3
(山西医科大学基础医学院1.机能实验室、2.药理教研室,山西 太原 030001,3.山西白求恩医院,山西医科大学第三医院普通外科,山西 太原 030032)
替米沙坦是经典的血管紧张素受体阻断剂,在临床上广泛用于高血压病和心力衰竭的治疗[1]。近年来,大量的文献表明,替米沙坦可以使糖尿病病人获益,机制包括保护胰岛β细胞功能[2],缓解周围胰岛素抵抗[3],改善糖尿病肾病[4],抑制高血糖的引起的心血管损害[5],改善肥胖病人的能量代谢,维持瘦素的敏感性[6],减轻高糖带来的抑郁[7]等。2型糖尿病以胰岛素分泌不足和胰岛素抵抗为主要特征,其中胰岛素分泌不足被认为是决定糖尿病发生发展的重要因素。但是,目前替米沙坦可以调控胰岛素分泌,直接影响胰岛素的分泌却鲜有报道。本研究旨在研究替米沙坦对胰岛素分泌的影响,同时由于β细胞的胰岛素分泌是电生理过程[8],我们通过钙成像及膜片钳技术进一步研究其相关的机制。
1 材料与方法
1.1 材料
1.1.1实验动物 ♂Wistar大鼠,体质量为(240~260)g,清洁级,由山西医科大学实验动物中心提供。生产许可证号:SYXK (晋)2019-0007。
1.1.2药品及试剂 替米沙坦,美国MCE公司(批号144701-48-4);胶原酶P(collagenase P):瑞士Roche公司(批号11213865001);Histopaque-1077:美国Sigma-Aldrich公司(RNBJ0578);Fluo-2AM染料:日本同仁化学研究所(批号11213865001);RPMI 1640培养基:上海生工(批号C518FA0002);胎牛血清:上海生工(批号B326FA0092)。
1.1.3实验仪器 体式显微镜:上海中恒(型号SM262);倒置显微镜:日本OLYMPUS(型号AE-2000);CO2细胞培养箱,德国Eppendorf(型号Galaxy 170);电极拉制仪:日本Narishige(型号PB-830);膜片钳系统:德国HEKA(型号MP-285);钙成像系统:北方MDE公司(型号LAMBDA 10-B)。
1.2 实验方法
1.2.1大鼠胰岛及胰岛细胞的分离与培养 断头处死大鼠后迅速打开腹腔,经胆总管向胰管内注入1 g·L-1的胶原酶P,将膨胀的胰腺完整剥离后置于37 ℃恒温振荡器中水浴消化11 min。培养液终止消化后加入Histopaque-1077分离液,梯度离心法分层制得大鼠胰岛。在体式显微镜下挑取形态饱满、大小适中的胰岛。在含胰岛的培养液中加入5 g·L-1DispaseⅡ溶液分离胰岛制得胰岛细胞。大鼠胰岛和胰岛细胞均在含10%胎牛血清和青链霉素的RPMI 1640培养液中,置于37 ℃含5% CO2的细胞培养箱中培养。方法参考实验室传统成熟技术[9]。
1.2.2胰岛素分泌实验 将分离出的胰岛培养过夜后,根据实验目的分组,每组7管,每管放置挑选好的大小均等的胰岛5个。首先各组胰岛在含2.8 mmol·L-1葡萄糖的培养液中预孵育30 min,弃去上清液。再加入含不同葡萄糖浓度和药物的培养液继续孵育30 min,取上清液采用放射免疫法测定胰岛素含量。
1.2.3钙成像实验 将分离好的胰岛细胞置于载玻片上,在培养皿中用配好的含2.8 mmol·L-1葡萄糖和2 μmol·L-1Fura-2AM(钙离子荧光指示剂)的培养液中避光孵育30 min,清洗去除多余的染液,避光转移至含2.8 mmol·L-1葡萄糖培养液的钙离子成像系统的浴槽中。激发光波长分别设置为340 nm和380 nm,发射光波长设置为510 nm,荧光值F340/F380的改变即反映出细胞内钙离子浓度的变化。分别用含不同浓度的葡萄糖和药物的培养液干预细胞,观察细胞内荧光值比值随时间的变化情况。
1.2.4膜片钳实验 配置相应离子通道的电极内外液。电压门控性钾(Kv)通道电极内液各成分浓度依次为(mmol·L-1):NaCl 10,KCl 140,MgCl 1,EGTA 0.05,HEPES 10,Mg-ATP 0.3;外液为NaCl 138,KCl 5.6,MgCl21.2,CaCl22.6,HEPES 5。电压门控性钙通道(VGCC)的电极内液:CsCl 120,MgCl21,EGTA 0.05,TEA 20,HEPES 10,CAMP 0.1,Mg-ATP 5;外液为CsCl,NaCl 100,BaCl220,MgCl21,TEA 20,HEPES 5。用电极拉制仪和抛光仪制备电极,电阻大小为5~8 MΩ,充灌相应的电极内液,高阻封接后破膜,改为全细胞模式,快电容补偿。设置钳制电压为-70 mV,刺激步阶为10 mV,Kv通道序贯给予-70 mV到+80 mV的电压刺激,刺激时程为400 ms,VGCC则给予-50 mV到+30 mV的电压刺激,刺激时程为50 ms,记录时程内的各通道的电流变化。

2 结果
2.1 替米沙坦对离体大鼠的胰岛素分泌的影响如Tab 1所示:不同浓度的(10、50 μmol·L-1)的替米沙坦在低葡萄糖浓度(2.8 mmol·L-1)下对离体大鼠的胰岛素分泌没有影响,但在高葡萄糖浓度下(8.3 mmol·L-1)却表现出药物浓度依赖性的促胰岛素分泌作用。进一步我们在更高的葡萄糖浓度(11.1和16.7 mmol·L-1)下,采用10 μmol·L-1的替米沙坦干预,Tab 2显示随葡糖糖浓度的升高,替米沙坦的促胰岛素分泌作用逐渐增强。
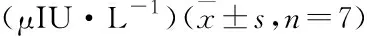
Tab 1 Effect of telmisartan on insulin secretion
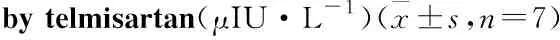
Tab 2 Insulin secretion glucose-dependently potentiated
2.2 替米沙坦对胰岛β细胞内Ca2+浓度的影响分别在低(2.8 mmol·L-1)和高(16.7 mmol·L-1)葡萄糖浓度下钙成像实验,Fig 1结果表明,在低糖浓度下浓度逐渐增高的替米沙坦并没有提高胰岛β细胞内的Ca2+浓度,而作为阳性对照的Tolbutamide却出现了明显的Ca2+浓度升高。在高糖浓度替米沙坦可以升高细胞内的Ca2+浓度,且随着替米沙坦剂量的逐渐增大(10、50 μmol·L-1),升钙作用逐渐增强(Fig 2)。
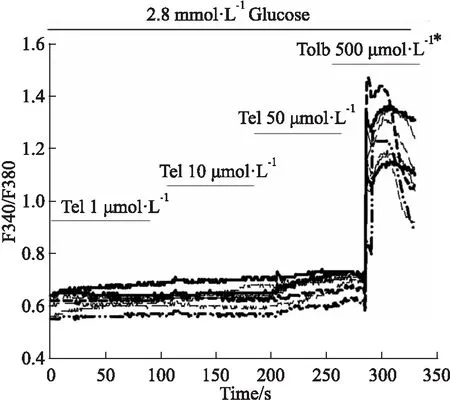
Fig 1 Effect of telmisartan on intracellular Ca2+concentration ([Ca2+]i) in low glucose condition
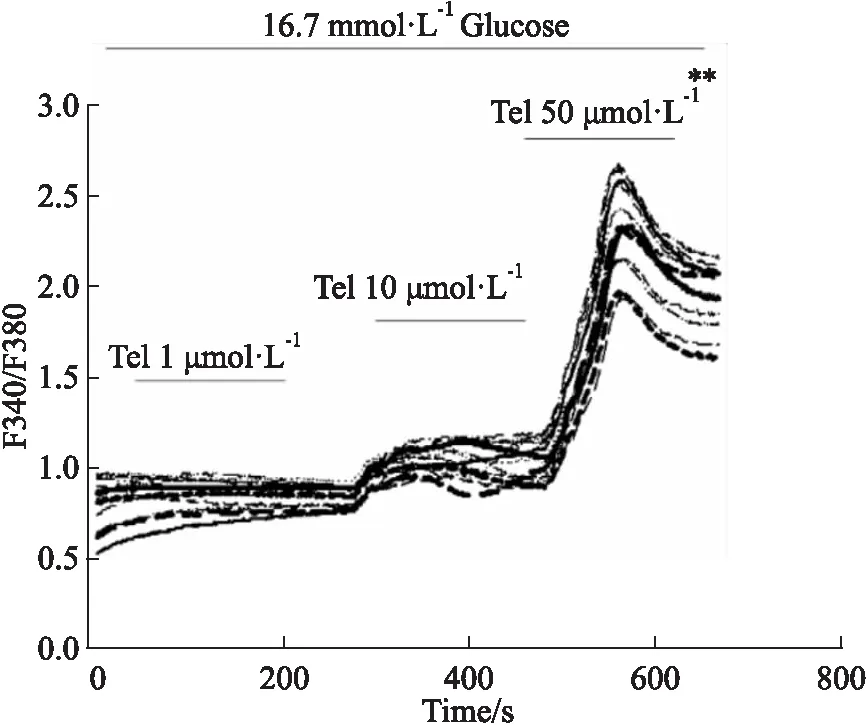
Fig 2 Effect of telmisartan on intracellular Ca2+concentration([Ca2+]i)in high glucose condition
2.3 替米沙坦对胰岛β细胞Kv通道的作用分别用不同剂量的替米沙坦行膜片钳实验,比较Kv通道电流-电压曲线中各组细胞在+80 mV时的电流密度。结果显示:10 μmol·L-1和50 μmol·L-1替米沙坦对胰岛β细胞的Kv通道具有明显的抑制作用(见Tab 3)。

2.4 Kv通道不是替米沙坦发挥作用的唯一因素在高糖浓度(8.3 mmol·L-1)下,采用Kv通道的抑制剂TEA(20 mmol·L-1)行胰岛素分泌实验,可以看出TEA明显促进了胰岛素分泌(P<0.01),但是,10 μmol·L-1的替米沙坦在TEA存在的情况下仍然可以明显地促进胰岛素分泌(P<0.01),这表明Kv通道不是替米沙坦促进胰岛素分泌的唯一因素(见Tab 4)。
Tab 4 Kv channels not alone involved in mediating telmisartan-induced insulin secretion(μIU·L-1)
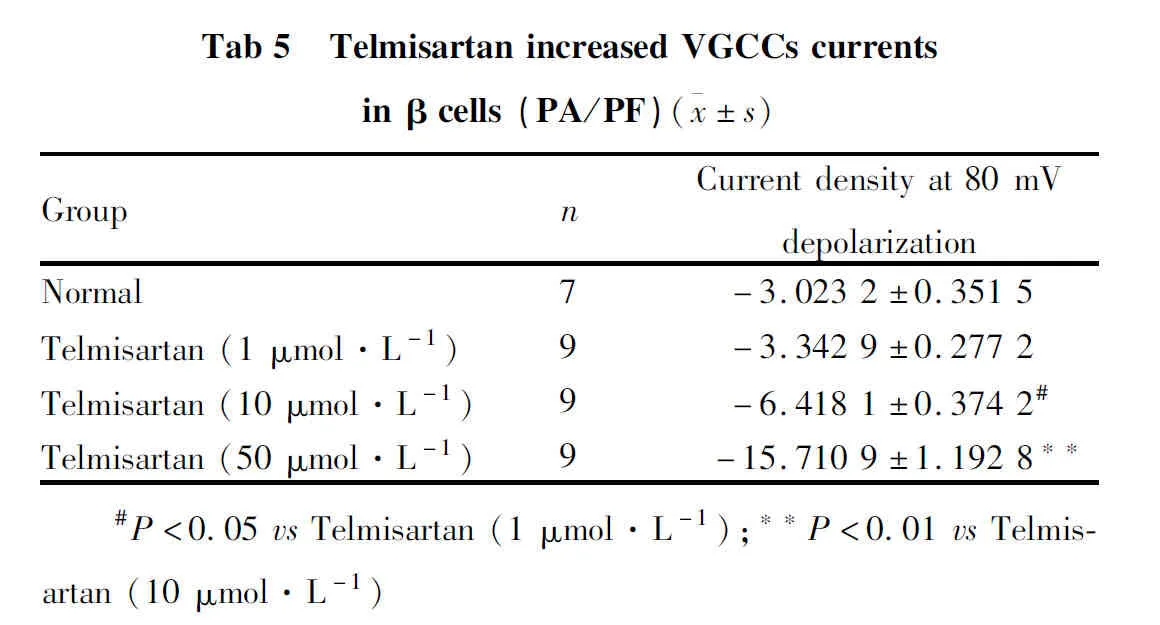
2.5 替米沙坦对胰岛β细胞VGCC的作用进一步行VGCC的膜片钳实验,观察替米沙坦对其的作用。电流-电压曲线中在0 mV时各组细胞的电流密度比较表明,随着剂量的逐渐增加,替米沙坦显示出逐渐增强的激活β细胞VGCC的作用(Tab 5)。
3 讨论
糖尿病和高血压是临床上最为常见的两种疾病,而且它们之间通过多种病理生理机制相互联系,形成恶性循坏,导致较高的死亡率和发病率,严重威胁人类的健康。由于血管紧张素受体阻滞剂可以使糖尿病和糖尿病前期的患者获益,因此被美国糖尿病协会等机构推荐作为糖尿病合并有高血压的病人降压治疗的一线药物[10]。但目前尚未见到关于此类药物对胰岛素分泌作用影响的报道。即使有可见的有关替米沙坦促进胰岛素分泌的文献,也仅仅是替米沙坦由于抑制高糖引起的炎症反应和氧化应激,进而避免胰岛β细胞功能失衡,抑制β细胞凋亡的长期保护作用的结果[2,11]。本次研究我们首次发现替米沙坦作为胰岛素促泌剂,可以“急性”地促进胰岛素分泌。
本实验表明,替米沙坦不仅可以迅速地促进胰岛素的分泌,而且更为关键的是,这种促分泌作用是葡萄糖浓度依赖性的,即只在高糖浓度下发挥作用,低糖浓度下无促进作用。这说明替米沙坦可以在促进胰岛素分泌的前提下最大可能地避免低血糖的发生。低血糖是目前糖尿病治疗过程中最为常见也是最为严重的并发症;不仅仅是因为通常所认识的“显性”的低血糖可以引起昏迷和神志不清,影响日常生活,更为重要的是反复的“隐匿”的低血糖可以引起一些致死性的心脏并发症,如心律失常、心肌缺血梗死,而且引起神经认知系统的损害,可能加剧中老年糖尿病人发生痴呆的风险[12]。所以,避免低血糖并发症的发生,目前成为评价治疗糖尿病药物的一个重要指标[13]。同时目前关于“胰岛素的过分泌”的理论逐渐受到重视,很多文献指出持续地促进胰岛素的分泌,具有潜在的加剧胰岛β细胞功能恶化的趋势,有可能加速2型糖尿病的进程[14]。临床报道也证实如甲苯磺丁脲一类的葡萄糖浓度非依赖性的胰岛素促泌剂,确实存在比其它如格列本脲、二甲双胍等抗糖尿病药物整体长期疗效差的不足[15]。而我们的实验结果表明,替米沙坦可以在适当的时候根据葡萄糖浓度的需要成比例地“智能化”促进胰岛素的分泌,这无疑可以最大程度地避免以上弊端。
细胞内钙离子浓度在胰岛β细胞分泌胰岛素中发挥着重要作用,包括胰岛素的合成、分泌[8]。我们进一步研究了替米沙坦与胰岛β细胞内钙离子浓度的关系,与其促胰岛素分泌作用一致,只有在高糖浓度下才可见明显的升高细胞内钙离子浓度,且随着药物浓度的增高,细胞内的钙离子浓度进一步升高。β细胞分泌胰岛素是一个电生理过程。考虑到Kv通道在葡萄糖浓度依赖性地促进胰岛素分泌和提高细胞内钙离子浓度中起重要作用[16-18],所以进一步我们用膜片钳技术探索替米沙坦对Kv通道的影响,结果表明替米沙坦确实抑制Kv通道的电流。高糖浓度下,葡萄糖代谢转化为ATP浓度的升高,使得ATP/ADP 比例升高,这会导致β细胞的KATP通道关闭,引起细胞膜去极化。细胞的去极化会同时激活细胞的Kv通道和钙通道,引起钾离子外流和钙离子内流,这两种电流相互对抗共同构成了细胞的复极化阶段[16,18]。抑制Kv通道影响分泌和钙离子浓度的机制在于其可以延缓钾离子外流,削弱对钙离子内流的对抗而延长复极化的时间,也就是钙内流的时间,因而提高了钙离子浓度,促进了胰岛素的分泌。
TEA是Kv通道的抑制剂,文献报道20 mmol·L-1的TEA可以抑制几乎85%~90%的钾电流,从而促进胰岛素分泌[17]。但我们的实验却表明,即使在TEA显著提高细胞内钙离子浓度,促进胰岛素分泌的基础上,替米沙坦仍然可以继续发挥作用,这表明Kv通道不是替米沙坦发挥作用的唯一因素。随之的结果也表明了这一点,替米沙坦还可以激活VGCC。正是因为钾通道和钙通道的激活均必须在高糖状态下关闭KATP通道引起细胞去极化的前提下,所以替米沙坦的电生理特征,即抑制Kv通道延长钙内流的时间,激活钙通道促进钙内流,决定了替米沙坦促进胰岛素分泌的葡糖糖浓度依赖性。
作用于胰岛β细胞的KATP通道、Kv通道和VGCC这三种通道的药物都会影响胰岛素的分泌。而关闭KATP通道的药物如临床中常见的磺酰脲类降糖药,其促进胰岛素分泌的途径绕过了细胞内葡萄糖代谢这一环节,降糖作用不依赖于体内的血糖水平。而由于本实验中,替米沙坦在低糖浓度(2.8 mmol·L-1)下没有增强胰岛素分泌(Tab 1,2)。另外,在低糖浓度下亦未增加β细胞内的钙离子浓度,而作为阳性对照的KATP通道阻断剂的磺酰脲类药物甲苯磺丁脲干预后,却明显升高了β细胞内的钙离子水平(Fig 1)。这亦说明替米沙坦和甲苯磺丁脲作用于不同的靶点。
综上,本实验表明,替米沙坦通过影响β细胞的离子通道而发挥与既往文献不同的调控胰岛素分泌的作用,这为替米沙坦在治疗糖尿病中的应用展示了一个新的视野。同时,令我们感到欣喜的是,替米沙坦的促分泌作用是葡糖糖浓度依赖性的,不会出现一般的降血糖药物的“低血糖”和引起“胰岛细胞过度分泌”的副作用,这也将为葡萄糖浓度依赖性胰岛素促泌剂的开发提供了一个新的思路。