基于sfGFP系统的嫁接体接口处的细胞质融合检测
李冬怡,邓竹英,梁大成
(1.湖北省主要粮食作物产业化协同创新中心,湖北 荆州 434025;2.长江大学 湿地生态与农业利用教育部工程研究中心, 湖北省涝渍灾害与湿地农业重点实验室,湖北 荆州 434025)
嫁接是指把一株植物的枝或芽接到另一株植物的茎或根上,二者切口紧密连接共同生长,使接在一起的2个部分长成一个完整植株的技术[1],嫁接的方法有多种,包括侧接、舌接、劈接、剪接等[2]。嫁接作为一项技术手段广泛应用于农业生产中,用来提高作物产量、改变植株分支结构、增强作物对生物和非生物胁迫的耐受性等[3-4],同时也是研究参与基本生物过程的可移动蛋白、mRNA、小RNA的重要手段[5-8]。嫁接除了作为一项技术广泛应用于农业生产和基础研究外,嫁接体接口愈合机制的研究也十分重要。
嫁接体愈合机制的研究主要涉及创伤应急响应、愈伤组织形成、维管束重连、砧穗间的通讯、遗传物质转移等方面[9-11]。在嫁接体接口细胞互作及遗传物质传递研究中,许多研究者认为,砧穗间仅蛋白质和RNA分子移动,并无遗传物质交流,Stegemann等[12]、Fuentes等[13]、Gurdon等[14]和Bock[15]的研究证明,整个基因组可以在接穗和砧木间移动。Stegemann等[16]将在叶绿体中表达壮观霉素抗性基因和绿色荧光蛋白(GFP)基因的转基因普通烟草接穗嫁接到在细胞核中表达卡那霉素抗性基因和黄色荧光蛋白(YFP)基因的转基因粉蓝烟草砧木上,接口愈合后,截取嫁接体接口部位移至含有卡那霉素和壮观霉素的培养基中,结果发现,被截取的接口部位能够在培养基中长出愈伤组织,并生长出新植株,这表明砧穗间已发生遗传信息的转移。它们利用共聚焦激光扫描显微镜观察到嫁接体中GFP和YFP荧光信号在同一细胞中表达,表明叶绿体基因组可以通过嫁接从一个物种传递到另一个物种。Lu等[17]的研究也证实了这一结论。前人的研究表明,植物细胞器的基因组参与嫁接体植物间水平基因组转移,但并不清楚基因组是如何从一个细胞移至另一个细胞,以及它们是作为游离DNA分子还是包裹在细胞器中移动。Hertle等[18]为探究嫁接体接口处叶绿体在细胞间的移动机制,将Pt-spec∶dsRed接穗嫁接到Nuc-kan∶YFP砧木上,利用共聚焦显微镜观察不同时期嫁接体接口处愈伤组织切片,发现砧穗间愈伤组织开始黏附时就已出现叶绿体的移动,叶绿体在砧穗间的移动可能发生在维管束重连之前。且利用透射电镜观察到,嫁接体接口愈伤组织形成初期,细胞壁会形成大孔,细胞质中的物质通过这些孔转运到相邻细胞,证实细胞器可以在细胞间移动,表明遗传物质可能是被包裹在细胞器中移动的。
目前,绿色荧光蛋白(GFP)、黄荧光蛋白(YFP)和红荧光蛋白(RFP)作为荧光标签多被用在嫁接体愈合机制的研究中[16-18],本研究中用到自组装拆分的超折叠绿色荧光蛋白(sfGFP)系统。sfGFP可拆分为2个片段,分别为sfGFP1-10和GFP11。这2个单独的片段是非荧光的,因为GFP11中保守的E222残基对于发色团的成熟至关重要,一旦它们邻近存在,2个片段就会重组成β桶状结构并发出荧光[19]。前人利用自组装拆分的sfGFP系统进行亚细胞定位的研究有很多,Van Engelenburg等[20]利用自组装拆分的sfGFP系统对沙门氏菌直接分泌的三型效应物(T3E)进行了监测。Park等[21]基于改进的sfGFP1-10优化了自组装拆分的sfGFP系统,提高sfGFP1-10片段的溶解度,增强GFP荧光强度,以监测丁香假单胞杆菌三型效应因子(T3Es)在植物细胞中的亚细胞定位。sfGFP系统还被用来研究哺乳动物蛋白的亚细胞定位[22]以及可视化通过T4SS传递的农杆菌VirE2进入植物细胞的过程[23]。目前,sfGFP系统还未被用在嫁接体愈合机制研究中。本研究构建了在细胞质中单独表达sfGFP1-10和mCherry-11的转基因拟南芥和在细胞质中单独表达sfGFP1-10和mCherry-11的转基因烟草植株,嫁接后利用激光共聚焦显微镜观察接口处GFP荧光信号,检测嫁接体接口处细胞质的融合发生事件。
1 材料和方法
1.1 试验材料
野生型拟南芥(Col-0)和野生型本生烟草(Nicotianabenthamiana)均由长江大学农学院湿地作物微嫁接实验室提供,转化所用根癌农杆菌GV3101由本实验室制作保存。试验所需分别带有基因sfGFP1-10和mCherry-11靶向细胞质的质粒CYTO-sfGFP1-10和CYTO-mCherry-11由美国加州大学生命科学学院植物生物学系和基因组中心Park Eunsook博士提供。
1.2 试验方法
1.2.1 拟南芥的遗传转化 将质粒CYTO-sfGFP1-10和CYTO-mCherry-11分别转入农杆菌感受态细胞GV3101,转化后的农杆菌GV3101涂布于LB固体平板(含卡那霉素、利福平和庆大霉素)上,28 ℃培养2 d,挑取单菌落于LB液体培养基(含卡那霉素、利福平和庆大霉素)中,28 ℃ 250 r/min摇菌48 h后,取1 mL菌液扩繁培养。6 000 r/min 10 min收集菌体,重悬于侵染液(5%的蔗糖、0.05%的 SilwetL-77),使OD600≈0.8。将野生型拟南芥Col-0的花苞分别浸泡在CYTO-sfGFP1-10和CYTO-mCherry-11的侵染液中1 min左右,暗处生长2 d后正常培养,10 d后进行二次侵染,成熟后收取的拟南芥种子即为T0种子,在含潮霉素的MS培养基中筛选生长健康的单株并种植于土壤中,再收获得到T1种子。
1.2.2 烟草的遗传转化 按1.2.1方法得到CYTO-sfGFP1-10和CYTO-mCherry-11的扩繁菌液。83 r/s 5 min收集菌体,重悬于侵染液(液体MS培养基、100 μm AS),使OD600≈0.5。将在无菌条件下生长28 d左右的野生型本生烟(Nicotianabenthamiana)叶片剪成圆片形状,浸泡于侵染液中2 min,用镊子取出叶片放在无菌滤纸上吸干表面残留液体,放到含无菌滤纸的固体MS培养基(含100 μm AS和1 mg/L 6-BA)上,28 ℃黑暗条件下共培养2 d,移至新的固体MS培养基(含1 mg/L 6-BA、200 mg/L 头孢噻肟、250 mg/L 特美汀和50 mg/L 潮霉素)中,28 ℃ 黑暗条件下生长7 d转移到光照条件下生长,待愈伤长出烟草后移至生根培养基(含1 mg/L NAA、200 mg/L 头孢噻肟、250 mg/L 特美汀和50 mg/L 潮霉素)中。长出根系的烟草移至土壤里种植,成熟后收获得到T1种子。
1.2.3 嫁接体构建 将在细胞质中单独表达sfGFP1-10和mCherry-11的转基因拟南芥T1种子和在细胞质中单独表达sfGFP1-10和mCherry-11的转基因烟草T1种子播种在MS培养基(含潮霉素)中,8 d后,选取生长健壮的拟南芥(At-1-10、At-11)和烟草(Nb-1-10、Nb-11)幼苗作为嫁接材料。将在细胞质中表达sfGFP1-10的转基因拟南芥接穗嫁接到在细胞质中表达mCherry-11的转基因烟草砧木上构建远缘嫁接体At-1-10/Nb-11,将在细胞质中表达sfGFP1-10的转基因拟南芥幼苗接穗嫁接到在细胞质中表达mCherry-11的转基因拟南芥砧木上构建自体嫁接体At-1-10/At-11,将在细胞质中表达sfGFP1-10的转基因烟草接穗嫁接到在细胞质中表达mCherry-11的转基因烟草砧木上构建自体嫁接体Nb-1-10/Nb-11。同时构建3组对照嫁接体:At-11/Nb-11、At-11/At-11、Nb-11/Nb-11。
1.2.4 共聚焦激光显微镜观察 在嫁接后第4天,制作嫁接体徒手切片以及在细胞质中单独表达sfGFP1-10和mCherry-11的转基因拟南芥未嫁接单株和在细胞质中单独表达sfGFP1-10和mCherry-11的转基因烟草未嫁接单株的徒手切片,利用徕卡TCS SP8共聚焦显微镜观察切片的GFP荧光信号(GFP荧光信号的观察选择488 nm激光波长进行激发)。
2 结果与分析
2.1 拟南芥、烟草转化后代筛选及嫁接体的构建
选取MS固体培养基(含潮霉素)中生长健壮的T1转基因拟南芥幼苗(图1-A、B)和T1转基因烟草幼苗(图1-C、D)作为嫁接材料,成功构建嫁接体At-1-10/Nb-11、At-1-10/At-11 和Nb-1-10/Nb-11(图1-E—G),在嫁接后第4天,制作嫁接体及T1转基因拟南芥和烟草未嫁接幼苗的徒手切片,利用激光共聚焦显微镜观察GFP荧光信号。
2.2 sfGFP系统可视化拟南芥/拟南芥嫁接体接口处细胞质的融合
用共聚焦显微镜观察发现,在细胞质中单独表达sfGFP1-10和mCherry-11的未嫁接拟南芥幼苗At-1-10和At-11以及嫁接体At-11/At-11中均无GFP信号的表达(图2-A—C)。在拟南芥自体嫁接体At-1-10/At-11接口处观察到GFP信号,出现的GFP信号多聚集在接口处,少量移动到接穗和砧木部位(图2-D)。结果表明,在嫁接后第4天,拟南芥自体嫁接体砧穗间已经发生了细胞质的融合。嫁接体接口愈合过程中,拟南芥接穗中靶向细胞质的sfGFP1-10和砧木中靶向细胞质的mCherry-11重组成sfGFP发出荧光。因此,自组装拆分的sfGFP系统可用于监测拟南芥自体嫁接体接口处细胞质的融合。
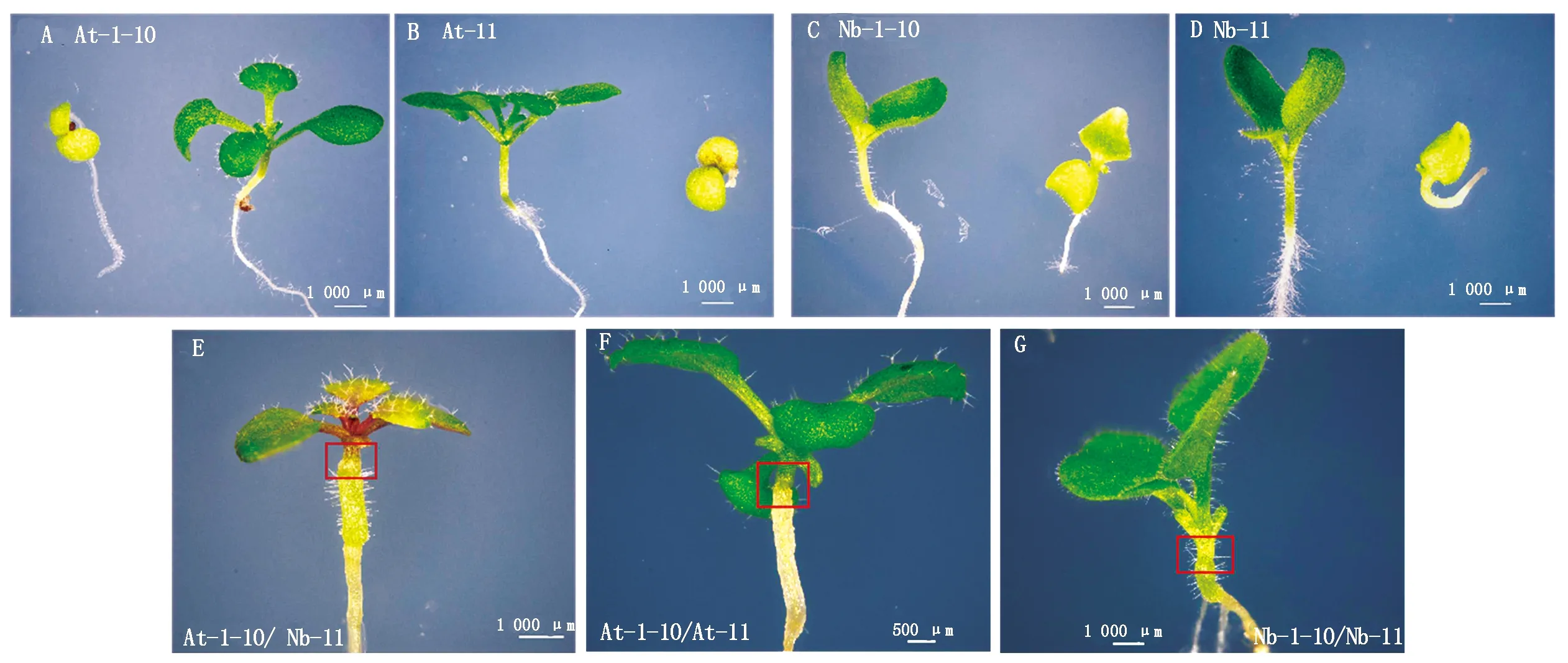
图1 转基因拟南芥与烟草及构建的嫁接体Fig.1 Transgenic Arabidopsis thaliana and Nicotiana benthamiana plants and constructed grafts
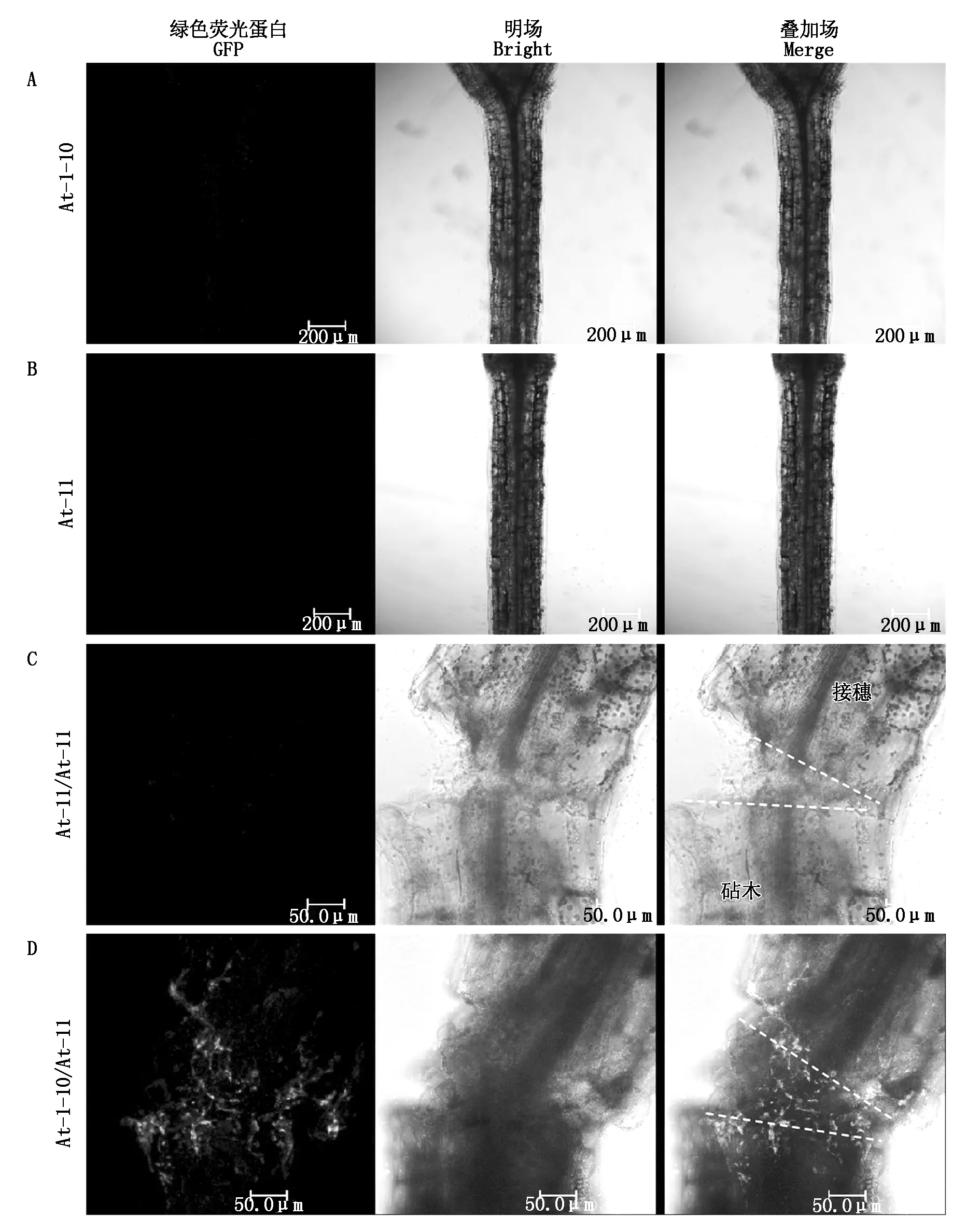
图2 转基因拟南芥单株及拟南芥/拟南芥嫁接体GFP信号观察Fig.2 GFP signal observation of transgenic Arabidopsis thaliana plants and At/At grafts
2.3 sfGFP系统可视化烟草/烟草嫁接体接口处细胞质的融合
为了探究烟草自体嫁接体接口细胞质的融合情况,用共聚焦显微镜观察了在细胞质中单独表达sfGFP1-10和mCherry-11的未嫁接烟草幼苗Nb-1-10和Nb-11以及烟草自体嫁接体Nb-11/Nb-11和Nb-1-10/Nb-11。结果发现,未嫁接烟草幼苗Nb-1-10和Nb-11以及烟草自嫁接体Nb-11/Nb-11中无GFP荧光信号(图3-A—C),而在烟草自体嫁接体Nb-1-10/Nb-11的接口处观察到GFP信号,且有部分荧光信号转移到接穗和砧木中,聚集在维管部位(图3-D)。
2.4 sfGFP系统可视化拟南芥/烟草嫁接体接口处细胞质的融合
利用sfGFP系统识别拟南芥自体嫁接体和烟草自体嫁接体接口处细胞质融合的方法是可行的,为进一步监测远缘嫁接体细胞质融合情况,将在细胞质中表达sfGFP1-10的拟南芥接穗嫁接到在细胞质中表达mCherry-11的烟草砧木上构建远缘嫁接体At-1-10/Nb-11。在嫁接后第4天,用共聚焦激光显微镜观察发现,对照嫁接体At-11/Nb-11中无GFP信号(图4-A),拟南芥与烟草的远缘嫁接体At-1-10/Nb-11接口处检测到GFP信号,拆分的sfGFP片段在接口处重组后移动到接穗部位,大量聚集在接穗维管束周围(图4-B)。
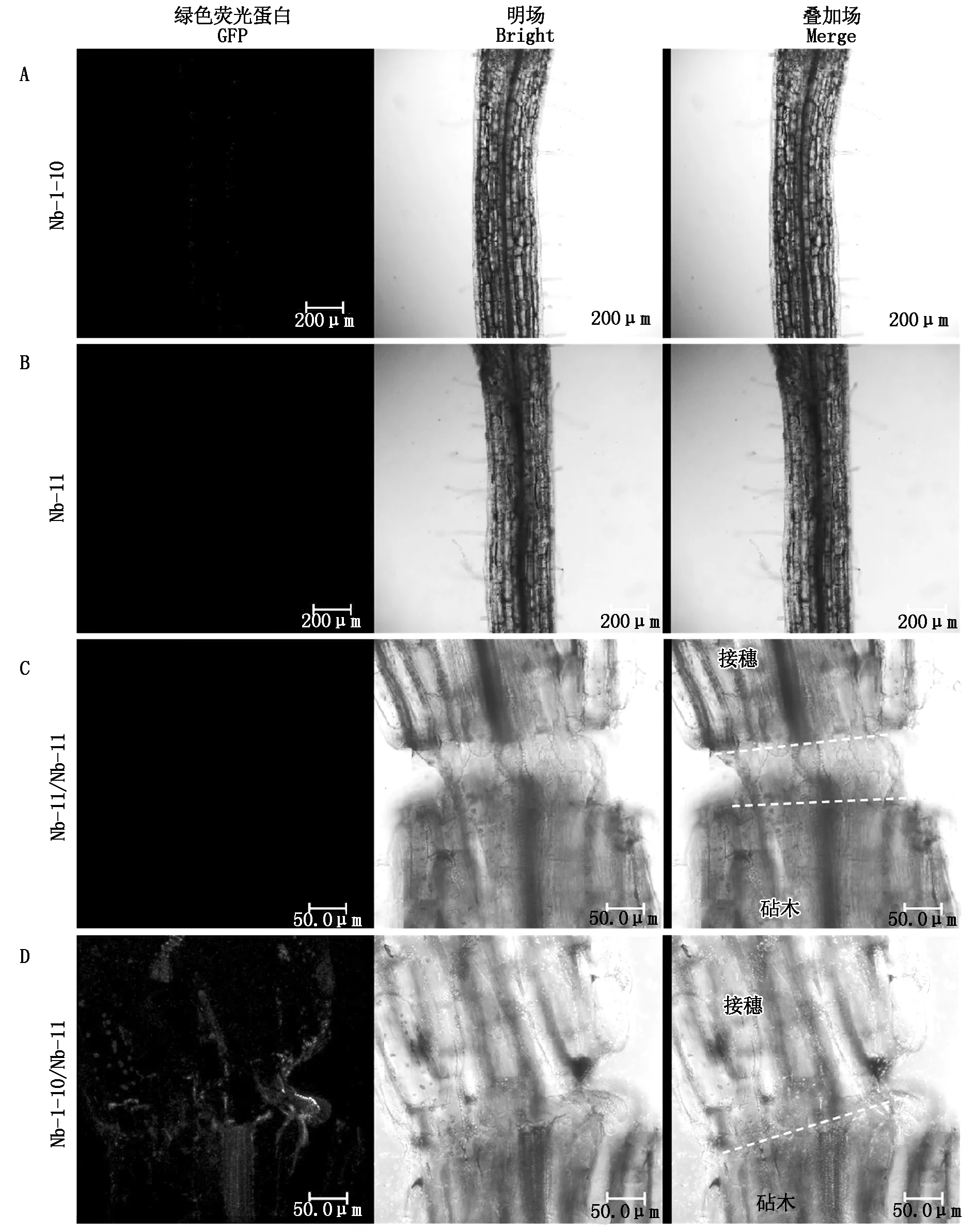
图3 转基因烟草单株及烟草/烟草嫁接体GFP信号观察Fig.3 GFP signal observation of transgenic Nicotiana benthamiana plants and Nb/Nb grafts
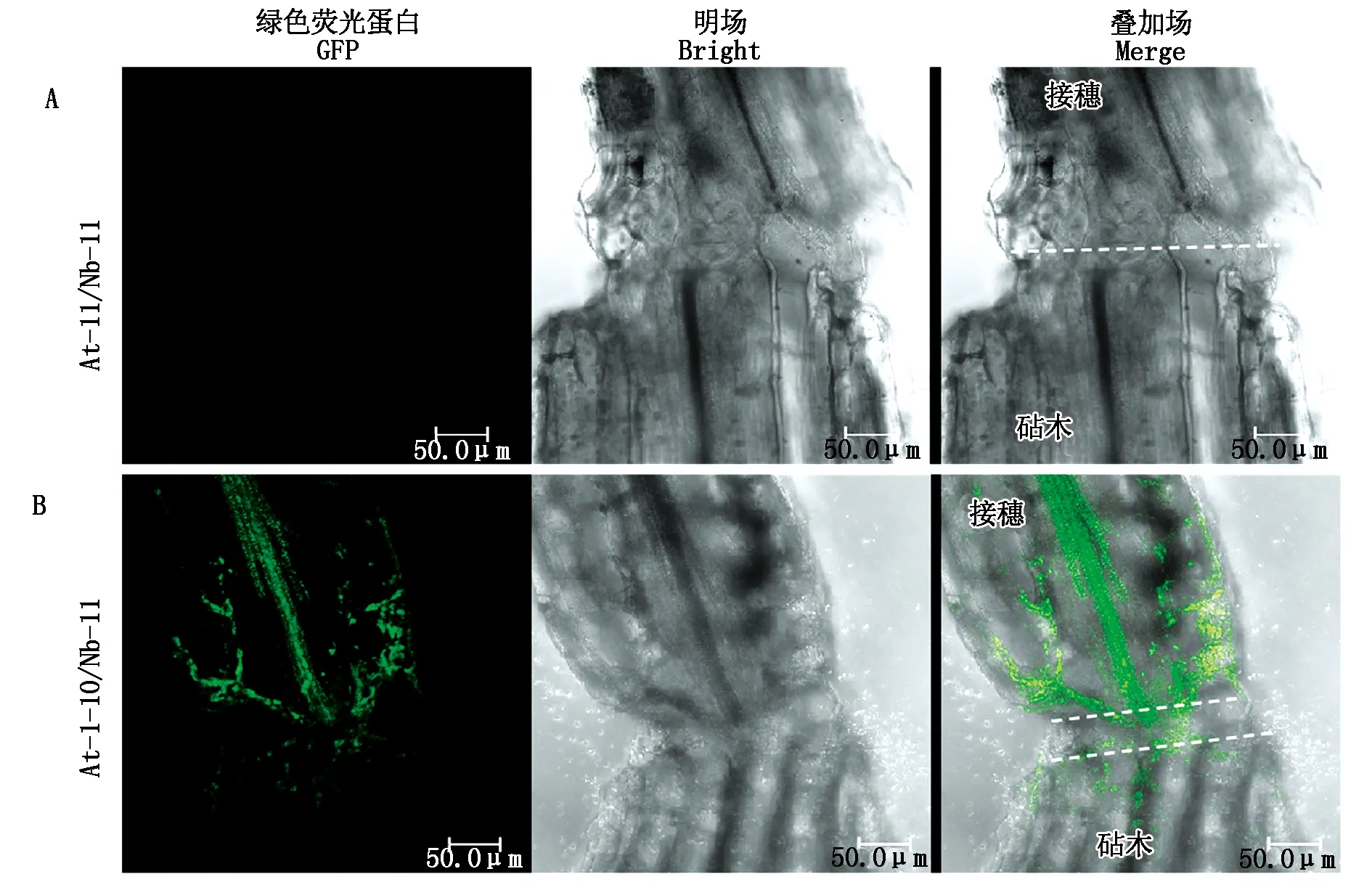
图4 拟南芥/烟草嫁接体GFP信号观察Fig.4 GFP signal observation of At/Nb grafts
2.5 远缘嫁接与自体嫁接接口处细胞质融合差异
为了比较自体嫁接体与远缘嫁接体在细胞质融合上的差异,用LAS AF Lite统计嫁接体接口处及附近部位的GFP荧光表达量,结果发现,在嫁接后第4天,拟南芥和烟草的远缘嫁接体At-1-10/Nb-11的GFP荧光强度显著强于自体嫁接体At-1-10/At-11和Nb-1-10/Nb-11(P<0.05),且拟南芥自体嫁接体的荧光强度显著强于烟草自体嫁接体(P<0.05)(图5)。
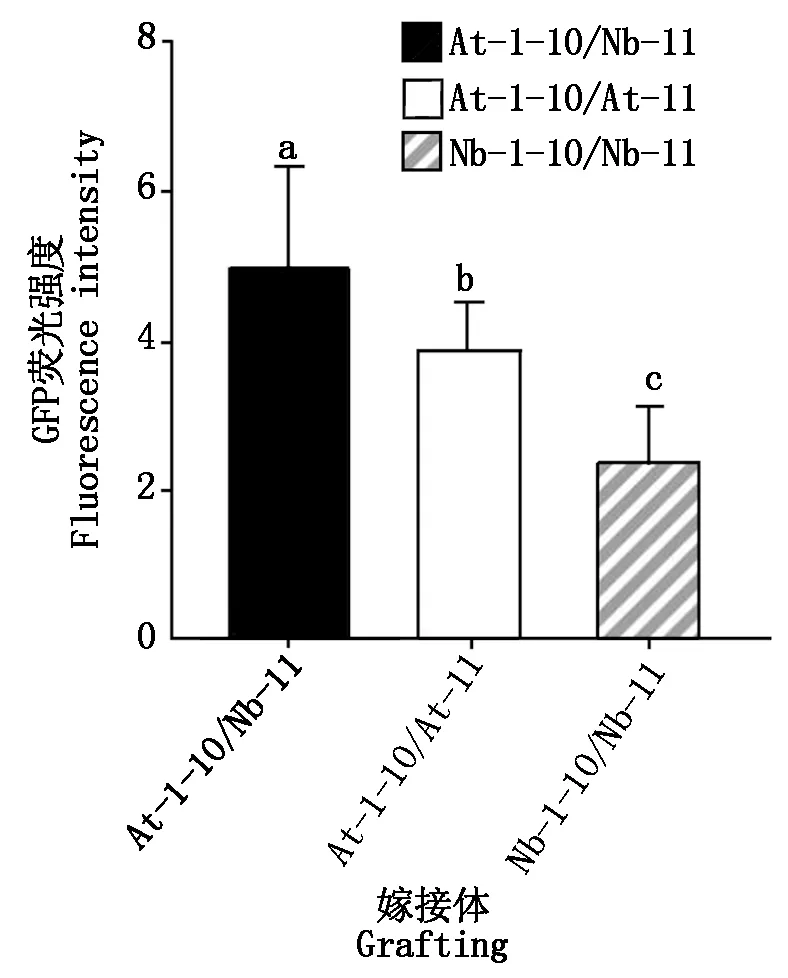
不同小写字母表示数据之间存在显著差异(P<0.05)。 Different lowercase letters indicated significant differences between the data(P<0.05).
3 结论与讨论
Stegemann等[16]、Lu等[17]和Hertle等[18]的研究表明,嫁接可以使叶绿体基因组跨越物种屏障,且叶绿体能够在砧穗间移动,它们在试验中将GFP、YFP和RFP作为标签对嫁接体接口细胞器的移动进行监测追踪。本研究利用拆分的sfGFP系统可视化自体嫁接与远缘嫁接细胞质融合的方法更直观简便,省去双抗性培养基筛选愈伤组织的过程,构建了在细胞质中单独表达sfGFP1-10和sfGFP11的转基因拟南芥和在细胞质中单独表达sfGFP1-10和sfGFP11的转基因烟草植株,嫁接后利用共聚焦显微镜观察嫁接体接口处是否存在GFP荧光信号,以此判断接穗与砧木接口处细胞间细胞质是否发生融合。结果表明,在嫁接后第4天,自体嫁接与远缘嫁接体接口处细胞质已经发生融合,远缘嫁接体与自体嫁接体接口处的GFP信号都向嫁接体接穗和砧木部位发生不同程度的转移,大量聚集在维管束附近,这与Hertle等[18]和Melnyk等[24]的结论一致,推测细胞质的融合发生在维管束重连(3 DAG)之前,可能在嫁接后短时间内接口处就产生了细胞质融合;同时发现,远缘嫁接体发生的细胞质融合程度远强于自体嫁接,这可能与物种间不亲和性有关,远缘物种在嫁接愈合过程中接口处细胞间的识别以及维管束的变化是剧烈的[25],为响应这一系列剧变,可能导致远缘嫁接体砧穗间细胞器的融合及移动发生时期更早,且强度强于自体嫁接体,具体原因尚需进一步研究。本研究仅观察了在嫁接后第4天嫁接体接口处细胞质融合情况,尚不清楚接口处细胞质是从何时开始融合转移的。为进一步探究嫁接体砧穗间细胞器的融合互作机制,在本研究的基础上,可以构建在细胞核、叶绿体和线粒体等细胞器单独表达sfGFP1-10和mCherry-11的转基因拟南芥和烟草植株,分别在嫁接后第3天、嫁接后第2天、嫁接后1天甚至嫁接后更短时间内观察接口处的荧光表达情况。
目前,砧穗间细胞互作相关研究还处于初级阶段,尚未弄清接口处细胞间细胞器是如何融合移动的。本研究将sfGFP系统应用于研究砧穗间细胞互作的方法是新颖的,利用这种自组装拆分sfGFP系统的发光机制,可视化嫁接体接口处细胞质的融合,证实了sfGFP系统在嫁接体愈合机制研究中的可行性,为研究嫁接体接口处细胞学事件提供了新思路和方法。

