疼痛感觉易感与非易感神经生物学机制的研究进展*
疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历
。生理状态下,疼痛是机体受到伤害性刺激时为避免受到进一步的损伤而做出的一种保护性反应,常伴有厌恶、恐惧等情感改变。2018 年流行病学调查显示我国罹患慢性躯体疼痛的病人占总人口的35.9%,全球排名第六
。疼痛及其相关的医疗与社会现象(如阿片危机),现已成为一个危害严重的全球性公共卫生问题。
调查发现,想继续深造的学生随着年级的升高比例逐级降低。三年级后学生分流明显,确定考研的同学会坚持到最后。出现这种现象的原因主要有两个:第一,就业压力增大,社会对学历的要求越来越高,学生已经认识到了学历的重要性,所以坚持不懈。第二,很多学生认为自己高考发挥欠佳,入学时就订下目标,希望考上研究生。但随着时间的推移,学习不努力、成绩不如意等又使部分学生继续深造的意愿越来越淡。因此,采取一定措施,有效保护学生的学习热情是摆在学院和教师面前的一道难题。
疼痛及其相关的情感、认知与社会维度的表现属于脑的高级活动。疼痛不仅是对于伤害性刺激的感觉和情感体验,还是多种信息相互整合的一个复杂过程。同时,疼痛的产生也受到心理、社会和环境等多种因素的影响。因此,个体对疼痛刺激和疼痛状态的反应也表现出很大的差异。临床研究发现,疼痛个体差异现象普遍存在,例如对同等强度的机械刺激,有的正常志愿者表现出轻度疼痛,而有的表现为强烈的疼痛
。病理性疼痛作为某些疾病的伴随症状,在人群中的发生率也不同,存在明显的个体差异:34%的糖尿病病人会出现神经病理性疼痛
;12.8%的带状疱疹病人会出现后遗神经痛
;根据手术类型的不同,经历过手术的病人中5%~40%存在不同程度的术后疼痛
;骨关节炎病人的疼痛敏感性也存在较大个体差异,且与关节损伤程度无必然联系
。
引领儿童潜心投入,读活文本 从诵读入手,凭借语言文字,形成表象,让学生进入情境,使课文中的人、事、景、物在脑海中活脱脱地浮现,实现“情景再现”,与文中的主人公同欢笑、共悲伤,产生共鸣。这种深入的情感交流和心灵对话,让学生将自己的阅读感受与作者的意图进行比较,为文本的内容和表达创造出新的意义,使阅读成为一种“被引导的创造”。
过去,人们将这种对疼痛感知的差异性总结为“疼痛的个体差异”“疼痛的主观反映”或“疼痛的敏感程度”等
。2006 年,Karoly 和Ruehlman对这一现象进行了更加深入的解释,他们认为个体经历较强的疼痛刺激,但表现出较低的负性情绪和疼痛相关的功能障碍是对疼痛的非易感 (resilience),反之则是对疼痛的易感
。此后,越来越多的研究提示疼痛的易感 (vulnerability/susceptibility) 与非易感是一种稳定的临床现象
。2020 年,Nestler 和Waxman 进一步提出了“疼痛非易感” (resilience to pain) 的概念,并指出疼痛非易感可能是疼痛与镇痛领域未来一个重要的研究方向,促进非易感机制是一种崭新的镇痛理念
。近年来,关于疼痛易感与非易感的研究逐渐增加,但由于缺乏理想的动物模型,相关的基础研究较少且多聚焦于理论,导致其背后的神经生物学机制尚不明确。疼痛易感与非易感的存在,往往会增加疼痛治疗的难度,带来“镇痛不足”或者“过度镇痛”等医疗问题,难以实现疼痛的精准治疗。因此,理解疼痛感觉易感与非易感的机制,不仅有助于开发针对疼痛差异性个体的治疗药物和方法,也有利于通过促进机体主动非易感机制,开创全新的镇痛理念。
陕北属于干旱半干旱地区,其山地红枣是西北乃至全国知名的经济作物,对于当地农民收入和陕北农业经济发展具有重要的促进作用。但是由于陕北地区位于内陆,且地形较为复杂,昼夜温差较大,阳光直射时间较长,强烈的地面蒸发和作物蒸腾促使地下水中的盐分向上运移,导致陕北土壤中盐分逐渐表面化和累计化,形成土壤次生盐碱化。土壤次生盐碱化会降低土壤中的水分,使植物水分吸收不足,甚至造成植物水分外泄,形成生理性干旱。此外,次生盐碱化会导致土壤中离子失调与单盐毒害,长期作用会抑制山地红枣的生长和发育。
围绕疼痛易感与非易感这一现象,本文梳理了疼痛个体差异或易感与非易感的相关概念,系统综述了疼痛个体差异的影响因素及其潜在的外周与中枢机制,提出了疼痛个体差异研究领域内存在的重要问题与挑战,并对未来的发展方向进行了讨论与展望,以期为未来疼痛神经生物学机制的研究提供基于易感与非易感的新方向,为临床疼痛治疗提供新的思路。
一、疼痛个体差异的相关概念
1. 疼痛的定义
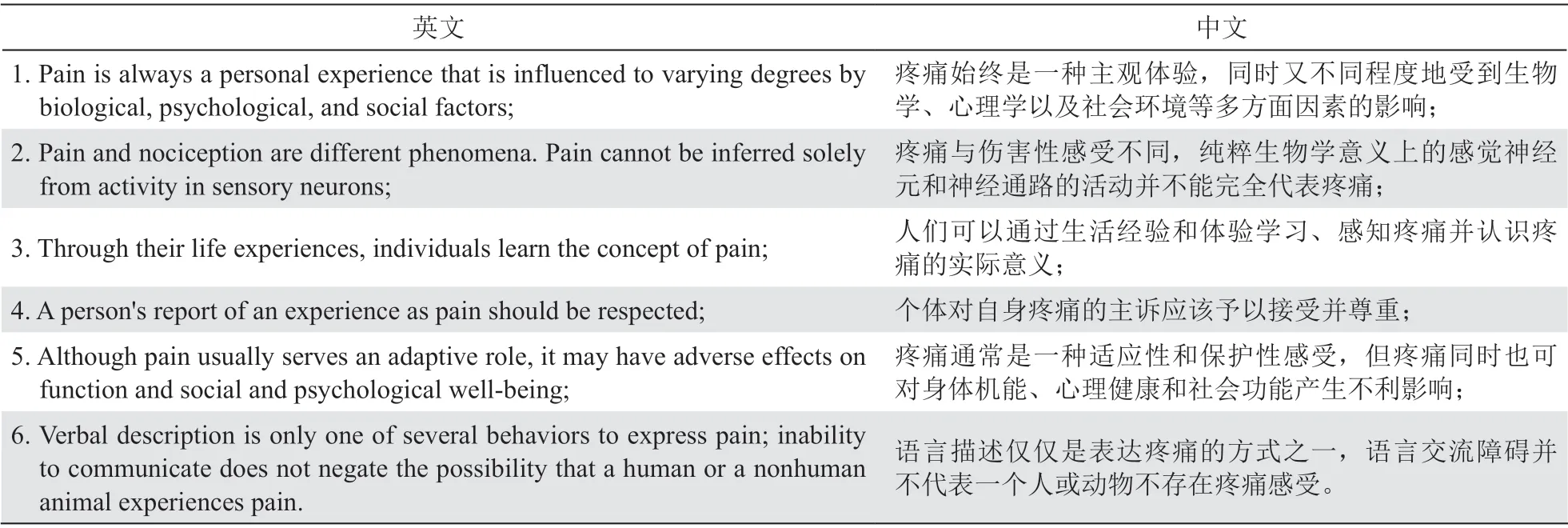
1979 年,国际疼痛学会 (International Association for the Study of Pain, IASP) 提出疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验。该定义某种程度上排除了疼痛体验中不可或缺的认知和社会因素。之后,IASP 先后在1986 年、1994 年和2010 年对疼痛的定义进行了修正,疼痛的内涵不断丰富。2016 年,Williams 和Craig 两位学者提出疼痛四个维度的概念,认为疼痛是一种与实际或潜在组织损伤相关的感觉、情感、认知和社会维度的痛苦体验
。2020 年,IASP 重新修订该定义认为疼痛是一种与实际或潜在的组织损伤相关的不愉快的感觉和情绪情感体验,或与此相似的经历。同时,新的定义附加了六条说明(见表1)
。其中第一条也指出,个体因为生理、心理和社会因素的影响,疼痛的程度也会不同,即疼痛的个体差异。新修订的疼痛定义在感觉和情感体验的基础上,还加入了认知和社会维度,更全面地阐述了疼痛的本质。
2.易感与非易感的定义
非易感的概念最早出现在心理学领域
,2015年美国心理学协会 (American Psychological Association,APA) 将非易感进一步定义为一种在逆境、创伤、悲剧、威胁甚至重大应激源的情况下,机体表现出适应良好的动态过程
,是一种积极主动的保护性过程,并非是机体没有发生病理生理学改变;易感则被认为是一种机体适应不良的过程,打破了原来的生理稳态。近年来,这一概念被引入精神疾病领域,例如经历慢性社交挫败 (chronic social defeat stress, CSDS) 模型的小鼠可以根据社交比率划分为抑郁的易感亚群和不抑郁的非易感亚群
。在此模型基础上,抑郁非易感也成为精神病领域新的研究热点,为抑郁症的治疗提供了新的理念—促进非易感,并表现出巨大的临床转化潜能
。
3. 疼痛个体差异、疼痛感觉易感与非易感的定义
从进化的角度看,疼痛反应是一种重要的自我调节和预警信号,可帮助机体主动恢复到自然稳态或避免机体受到进一步的伤害
。美国联邦疼痛研究战略 (federal pain research strategy, FPR) 研究小组认为,在心理(如情绪、认知等)、社会(如文化、社交等)和生物(如免疫学、遗传学等)机制的作用下,个体对疼痛的感知很大程度上受其自身感觉和认知方式的影响,具有主观性。因此,不同个体对同样的疼痛刺激或临床疾病会产生不同的疼痛感受,即疼痛敏感性的个体差异
,并且这一现象在现实生活和临床实践中普遍存在。例如,机体受到疼痛刺激或处于病理性疼痛状态时,有的个体表现出严重不适,而有的个体则感到中度或轻度不适。因此,有必要通过提出新的术语,进一步区分疼痛感觉个体差异的不同群体来指导今后的基础研究与临床实践。2006 年,Karoly 和Ruehlman 对这一现象进行了更加深入的解释,提出了疼痛的易感与非易感的术语。之后,这一术语在临床研究中得到了广泛的应用。
武术散打项目进入高校,是我国新课改目标的重要体现,相对于我国传统保守的教学模式,已经迈出了一步。武术散打项目采取的是立体式等多种方式结合的教学方式,可以很大程度上提高练习者对于散打运动的了解,教师还可以通过给学生播放视频资料等方式帮助学生更好地领会武术散打的精髓,感受我国传统体育文化的魅力。武术散打运动从历史上传承下来的有不怕苦、不怕累、顽强拼搏向上的精神,高校学生学习散打不止可以继承我国优秀的民族体育精神,其非常重要的是发扬传统体育精神和正义精神,激发高校学生向上拼搏的学习态度,从而为国家培养一批有全面素质的高材生。
选取2017年1月—2018年9月收治的60例带状疱疹后遗症神经痛患者,按照随机数字法分为两组。基础组30例,年龄43~73岁,平均(58.09±10.26)岁,男女比13∶17,神经痛部位:8例颈部、9例肋间、6例三叉神经、3例臂丛、4例腰骶;联合组44~73岁,平均(58.56±10.31)岁,男女比14∶16,神经痛部位:9例颈部、11例肋间、7例三叉神经、2例臂丛、1例腰骶。组间临床资料数据差异无统计学意义(P>0.05)。
与CSDS 模型条件下的抑郁易感与非易感“有或无”的行为学表型不同,疼痛感觉的易感与非易感建立在同一状态下个体对疼痛刺激感受或疼痛反应的不同程度上。出现这一差异的原因可能是,与情绪应激相比,疼痛是更加强烈的应激,通过常规的直接物理或化学手段制作的疼痛动物模型不能模拟出“无疼痛表型”的非易感状态。因此,我们认为易感与非易感作为一种现象,在不同的条件下,其内涵也有所不同
。例如,在疼痛的不同时相中,疼痛感觉的易感与非易感表型也被赋予了不同的含义:正常静息状态下,对同等强度的阈下疼痛刺激,有的个体表现出在正常范围内对疼痛的相对敏感性(易感),而有的表现为在正常范围内对疼痛的相对不敏感或抗伤害性(非易感)
;在经历同样的伤害性疼痛刺激时,有的个体表现为强烈的疼痛感觉(易感),有的则表现出轻度疼痛感觉(非易感)
;同样的急性疼痛病人,有的最终演变为了慢性疼痛(易感),而有的疼痛症状得到了很好地缓解(非易感)
。
以上这些证据都可以表明,以ACC、PFC、Ins为主的情绪-认知系统与疼痛易感与非易感的个体差异性和时空差异性密切相关。
二、疼痛易感与非易感的影响因素
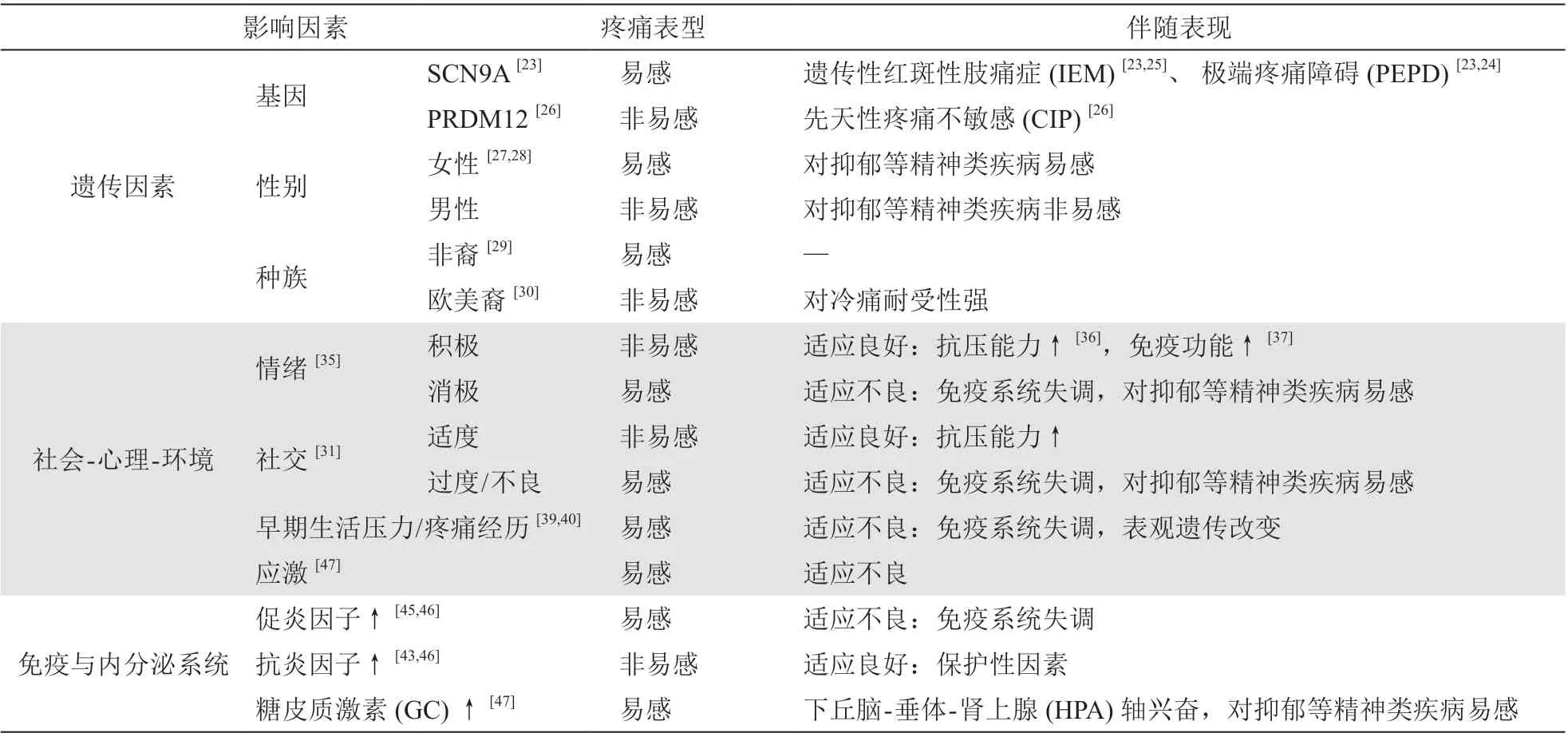
1. 遗传等固有生理属性
目前已知与应激相关的神经内分泌机制,也在疼痛信息处理过程中发挥重要作用。一方面,慢性疼痛病人皮质醇含量升高(皮质醇被认为是一种应激相关的特异性生物标记物);另一方面,应激反应相关激素或受到应激激素影响的脑内系统的改变
,导致机体适应不良,表现为对疼痛的易感。根据上述证据,我们推测一些免疫因子和激素可能作为疼痛感觉易感与非易感的相关预测指标。
此外,性别也是影响疼痛个体差异的重要因素。研究发现,女性对急性疼痛的敏感性均明显高于男性
,基础研究也发现雌性小鼠可能对疼痛更易感
。研究证实种族差异也会导致疼痛感觉的易感与非易感:例如,非裔对疼痛更易感;而欧美种群对冷痛的耐受性更高,表现为非易感
。
2. 社会-心理-环境
大量证据表明,社会、心理与环境因素,例如社交活动或社会角色、积极或消极的情绪以及生命早期的生活经历,可能在疼痛的发生、发展中发挥双向调控作用
,而且这三种因素在疼痛过程中常同时存在,共同影响疼痛结局。
消极被动的社会关系,例如被拒绝、被排斥或丧亲等负性社会关系变化,可能产生社会性疼痛,而积极的社会交往活动可以提高机体对疼痛的抵抗能力,使个体表现出疼痛非易感
。疼痛存在社会转移现象,慢性疼痛病人的配偶或者亲属
,与疼痛动物共同饲养的正常动物也常出现疼痛样的表现
。临床实践中,社会行为认知干预也是有效的疼痛缓解措施
。此外,积极情绪是促进疼痛非易感的重要心理因素。情绪积极的类风湿关节炎病人更容易对疼痛非易感,表现为无痛或轻度疼痛和较低的抑郁倾向
。因此,积极的社交和情绪活动有助于增强机体抗压能力
,提高机体自身免疫系统功能,促进机体主动应对、适应疼痛状态,降低疼痛强度等级
,最终表现出对疼痛的非易感性
;而负面情绪使机体免疫系统功能下降,表现出适应不良的整体状态,抑郁等精神障碍相关疾病风险增高,且对疼痛也更易感。
生命早期的创伤、应激和疼痛经历会增加成年后慢性疼痛的发生率。基础研究发现,生命早期慢性足部电击、炎症和切口相关的疼痛经历会增加成年期急性疼痛的疼痛强度
;早期母婴分离后会增加小鼠成年后内脏痛的敏感性,表现出对疼痛的易感
。
基于上述证据,我们认为利用社会、心理及环境等多种因素与机体的相互作用,采用相对温和的、非组织损伤相关的应激因素来影响动物疼痛行为,有望实现疼痛易感与非易感的动物模型化。
本文提出了一种基于Google影像分割规范和栅格数据处理库GDAL设计和实现的高清航拍数据场景展现系统,用高速实时切片服务和缓存队列替代传统的预切片方式,以牺牲少量切片读取性能为代价,节约了巨量的预处理时间和磁盘占用,并获得了热替换数据的能力。这些优点,使得本文所述系统在高清航拍影像的三维场景展现业务中,具有广阔的应用场景。
3.免疫与内分泌系统
神经损伤
与负性社会因素
会触发疼痛相关的神经炎症,免疫系统对神经炎症的调节作用可能是机体的一种保护机制
。例如,神经性疼痛中会出现T 细胞移位的现象,这可能代表一种保护性抗炎过程
,进而表现出对疼痛的非易感倾向
。同样,在慢性疼痛病人中外周血IL-6 等促炎因子与疼痛强度相关,纤维肌痛病人外周血IL-8 与疼痛强度相关
。总的来说,机体的炎症与抗炎平衡可能是疼痛易感与非易感的一个重要机制:当机体受到疼痛刺激时,自身生理稳态平衡被打破并启动免疫抗炎程序,当抗炎因子(如IL-4、IL-10、TGF-β)释放多于促炎因子时,个体表现出疼痛非易感状态;相反,促炎因子(如IL-6、IL-1β、TNF-α)释放多于抗炎因子时,个体表现为疼痛易感状态
。
大量研究认为,疼痛敏感性的个体差异或疼痛感觉的易感与非易感与遗传等固有因素密切相关。临床研究发现,患有慢性疼痛的父母,其子代患慢性疼痛的风险也会增加
。不仅如此,临床上也存在与疼痛相关的遗传性疾病。例如极端疼痛障碍
、遗传性红斑性肢痛症
或先天性疼痛不敏感
等,而这些疾病中个体的疼痛程度也存在较大差异(易感与非易感现象)。在上述这些遗传性疾病的研究中,科学家们认识到一些离子通道(如SCN9A)、受体(如NTRK1)、生长因子(如NGF)或转录因子(如PRDM12)是决定个体疼痛感觉易感与非易感的重要因素。
综上所述,疼痛的易感与非易感受先天和后天因素的影响(见表2),通过临床前和临床研究揭示其背后的神经生物学机制,可能发现新的疼痛治疗理念和策略,例如通过促进非易感机制或行为认知干预治疗疼痛
。
三、疼痛非易感的外周机制
谷氨酸 (Glu) 和γ-氨基丁酸(GABA)是疼痛处理过程中的关键神经递质,参与各种疼痛调节过程,谷氨酸和/或谷氨酰胺 (Glx) 和GABA 与临床疼痛程度密切相关。Zunhammer 等发现
,在健康受试者的疼痛相关脑区,如Ins、ACC、dlPFC、丘脑内,对疼痛易感的个体Glx 释放增多,而非易感的个体则释放较少。基础研究中科学家们发现
,与对照组相比坐骨神经慢性压迫造模后的大鼠Ins 中Glu水平较高,而GABA 水平较低。Thiaucourt 等
使用256 mN 和512 mN 不同强度的针刺刺激,发现被试者疼痛易感与非易感的感知程度与后岛叶的Glu水平呈正相关,与GABA 水平呈负相关。这些结果表明疼痛的易感人群Ins 内Glx/GABA 的比率升高。
疼痛非易感外周机制中研究比较深入的一个疾病是遗传性红斑性肢痛症 (inherited erythromelalgia,IEM)。IEM 是一种罕见的外周血管性疼痛疾病,属于常染色体显性遗传,临床表现为轻度的温热刺激便能引发病人烧灼样的剧痛,这种疼痛通常不伴有组织损伤或生理功能失调。
IEM 是由SCN9A 基因功能获得性突变引起的,这种突变会增强Na
1.7 的活性并抑制其失活,进而导致背根神经节 (dorsal root ganglia, DRG) 中C 纤维过度兴奋,引起痛觉过敏
。虽然大多数IEM 病人会经历难以忍受的剧烈疼痛,但也会有个别病人仅表现为轻中度痛觉过敏
,呈现出相对非易感的现象。
Geha 等
针对一个IEM 家庭进行了系列研究,在这个家庭中,父亲属于正常人群,母亲和儿子都存在这种遗传性疾病,儿子表现为IEM 经典的重度痛觉过敏,而母亲仅表现为轻度痛觉过敏,并且发作次数较少,发作时持续时间也更短,即处于一种疼痛非易感的状态。Sanger 测序结果发现,母亲与儿子都携带相同的Na
1.7-S241T 突变基因。一般情况下,这种突变使Na
1.7 活性增强
,引起DRG神经元过度兴奋。然而,针对这对母子的诱导性多能干细胞 (induced pluripotent stem cells, iPSCs) 分化的外周感觉神经元样细胞的离体电生理记录发现,诱导分化的神经细胞兴奋性与病人的疼痛强度之间呈正相关关系,提示还有其他机制抵消了Na
1.7 活性增强引起的DRG 神经元过度兴奋。后续的研究发现,两组细胞的钾 (K
) 通道的活性也不同,表现为对疼痛非易感的母亲体内KCNQ2 编码的K
7.2变异(K
7.2-T730A 突变),后者使膜静息电位绝对值增大,抑制了DRG 神经元的兴奋性。同样,在另一组家庭中发现了K
7.3 也有类似的作用
。这些研究提示外周Na
1.7 与相关K
通道之间的内在稳态平衡决定了病人的疼痛行为表现。然而,疼痛易感与非易感的高级中枢机制尚不清楚。
四、疼痛感觉易感与非易感的中枢机制
由于缺乏理想的实验动物模型,目前我们对疼痛感觉易感与非易感的中枢机制的认识十分有限,来自临床神经影像学观察和功能推断的结果通常是描述性的,缺乏功能干预的验证。
采用SPSS 17.00统计软件。以百分率(%)表示计数资料,行χ2检验;以表示计量资料,行 t检验。以P<0.05表示差异有统计学意义。
疼痛是一种多维体验,当外周伤害性信息传入皮质后,疼痛信号与其他不同维度的信息相互整合,并通过下行调节系统进行反馈调节
,最后表现出疼痛感知的个体差异。我们通过梳理参与疼痛的脑内神经回路发现
,感觉和情感两个维度相关的脑区可能参与调控疼痛的易感与非易感表型,特别是以前扣带皮质 (anterior cingulate cortex, ACC)、前额叶皮质 (prefrontal cortex, PFC)、岛叶(insula, Ins) 为主的情绪-认知系统、中脑导水管周围灰质 (periaqueductal gray, PAG) 为主的下行疼痛调节系统和奖赏系统
。
1. ACC、PFC、Ins 为主的情绪-认知系统参与调节疼痛感觉的易感与非易感
动物实验以及人脑功能成像研究均表明,外周伤害性刺激可激活包括ACC、PFC、Ins 在内的多个大脑皮质区域。ACC 是大脑边缘系统的一部分,主要接收来自丘脑内侧核的信息传入
,参与调控与疼痛相关的情感变化。PFC 尤其是内侧前额叶皮质 (medial prefrontal cortex, mPFC),能够接收所有类型的感觉信息
,在与疼痛相关的工作记忆、情感和注意力方面发挥着重要作用。最近研究发现,疼痛信息首先被传递至后岛叶(负责处理疼痛感觉方面的信息),然后再传送到前岛叶(负责处理疼痛情绪与认知方面的信息)
,从而参与疼痛强度的编码。ACC、mPFC、Ins 与其他情感和动机相关的边缘结构相互连接(如杏仁核、伏隔核和PAG),共同调控疼痛体验的动机和情感维度
。
对人类和啮齿动物的功能性磁共振成像 (functional magnetic resonance imaging, fMRI) 研究表明,没有一个单一的脑内结构能负责疼痛感知的全部过程
。大量证据表明,大脑皮质区域能够反映疼痛敏感性的个体差异,在高度敏感的个体中,大脑皮质区域激活得更为频繁、剧烈。例如,Coghill 等
根据对热痛 (49℃) 的感知将受试者分为高敏感(易感)组和低敏感(非易感)组进行研究。结果发现在易感组中,与感觉、注意力和情感相关的大脑皮质区域激活频率明显高于非易感组,尤其是ACC、PFC 和Ins。此外,人类背外侧前额叶皮质(dorsolateral prefrontal cortex, dlPFC) 在疼痛的认知和情感调节中起重要作用,dlPFC 的活动与慢性疼痛病人的不愉快体验呈正相关关系
,刺激该区域有助于急性疼痛的调节和慢性疼痛的治疗
。
虽然疼痛易感与非易感的临床现象非常明确,但其背后的机制尚不清楚
,目前的研究主要局限于临床观察及其外周机制。临床上通常使用疼痛时间总和 (temporal summation of pain, TSP) 来反映个体对伤害性刺激的中枢敏感程度。既往的TSP 研究显示,由于不同个体对疼痛的处理和/或调节能力不同,受试者TSP 存在巨大的差异性,表现出疼痛感觉的易感与非易感表型
。进一步研究发现,TSP与外周脊髓背角NMDA 受体的激活有关,并受内源性阿片系统调节
,提示了内源性镇痛机制在疼痛非易感过程中的重要作用。上述证据提示,外周脊髓背角NMDA 受体等分子的含量变化未来可能成为疼痛感觉易感与非易感的相关标记物或预测指标,但仍需要进一步的验证。
教师不要担心被问倒,教师对某本课外书没有全盘了解也不要担心。艾登·钱伯斯说:“教师应该建立这样的观念:不是只有自己知道答案的问题才能提出来讨论。身为教师应该坦然告诉孩子们自己并非全知全能,但绝对愿意和大家一起动脑筋,试着找出答案。”
疼痛的易感与非易感表型可能取决于个体对疼痛信息和情绪-认知系统信息整合的过程。疼痛是一种高度主观的感觉,同一个体在不同的时间疼痛感觉也存在明显差异。因此我们认为,疼痛感觉的易感与非易感不但存在个体差异性,而且在同一个体中还存在时空差异性。这种时空差异性导致的疼痛易感与非易感通常是由疼痛的认知变量引起的,其中注意力、期望相关的脑内机制研究最为广泛
。心理学研究表明,注意力可以通过调节疼痛的空间整合来影响疼痛的感觉:当从疼痛中分散注意力时,疼痛感会明显减弱,表现出对疼痛的非易感
;但当其注意力集中在疼痛上时,疼痛感又会增强,表现出对疼痛的易感
。同样地,Porro 等
研究表明,当人们出现疼痛减轻的预期心理后,会导致疼痛感减轻10%~48%。fMRI 发现,与注意力、期望相关的脑内结构在疼痛感觉、认知和情感活动中也被显著激活,特别是ACC、mPFC、Ins 和PAG
;在神经病理性疼痛病人中,前岛叶皮质尾部的活性与其主观疼痛感觉密切相关
。此外,前岛叶还与焦虑、抑郁、肠易激综合征、慢性疲劳、纤维肌痛、躯体化和恐惧情绪有关,因此Tracey 等推测
,Ins 不仅介导疼痛的易感与非易感表型,还能影响之后的疼痛体验。
2.2.5 胃肠道准备 由于无气腹手术时腹腔内没有CO2气腹时的压力,使肠管和大网膜向上排移时受到局限,且肠管不停蠕动,使手术视野受限,特别是肥胖患者,因此,肠道准备尤为重要。术前1 d予清淡易消化的半流食,禁易产气类食物,预计手术可能涉及肠管,如卵巢癌有肠道转移者,手术前3 d进无渣半流食,并按医嘱给肠道制菌药物。术前禁食8~12 h,禁饮6 h。手术前晚予恒康正清口服,使患者能排便3次以上,手术日晨再用肥皂水清洁灌肠,使效果满意,以减少手术中因牵拉内脏引起的恶心、呕吐反应,使术后肠道得以休息,促使肠功能恢复。输卵管妊娠者禁灌肠,须禁饮食8 h以上。
综上所述,探索疼痛非易感的机制可能从机体主动适应的角度为疼痛治疗开辟新的方向,对于改善临床疼痛预测、评估方法和个体化治疗具有重要的现实意义。
2. PAG 为主的疼痛下行调节系统参与调节疼痛感觉的易感与非易感
疼痛下行调节系统是一个复杂的脑内网络,主要包括皮质、下丘脑和脑干结构,可以调节脊髓背角的伤害性信息处理,从而控制伤害性信号进入大脑
。导水管周围灰质 (periaqueductal gray, PAG) 接收来自下丘脑、杏仁核、PFC 和ACC 的输入,疼痛信息经ACC、PFC 等高级中枢整合处理后,依靠PAG 下行疼痛调节系统作出反应
。
传统研究认为痛觉敏化和内源性镇痛系统是产生痛觉感知差异的重要调节机制,与疼痛易感与非易感既有差别又有联系。基于大量的临床证据,我们认为疼痛感觉的易感是疼痛敏感化(低强度的致痛刺激导致强烈的疼痛)或超敏感化(无痛刺激导致疼痛)的一种体现形式,强调的是同等条件下相对强烈的疼痛状态;而疼痛感觉的非易感可能是一种内在的主动镇痛过程,但其与内源性镇痛之间的关系及其是否通过已知的内在镇痛机制发挥作用,尚有待进一步研究。因此,疼痛感觉易感与非易感概念的提出,重新划分了疼痛感觉的行为学表型范畴,开辟了疼痛与镇痛领域内的全新研究方向,将产生基于对抗易感机制和促进非易感机制的全新治疗策略和研发理念。构建相应的疼痛易感与非易感动物模型,或者通过探究作为伴发或继发症状所表现出的疼痛感觉的易感与非易感性。例如,抑郁症和帕金森等精神与认知障碍引起的疼痛症状,可能是未来模拟和研究“无疼痛表型”非易感状态的潜在策略。
杏仁核是包括疼痛在内的感觉刺激的情感处理中心。多项研究表明杏仁核在疼痛发生中起着重要作用,尤其是调节疼痛相关的情绪反应
。有研究结果表明,情绪反应过程中的个体差异在疼痛的发展中起着一定的作用
。因此,杏仁核可能从疼痛的情绪反应方面调控疼痛的易感与非易感。Bornhövd 等
的fMRI 研究发现,在红外热痛刺激下杏仁核激活程度与志愿者的主观疼痛感觉相关。Lapate 等
对正常人进行了一项短期的临床跟踪实验,通过面部肌电图 (EMG) 来评估受试者面对负性图片(如车祸图片等)的心理生理情绪调节能力。他们发现受试者面对负性图片调节负性情绪时杏仁核活动的变化幅度越大,未来两年其杏仁核参与热痛调节能力也就越强。
Cheng 等
发现在对热痛易感的对象中,表现为上行疼痛伤害性感受信息的传递增强,以PAG 为主的下行疼痛调节系统的功能减弱,而在热痛非易感对象中显示出相反的情况。因此我们推测,疼痛上行和下行调节系统之间的动态平衡可能是决定疼痛易感与非易感的一个重要机制,易感是机体适应不良的结果,而非易感是机体的主动适应性改变,后者可能需要更多的机制来重建和维持机体的内在稳态。
3. 中脑奖赏系统参与调节疼痛感觉的易感与非易感
越来越多的临床和基础研究表明,疼痛与涉及情感和动机的神经结构功能异常密切相关,其中中脑奖赏系统是调控疼痛与镇痛的热点与关键脑结构。中脑奖赏系统由中脑腹侧被盖区 (ventral tegmental area, VTA) 及其投射靶区如伏隔核 (nucleus accumbens, NAc)、PFC 等多个核团共同构成,在情感、感觉、应激、动机和奖赏等相关生理和病理行为中发挥重要作用。近二十年来的基础与临床研究也发现,中脑多巴胺奖赏系统也是调控抑郁症等精神疾病易感与非易感的重要脑结构
。
一项针对亚急性背痛病人的研究发现
,急性疼痛发生后的1 年里,有12 例病人演变为了慢性疼痛(慢性疼痛易感),而另有12 例病人疼痛缓解(慢性疼痛非易感)。相比于疼痛非易感组,在慢性疼痛易感组中,病人灰质密度降低,且超过80%的易感组病人NAc 与mPFC 之间的功能连接更为显著,这意味着mPFC-NAc 回路可能与急性疼痛慢性化的易感密切相关。这些研究表明大脑奖赏系统的功能连接可能预测急性疼痛慢性化和慢性疼痛的易感性,也为急性疼痛慢性化的早期临床干预提供了科学依据。积极的社会关系也能促使机体在疼痛刺激下起到保护作用,有科学家推测其原因可能是奖赏系统使机体增加对疼痛的适应能力,从而表现出对疼痛的非易感
,但其具体机制并不明确。
总的来说,越来越多的证据提示,中脑多巴胺奖赏系统是调控疼痛易感与非易感的重要脑结构,但由于缺乏理想的研究范式,其脑机制的研究仍是脑科学领域一个重大的挑战。
4. 杏仁核参与调节疼痛感觉的易感与非易感
疼痛尤其是慢性疼痛常与负性情绪相关的精神障碍相互促进,形成恶性循环。作为一种剧烈的长期应激,慢性疼痛在显著增加机体的稳态负荷(稳态负荷指机体为维持稳态平衡,在生理和心理系统施加的负荷)的同时
,还促进体内炎症因子(如IL-6)释放,引起神经、免疫等多系统的异常适应性改变
,增加焦虑、抑郁等负性情绪障碍或共病状态的发生率。同样,情绪也是影响疼痛易感与非易感的重要因素:积极情绪是促进疼痛非易感的重要心理社会因素,厌恶情绪或认知与情绪障碍使机体倾向于表现出疼痛的易感性
。
PAG 是阿片类药物发挥镇痛作用的关键脑区。有研究发现疼痛的非易感依赖内源性阿片系统,可能是通过脑啡肽降解酶抑制内源性阿片类物质的分解,发挥镇痛效果
,从而表现出对疼痛的非易感。同样的,疼痛易感状态也可能是疼痛下行调节系统对内源性阿片类物质的调控异常所导致的。例如,纤维肌痛
、中风后疼痛
等易感人群相比于非易感人群体内结合的阿片类受体数量明显减少。此外,PAG 也参与了疼痛注意力的信息处理
,而后者与安慰剂镇痛效应密切相关
。安慰剂可减弱大脑对疼痛相关区域有害刺激的反应,起到镇痛的效果
。fMRI 结果显示dlPFC、rACC和PAG 参与介导安慰剂诱导的镇痛作用
,且在这些脑区中μ 阿片受体(MOR)密度增高
。于是,我们推测疼痛的非易感表型可能与安慰剂镇痛机制类似,在疼痛信息处理中能促进机体释放更多地内源性阿片类物质,经PAG下行疼痛调节系统发挥镇痛作用。
杏仁核中的伤害性感受神经元具有异质性,其中中央杏仁核 (central nucleus of the amygdala, CeA)对疼痛感觉具有双向调节作用
:单独激活CeA中表达生长抑素 (CeA-SOM) 的GABA 能神经元介导了镇痛作用;而神经病理性疼痛激活了CeA 中表达蛋白激酶C-delta (CeA-PKCδ) 的GABA能神经元,并抑制了CeA-SOM 能神经元,使得CeA 伤害性神经元净输出呈现兴奋性。这提示我们,CeA 的这两种神经元在不同疼痛刺激背景下,通过净输出的动态平衡,起到了一个“疼痛调节器”的作用,这可能是杏仁核参与疼痛非易感的潜在机制。因此,解析杏仁核中哪些神经元在不同的心理、情绪背景下被招募,导致机体呈现出对疼痛易感或非易感的结果,可能是未来的一个重要研究方向。
综上所述,疼痛感觉是多个功能系统共同整合疼痛相关信息后做出的主观反应,由于受到先天与后天因素的影响,机体做出的适应性动态反馈存在很大的个体差异
,从而表现出对疼痛的易感与非易感性(见图1)。
公路桥梁施工过程中,会遇到不同的地质条件,因此就需要使用不同的施工技术。常见的桥梁基础施工技术包括桩基础施工技术以及扩大基础施工技术,桩基础施工技术还可以分为旋喷桩、沉桩以及人工挖孔桩等施工技术。公路桥梁基础施工过程中,不仅需要对施工技术进行合理的选择,同时还需要对施工细部环节施工以及测量放线工作进行严格的质量控制[2]。

5. 疼痛感觉易感与非易感的表观遗传学机制
表观遗传学是疼痛领域重要的研究方向,负性情绪与生命早期应激等预测和影响疼痛的因素也有其表观遗传学机制,提示表观遗传学改变,例如DNA 修饰与组蛋白修饰等过程可能参与个体对疼痛感觉的易感与非易感
。另外,参与急性疼痛慢性化的非编码RNA 也可能是影响慢性疼痛易感和非易感的重要机制
。虽然目前相关研究较少,但我们认为编码疼痛及其影响因素的表观遗传学机制可能参与疼痛感觉易感与非易感的调控。未来,表观遗传学可能是疼痛易感与非易感的一个重要研究方向。
五、总结与展望
疼痛是一种高度个体化的复杂感觉和情感体验,受到认知、情绪等因素的影响,存在明显的个体差异,也称易感与非易感现象。
中国原子能科学事业创始人之一、“中国原子弹之父”、“两弹一星”功勋奖章获得者钱三强之子钱思进,现任北京大学物理学院教授、博士生导师。一次,他在欧洲核子研究中心外用中文向一群东方游客介绍质子对撞机的基本原理时,游客对于这位白发苍苍的学者在街头进行科普,很是好奇,当看到他的工牌上的“钱思进”三个字时,有人轻声问:“您父亲是钱三强教授吗?”他飞速回应一句“主要靠自己”,就继续他的科普了。
在各层混凝土的接触面及横缝面处设置悬臂模板,以方便安装并保证混凝土浇筑时分层错缝的稳定,在溢流堰的布局上采用异型宽尾敦结构。此外,对于排水廊道等结构而言,应根据其实际平面尺寸采用预制混凝土。
目前关于疼痛的研究多集中在疼痛状态的临床观察与干预以及基于疼痛动物模型的临床前机制研究等方面。这些研究增加了我们对疼痛相关机制的认识,也为疼痛的临床治疗提供了重要参考。但疼痛非易感的现实意义与机制仍有待探索。我们认为疼痛非易感是一种主动适应过程,机体调动了更多的全身性机制使个体在面临疼痛刺激或疼痛状态时能更好地适应。促进非易感可能是一种不同于目前疼痛治疗策略的主动镇痛理念,探索其背后的机制可能发现基于此的崭新镇痛药物或镇痛靶点。
尽管疼痛感觉的易感与非易感现象在临床上普遍存在,但由于缺乏可靠的动物模型,其神经生物学机制尚不清楚。现有物理或化学损伤动物模型(如神经病理性疼痛、炎性疼痛模型等)大都基于炎症或组织损伤(神经组织或非神经组织),疼痛表现个体差异小,也不能模拟出“无疼痛表型”的非易感状态,不具备划分疼痛易感与非易感表型的可能。因此,基于疼痛易感与非易感的研究范式的创新成为疼痛与镇痛领域内一个重要的挑战。我们推测,影响疼痛的温和应激(如负性情绪和生命早期应激等)引起的疼痛个体差异可能是构建疼痛易感与非易感动物模型的切入点。
此外,探索预测疼痛易感或非易感的客观指标,有利于指导临床早期干预治疗,做到早预防、早诊断、早治疗和预防急性疼痛的慢性化。外周血免疫因子和内分泌激素等分子的含量变化有望在未来作为预测和评估疼痛信息处理能力与疼痛易感与非易感的客观指标。
综上所述,本文对疼痛感觉易感与非易感的影响因素、外周和中枢机制进行了系统综述,讨论了疼痛易感与非易感研究对更新疼痛治疗理念的现实意义,剖析了基础研究中存在的问题与挑战,展望了未来的研究方向,促进了我们对疼痛个体差异的理解,也为其他背景下易感与非易感的研究提供了一定的启示。
利益冲突声明:作者声明本文无利益冲突。
[1] 宋学军,樊碧发,万有,等.国际疼痛学会新版疼痛定义修订简析[J]. 中国疼痛医学杂志, 2020, 26 (9):641-644.
[2] Chen B, Li L, Donovan C,
. Prevalence and characteristics of chronic body pain in China: a national study[J]. Springerplus, 2016, 5(1):938.
[3] Tu Y, Zhang B, Cao J,
. Identifying inter-individual differences in pain threshold using brain connectome:a test-retest reproducible study[J]. Neuroimage, 2019,202:116049.
[4] Denk F, Mcmahon SB, and Tracey I. Pain vulnerability:a neurobiological perspective[J]. Nat Neurosci, 2014,17(2):192-200.
[5] Thompson RR, Kong CL, Porco TC,
. Herpes zoster and postherpetic neuralgia: changing incidence rates from 1994 to 2018 in the united states[J]. Clin Infect Dis, 2021, 73(9):e3210-e3217.
[6] 刘风雨. 采用诱导性多潜能干细胞(iPSC)研究疼痛个体差异的机制[J]. 中国疼痛医学杂志, 2019,25(7):487.
[7] Karoly P, Ruehlman LS. Psychological "resilience" and its correlates in chronic pain: findings from a national community sample[J]. Pain, 2006, 123(1-2):90-97.
[8] Casale R, Sarzi-Puttini P, Botto R,
. Fibromyalgia and the concept of resilience[J]. Clin Exp Rheumatol,2019, 37 Suppl 116(1):105-113.
[9] Tanner JJ, Johnson AJ, Terry EL,
. Resilience, pain,and the brain: relationships differ by sociodemographics[J]. J Neurosci Res, 2021, 99(5):1207-1235.
[10] Nestler EJ, Waxman SG. Resilience to stress and resilience to pain: lessons from molecular neurobiology and genetics[J]. Trends Mol Med, 2020, 26(10):924-935.
[11] Williams ACC, Craig KD. Updating the definition of pain[J]. Pain, 2016, 157(11):2420-2423.
[12] Earvolino-Ramirez M. Resilience: a concept analysis[J].Nurs Forum, 2007, 42(2):73-82.
[13] Yao ZF, Hsieh S. Neurocognitive mechanism of human resilience: a conceptual framework and empirical review[J]. Int J Environ Res Public Health, 2019,16(24):5123.
[14] Krishnan V, Han MH, Graham DL,
. Molecular adaptations underlying susceptibility and resistance to social defeat in brain reward regions[J]. Cell, 2007,131(2):391-404.
[15] Costi S, Han MH, Murrough JW. The potential of KCNQ potassium channel openers as novel antidepressants[J]. CNS Drugs, 2022, 36(3):207-216.
[16] Costi S, Morris LS, Kirkwood KA,
. Impact of the KCNQ2/3 channel opener ezogabine on reward circuit activity and clinical symptoms in depression: results from a randomized controlled trial[J]. Am J Psychiatry,2021, 178(5):437-446.
[17] Tan A, Costi S, Morris LS,
. Effects of the KCNQ channel opener ezogabine on functional connectivity of the ventral striatum and clinical symptoms in patients with major depressive disorder[J]. Mol Psychiatry,2020, 25(6):1323-1333.
[18] Friedman AK, Juarez B, Ku SM,
. KCNQ channel openers reverse depressive symptoms via an active resilience mechanism[J]. Nat Commun, 2016, 7:11671.
[19] Craig AD. An interoceptive neuroanatomical perspective on feelings, energy, and effort[J]. Behav Brain Sci,2013, 36(6):685-686; discussion 707-726.
[20] Cheng JC, Erpelding N, Kucyi A,
. Individual differences in temporal summation of pain reflect pronociceptive and antinociceptive brain structure and function[J]. J Neurosci, 2015, 35(26):9689-9700.
[21] Baliki MN, Petre B, Torbey S,
. Corticostriatal functional connectivity predicts transition to chronic back pain[J]. Nat Neurosci, 2012, 15(8):1117-1119.
[22] Stone AL, Wilson AC. Transmission of risk from parents with chronic pain to offspring: an integrative conceptual model[J]. Pain, 2016, 157(12):2628-2639.
[23] Meijer IA, Vanasse M, Nizard S,
. An atypical case of SCN9A mutation presenting with global motor delay and a severe pain disorder[J]. Muscle Nerve, 2014,49(1):134-138.
[24] Han C, Yang Y, Te Morsche RH,
. Familial gain-of-function Na(v)1.9 mutation in a painful channelopathy[J]. J Neurol Neurosurg Psychiatry, 2017,88(3):233-240.
[25] Yang Y, Wang Y, Li S,
. Mutations in SCN9A,encoding a sodium channel alpha subunit, in patients with primary erythermalgia[J]. J Med Genet, 2004,41(3):171-174.
[26] Chen YC, Auer-Grumbach M, Matsukawa S,
.Transcriptional regulator PRDM12 is essential for human pain perception[J]. Nat Genet, 2015, 47(7):803-808.
[27] Labus JS, Gupta A, Coveleskie K,
. Sex differences in emotion-related cognitive processes in irritable bowel syndrome and healthy control subjects[J]. Pain,2013, 154(10):2088-2099.
[28] Yu W, Pati D, Pina MM,
. Periaqueductal gray/dorsal raphe dopamine neurons contribute to sex differences in pain-related behaviors[J]. Neuron, 2021,109(8):1365-1380. e5.
[29] Kim H, Neubert JK, Rowan JS,
. Comparison of experimental and acute clinical pain responses in humans as pain phenotypes[J]. J Pain, 2004, 5(7):377-384.
[30] Cruz-Almeida Y, Sibille KT, Goodin BR,
. Racial and ethnic differences in older adults with knee osteoarthritis[J].Arthritis Rheumatol, 2014, 66(7):1800-1810.
[31] Sturgeon JA, Zautra AJ. Social pain and physical pain:shared paths to resilience[J]. Pain Manag, 2016, 6(1):63-74.
[32] De Waal FBM, Preston SD. Mammalian empathy:behavioural manifestations and neural basis[J]. Nat Rev Neurosci, 2017, 18(8):498-509.
[33] Smith ML, Asada N, Malenka RC. Anterior cingulate inputs to nucleus accumbens control the social transfer of pain and analgesia[J]. Science, 2021, 371(6525):153-159.
[34] Cherkin DC, Sherman KJ, Balderson BH,
. Effect of mindfulness-based stress reduction vs cognitive behavioral therapy or usual care on back pain and functional limitations in adults with chronic low back pain: a randomized clinical trial[J]. JAMA, 2016,315(12):1240-1249.
[35] Treharne GJ, Kitas GD, Lyons AC,
. Well-being in rheumatoid arthritis: the effects of disease duration and psychosocial factors[J]. J Health Psychol, 2005, 10(3):457-474.
[36] Fredrickson BL, Levenson RW. Positive emotions speed recovery from the cardiovascular sequelae of negative emotions[J]. Cogn Emot, 1998, 12(2):191-220.
[37] Finan PH, Quartana PJ, Smith MT. Positive and negative affect dimensions in chronic knee osteoarthritis: effects on clinical and laboratory pain[J]. Psychosom Med, 2013,75(5): 463-470.
[38] Zautra AJ, Johnson LM, Davis MC. Positive affect as a source of resilience for women in chronic pain[J]. J Consult Clin Psychol, 2005, 73(2):212-220.
[39] Low LA, Fitzgerald M. Acute pain and a motivational pathway in adult rats: influence of early life pain experience[J]. PLoS One, 2012, 7(3):e34316.
[40] Moloney RD, O'leary OF, Felice D,
. Early-life stress induces visceral hypersensitivity in mice[J].Neurosci Lett, 2012, 512(2):99-102.
[41] Ellis A, Bennett DL. Neuroinflammation and the generation of neuropathic pain[J]. Br J Anaesth, 2013,111(1):26-37.
[42] Cole SW, Arevalo JM, Manu K,
. Antagonistic pleiotropy at the human IL6 promoter confers genetic resilience to the pro-inflammatory effects of adverse social conditions in adolescence[J]. Dev Psychol, 2011,47(4):1173-1180.
[43] Lyman M, Lloyd DG, Ji X,
. Neuroinflammation:the role and consequences[J]. Neurosci Res, 2014, 79:1-12.
[44] Luchting B, Rachinger-Adam B, Heyn J,
. Antiinflammatory T-cell shift in neuropathic pain[J]. J Neuroinflammation, 2015, 12: 12.
[45] Gür A, Karakoç M, Nas K,
. Cytokines and depression in cases with fibromyalgia Anti-inflammatory T-cell shift in neuropathic pain[J]. J Rheumatol, 2002,29(2):358-361.
[46] Vasic V, Schmidt MHH. Resilience and vulnerability to pain and inflammation in the hippocampus[J]. Int J Mol Sci, 2017, 18(4):739.
[47] Vachon-Presseau E, Roy M, Martel MO,
. The stress model of chronic pain: evidence from basal cortisol and hippocampal structure and function in humans[J]. Brain, 2013, 136(Pt 3):815-827.
[48] Staud R, Weyl EE, Riley JL, 3rd,
. Slow temporal summation of pain for assessment of central pain sensitivity and clinical pain of fibromyalgia patients[J].PLoS One, 2014, 9(2):e89086.
[49] Guan Y, Borzan J, Meyer RA,
. Windup in dorsal horn neurons is modulated by endogenous spinal muopioid mechanisms[J]. J Neurosci, 2006, 26(16):4298-4307.
[50] Namer B, Ørstavik K, Schmidt R,
. Specific changes in conduction velocity recovery cycles of single nociceptors in a patient with erythromelalgia with the I848T gain-of-function mutation of Na
1.7[J]. Pain,2015, 156(9):1637-1646.
[51] Geha P, Yang Y, Estacion M,
. Pharmacotherapy for pain in a family with inherited erythromelalgia guided by genomic analysis and functional profiling[J]. JAMA Neurol, 2016, 73(6):659-667.
[52] Lampert A, Dib-Hajj SD, Tyrrell L,
. Size matters: erythromelalgia mutation S241T in Na
1.7 alters channel gating[J]. J Biol Chem, 2006, 281(47):36029-36035.
[53] Yuan JH, Estacion M, Mis MA,
.
variants and pain modulation: a missense variant in Kv7.3 contributes to pain resilience[J]. Brain Commun, 2021,3(3):fcab212.
[54] Coghill RC. Individual differences in the subjective experience of pain: new insights into mechanisms and models[J]. Headache, 2010, 50(9):1531-1535.
[55] 陈丹丹, 周瑜, 翟晓静, 等. 基于光遗传学与化学遗传学技术的疼痛脑环路研究进展[J]. 中国疼痛医学杂志, 2022, 28(1):7-20.
[56] Vogt BA, Pandya DN, and Rosene DL. Cingulate cortex of the rhesus monkey: I. Cytoarchitecture and thalamic afferents[J]. J Comp Neurol, 1987, 262(2):256-270.
[57] Wiech K, Ploner M, and Tracey I. Neurocognitive aspects of pain perception[J]. Trends Cogn Sci, 2008,12(8):306-313.
[58] Frot M, Faillenot I, Mauguière F. Processing of nociceptive input from posterior to anterior insula in humans[J]. Hum Brain Mapp, 2014, 35(11):5486-5499.
[59] Bastuji H, Frot M, Perchet C,
. Pain networks from the inside: spatiotemporal analysis of brain responses leading from nociception to conscious perception[J].Hum Brain Mapp, 2016, 37(12):4301-4315.
[60] Rainville P, Duncan GH, Price DD,
. Pain affect encoded in human anterior cingulate but not somatosensory cortex[J]. Science, 1997, 277(5328):968-971.
[61] Apkarian AV, Bushnell MC, Treede RD,
. Human brain mechanisms of pain perception and regulation in health and disease[J]. Eur J Pain, 2005, 9(4):463-484.
[62] Coghill RC, Mchaffie JG, Yen YF. Neural correlates of interindividual differences in the subjective experience of pain[J]. Proc Natl Acad Sci U S A, 2003,100(14):8538-8542.
[63] Lorenz J, Minoshima S, Casey KL. Keeping pain out of mind: the role of the dorsolateral prefrontal cortex in pain modulation[J]. Brain, 2003, 126(Pt 5):1079-1091.
[64] Seminowicz DA, Moayedi M. The dorsolateral prefrontal cortex in acute and chronic pain[J]. J Pain, 2017,18(9):1027-1035.
[65] Zunhammer M, Schweizer LM, Witte V,
. Combined glutamate and glutamine levels in pain-processing brain regions are associated with individual pain sensitivity[J]. Pain, 2016, 157(10):2248-2256.
[66] Watson CJ. Insular balance of glutamatergic and GABA ergic signaling modulates pain processing[J]. Pain,2016, 157(10):2194-2207.
[67] Thiaucourt M, Shabes P, Schloss N,
. Posterior insular GABA levels inversely correlate with the intensity of experimental mechanical pain in healthy subjects[J].Neuroscience, 2018, 387:116-122.
[68] Terkelsen AJ, Andersen OK, Mølgaard H,
. Mental stress inhibits pain perception and heart rate variability but not a nociceptive withdrawal reflex[J]. Acta Physiol Scand, 2004, 180(4):405-414.
[69] Taylor JJ, Borckardt JJ, George MS. Endogenous opioids mediate left dorsolateral prefrontal cortex rTMS-induced analgesia[J]. Pain, 2012, 153(6):1219-1225.
[70] Porro CA, Baraldi P, Pagnoni G,
. Does anticipation of pain affect cortical nociceptive systems?[J]. J Neurosci, 2002, 22(8):3206-3214.
[71] Atlas LY. A social affective neuroscience lens on placebo analgesia[J]. Trends Cogn Sci, 2021, 25(11):992-1005.
[72] Schweinhardt P, Glynn C, Brooks J,
. An fMRI study of cerebral processing of brush-evoked allodynia in neuropathic pain patients[J]. Neuroimage, 2006,32(1):256-265.
[73] Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation[J]. Neuron, 2007, 55(3):377-391.
[74] Rainville P. Brain mechanisms of pain affect and pain modulation[J]. Curr Opin Neurobiol, 2002, 12(2):195-204.
[75] Ossipov MH, Dussor GO, Porreca F. Central modulation of pain[J]. J Clin Invest, 2010, 120(11):3779-3787.
[76] Le Guen S, Mas Nieto M, Canestrelli C,
. Pain management by a new series of dual inhibitors of enkephalin degrading enzymes: long lasting antinociceptive properties and potentiation by CCK2 antagonist or methadone[J]. Pain, 2003, 104(1-2):139-148.
[77] Harris RE, Clauw DJ, Scott DJ,
. Decreased central mu-opioid receptor availability in fibromyalgia[J]. J Neurosci, 2007, 27(37):10000-10006.
[78] Willoch F, Schindler F, Wester HJ,
. Central poststroke pain and reduced opioid receptor binding within pain processing circuitries: a [11C] diprenorphine PET study[J]. Pain, 2004, 108(3):213-220.
[79] Jones AKP, Brown CA. Predictive mechanisms linking brain opioids to chronic pain vulnerability and resilience[J]. Br J Pharmacol, 2018, 175(14):2778-2790.
[80] Wager TD, Rilling JK, Smith EE,
. Placebo-induced changes in FMRI in the anticipation and experience of pain[J]. Science, 2004, 303(5661):1162-1167.
[81] Atlas LY, Wager TD. A meta-analysis of brain mechanisms of placebo analgesia: consistent findings and unanswered questions[J]. Handb Exp Pharmacol,2014, 225:37-69.
[82] Wager TD, Scott DJ, Zubieta JK. Placebo effects on human mu-opioid activity during pain[J]. Proc Natl Acad Sci U S A, 2007, 104(26):11056-11061.
[83] Friedman AK, Walsh JJ, Juarez B,
. Enhancing depression mechanisms in midbrain dopamine neurons achieves homeostatic resilience[J]. Science, 2014,344(6181):313-319.
[84] Zhang HX, Chaudhury D, Nectow AR,
. α
- and β
-adrenergic receptor-mediated mesolimbic homeostatic plasticity confers resilience to social stress in susceptible mice[J]. Biol Psychiatry, 2019, 85(3):226-236.
[85] Younger J, Aron A, Parke S,
. Viewing pictures of a romantic partner reduces experimental pain:involvement of neural reward systems[J]. PLoS One,2010, 5(10):e13309.
[86] Kross E, Berman MG, Mischel W,
. Social rejection shares somatosensory representations with physical pain[J].Proc Natl Acad Sci U S A, 2011, 108(15):6270-6275.
[87] Gündel H, O'connor MF, Littrell L,
. Functional neuroanatomy of grief: an FMRI study[J]. Am J Psychiatry, 2003, 160(11):1946-1953.
[88] Rhudy JL, Meagher MW. Fear and anxiety: divergent effects on human pain thresholds[J]. Pain, 2000, 84(1):65-75.
[89] Becker S, Gandhi W, Elfassy NM,
. The role of dopamine in the perceptual modulation of nociceptive stimuli by monetary wins or losses[J]. Eur J Neurosci,2013, 38(7):3080-3088.
[90] Thompson JM, Neugebauer V. Amygdala plasticity and pain[J]. Pain Res Manag, 2017, 2017:8296501.
[91] Gandhi W, Rosenek NR, Harrison R,
. Functional connectivity of the amygdala is linked to individual differences in emotional pain facilitation[J]. Pain, 2020,161(2):300-307.
[92] Bornhövd K, Quante M, Glauche V,
. Painful stimuli evoke different stimulus-response functions in the amygdala, prefrontal, insula and somatosensory cortex: a single-trial fMRI study[J]. Brain, 2002, 125(Pt 6):1326-1336.
[93] Lapate RC, Lee H, Salomons TV,
. Amygdalar function reflects common individual differences in emotion and pain regulation success[J]. J Cogn Neurosci, 2012, 24(1):148-158.
[94] Wilson TD, Valdivia S, Khan A,
. Dual and opposing functions of the central amygdala in the modulation of pain[J]. Cell Rep, 2019, 29(2):332-346. e5.
[95] Kucyi A, Davis KD. The dynamic pain connectome[J].Trends Neurosci, 2015, 38(2):86-95.
[96] Dudley KJ, Li X, Kobor MS,
. Epigenetic mechanisms mediating vulnerability and resilience to psychiatric disorders[J]. Neurosci Biobehav Rev, 2011,35(7):1544-1551.
[97] Zannas AS, West AE. Epigenetics and the regulation of stress vulnerability and resilience[J]. Neuroscience,2014, 264:157-170.
[98] Chidambaran V, Zhang X, Geisler K,
. Enrichment of genomic pathways based on differential DNA methylation associated with chronic postsurgical pain and anxiety in children: a prospective, pilot study[J]. J Pain, 2019, 20(7):771-785.
[99] Lutz BM, Bekker A, Tao YX. Noncoding RNAs: new players in chronic pain[J]. Anesthesiology, 2014,121(2):409-417.

