酶解改性对小麦醇溶蛋白致敏性的影响与工艺优化
孟智鹏,温青玉,张 雨,李天齐,张康逸
(1. 河南工业大学 国际教育学院,河南 郑州 450007;2. 河南省农业科学院 农副产品加工研究中心/河南省全谷物小麦制品加工国际联合实验室/河南省全谷物鲜食加工工程技术研究中心,河南 郑州 450002;3. 河南省安康食品科技研究院,河南 郑州 450047;4. 河南省安康未来食品科技有限公司,河南 郑州 450066)
随着世界范围内食物过敏发病率的不断上升[1‑2],食物过敏已成为人们重点关注的食品安全问题之一。小麦是全球最重要的粮食作物之一,也是8 种主要的食物过敏原中较为重要的一类[3]。据研究,小麦食物过敏致敏率已接近全球人口的1%:在儿童中的致敏率为0.4%~1.3%,在成人中的致敏率为0.2%~0.9%[4]。小麦醇溶蛋白(GLI)被认为是引起小麦食物过敏的主要过敏原[5]。
酶法处理过敏原是目前高效降低致敏性的手段之一,主要原理是通过部分或完全地将过敏蛋白水解成肽或者氨基酸,进一步破坏过敏原的线性表位和构象表位,从而达到降低致敏性的效果[6]。KASERA 等[7]研究了酶水解对芸豆、黑豆和花生等3种豆类致敏性的影响,发现酶水解可有效减弱豆类蛋白的过敏性;CUADRADO 等[8]通过研究蛋白酶对腰果和开心果的酶解反应,发现酶解反应显著降低了腰果与开心果过敏原结合IgE 的能力。值得注意的是,如果酶解条件不适宜,可能会暴露出更多的抗原表位,反而会提高过敏原的致敏性[9]。目前,有研究者发现通过酶解法也可降低GLI致敏性[10‑11],但降低GLI 致敏性的最佳酶解工艺以及酶解与GLI致敏性的关系还有待进一步探究。
为深入研究酶解改性对GLI的影响并达到最佳的降敏效果,以致敏性特征值OD450为评价指标,从6 种蛋白酶中筛选出合适的2 种酶,以OD450和水解度(DH)为指标设计单因素试验,并在此基础上通过响应面试验对酶解的工艺进行优化,获得最优的酶法改性配方;同时,通过SDS-PAGE、Tricine-SDS-PAGE、Western blot 和ELISA 试验进一步探究酶法改性对GLI致敏性的影响。以期为开发低致敏小麦产品提供理论依据,同时也为其他食物过敏原致敏性的降低或消除提供借鉴。
1 材料和方法
1.1 试验材料
GLI 购自上海麦克林生化科技有限公司;蛋白酶购自Novozymes 公司;SDS-PAGE 凝胶试剂盒、山羊抗兔IgG-HRP 购自上海雅酶生物医药科技有限公司;2×Tricine-SDS-PAGE 蛋白质上样缓冲液、三(羟甲基)甲基甘氨酸(Tricine)、TMB 显色液、DAB显色液、考马斯亮蓝G-250、蛋白质Marker 等均购自Solarbio公司。
1.2 试验方法
1.2.1 单酶筛选 选取6 种蛋白酶对GLI 进行酶解。称取一定量GLI,加入蒸馏水搅拌制备成30 g/L的悬浮液,在表1 中各酶的最适温度与pH 值条件下,添加酶(酶活性设定为3 000 U/g)进行酶解反应4 h。反应过程中维持pH 值在最适范围内。酶解结束后,95 ℃水浴10 min。

表1 不同蛋白酶的酶解反应最适条件Tab.1 Optimal enzymatic parameters of various proteases
1.2.2 酶解单因素试验 以致敏性特征值OD450和水解度为评价指标,主要考察各单因素包括酶添加量(1 000、2 000、3 000、4 000、5 000 U/g)、酶解pH值(6.5、7.0、7.5、8.0、8.5)、酶解温度(40、45、50、55、60 ℃)、底物质量浓度(10、20、30、40、50 g/L)以及酶解时间(2、3、4、5、6 h)对GLI致敏性的影响。
1.2.3 双酶酶解工艺优化试验 在单因素试验结果的基础上,以致敏性特征值OD450为评价指标,采用Design Expert 8.0.6 软件设计响应面试验,进一步优化酶添加量(A)、酶解pH值(B)、酶解温度(C)、底物质量浓度(D)4 个因素对GLI 致敏性的影响,从而得出最佳酶解工艺。以-1、0、1 分别代表变量的水平,试验设计的响应面因素和水平见表2。

表2 响应面法优化GLI酶解条件的因素和水平Tab.2 Factors and levels of optimization of GLI enzymatic hydrolysis conditions by response surface methodology
1.3 测定方法
1.3.1 水解度测定 借鉴范三红等[12]的方法采用甲醛滴定法测定蛋白质水解度。
1.3.2 兔抗GLI多克隆抗体制备及抗原性评估
1.3.2.1 多克隆抗体制备 选取4 只8 周龄且健康的日本大耳兔,使用不含过敏原的饲料喂养,采用静脉多点注射进行免疫。用PBS(pH 值为7.0,0.01 mol/L)稀释过敏蛋白GLI,首次免疫使用等体积的弗氏完全佐剂进行乳化,免疫剂量为每只兔2 mg/mL;之后每隔14 d 进行一次加强免疫,加强免疫使用弗氏不完全佐剂进行乳化,免疫剂量为每只兔0.5 mg/L。效价达标后,从动脉大量取血,37 ℃凝血1 h 后,4 ℃放置过夜,分离血清(4 000 r/min 离心3 min),-20 ℃冻存备用[13]。
1.3.2.2 ELISA 测定 借鉴韩建勋[14]的方法并进行改进,采用ELISA 评估GLI 的抗原性。取100 μL 样品(2 μg/mL,用包被液稀释)至96孔微量酶标板,每个稀释度设置6 个平行,在4 ℃下包被过夜;之后每孔加100 μL 含5%脱脂奶粉的封闭液,在37 ℃下封闭2 h;再加入100 μL兔抗GLI多克隆抗体(用PBST稀释100 000倍),37 ℃孵育1 h;加入100 μL羊抗兔IgG-HRP(用PBST 稀释3 000 倍),37 ℃孵育1 h;以上每个步骤处理后均用PBST 洗板3 次并拍干。最后加入100 μL TMB 显色液,避光显色10 min 后,加入50 μL 2 mol/L 的H2SO4终止反应,使用酶标仪(Multiskan™FC,Thermo公司)读取450 nm处的吸光值,记作OD450。
1.3.3 SDS-PAGE 和Tricine-SDS-PAGE 电泳 将GLI 溶液及其酶解液稀释为0.5 g/L,与蛋白质上样缓冲液混合,沸水浴加热8 min,以10 000 r/min离心1 min。制备5%浓缩胶和12%分离胶,使用DYCZ-24D 蛋白质电泳仪进行SDS-PAGE 电泳。制备4%浓缩胶、10%夹层胶和16.5%分离胶,使用DYCZ-40D 转印电泳仪进行Tricine-SDS-PAGE 电泳,然后将分离胶转移至固定液中固定1 h。电泳结束后进行染色、脱色和拍照。
1.3.4 Western blot 分析 参考MENG 等[15]的方法,用SDS-PAGE 电泳将待测样品分离,方法同1.3.3,然后将分离胶上的蛋白质条带经过湿法转移至PVDF 膜上。用封闭液于室温下封闭2 h 后洗涤,之后将膜转移至经稀释的兔抗GLI 多克隆抗体(用PBST 稀释10 000 倍)中,在37 ℃下摇动孵育2 h 后洗涤;然后,再将膜转移至山羊抗兔IgG-HRP(用PBST 稀释2 000 倍)稀释液中,在37 ℃下摇动孵育1 h 后洗涤。洗涤方法均为用PBST 振荡洗涤3 次,每次6 min。最后加入DAB 显色液避光摇动显色,显色至预期效果,用蒸馏水清洗,终止反应,将膜晾干后进行拍照。
1.3.5 数据处理 用Origin 9.0、SPSS 23 和Design Expert 8.0.6等软件对试验数据进行处理和作图。
2 结果与分析
2.1 单酶筛选结果
由图1可知,经不同酶解后,GLI的OD450均有不同程度的降低,说明酶解对降低GLI 的致敏性有显著效果。尤其经碱性蛋白酶、复合蛋白酶水解后,OD450降低程度最大,分别降至0.536 2、0.580 1,说明其降低致敏性效果最佳。因此,本研究选择碱性蛋白酶、复合蛋白酶等比添加进行后续的双酶酶解试验。

图1 6种酶对GLI OD450的影响Fig.1 The effects of six enzymes on OD450 of GLI
2.2 单因素试验结果
由图2A 所示,随着酶添加量的增加,水解度逐渐升高然后趋于平缓,但OD450呈现先减小后增大趋势,在3 000 U/g 时降敏效果最佳,继续增加酶添加量可以进一步增加水解度,但降敏效果反而变差。在图2B、C、D 中,随pH 值、温度和底物质量浓度的增加,水解度均呈现先增加后降低的趋势,分别在pH 值7.5、50 ℃和30 g/L 的底物质量浓度条件下达到最大值,而OD450变化与水解度均呈相反趋势,水解度最大时OD450最小,随着水解度的降低,致敏性又逐渐增大。在图2E 中,随着酶解时间的增加,水解度同样逐渐升高然后趋于平缓,4 h 时水解度与致敏性降低效果均达到最大,4 h 后再继续酶解,致敏性效果并没有明显变化。因此,确定4 h 为最佳酶解时间。为了进一步研究降低GLI致敏性的最佳酶解工艺,对除酶解时间之外的另外4 种因素进一步进行响应面分析。
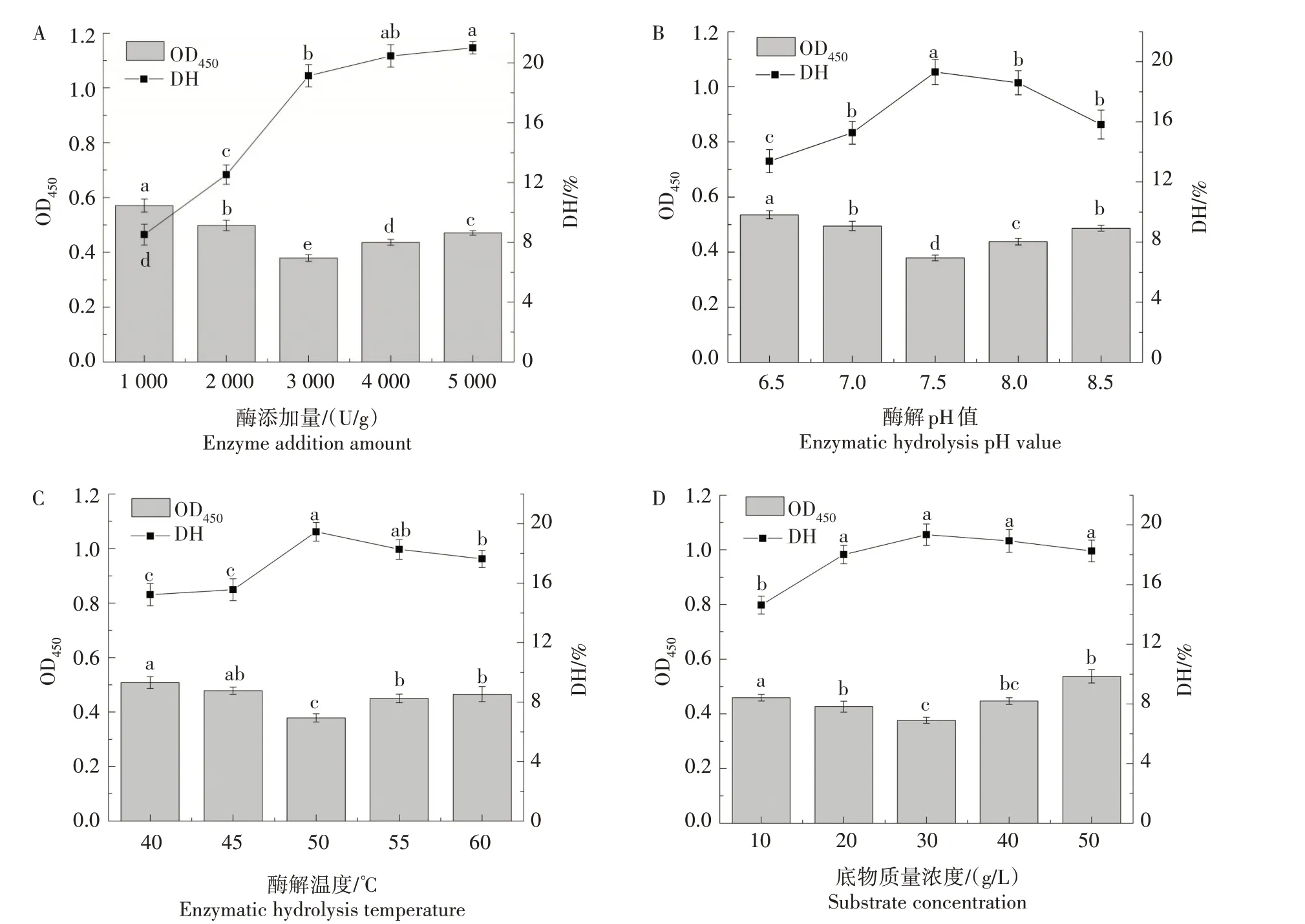

图2 酶添加量(A)、酶解pH值(B)、酶解温度(C)、底物质量浓度(D)和酶解时间(E)对GLI OD450和水解度的影响Fig.2 Effects of enzyme addition amount(A),enzymatic hydrolysis pH value(B),enzymatic hydrolysis temperature(C),substrate concentration(D)and enzymatic hydrolysis time(E)on the OD450 and hydrolysis degree of GLI
2.3 响应面优化设计试验结果
在单因素测试的基础上,运用Design Expert 8.0.6 软件中Box-Behnken 程序设计进行优化,设计四因素三水平,共29组试验组合。试验设计方案及结果如表3所示。

表3 响应面试验设计方案及结果Tab.3 The schemes and results of response surface design
通过Design Expert 8.0.6 响应面分析软件对29组OD450试验结果进行回归拟合,得到OD450的回归方程:
OD450=0.369 8-0.004 2A-0.000 3B-0.001 3C+0.004 1D+0.0060AB-0.002 4AC-0.000 9AD-0.006 8BC-0.000 4BD+0.000 8CD+0.012 7A2+0.017 9B2+0.019 6C2+0.011 1D2。
对回归方程进一步进行方差分析,结果见表4。由表3、表4 可知,以OD450为响应值的模型中,一次项A、D,二次项A2、B2、C2、D2,交互项AB、BC对OD450的影响极显著(P<0.01)。由此可知,各个因素之间的交互作用比较显著,各因素对OD450的影响不是简单的线性关系。由表4 可知,本试验的回归方程模型为极显著水平(P<0.01),该模型的失拟项(P>0.05)不显著,表明该模型的拟合度较好。因此,该回归方程可用于OD450的分析。方程的决定系数R2为0.971 3,表明方程的相关性较好,说明该模型对OD450可以进行预测;修正决定系数R2Adj为0.943 6,说明该模型可以解释94.36%的响应值变化;R2Pred(0.863 8)与R2A(dj0.943 6)的差值小于0.2,说明该回归模型可以充分地解释GLI的酶解过程。试验的精确度可以用离散系数表示[16],此次试验的精确度为0.829 0%,说明该方程能够很好地反映真实值。

表4 响应面方差分析结果Tab.4 Analysis of variance results of response surface
响应面是响应值对各试验因素所构成的三维空间曲面图,通过曲面的坡度可以看出两因素交互作用的强弱[17]。研究各试验因素间的相互作用对OD450的影响,由二次回归模型绘制的响应面图如图3 所示。随着各试验因素水平的逐渐升高,OD450均呈现先减小后增大的趋势,说明4 个因素在所设定范围内均存在最值。结合表4 可知,4 个因素中酶添加量对OD450的影响最大,其次为底物质量浓度、酶解温度、酶解pH值。而且酶添加量和酶解pH值、酶解pH值和酶解温度的交互作用对OD450影响极显著(P<0.01),与方差分析结果一致,其他交互作用影响不显著(P>0.05)。

图3 酶添加量、酶解pH值、酶解温度、底物质量浓度交互的响应面分析Fig.3 Response surface analysis of interaction among enzyme addition amount,enzymatic hydrolysis pH value,temperature and substrate concentration
2.4 最优化酶解工艺条件验证
响应面分析结果表明,降低GLI 致敏性的最佳酶解工艺:酶添加量为3 080 U/g,底物质量浓度为32 g/L,酶解温度为50.5℃,酶解pH 值为7.48,酶解时间为4 h。在此条件下,通过3 次验证试验,OD450由未处理的1.013 2 降至0.363 5。说明该模型具有较好的适用性,可以用来预测试验结果。
2.5 GLI酶解产物的分子质量分布
通过SDS-PAGE 与Tricine-SDS-PAGE 电泳对GLI 酶解产物分子质量分布进行分析,结果如图4所示。经过碱性蛋白酶、复合蛋白酶单酶解后,GLI在30~48 ku 的条带几乎完全消失,新产生的条带多集中在3.3~14.4 ku;经过最优配方酶解后,仅在14.4 ku 附近有部分残留,更多的条带被水解成3.3 ku 以下的小肽段,这说明最优配方酶解更能有效水解GLI。

图4 GLI酶解产物SDS-PAGE(A)、Tricine-SDS-PAGE(B)分析结果Fig.4 SDS-PAGE(A),Tricine-SDS-PAGE(B)analysis results of wheat gliadin hydrolysis products
2.6 GLI酶解产物分析
由图5A可知,GLI经过酶解后,OD450显著降低,尤其在最优配方下,OD450最小,说明双酶酶解最优配方降低GLI 致敏性效果最好。通过Western blot进一步验证,未处理的GLI免疫条带清晰,但酶解之后几乎检测不到条带(图5B),再次证明酶法改性降低GLI 致敏性的效果明显。综上所述,酶法改性降低GLI 致敏性的效果明显,最优酶配方(双酶)比单酶降低致敏性效果更佳。

图5 ELISA(A)和Western blot(B)分析酶法改性对GLI致敏性的影响Fig.5 The effects of enzymatic modification on allergenicity of GLI determined by ELISA(A)and Western blot(B)
3 结论与讨论
探索酶解改性对小麦醇溶蛋白致敏性影响研究具有重要意义。本研究通过酶解改性来降低GLI的致敏性,以致敏性特征值OD450为评价指标,通过单酶筛选,确定碱性蛋白酶和复合蛋白酶对GLI 进行同步酶解。通过单因素试验与响应面试验优化了双酶酶解工艺,获得降低GLI 致敏性的最佳酶解工艺:酶添加量为3 080 U/g,底物质量浓度为32 g/L,酶解温度为50.5 ℃,酶解pH 为值为7.48,酶解时间为4 h。经试验验证,在此条件下酶解产物的OD450由未处理的1.013 2降至0.363 5。
酶解改性有一定的降低致敏性能力,LIANG等[18]通过酶水解降低了牛奶产品的免疫反应性。而降敏效果与酶解底物、酶种类和酶解条件均有关。本研究用6 种酶分别酶解GLI 后,其OD450差异化的主要因素是各酶酶切位点的不同,而这些酶切位点仅有少数分布于抗原表位肽段中。酶切位点不同导致抗原表位的暴露情况不同,由此表现出不同的致敏性效果,只有在合适条件下,酶解改性才有显著的降低致敏性效果。蛋白酶只有在合适的酶解条件下活性最高,在过高或过低pH 值和温度下,导致部分酶变性,酶活力降低,不利于酶解反应进行[19‑20]。随底物质量浓度增加水解度也呈先增大后减小趋势。当底物质量浓度增大时,增大了反应体系的黏度,使得酶在溶液中流动性变差。赵立娜等[21]的研究也发现,酶与底物不能充分的接触会抑制蛋白质酶解。另外,单因素研究发现,水解度与致敏性之间没有明确联系,水解度过低时,通过酶解降低致敏性效果有限。然而过度水解可能导致无致敏性的肽段被分解成更小的肽段,抗原表位暴露,反而产生了致敏性。在HE 等[22]的研究中也发现了这种现象,说明适度水解对降低GLI 致敏性很有必要。
SDS-PAGE 和Tricine-SDS-PAGE 电 泳 结 果 显示,最优条件下双酶酶解得到分子质量低于3.3 ku以下的小肽段,比单酶酶解效果好。范志军等[23]的研究结果表明,分子质量的降低往往伴随着致敏表位的降解,可以降低过敏原结合IgE 的能力,这可能是致敏性降低的主要原因。党慧杰等[24]提出,蛋白质降解的越多,水解度越高,其致敏性越低。然而,水解过度会导致肽段分子质量过低,隐藏的抗原表位可能暴露,不利于降低致敏性,这与水解度测定结果一致。
ELISA 和Western blot 分析进一步评估了酶解改性对GLI 致敏性的影响。本研究发现,酶法改性一定程度上破坏了GLI 的线性表位,且最优酶配方(双酶)比单酶降低致敏性的效果更显著。LI等[10]也得出了相似的结论,双酶经过合适的配比和酶解路线对过敏蛋白进行酶解,比单酶降低致敏性的效果更显著。
食物过敏是世界范围内主要的健康问题之一,小麦是我国最重要的谷物之一,不仅作为日常碳水化合物的主要来源,而且也作为具有独特质地的食物来源。小麦醇溶蛋白作为小麦中的主要过敏蛋白,易引起过敏反应,包括荨麻疹、呼吸不顺畅甚至休克或死亡。到目前为止,小麦过敏无法根治,最佳的方法就是尽量避免食用含小麦的食物,但完全避免食用含小麦食物是相当困难的。因此,深入探究降低或消除小麦醇溶蛋白的致敏性显得格外重要。目前,降低过敏原致敏性手段主要包括物理法、化学法、酶法、生物法,其中,酶解改性方法简单易于控制,相比其他处理成本较低。为了更深入评价酶解改性对过敏蛋白致敏性的影响,下一步可以建立致敏动物模型进行体内评价。另外,过敏蛋白致敏的前提是抗原表位的存在,而表位的构成是某些特定的氨基酸残基连续或不连续组合。后续可以进行GLI 表位的鉴定,对于深层次研究改性手段与降低过敏蛋白致敏性的机制具有重要意义。

