新型冠状病毒肺炎无症状感染者的临床与免疫学特征分析
申 川,秦 浩,马路园,李星宇,宋枚芳,张云涛,高会霞,王 洋,戴二黑,赵彩彦
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)是由严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的一种以病毒性肺炎为突出表现的全身感染性疾病。截至到2022年7月26日,已导致全球200个以上的国家和地区超过5.6亿人感染,死亡人数达637万人[1],严重影响了全球社会经济活动与人类的生活,也造成了巨大的经济损失。COVID-19的疾病谱中除包括轻型、普通型、重型、危重型患者外,还存在一部分“无症状”感染者。这些感染者无明显临床症状,尤其在聚集性感染病例中较为常见,常通过密切接触者筛查、聚集性疫情调查、传染源追踪调查发现,极易被忽视,且作为隐匿传染源可造成疫情广泛传播。本研究通过分析河北省COVID-19救治定点医院(石家庄市第五医院)2020年1月22日—6月22日期间确诊的COVID-19患者的临床资料,初步探讨COVID-19无症状感染者的临床特征和宿主T淋巴细胞亚群、细胞因子/趋化因子谱的特征,完善对COVID-19疾病谱及致病机理的认识,为疫情防控提供理论依据。
1 对象与方法
1.1 对象 选取2020年1月22日—6月22日石家庄市第五医院收治的59例COVID-19患者作为研究对象,同时选取24例健康者作为对照组。本研究通过河北医科大学第三医院(科2020-009-1)、石家庄市第五医院(2020013)伦理委员会审核批准,所有研究对象均知情同意并签属知情同意书。
1.2 方法
1.2.1 信息收集 收集59例COVID-19患者的人口学(年龄、性别等)资料、流行病学特征、临床表现、胸部CT等临床资料。
1.2.2 纳入、排除标准 纳入标准:参照《新型冠状病毒感染的肺炎诊疗方案(试行第八版)》[2],COVID-19患者须具有流行病学史,咽或鼻拭子SARS-CoV-2核酸检测阳性,伴或不伴临床表现、COVID-19胸部CT特征。排除标准:①疑似患者;②由其他病原体导致的肺部或全身感染、自身免疫性疾病、恶性肿瘤者;③无症状感染者应该排除入组时尚处于潜伏期而无症状,但随疾病进展出现相应临床表现的轻型、普通型、重型/危重型COVID-19患者。
1.2.3 患者分组 根据《新型冠状病毒感染的肺炎诊疗方案(试行第八版)》[2],将59例COVID-19患者分为4组:无症状感染组(n=28)、轻型组(n=6)、普通型组(n=19)、重型/危重型组(n=6)。无症状感染:核酸检测阳性至核酸转阴,自始至终不出现任何症状、体征和影像学表现。轻型:临床症状轻微,影像学检查未见COVID-19表现。普通型:具有发热、呼吸道等症状,影像学检查可见COVID-19表现。重型:符合以下情况之一者,①出现气促,呼吸频率≥30 次/min;②静息状态下,吸气时指氧饱和度≤93%;③动脉氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg;④临床症状进行性加重,胸部影像学显示24~48 h内病灶明显进展(>50%)。危重型:符合以下情况之一者,①出现呼吸衰竭,且需要机械通气;②出现休克;③合并其他器官功能衰竭,需ICU监护治疗。因重型、危重型患者例数较少,故将其合并为重型/危重型组。
1.2.4 标本采集与处理 留取59例COVID-19患者EDTA-K2抗凝管静脉血标本用于检测T细胞亚群计数;留取59例COVID-19患者和24例健康对照者的促凝管静脉血标本,分离血清后,置于-80 °C冰箱保存,检测细胞因子和趋化因子水平。首次血液标本采集在入院48 h(治疗前)内完成,根据临床诊治需要,部分患者同时采集入院第(14±2)d(治疗后)血液标本。全部检测均在符合生物安全要求的实验室完成。
1.2.5 T细胞亚群计数检测 取EDTA-K2抗凝血50 μl置于流式细胞管,加入 10 μl TriTESTCD3-PerCP/CD4-FITC/CD8-PE抗体,室温避光温育15 min,加入溶血素2 ml,温育15 min后离心,PBS洗涤2次,用FACS-Canto II流式细胞仪(美国BD公司)检测T细胞亚群计数。
1.2.6 血清细胞因子和趋化因子检测 用Procarta Plex多细胞因子检测系统(美国Thermo Fisher公司)检测血清中25种细胞因子:IFN-α、IFN-γ、TNF-α、TNF-β、IL-1α、IL-1RA、IL-1β、IL-2、IL-4、IL-5、IL-6、IL-7、IL-9、IL-10、IL-12p70、IL-13、IL-15、IL-17A、IL-18、IL-21、IL-22、IL-23、IL-27、IL-31、 粒 细 胞 -巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor, GM-CSF)及9种趋化因子:IL-8、干扰素诱导蛋白10(interferoninducible protein-10, IP-10)、嗜酸性粒细胞趋化因子(Eotaxin)、生长调节致癌基因(growthrelated oncogene, GRO)-α、单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)、巨噬细胞炎性蛋白(macrophage inflammatory protein, MIP)-1α、MIP-1β、基质细胞衍生因子(stromal cell derived factor, SDF)-1α、调节激活正常T细胞表达和分泌的趋化因子(regulated upon activation normal T-cell expressed and secreted, RANTES)的水平。具体方法为:将50 μl磁珠加入微孔板,离心弃去液体后,每孔加入25 μl缓冲液和25 μl样品或标准品,室温反应60~120 min,清洗微孔板2次,加入25 μl检测抗体混合液温育30 min后洗涤,再加入链霉亲和素-荧光色素偶联物温育30 min。采用LuminexTM200流式荧光检测仪读取数据。
1.3 统计学处理 用SPSS 26.0软件进行统计分析。计数资料以例数(%)表示,组间比较采用χ2检验。呈正态分布的计量资料以±s 表示,呈偏态分布的计量资料以M(P25,P75)表示,多组间总体差异比较采用Kruskal-Wallis H检验,组间比较采用Bonferroni法校正。配对设计采用Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 人口学数据和临床特征 59例COVID-19患者中,男性37例,女性22例,年龄31.0(22.0,49.0)岁;各组患者性别比较差异无统计学意义(χ2=0.716,P=0.869)。各组患者年龄比较,差异具有统计学意义(H=17.787,P=0.001),其中无症状感染组[23.0(19.3,34.8)岁]显著低于普通型组[35.0(24.0,52.0)岁]和重型/危重型组[64.5(52.0,68.3)岁](P均<0.05),而与轻型组[25.0(21.0,46.3)岁]比较,差异无统计学意义(P>0.05)。无症状感染组患者均无临床症状和特异性胸部CT病变,而普通型组、重型/危重型组具有不同程度的发热、乏力及呼吸道症状等,且至少存在累及1个肺叶的影像学改变。所有COVID-19患者均康复出院,无死亡病例,见表1。
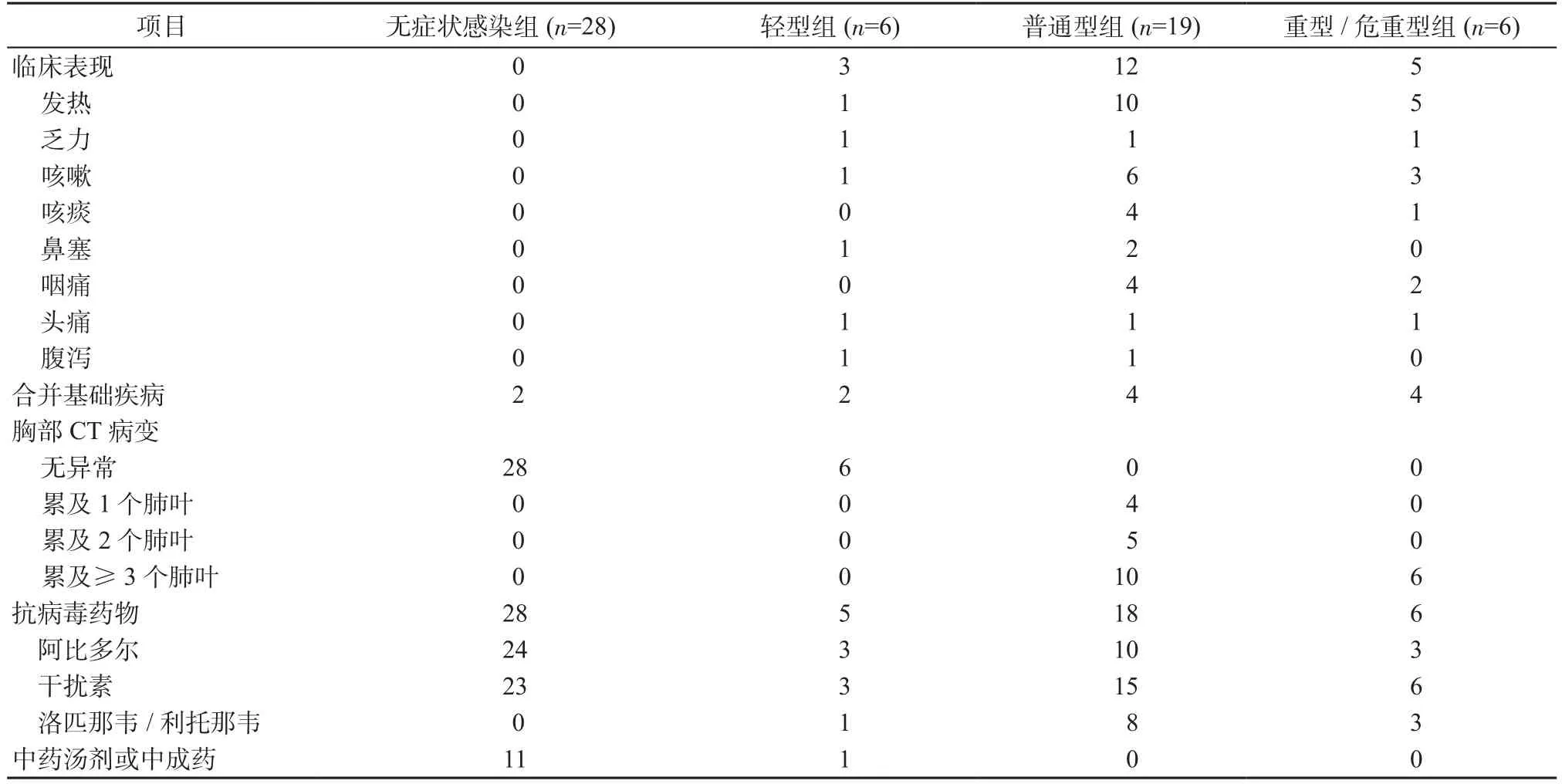
表1 COVID-19患者的临床特征(例)Table 1 Clinical characteristics of patients with COVID-19 (cases)
2.2 各组COVID-19患者治疗前T细胞亚群计数的比较 所有COVID-19患者入院首次T细胞亚群检测结果显示:无症状感染组10例(35.7%)、轻型组0例、普通型组13例(68.4%)、重型/危重型组6例(100%)患者的CD4+T细胞计数低于正常值下限(参考范围:550~1440个/μl);无症状感染组3例(10.7%)、轻型组0例、普通型组2例(10.5%)、重型/危重型组5例(83.3%)患者的CD8+T细胞计数低于正常值下限(参考范围:320~1250个/μl)。无症状感染组外周血CD4+T细胞、CD8+T细胞计数均显著高于重型/危重型组(P均<0.05),与轻型组比较差异均无统计学意义(P均>0.05),无症状感染组CD4+T细胞计数显著高于普通型组(P<0.05),见表2。
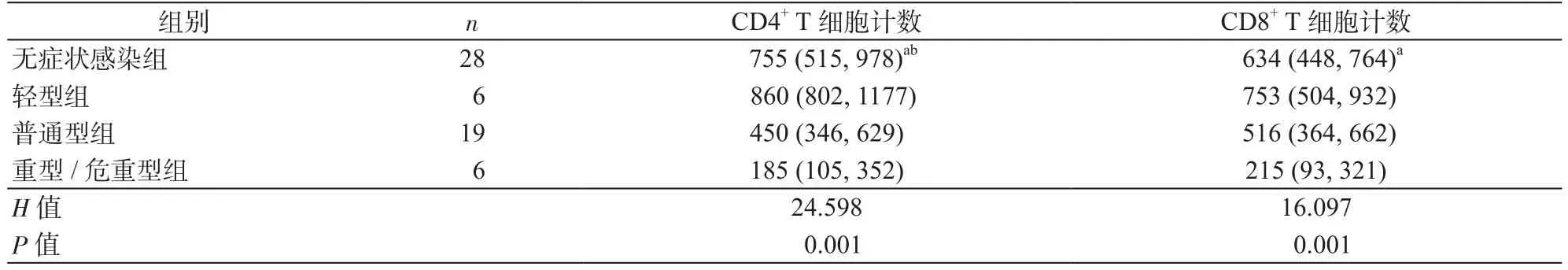
表2 各组COVID-19患者治疗前T细胞亚群计数的比较[M(P25,P75)]Table 2 Comparison of T-cell subsets in patients with various types of COVID-19 before treatment [M (P25, P75)]
2.3 各组COVID-19患者治疗前与治疗后T细胞亚群计数差值的比较 无症状感染组14例、普通型组13例、重型/危重型组6例患者在入院后第(14±2)d进行了第2次外周血T细胞亚群检测。与治疗前相比,治疗后无症状感染组4例(28.6%)、普通型组11例(84.6%)、重型/危重型组4例(66.7%)患者CD4+T细胞计数升高;无症状感染组8例(57.1%)、普通型组10例(76.9%)、重型/危重型组5例(83.3%)患者CD8+T细胞计数升高。14例无症状感染组患者治疗前与治疗后CD4+T细胞和CD8+T细胞计数比较,差异均无统计学意义(P均>0.05),见表3。普通型组、重型/危重型组治疗后CD4+T细胞、CD8+T细胞计数均较治疗前有不同程度的回升,但仅CD4+T细胞计数在上述2组中的上升幅度显著高于无症状感染组的变化幅度,差异具有统计学意义(P均<0.05),见表4。
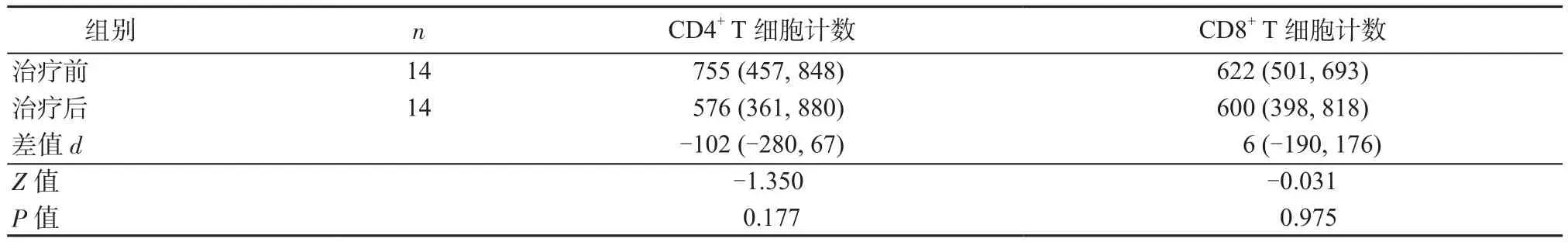
表3 14例无症状感染者治疗前和治疗后T细胞亚群计数的变化[M(P25,P75)]Table 3 Changes of T cell subsets in 14 asymptomatic infected patients before and after treatment [M (P25, P75)]
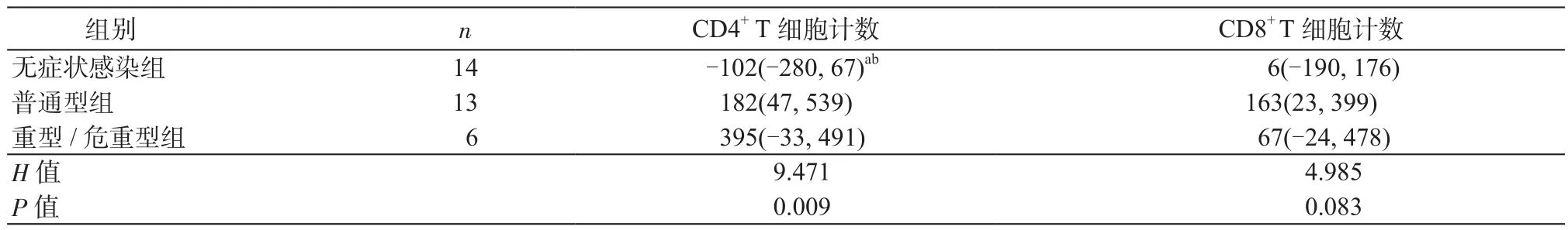
表4 各组COVID-19患者治疗前后T细胞亚群计数差值的比较[M(P25,P75)]Table 4 Comparison of T cell subpopulation count differences between patients with various types of COVID-19 before and after treatment [M (P25, P75)]
2.4 各组COVID-19患者治疗前细胞因子和趋化因子表达谱的比较 无症状感染组24例、普通型组15例、重型/危重型组6例患者和24例健康对照者进行了外周血细胞因子和趋化因子的检测。统计发现,在34种细胞因子和趋化因子中,23种在COVID-19患者及健康对照者中不能被检测到,故未进行统计学分析。不同临床分型COVID-19患者及健康对照者的血清细胞因子和趋化因子水平见图1。无症状感染组血清IL-7水平显著高于对照组(P<0.05),虽低于普通型组、重型/危重型组患者,但差异均无统计学意义(P均>0.05)。无症状感染组血清IP-10水平均显著低于普通型组、重型/危重型组(P均<0.05),但与对照组相比,差异无统计学意义(P>0.05)。

图1 各组COVID-19患者和对照组血清11种细胞因子和趋化因子水平直条矩形柱代表中位数,误差线代表四分位数间距;Kruskal-Wallis H检验比较多组间总体差异,IL-7:H=10.230,P=0.017;IL-8:H=1.101,P=0.777;IL-18:H=2.293,P=0.514;Eotaxin:H=2.152,P=0.411;GRO-α:H=2.797,P=0.424;IP-10:H=18.355,P=0.001;MCP-1:H=2.703,P=0.440;MIP-1α:H=2.271,P=0.518;MIP-1β:H=3.777,P=0.287;SDF-1α:H=7.393,P=0.060;RANTES:H=2.002,P=0.672;a. 与对照组比较,P<0.05;b. 与普通型组比较,P<0.05;c. 与重型/危重型组比较,P<0.05Figure 1 Serum levels of 11 cytokines and chemokines in patients with COVID-19 in each group and control group
3 讨 论
COVID-19无症状感染者是指没有可以自觉感知的相关临床表现如发热、咳嗽、咽痛或可以临床识别的症状和体征,而从呼吸道等标本中检测出SARS-CoV-2核酸阳性的一组人群[3-4]。研究发现,2020年COVID-19疫情早期时无症状感染者的占比在1.6%~59.0%之间[5-6];2021年广州暴发的德尔塔变异株疫情,无症状感染者占比为4.6%[7];2022年上海奥密克戎变异株疫情中,无症状感染者高达90%以上[8]。这提示随着SARS-CoV-2病毒株的不断进化,病毒毒力下降,加之疫苗的广泛接种后形成免疫屏障,无症状感染者成为最主要的感染类型。无症状感染者因具有高度的隐匿性,早期识别困难,常在密切接触者筛检、聚集性疫情调查、对有境内外SARS-CoV-2持续传播地区旅行或居住史的人员开展主动核酸检测时发现,因此探索无症状感染者的临床及免疫学特征,有助于及时发现和遏制疫情传播。
本研究显示,COVID-19无症状感染者主要集中在青年人群,较少伴有基础疾病,而普通型主要为中青年患者,重型/危重型更多见于老年患者,提示COVID-19的严重程度有年龄分布差异,这与其他一些研究的结果一致[9-11]。老年患者因免疫防御功能障碍、免疫衰老、发生免疫病理损伤的风险增高,使其发生重型、危重型COVID-19病例的比例显著增高,并导致较高的病死率[12]。而年轻患者的T细胞和B细胞功能较强,能更好地控制病毒复制,同时减轻机体的炎症反应,使得患者未出现临床症状[13]。世界卫生组织的报告显示全球70万例COVID-19患者的男女比例为1.03:1,而本研究也未发现COVID-19严重程度存在性别差异。
既往研究证实,潜伏期无症状感染者与持续无症状感染者具有不同的免疫表型,如CD8+初始T细胞、CD107alow经典单核细胞、过渡型单核细胞等亚群比例降低,并存在单核细胞过渡活化和分化抑制现象,提示2种“无症状”具有截然不同的进展方向[14]。本研究在纳入无症状感染者作为研究对象时,排除了处于潜伏期的COVID-19轻型、普通型、重型/危重型患者,只纳入属于持续无症状感染者,因此能真实反映该类型患者的免疫状态。
宿主免疫功能是决定感染性疾病临床转归的决定性因素之一。与前期一些研究结果相同,本研究也观察到CD4+和CD8+T细胞计数在COVID-19患者中随疾病进展明显降低,尤其是CD4+T细胞更为显著[11,15]。在SARS-CoV-2感染后,适应性免疫系统的辅助性T细胞、杀伤性T细胞及体液免疫的协同作用对疾病的预后和转归具有重要作用[16]。抗原特异性CD4+T细胞较CD8+T细胞介导的免疫应答对早期的病毒控制更为关键,无症状感染者被发现拥有更多具有功能性的抗原特异性CD4+T细胞[17],因此与较快的病毒清除和较轻的临床症状密切相关。同时,无症状感染者存在丰富的T细胞受体克隆,以及效应T细胞中干扰素刺激基因、细胞毒活性相关基因等的表达上调也对病毒的控制发挥重要作用[17-18]。本研究还发现,无症状感染者在治疗前后外周血CD4+T细胞计数差值未见明显上升甚至部分患者略有下降,这可能与免疫细胞上鞘氨醇-1及趋化因子受体的表达升高,促进免疫细胞向次级淋巴组织及肺组织迁移有关,从而有利于肺部SARS-CoV-2的清除同时避免严重的免疫炎症损伤[17]。
COVID-19危重型患者常出现免疫的过度激活、细胞因子风暴,表现为血清中多种细胞因子水平的显著增加,如IL-2、IL-6、IP-10、IP-10/CXC-10、MCP-1/CCL-2、GM-CSF、MIP1α/CCL3和TNF-α等[19]。这种过度的免疫反应导致免疫损伤,引起多器官功能障碍甚至衰竭死亡。但无症状感染者的细胞因子表达谱的特点在不同研究中差异较大[20]。本研究共检测34种细胞因子和趋化因子,发现COVID-19患者外周血IL-7和IP-10水平明显升高,且变化趋势随疾病严重程度递增。IL-7的产生相对恒定,其水平主要由T细胞消耗控制,外周血IL-7水平的升高预示着T细胞库的消耗,实质是对淋巴细胞减少产生的负反馈[21],故重型/危重型患者升高幅度最大。IP-10属于趋化因子CXC家族,可以通过激活机体免疫系统抵抗病毒抑制病毒复制。IP-10在单核巨噬细胞、活化的成纤维细胞、内皮细胞、淋巴细胞等多种免疫细胞表达,具有趋化炎症细胞、促进炎症因子释放、参与机体免疫调节等功能。与既往的研究结果一致,IP-10在COVID-19重型/危重型患者中显著升高,但在无症状感染者中未见明显变化,提示IP-10与COVID-19疾病严重程度相关,是反映疾病进展的一种重要趋化因子[22]。
本研究尚具备一定的局限性,如样本量偏小,尤其是轻症、重症、危重症患者例数较少,可能使研究结果对上述临床分型的代表性下降,同时因随访时间相对较短,未能观察到SARS-COV-2不同分型感染者的远期预后和转归。其次,因传染病标本检测的特殊性,本研究未能进一步对其他免疫细胞亚群(如B细胞、NK细胞、单核细胞等)、活化标记、效应功能等进行检测。上述问题有待于更深入的研究进一步阐明。
综上,COVID-19无症状感染者以青年为主,但未发现与性别因素相关。外周血T细胞亚群计数、细胞因子和趋化因子水平随COVID-19严重程度而变化,但在无症状感染者中未见显著改变,提示COVID-19无症状感染者通过适度的免疫应答实现SARS-CoV-2清除与避免免疫病理损伤的平衡。

