核桃分离蛋白的制备工艺优化及功能特性
高 盼, 李恒彬, 陈 哲, 杨歆萌, 胡传荣, 何东平,3, 张 晖, 张跃进, 王兴国,
(1.武汉轻工大学 食品科学与工程学院,武汉 430023; 2.大宗粮油精深加工教育部重点实验室,武汉 430023; 3.国家市场监管重点实验室(食用油质量与安全),武汉 430012; 4.武汉食品化妆品检验所,武汉 430012; 5.江南大学 食品学院,江苏 无锡 214122; 6.云南摩尔农庄生物科技开发有限公司,云南 楚雄 675000)
我国是全球最大的核桃生产国,同时也是全球最大的核桃消费国,核桃主要的消费方式是作为坚果食用和提取核桃油,对于核桃提油后产生的核桃粕的利用却很少(核桃粕中含有大量蛋白质[1]),造成了极大的资源浪费。核桃蛋白是一种优质的植物蛋白,含有丰富的人体必需氨基酸,同时也满足FAO/WHO对氨基酸摄入量的建议[2-5]。目前核桃蛋白多数仅为初加工产品,缺少高纯度的产品,无法占领食品原料和功能性食品添加剂市场,制约了核桃蛋白产品的发展。虽然已有研究者[6]优化了工艺,提高了核桃粕中蛋白质的提取率,但得到的蛋白纯度仍较低,不适合直接利用。高品质的核桃蛋白主要来源于蛋白质含量高于90%的核桃分离蛋白,而为了提高核桃蛋白的市场占有率,有必要对其进行纯化处理[7]。
蛋白纯化是利用蛋白质物理、化学性质的差异,使其达到纯化的目的[7]。蛋白纯化的传统方法是沉淀法,该方法具有成本低、操作简单、回收率高、设备要求低的优点,但是对蛋白的选择性不高,适用于蛋白的初步纯化和浓缩[8]。酶法是现今蛋白提取纯化的常用方法[8],其中糖化酶纯化是较为普遍的提纯方法,可将可溶性糖等非蛋白质组分溶出[9],在蛋白提取纯化方面有着广泛的应用[10],已在棉籽蛋白[9]和米糠蛋白[11]中被证明具有很好的纯化效果。因此,本实验选择糖化酶作为纯化用酶,纯化核桃蛋白制备核桃分离蛋白,采用单因素实验和正交实验对糖化酶纯化工艺进行优化,通过与低变性核桃蛋白粉比较考察核桃分离蛋白的氨基酸组成及功能特性,为高品质的核桃分离蛋白开发利用提供指导依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
核桃蛋白,由实验室制备(核桃仁经脱脂、粉碎后经酶法辅助碱溶酸沉制备),其蛋白质含量约为70%,水解度为4.50%。
糖化酶(1.5×105U/g),南宁庞博生物工程有限公司;氢氧化钠、硫酸、硼酸溶液、硫酸铜、盐酸、硫酸钾、乙醚、95%乙醇溶液、溴甲酚绿指示剂、甲基红指示剂,国药集团化学试剂有限公司。
1.1.2 仪器与设备
SZ-93自动双重纯水蒸馏器,上海亚荣生化仪器厂;FD-8型冷冻干燥机,北京博医康实验仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市英峪予华仪器厂;TDSZ台式离心机,湖南凯达科学仪器有限公司;K9840自动凯氏定氮仪,济南海能仪器有限公司;八孔消化炉,上海纤检仪器有限公司;通用实验室pH计,上海奥豪斯仪器有限公司;pH-Stat装置,上海亚荣生化仪器厂;101-1-S数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;L8800型全自动氨基酸分析仪,日本日立公司。
1.2 实验方法
1.2.1 核桃分离蛋白的纯化工艺
核桃蛋白→加水溶解→调节 pH →调节温度→加入糖化酶→酶解→高温灭酶(85℃,15 min)→调节pH至7.0→5 000 r/min离心10 min→加水洗涤(45℃,10 min)→调节pH至7.0→真空冷冻干燥→核桃分离蛋白。
1.2.2 基本指标的计算
蛋白提取率=提取液中蛋白质总量/原料中蛋白质总量×100%;蛋白纯度=干物质的蛋白质质量/干物质的质量×100%。
1.2.3 核桃蛋白的氨基酸组成及功能特性分析
1.2.3.1 氨基酸组成
在核桃蛋白中加入10 mL 6 mol/L盐酸溶液,真空充氮后封口。在110℃恒温干燥箱内水解24 h,取出过滤定容至50 mL。取1 mL滤液真空干燥,用蒸馏水溶解,过膜备用。
氨基酸自动分析仪测定条件:阳离子交换树脂色谱柱(4.6 mm×60 mm,3 μm),进样量20 μL,柠檬酸钠缓冲液流速0.4 mL/min,茚三酮流速0.4 mL/min,衍生温度135℃,测定波长570、440 nm。
1.2.3.2 功能特性
参考Ajibola等[12]的方法并略作修改对持水性和吸油性进行测定;参考李超等[13]的方法并略作修改对乳化性进行测定。
(1)持水性的测定
称取1.0 g待测样品,加入10 mL蒸馏水,充分搅拌混匀后,放在恒温加热磁力搅拌器中,设置不同温度保温30 min。将混合溶液倒入离心管中,4 500 r/min离心20 min,去除上层溶液后,称离心管质量。按下式计算持水性(Y1)。
Y1=(m2-m1)/m
(1)
式中:m为样品质量,g;m2为离心管和沉淀物的总质量,g;m1为离心管和样品的总质量,g。
(2)吸油性的测定
称取1.0 g待测样品,加入10 mL一级大豆油,充分搅拌混匀后,放在恒温加热磁力搅拌器中,设置不同温度保温30 min。将混合溶液倒入离心管中,4 500 r/min离心20 min,去除上层溶液后,称离心管质量。吸油性(Y2)计算按式(1)。
(3)乳化性的测定
称取2.0 g样品,加入40 mL 蒸馏水溶解,将溶液调节为不同pH,再加入40 mL一级大豆油,10 000 r/min均质2 min,1 500 r/min离心10 min,测定离心管中乳化层高度(H1)和液体总高度(H)。按下式计算乳化性(Y3)。
Y3=H1/H×100%
(2)
1.2.4 数据处理
本实验采用Excel 2016统计分析和Design-Expert 8.0.6软件进行数据处理、分析、作图,所有实验数据以“平均值±标准差”(n=3)表示。用SPSS 23.0的Duncan法对数据进行显著性分析。
2 结果与分析
2.1 核桃蛋白纯化的单因素实验
2.1.1 加酶量对蛋白提取率和蛋白纯度的影响
取8.0 g核桃蛋白,在料液比1∶10、酶解温度60℃、酶解时间30 min、酶解pH 4.0的条件下,调节加入糖化酶的量分别为20、40、60、80、100、120、140、160 U/g,探究加酶量对核桃蛋白提取率和蛋白纯度的影响,结果如图1所示。
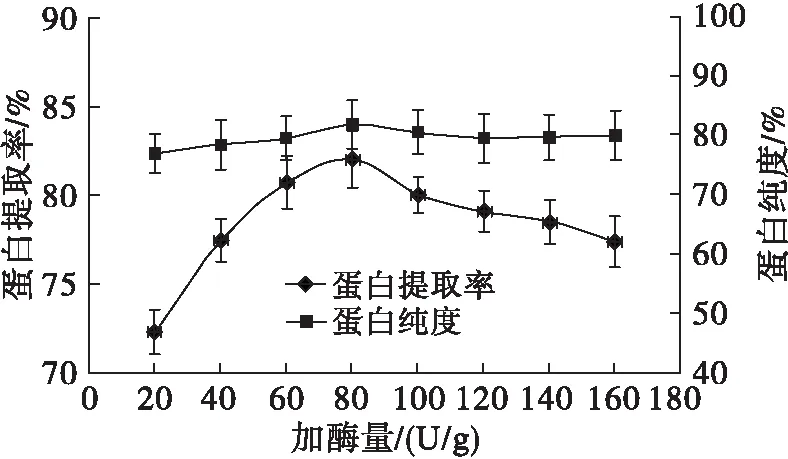
图1 加酶量对蛋白提取率和蛋白纯度的影响
由图1可见,随着加酶量的增加,蛋白提取率先增加后减少,当加酶量为80 U/g时,蛋白提取率最高,为82.04%,其后蛋白提取率逐渐下降。而蛋白纯度的变化相对较小,在加酶量为80 U/g时,蛋白纯度也达到了最高,为81.90%。因此,确定最佳的加酶量为80 U/g。
2.1.2 料液比对蛋白提取率和蛋白纯度的影响
取8.0 g核桃蛋白,在加酶量80 U/g、酶解温度60℃、酶解时间30 min、酶解pH 4.0的条件下,调节料液比分别为1∶6、1∶7、1∶8、1∶9、1∶10、1∶11、1∶12,探究料液比对核桃蛋白提取率和蛋白纯度的影响,结果如图2所示。
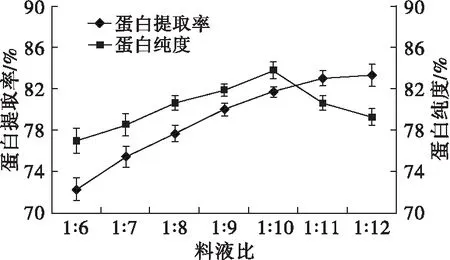
图2 料液比对蛋白提取率和蛋白纯度的影响
由图2可见,随着料液比的增加,蛋白提取率逐渐增加,当料液比超过1∶10时,再增加料液比,蛋白提取率增速明显减缓。而蛋白纯度随着料液比的增加呈先上升后降低的趋势,在料液比为1∶10时,蛋白纯度最高,为83.84%。因此,选择最佳料液比为1∶10。
2.1.3 酶解温度对蛋白提取率和蛋白纯度的影响
取8.0 g核桃蛋白,在加酶量80 U/g、料液比1∶10、酶解时间30 min、酶解pH 4.0的条件下,调节酶解温度分别为40、45、50、55、60、65℃,探究酶解温度对核桃蛋白提取率和蛋白纯度的影响,结果如图3所示。

图3 酶解温度对蛋白提取率和蛋白纯度的影响
由图3可见,随着酶解温度的升高,蛋白提取率变化很小,其提取率范围为82.77%~84.16%,提取率在55℃时达到最高。蛋白纯度随着酶解温度的上升呈先升高后下降的趋势,当酶解温度为60℃时,蛋白纯度达到最高,为84.82%。而继续升高温度,蛋白纯度显著下降,这可能是由于温度过高导致蛋白质发生不可逆的热变性,导致其溶解度下降,从而造成蛋白纯度下降。综合考虑提取率和纯度结果,当酶解温度为60℃时,蛋白提取率为83.96%,仅次于峰值,因此选择60℃为最佳酶解温度。
2.1.4 酶解时间对蛋白提取率和蛋白纯度的影响
取8.0 g核桃蛋白,在加酶量80 U/g、料液比1∶10、酶解温度60℃、酶解pH 4.0的条件下,调节酶解时间分别为10、20、30、40、50、60 min,探究酶解时间对核桃蛋白提取率和蛋白纯度的影响,结果如图4所示。
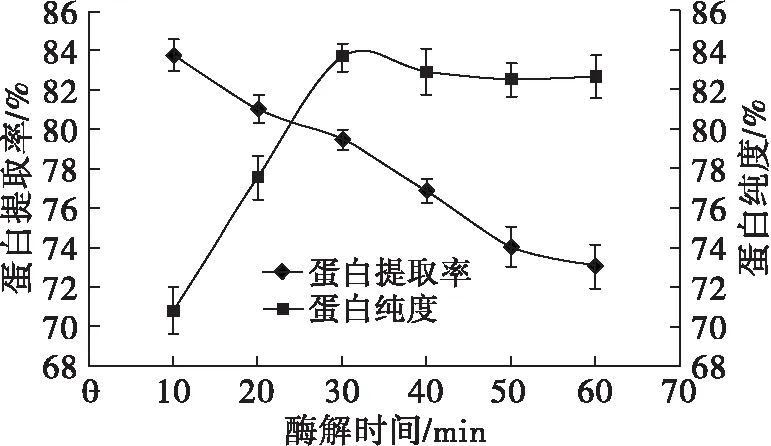
图4 酶解时间对蛋白提取率和蛋白纯度的影响
由图4可见,随着酶解时间的延长,蛋白提取率逐渐降低,从83.72%下降到73.08%,下降了10.64百分点,而核桃蛋白纯度呈先显著增加后趋于稳定的趋势,特别是在酶解时间30 min之后,蛋白纯度不再增加。这可能是由于初始酶解时,核桃蛋白的溶出速率较大,但随着酶解时间的延长,整个体系黏度增大,未溶出的核桃蛋白在传质过程中受到黏度的牵制,其溶出速率减慢,糖化酶酶解达到饱和后蛋白纯度不再提高。酶解30 min时,蛋白纯度为83.64%,而提取率为79.48%,也相对较高。因此,综合考虑选择最佳酶解时间为30 min。
2.1.5 酶解pH对蛋白提取率和蛋白纯度的影响
取8.0 g核桃蛋白,在加酶量80 U/g、料液比1∶10、酶解温度60℃、酶解时间30 min的条件下,调节酶解pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0,探究酶解pH对核桃蛋白提取率和蛋白纯度的影响,结果如图5所示。

图5 酶解pH对蛋白提取率和蛋白纯度的影响
由图5可见,随着酶解pH的增大,核桃蛋白提取率和蛋白纯度都呈先上升后下降的趋势,两者都在pH为4.0时达到最大,分别为83.72%和82.64%。这可能是由于糖化酶的最适pH在4.0左右,pH过高或过低都会降低糖化酶的活性,导致蛋白提取率和纯度下降。因此,选择pH 4.0为最佳酶解pH。
2.2 核桃蛋白纯化的正交实验
在单因素实验的基础上,选择酶解温度(A)、酶解pH(B)、酶解时间(C)、加酶量(D)和料液比(E)5个因素为考察对象,蛋白纯度为指标,设计L16(45)正交实验优化酶解工艺参数,正交实验设计及结果见表1。

表1 正交实验设计及结果
由表1可知,5个因素对蛋白纯度影响大小顺序为A>C>B>D>E,即酶解温度>酶解时间>酶解pH>加酶量>料液比。
蛋白纯度直观图如图6所示。由图6可知:酶解温度以55℃最佳;酶解pH以4.0最佳;酶解时间以40 min最佳;虽然图中加酶量100 U/g最佳,但与80 U/g的结果相差不大,且通过极差分析发现,加酶量对蛋白纯度的影响不大,从节约资源的角度出发,加酶量以80 U/g最佳;料液比以1∶8最佳。因此,理论最优方案为A2B2C3D2E1。通过3次平行实验发现,理论最优方案的蛋白纯度为93.86%,蛋白提取率为91.06%,略差于实验组的最优方案A2B4C3D2E1下的结果(蛋白纯度为94.37%,蛋白提取率为91.77%)。因此,以实验组的条件为最优方案,即酶解温度55℃、酶解pH 5.0、酶解时间40 min、加酶量80 U/g、料液比1∶8,在此条件下蛋白纯度可达到核桃分离蛋白的标准。
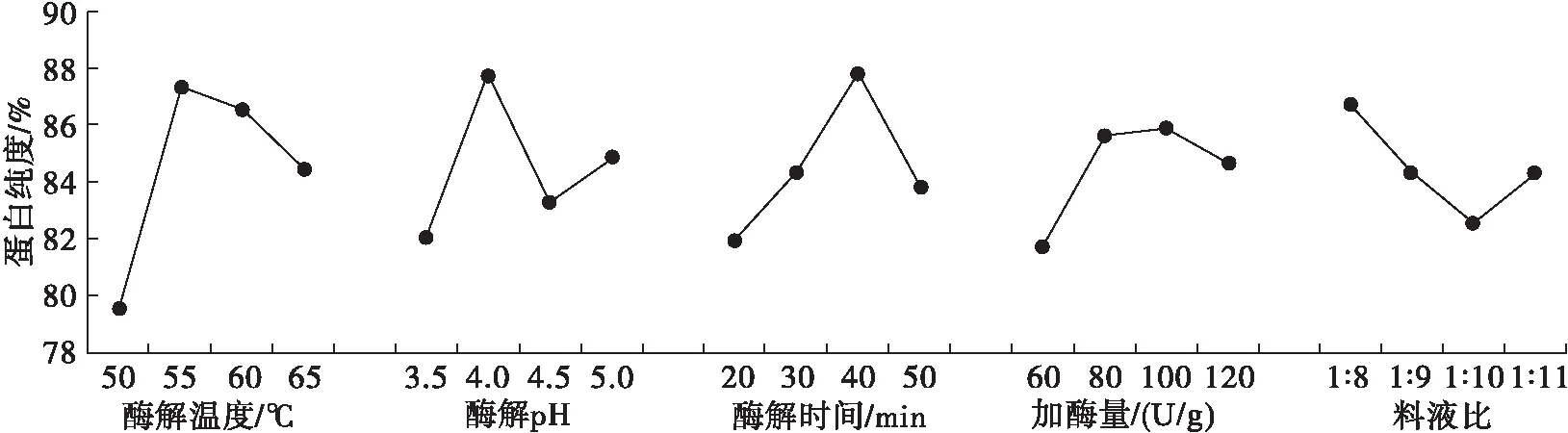
图6 蛋白纯度直观分析趋势图
2.3 核桃分离蛋白与低变性核桃蛋白粉的氨基酸组成与功能特性比较
2.3.1 氨基酸组成比较
为了进一步验证制备的核桃分离蛋白品质,将最优条件下制备的核桃分离蛋白与仅由核桃仁脱脂制备的低变性核桃蛋白粉进行比较。核桃分离蛋白与低变性核桃蛋白粉的氨基酸组成比较结果见表2。

表2 核桃分离蛋白和低变性核桃蛋白粉的氨基酸组成及含量 g/100 g
由表2可知,核桃分离蛋白和低变性核桃蛋白粉的氨基酸组成都较为全面,均含有7种人体必需氨基酸(色氨酸未测),证明了核桃是一种优质的蛋白来源。其中,核桃分离蛋白的氨基酸总量高达94.93 g/100 g,必需氨基酸含量为22.29 g/100 g,均高于低变性核桃蛋白粉(氨基酸总量52.33 g/100 g,必需氨基酸含量16.49 g/100 g)。此外,对人体有着重要生理功能的谷氨酸、天冬氨酸、精氨酸含量均高于低变性核桃蛋白粉。
2.3.2 持水性比较
核桃分离蛋白和低变性核桃蛋白粉随着温度变化的持水性比较如图7所示。由图7可知,随着温度的升高,核桃分离蛋白和低变性核桃蛋白粉的持水性都先上升后下降,在温度为50℃时,持水性都达到最大值,分别为3.72 g/g和1.83 g/g。对于核桃蛋白样品而言,温度升高会增加蛋白质分子的延展性,利于水分的吸收;但当温度持续升高后,蛋白质的热变性程度增加,蛋白质分子的氢键和离子基团水合作用减弱,使其吸水性降低。而在相同温度条件下,核桃分离蛋白的持水性始终优于低变性核桃蛋白粉。说明经过糖化酶纯化后,核桃分离蛋白的持水性得到了提升。
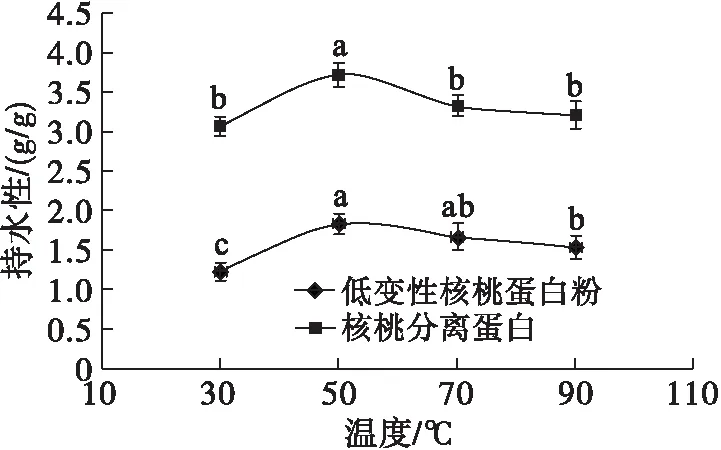
注:图中同一曲线不同字母表示差异显著(p<0.05)。下同图7 核桃分离蛋白和低变性核桃蛋白粉的持水性比较
2.3.3 吸油性比较
核桃分离蛋白和低变性核桃蛋白粉随着温度变化的吸油性比较如图8所示。由图8可知,随着温度的升高,核桃分离蛋白和低变性核桃蛋白粉吸油性都先上升后下降。而核桃分离蛋白的变化程度明显大于低变性核桃蛋白粉,在温度为50℃时,核桃分离蛋白和低变性核桃蛋白粉的吸油性都达到最大值,分别为1.57 g/g和0.62 g/g。对于核桃蛋白样品而言,当温度高于50℃时,油脂黏度下降,流动性增大,蛋白质分子间的吸附作用减弱,吸油性变差。而在相同温度条件下,核桃分离蛋白的吸油性始终优于低变性核桃蛋白粉。说明经过糖化酶纯化后,核桃分离蛋白的吸油性得到了提升。

图8 核桃分离蛋白和低变性核桃蛋白粉的吸油性比较
2.3.4 乳化性比较
核桃分离蛋白和低变性核桃蛋白粉随着pH变化的乳化性比较如图9所示。由图9可知,随着pH的增加,核桃分离蛋白和低变性核桃蛋白粉的乳化性都呈先略微下降后显著上升的趋势。而核桃分离蛋白的上升程度明显大于低变性核桃蛋白粉,在pH为9.0时,核桃分离蛋白和低变性核桃蛋白粉的乳化性都达到最大值,分别为57.60%和21.22%。蛋白质分子中存在大量亲水或亲油的基团,这些基团在乳化体系形成过程中起到了乳化作用,核桃蛋白的等电点在5.0左右,当溶液体系接近等电点时,蛋白质分子所带电荷为零,蛋白质表面无法形成水化层,使得乳化粒子发生絮凝和聚集作用,乳化性能降低;当溶液体系在非等电点时,蛋白质溶解性增加,乳化程度升高。而在相同pH条件下,核桃分离蛋白的乳化性始终优于低变性核桃蛋白粉。说明经过糖化酶纯化后,核桃分离蛋白的乳化性得到了提升。

图9 核桃分离蛋白和低变性核桃蛋白粉的乳化性比较
3 结 论
本研究采用糖化酶酶解纯化核桃蛋白制备核桃分离蛋白。通过单因素实验,分析加酶量、料液比、酶解温度、酶解时间和酶解pH 5个因素对核桃蛋白提取率和纯度的影响,并采用正交实验优化了工艺条件,最终得到了最佳工艺条件为加酶量80 U/g、料液比1∶8、酶解温度55℃、酶解时间40 min、酶解pH 5.0,在此条件下蛋白纯度为94.37%,符合核桃分离蛋白标准。通过比较核桃分离蛋白和低变性核桃蛋白粉的氨基酸组成及功能特性发现,核桃蛋白的氨基酸组成全面,含有7种人体必需氨基酸,且核桃分离蛋白的氨基酸总量和必需氨基酸含量均高于低变性核桃蛋白粉,且核桃分离蛋白产品持水性(3.72 g/g)、吸油性(1.57 g/g)和乳化性(57.60%)皆优于低变性核桃蛋白粉,说明制备的核桃分离蛋白具有良好的品质及功能特性。

