基于粒径及温度效应的纳米MoS2热力学性质探究
何念新, 施晴晴, 颜芷玉, 王异, 林宗畅, 蓝芝文, 谭秀娘, 黄在银,2*
(1.广西民族大学 化学化工学院, 广西 南宁 530008 2.广西高校食品安全与药物分析化学重点实验室, 广西 南宁 530008)
0 引言
近年来,石墨烯基器件的成功制造激发了人们对石墨烯类层状材料的研究兴趣。过渡金属二卤族化合物由碳以外的元素组成,有望获得一些不同寻常的性能。其中二硫化钼(MoS2)是一种典型的层状过渡金属二卤代化合物,被研究人员广泛研究。层状MoS2层与层之间黏合性特别弱,并且其单层结构由微弱的范德华键连接形成。减小颗粒粒径可以显著改善MoS2的黏合性、覆盖性和耐磨性,因此在电子晶体管[1]、加氢脱硫催化剂[2]、析氢催化剂[3]、储氢催化剂[4]、摩擦学润滑剂[5]和场发射[6],以及超级电容器[7-8]和锂电池的电极组件[9]等领域得到广泛应用。此外,MoS2纳米材料在催化、电子和光学等领域也有应用。同时,相关文献还报道了具有纳米管[10]、空心纳米球[11]、花状微球[12]、纳米棒[13]和纳米片[14]等多种形貌的MoS2纳米材料。在各种形貌中,MoS2纳米粒子因具有不同于块体材料的独特的物理化学性质而具有广阔的应用前景,因此,纳米MoS2的可控合成具有重要意义。
MoS2是二维材料研究领域里重要材料,具有独特的物理化学性质。MoS2纳米材料在电学、力学、催化[15]、光学[16]、吸附[17-18]和储能等多个领域已得到了广泛而深入的研究,而利用电位对MoS2热力学性质的研究却十分欠缺。热力学性质[19]是纳米材料的基本属性。表面熵、表面吉布斯自由能和表面焓等表面热力学特性,是纳米材料的重要研究数据。热力学的研究和化学反应热力学的研究,在全世界具有巨大的影响力。纳米材料的特性在很大程度上取决于其自身的粒径、形貌与结构。相关研究表明,反应物表面的原子也参与化学反应,极大地增加反应物的能量,对反应过程中的表面熵、表面焓和表面吉布斯自由能均有不同程度的影响,因此,探索纳米材料表面热力学性质的粒径、形貌、结构和温度效应[20]进行理论分析,是当前纳米热力学和表面化学研究的热点。
结合本课题组前期对多种纳米材料热力学性质的研究基础,本文采用溶剂热法,通过控制表面活性剂的量合成不同粒径的MoS2纳米材料,在不同温度下测定电导率数值研究粒径和温度对MoS2纳米材料热力学性质的影响。
1 基本原理
1.1 溶解热力学函数
根据标准溶解平衡常数公式[21],可以得到标准摩尔溶解吉布斯能为ΔGӨm
ΔGӨm=-RTlnKӨ。
(1)
在恒定温度和压力下,根据下式计算标准摩尔溶解焓和标准摩尔溶解熵:
ΔGӨm=ΔHӨm-TΔSӨm。
(2)
通过绘制恒压下的ΔGӨm对T的关系图,曲线截距为实验温度范围内的平均标准摩尔溶解焓ΔHӨm,斜率的负数为曲线线性关系良好时的平均摩尔标准摩尔溶解熵ΔSӨm。
标准溶解焓在温度变化范围不大时,可视为该温度范围内的平均值,可以通过溶解平衡常数和温度的关系线性回归计算。
1.2 表面热力学函数

GS=4πσr2N,
(3)
(4)
(5)

(6)
(7)
式中α、T分别为纳米颗粒的体积膨胀系数、热力学温度。
(8)
(9)
由此得到的摩尔表面热力学性质为偏摩尔表面热力学性质。因为纳米粒子的溶解过程是特殊的过程,所以它的摩尔表面热力学性质也可以看成是偏摩尔表面热力学性质,但是,对于不同粒径的纳米颗粒的溶解过程,其偏摩尔表面热力学性质不等于摩尔表面热力学性质。
结合本课题组前期工作,可以得到纳米粒子的吉布斯能、焓以及熵全部存在于其体相中[22],而块体的标准摩尔溶解热力学函数与纳米材料的标准摩尔溶解热力学函数之差就是纳米粒子的偏摩尔表面热力学函数,即
(10)
(11)
(12)

1.3 规定热力学函数
根据本课题组的前期工作[23-24]可知:纳米颗粒由体相加表面相组成,忽略块体的表面相,假设纳米颗粒的体相和块体的体相相同,同理推导得到
(13)
(14)
(15)
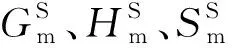
2 实验
2.1 材料与仪器
乙醇(分析纯,C2H5OH);聚乙烯吡咯烷酮(分析纯,PVP);二水合钼酸钠(分析纯,Na2MoO4·2H2O)、L-半胱氨酸(分析纯,C3H7NO2S)均购自上海麦克林生化科技有限公司。不同粒径的MoS2为实验室自主合成。X射线衍射仪(美国AMC公司,Philips PW1710型),(CuKα射线,λ=0.154 06 nm)。
2.2 纳米MoS2的制备与表征
将一定量Na2MoO4·2H2O溶解于去离子水中,用浓度为0.1 mol/L的NaOH调节溶液至pH=6.5,再添加一定量L-半胱氨酸与不同量的PVP,搅拌5 min后将溶液转移到含有聚四氟乙烯内衬的高压釜中,密封并在180 ℃的烘箱中持续加热48 h。反应结束后收集产物。分别用蒸馏水、C2H5OH洗涤数次,并在80 ℃的真空烘箱中持续干燥12 h。用XRD对制备的样品进行表征,并采用Scherrer公式计算纳米MoS2的平均粒径。随后使用高精度、高灵敏度的恒温水槽和电导率仪,在不同温度下测定不同粒径纳米MoS2的电导率数据。
3 结果与讨论
3.1 MoS2的表征
5个产物的XRD图谱如1所示。可以看出,所有的衍射峰都与纯六方相MoS2(JCPDS No.37-1492)相匹配,表明所制备的物质为MoS2。值得注意的是,衍射峰都很宽,源于晶体的粒径很小。根据XRD图谱结合Scherrer公式计算出每个产物对应的粒径,结果显示所制备产物粒径均小于10 nm。

图1 纳米MoS2的XRD图谱
3.2 标准摩尔溶解热力学函数的粒径和温度效应
3.2.1 标准摩尔溶解热力学函数的粒径效应
由式(1)、(2)计算得到标准摩尔溶解热力学函数,并将计算结果对粒径的倒数进行拟合(图2)。如图所示,MoS2的标准摩尔溶解吉布斯能与粒径的倒数存在良好的线性关系,且随着粒径的增大而增大,表明粒径大的MoS2纳米材料在溶解时比粒径小的MoS2纳米材料需要更多的能量。

(a)标准溶解吉布斯能
MoS2的标准摩尔溶解焓和标准摩尔溶解熵均与粒径的倒数存在良好的线性关系,且均随粒径的增大而增大。此结论与前述的理论部分完全符合。
3.2.2 标准摩尔溶解热力学函数的温度效应
将式(1)、(2)计算得到标准摩尔溶解函数的结果对温度进行拟合(图3)。

(a)标准溶解吉布斯能
如图所示,MoS2标准摩尔溶解吉布斯能与温度存在着良好的线性关系,且随着温度的升高而增大,说明温度的升高给纳米MoS2的溶解提供了更多的能量,使溶解过程更容易发生。此结论与前述理论部分完全符合。
同样,MoS2的标准摩尔溶解焓和标准摩尔溶解熵均与温度存在良好的线性关系,且均随着温度的升高而减小。此结论与前述的理论部分完全符合,说明温度越高而熵的变化越小,原因是升温过程中混乱度本来就很大,吸收同样多的热量只能使混乱度略微增加。
3.3 偏摩尔表面热力学函数的粒径和温度效应
3.3.1 偏摩尔表面热力学函数的粒径效应
由式(10)—(12)计算得到偏摩尔表面热力学函数,并将算出的结果对粒径的倒数进行拟合(图4)。

(a)偏摩尔表面吉布斯能
由图可知,纳米MoS2的偏摩尔表面吉布斯能、偏摩尔表面焓和偏摩尔表面熵均与粒径的倒数存在良好的线性关系,且均随着粒径的增大而减小。原因是标准摩尔溶解吉布斯能随着粒径的增大而增大,而当温度一定时块体MoS2的标准摩尔溶解吉布斯能数值是固定的,导致纳米MoS2的偏摩尔表面吉布斯能随着粒径的增大而减小。偏摩尔表面焓和偏摩尔表面熵的变化原因与偏摩尔表面吉布斯能同理。
3.3.2 温度对偏摩尔表面热力学函数的影响
将式(10)—(12)计算得到偏摩尔表面热力学函数的结果对温度进行拟合(图5)。

(a)偏摩尔表面吉布斯能
由图5可知,MoS2的偏摩尔表面吉布斯能、偏摩尔表面焓和偏摩尔表面熵均与温度存在着良好的线性关系,且均随着温度的升高而减小,说明随着温度的升高,纳米MoS2的表面化学势逐渐减小。由此得出结论与前面理论部分推导相一致。结合理论部分和图5可知,在MoS2溶解过程中,块体MoS2和纳米MoS2的标准摩尔溶解焓和标准摩尔溶解熵均随着温度的升高而减小,导致纳米MoS2的偏摩尔表面焓和偏摩尔表面熵的值均减小。
3.4 摩尔表面热力学函数的粒径和温度效应
3.4.1 摩尔表面热力学函数的粒径效应
结合理论计算,根据溶解过程中偏摩尔表面热力学函数与表面热力学函数之比为2∶3推导得到纳米MoS2摩尔表面热力学函数,并将所得结果与粒径的倒数进行拟合(图6)。

(a)摩尔表面吉布斯能
由图可知,MoS2的摩尔表面吉布斯能、摩尔表面焓和摩尔表面熵均与粒径的倒数存在着良好的线性关系,且均随着粒径的减小而增大,原因可能是颗粒减小到纳米级时,比表面积的急剧增加,以及表面原子占原子总数比例的增大,因为表面原子处于亚稳态,邻接配位较低,应力不均匀,表面张力、混乱度和内能增大,所以摩尔表面吉布斯能、摩尔表面焓和摩尔表面熵增大。
3.4.2 摩尔表面热力学函数的温度效应
结合理论计算,根据溶解过程中偏摩尔表面热力学函数与表面热力学函数之比为2∶3推导得到纳米MoS2的摩尔表面热力学函数,并将所得结果与温度进行拟合(图7)。

(a)摩尔表面吉布斯能
由图7可知,MoS2的摩尔表面吉布斯能、摩尔表面焓和摩尔表面熵均与粒径倒数存在着良好的线性关系,且均随着温度的升高而减小。可能的原因是,当温度升高时表面原子热运动增强,同时系统动能和势能等内能增大,系统中原子无序程度也增大,导致摩尔表面焓和摩尔表面熵均增大。
3.5 等压摩尔表面热容的粒径和温度效应
结合理论计算,将恒压条件下的摩尔表面焓对温度进行求偏导可得到等压摩尔表面热容,并将所得结果与粒径的倒数进行拟合(图8)。
由图8可知,纳米MoS2的等压摩尔表面热容与粒径倒数存在着良好的线性关系,且随着粒径的增大而减小。纳米MoS2的摩尔表面热容与温度存在着良好的线性关系,且随着温度的增大而减小。

(a)粒径倒数
3.6 粒径对规定摩尔热力学函数的影响
根据兰氏化学手册查到的块体MoS2在热力学温度298.15 K时的规定摩尔热力学函数,结合式(13)—(15)可计算出纳米各粒径MoS2的规定摩尔热力学函数。将所得计算结果与粒径的倒数进行拟合(图9)。由图可知,298.15 K时纳米MoS2的规定摩尔吉布斯能的绝对值和规定摩尔焓的绝对值均随着粒径的增大而增大,而纳米MoS2的规定摩尔熵随着粒径的增大而减小,表明当物质的粒径不同时,系统对环境做的有用功越多,释放的热量越多。系统的混乱度越小,大粒径系统越稳定,充分说明了随着颗粒粒径的减小,MoS2表面暴露的原子比例和活性位点数量增加。

(a)规定摩尔吉布斯能
4 结论
本文中采用溶剂热法并通过调控表面活性剂的用量,制备了一系列不同粒径的纳米MoS2颗粒。运用X射线粉末衍射仪表征MoS2的物相,并通过Scherrer公式计算了纳米MoS2的平均粒径。实验使用高精度、高灵敏度的恒温水槽和电导率仪,测定不同粒径的MoS2在不同温度条件下的电导率数值,根据溶解热力学理论计算不同粒径MoS2在不同温度下的热力学性质,结果表明:
① 纳米MoS2的标准摩尔溶解吉布斯能、标准摩尔溶解焓和标准摩尔溶解熵均随着粒径的增大而增大,而摩尔表面吉布斯、摩尔表面焓、摩尔表面熵和等压时的摩尔表面热容均随着粒径的增大而减少;
② 纳米MoS2的标准摩尔溶解焓、标准摩尔溶解熵、摩尔表面吉布斯能、摩尔表面焓、摩尔表面熵和等压时的摩尔表面热容均随着温度的升高而减小,而标准摩尔溶解吉布斯能却随着温度的升高而增大。
该热力学关系可方便地用于预测和解释纳米晶体在化学反应、相变、催化、吸附和溶解等过程中粒度对热力学性质的影响规律,具有重要参考价值。

