低氧环境下HLA-G及EPAS1参与大鼠子痫前期发病机制研究
谢莹莺,马 萌,赵海宁,徐梦婷,何岑盈,孙春蕾,许文宇
高原地区有低压、缺氧、寒冷、强紫外线辐射等特点,其中最重要的是低氧环境,易诱发子痫前期(preeclampsia,PE)。该课题组前期研究[1]发现,低氧条件下通过小分子干扰RNA抑制绒毛膜滋养细胞系JEG-3细胞人类白细胞抗原-G(human leukocyte antigen-G,HLA-G)的表达,可能影响滋养细胞的增殖及侵袭能力,参与妊娠期高血压疾病的发生。内皮PAS结构域包含蛋白1(endothelial PAS domain-containing protein 1,EPAS1)是细胞在缺氧应答反应中最重要的调节因子之一。依据EPAS1的生物学特性,可将EPAS1低氧信号通路作为主要细胞信号通路,通过大鼠实验来明确HLA-G、EPAS1蛋白参与高原低氧环境下子痫前期发病的分子机制。故该研究建立PE孕鼠模型,在模拟低氧环境下研究低氧环境对正常妊娠和PE孕鼠血压、24 h尿蛋白、血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)、白蛋白(albumin,ALB)、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)值的影响及胎盘HLA-G蛋白和EPAS1蛋白表达变化,探讨低氧环境下孕鼠胎盘HLA-G、EPAS1低氧反应通路对子痫前期的影响。
1 材料与方法
1.1 实验动物雌性和雄性SD大鼠,10~12周龄,体质量(230±20)g,SPF级,购于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006]。SD大鼠于动物饲养中心适应性喂养1周后,于下午18点将雌鼠与雄鼠按2 ∶1合笼,次日上午8点观察受孕情况,以观察到阴道栓日为妊娠第1天。本实验通过了青海大学附属医院伦理委员会的伦理审查(伦理批号:P-SL-2017064)。
1.2 方法
1.2.1实验分组 观察到孕栓的大鼠随机分为常氧组(5只正常妊娠孕鼠,5只PE模型孕鼠,共10只),急性低氧组:分48 h、72 h 和1周三个时间点,(每个低氧时间点包括5只正常妊娠孕鼠、5只PE模型孕鼠,共30只),慢性低氧组:分2周、3周两个时间点(每个低氧时间点包括5只正常妊娠孕鼠、5只PE模型孕鼠,共20只)。因大鼠平均孕期在22 d左右,低氧48 h处理孕鼠于妊娠第19天放置低压氧舱中(模拟5 000 m海拔,氧浓度12%左右),低氧72 h处理孕鼠于妊娠第18天放置低压氧舱中,低氧1周处理孕鼠于妊娠第14天放置低压氧舱中,低氧2周处理孕鼠于妊娠第7天放置低压氧舱中,低氧3周处理孕鼠于妊娠第1天放置低压氧舱中,这样检测孕鼠胎盘因子表达结果时,孕鼠都处于妊娠晚期,可消除妊娠不同时期胎盘因子的变化对实验结果的影响。低氧处理期间每日固定时间喂水,喂食。
1.2.2PE造模 孕鼠于妊娠第11天开始,使用亚硝基左精氨酸甲酯 (N-nitro-L-arginine methylester, L-NAME)溶液(美国SIGMA公司)0.25 g/(kg·d)腹腔注射,共7 d,正常妊娠孕鼠于妊娠第11天开始规律腹腔注射同剂量生理盐水,共7 d。低氧48 h、72 h模型组大鼠为造模成功后放置低压氧舱中,低氧1周、2周、3周模型组大鼠为低氧处理同时腹腔注射L-NAME。所有孕鼠于妊娠第9天和妊娠第21天运用大鼠鼠尾无创血压仪(安徽正华生物仪器设备有限公司)测量血压;分别于妊娠第9天和妊娠第21天放入代谢笼中,禁食不禁水,收集孕鼠24 h尿液。运用全自动生化分析仪测量24 h尿蛋白总量。
目前国内外尚无统一的动物子痫前期诊断标准,本实验按收缩压和(或)舒张压达到140 mmHg和(或)90 mmHg[2],造模前后24 h尿蛋白明显升高为造模成功。
1.2.3肝、肾功能检测 于妊娠第21天,使用20%乌拉坦按[梯希爱(上海)化成工业发展有限公司]5 ml/kg剂量腹腔注射麻醉后,留取下腔静脉血4 ml左右,全自动生化分析仪检测ALT、ALB、BUN、Cr值。
1.2.4免疫组化检测胎盘组织HLA-G、EPAS1蛋白表达 孕鼠麻醉后切开子宫,无菌剪剪取适量胎盘组织,放至甲醛溶液(中性)中固定。免疫组化检测胎盘组织中HLA-G、EPAS1低氧反应通路蛋白表达。

2 结果
2.1 大鼠无创血压仪测量血压值妊娠第1天,各组孕鼠平均收缩压与舒张压差异无统计学意义(P>0.05)。妊娠第21天,各组孕鼠平均收缩压与舒张压均有差异,且差异有统计学意义(P<0.05),其中,与同条件正常妊娠孕鼠比较,各PE组平均收缩压、舒张压均升高,差异有统计学意义(P<0.05),PE孕鼠造模成功;各正常妊娠低氧组、PE低氧组孕鼠平均收缩压、舒张压分别与对应常氧组比较差异无统计学意义(P>0.05),即低氧处理对孕鼠血压无影响,见表1。
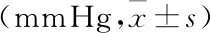
表1 各组孕鼠收缩压、舒张压变化
2.2 全自动生化分析仪测量24h尿蛋白总量妊娠第1天,各组孕鼠24 h尿蛋白差异无统计学意义(P>0.05)。妊娠第21天,各组孕鼠24 h尿蛋白间差异有统计学意义(P<0.05),其中,与同条件正常孕鼠比较,各PE组24 h尿蛋白增加,差异有统计学意义(P<0.05),即注射L-NAME溶液后孕鼠24 h尿蛋白增加;各正常妊娠低氧组、PE低氧组孕鼠24 h尿蛋白与同条件常氧组比较均差异无统计学意义(P>0.05),即低氧处理对正常妊娠孕鼠、PE孕鼠24 h尿蛋白无影响,见表2。
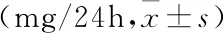
表2 各组孕鼠24h尿蛋白变化
2.3 全自动生化分析仪检测ALT、ALB、BUN、Cr值各组孕鼠ALT、BUN值比较差异有统计学意义(P<0.05),其中低氧环境下正常妊娠孕鼠ALT、BUN值均呈一过性改变,ALT值在低氧72 h后开始上升,低氧1周、2周升高达最大值,低氧3周下降,但仍比常氧组和低氧48 h组增高(P<0.05);BUN值在低氧48 h后即开始升高,至低氧1周达最大值,低氧2周、3周降低,但仍比常氧组稍高(P<0.05),PE组ALT、BUN值呈相同趋势;各低氧时间点的PE组ALT、BUN值与同条件正常妊娠组比较,差异无统计学意义(P>0.05),即注射L-NAME对孕鼠ALT、BUN值无影响。各组孕鼠ALB、Cr值比较均差异无统计学意义(P>0.05),即低氧处理和注射L-NAME溶液对正常妊娠孕鼠和PE孕鼠ALB、Cr值无影响,见表3。
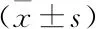
表3 各组孕鼠ALT、ALB、BUN、Cr值变化
2.4 各组孕鼠胎盘组织HLA-G蛋白表达每张免疫组化片子里随机选取20个高倍视野,每组5张片子,共100个视野进行统计分析。HLA-G蛋白主要表达于胎盘滋养细胞的胞质和胞膜中(见图1A、B)。低氧环境下正常妊娠组内胎盘组织HLA-G蛋白表达比较,差异有统计学意义(χ2=201.62,P<0.001)、PE组内比较差异亦有统计学意义(χ2=159.74,P<0.001),说明低氧环境影响HLA-G蛋白表达;正常妊娠组组内比较,胎盘HLA-G蛋白表达阳性率在低氧48 h、72 h处理后下降,低氧1周处理后阳性率较低氧48 h、72 h增加,但仍低于常氧水平,至低氧2周、3周阳性率与常氧无差异,PE组组内比较胎盘HLA-G蛋白阳性表达率呈相同趋势。各PE组孕鼠胎盘HLA-G蛋白表达阳性率与同条件正常妊娠组孕鼠比较,HLA-G蛋白表达阳性率均下降,差异有统计学意义(P<0.05),即PE孕鼠胎盘HLA-G蛋白阳性表达率低于正常妊娠孕鼠,见表4。
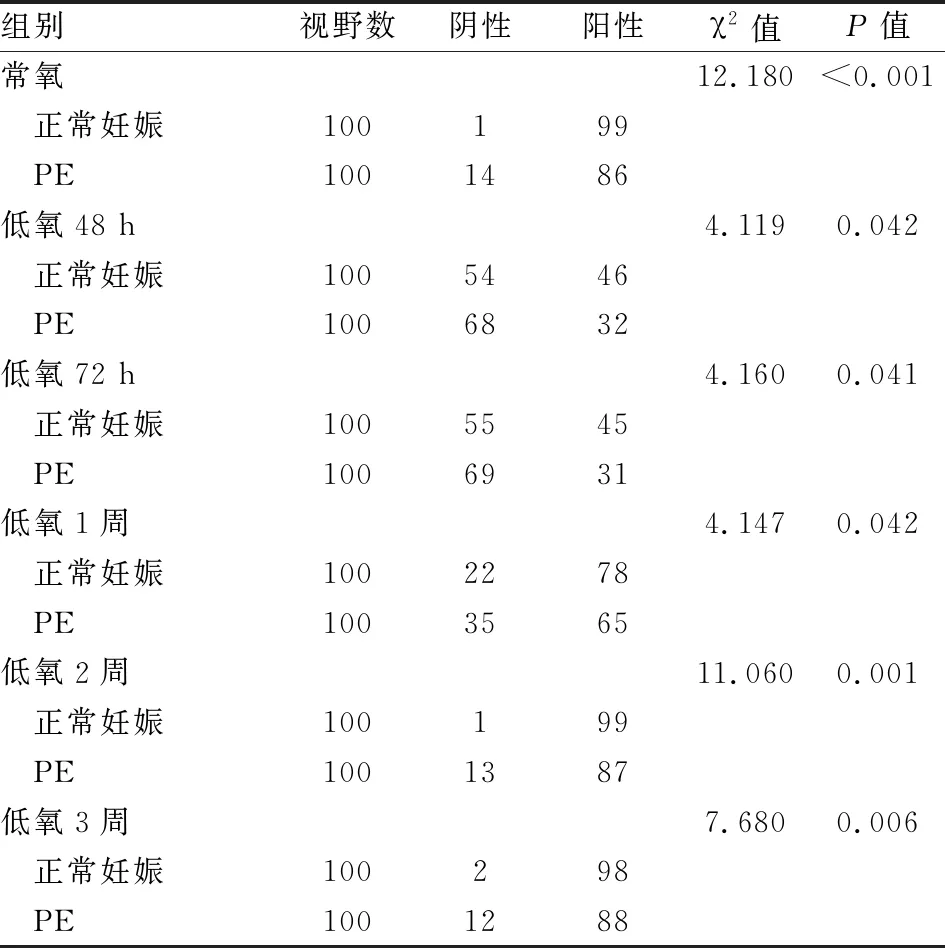
表4 低氧环境孕鼠HLA-G蛋白表达变化
正常妊娠组和PE组孕鼠组内两两比较调整检验水准=0.05/15=0.003 3。正常妊娠组组内比较总χ2=194.609,P=0.000,PE组组内比较总χ2=162.232,P=0.000,两组组内均是除低氧48 h组vs低氧72 h组、低氧2周组vs常氧组、低氧3周组vs常氧组、低氧2周组vs低氧3周组无差异,其余组间两两比较P均<0.003 3
2.5 各组孕鼠胎盘组织EPAS1蛋白表达EPAS1蛋白主要表达于滋养细胞胞核和胞质(见图1C、D)。低氧环境下正常妊娠组内胎盘组织EPAS1蛋白表达比较,差异有统计学意义(χ2=229.04,P=0.000)、PE组内比较差异亦有统计学意义(χ2=245.73,P=0.000),说明低氧环境下EPAS1蛋白表达水平升高;正常妊娠组组内比较,胎盘EPAS1蛋白表达阳性率在低氧48 h、72 h处理后阳性率上升,低氧1周处理后阳性率下降,至低氧2周、3周阳性率与常氧无差异,PE组组内比较胎盘EPAS1蛋白阳性表达率呈相同趋势。各PE组孕鼠胎盘EPAS1蛋白表达阳性率与同条件正常妊娠组孕鼠比较,EPAS1蛋白表达阳性率均上升,差异有统计学意义(P<0.05)。即PE孕鼠胎盘EPAS1蛋白阳性表达率高于正常妊娠孕鼠,见表5。

图1 HLA-G蛋白与EPAS1蛋白免疫组化表达部位 SP×400
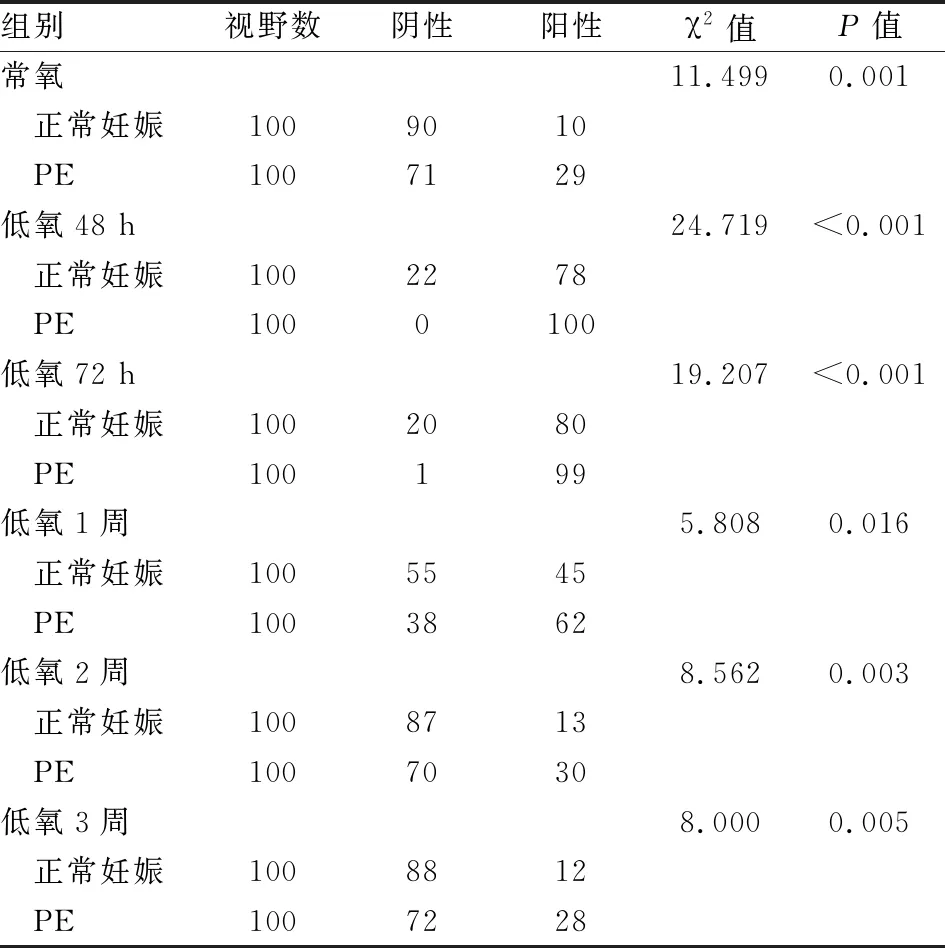
表5 低氧环境孕鼠EPAS1蛋白表达变化
3 讨论
3.1 高原低氧环境与PE的关系高原低氧是人类生存面临的最大环境威胁之一,缺氧是许多广泛存在的人类疾病的中心特征,而且高海拔会损害胎儿生长,增加PE的发病率,并因此增加围产期和/或产妇发病率和死亡率的风险[3]。众所周知,血管内皮细胞损伤是PE的基本病理变化之一,它使血正常妊娠组内和PE组孕鼠组内两两比较调整检验水准=0.05/15=0.003 3。正常妊娠组内比较总χ2=229.036,P=0.000,PE组组内比较总χ2=245.731,P=0.000,两组组内均是除低氧48 h组vs低氧72 h组、低氧2周组vs常氧组、低氧3周组vs常氧组、低氧2周组vs低氧3周组无差异,其余组间两两比较P均<0.003 3管扩张物质如一氧化氮等合成减少,从而促进血管痉挛。L-NAME作为一种一氧化氮合酶的抑制剂,可抑制一氧化氮产生,使动物模型的血流动力学发生了一系列变化,包括胎盘和肾脏缺血,缺氧症状,血管内皮损伤、氧化应激和炎症反应加剧,L-NAME诱发PE模型为研究PE的发病机制提供了强有力的工具[4]。本研究使用L-NAME溶液制作PE孕鼠模型,模拟海拔5 000 m高原低氧环境研究低氧对正常孕鼠及PE孕鼠的影响,结果显示低氧处理对孕鼠ALB、Cr值均无影响,ALT、BUN值于低氧48 h至72 h后开始上升,低氧1周、2周升高达最大值,可能是ALT、BUN值对缺氧的反应更为敏感。而低氧对孕鼠血压、尿蛋白无明显影响,不能体现高原地区对PE发病率的影响,可能与实验样本量不够大及大鼠在西宁地区(海拔2 200 m)适应性喂养1周有关。
3.2 低氧环境下大鼠胎盘组织HLA-G表达的影响HLA-G称为非经典的HLA-Ⅰ分子,区别于经典HLA分子,具有有限的基因多态性、限制性组织分布、特殊的选择性剪切模式的特点[5]。HLA-G分子的特点及功能决定了它必然在母胎免疫耐受方面具有关键性作用。首次对青海高原地区PE患者胎盘组织中HLA-G mRNA及蛋白进行定量分析发现,HLA-G基因转录的下调及其蛋白质表达下降,在青海高原地区PE的发生发展过程中可能发挥重要作用[6]。前期还研究了不同海拔PE患者HLA-G的表达,结果发现海拔的增高引起HLA-G低表达,可能是高原地区PE发病率高于平原地区的原因之一[7]。本研究中通过免疫组化研究了低氧环境下孕鼠胎盘HLA-G蛋白的表达,结果表明HLA-G蛋白在PE孕鼠胎盘阳性表达率明显降低,进一步通过动物实验验证了HLA-G可能参与PE的发病机制。另外胎盘HLA-G蛋白整体表达呈先下降后上升的动态变化。这与课题组前期低氧环境下细胞实验结果一致,低氧组在48 h及72 h,JEG-3细胞中HLA-G mRNA水平较常氧组降低[8]。急性低氧可能加重母体对胎盘产生免疫攻击性,但在机体适应低氧后,母体和胎盘免疫关系又恢复正常。
3.3 低氧环境下大鼠胎盘组织EPAS1表达的影响胎盘最初是在含氧量为1%的低氧环境中发育,直到怀孕10周后。在此期间,氧浓度对滋养细胞活性有重要影响,缺氧诱导因子被认为是影响妊娠早期滋养细胞生物学行为的重要调节因子之一[9]。其中HIF-1和 EPAS1是细胞在缺氧应答反应中最重要的调节因子。EPAS1又名缺氧诱导因子2(hypoxia inducible factor-2,HIF-2)。有研究报道低氧状态下为维持内皮细胞氧平衡,HIF-2α可能替代HIF-1α起作用,HIF-2α在长期慢性缺氧反应中起着重要作用,HIF-1α则与急性缺氧反应有关[10]。本研究发现,各PE组的孕鼠胎盘EPAS1蛋白阳性表达率较正常妊娠孕鼠高,EPAS1可能参与PE的发病机制。另外低氧环境下胎盘EPAS1蛋白整体表达呈先上升后下降的动态变化,这表明孕鼠在急性缺氧的48 h、72 h内对EPAS1蛋白的影响最大,从低氧1周开始由急性缺氧转为初期习服过程,至低氧2周、3周,尤其3周达到习服水平,与Ahmed et al[11]的研究结果一致,可能预示着PE的低氧细胞对缺氧的高选择性压力的反应,具有更高的遗传变异性,这可能导致适应高海拔。
综上所述,HLA-G和EPAS1可能参与PE发病机制。本研究推测,HLA-G作为一种免疫抑制因子,急性低氧可能会下调HLA-G表达使母胎免疫失衡。在急性低氧环境下滋养细胞可能为了应对低氧使EPAS1表达增加,从而调节下游基因使血管生成增加,组织血供增加应对缺氧,在机体适应缺氧后EPAS1蛋白表达又恢复至正常水平,低氧环境下胎盘EPAS1的整体表达趋势可看作机体对低氧反应的适应。而HLA-G和EPAS1也可能存在某种关系,将下一步实验计划中尝试通过细胞实验检测沉默表达后HLA-G、EPAS1和其下游基因的变化,为PE的发病机制和治疗提供更好的依据。

