柚皮素对胰脂肪酶抑制作用的研究
沈彬,王松雪,张瑜,尚逢实,张馨月,王可心,刘素稳,范志光,王浩*
(1.中科兰丁(天津)自然医学研究院,天津 300308;2.天津科技大学食品科学与工程学院,天津 300457;3.河北科技师范学院食品科学与技术学院,河北 秦皇岛 066600)
世界肥胖人数持续上升,且发病人群开始低龄化,这已经成为一个全球范围内的健康问题[1]。多种疾病例如心脏病、糖尿病、动脉粥样硬化以及癌症,都与肥胖紧密相关[2]。寻找有效的代谢酶抑制剂是治疗由饮食引起的肥胖的有效方法之一,因为它能够阻止脂肪的吸收和消化。胰脂肪酶是消化膳食脂肪的关键酶,抑制胰脂肪酶活性以减少膳食甘油三酯的消化和吸收已成为近期药理学干预策略的重点[3]。一些降脂药物,如奥利司他可以通过抑制胃肠道的胰脂肪酶来阻止甘油三酯水解为游离脂肪酸和单酰基甘油酯,从而减少膳食中甘油三酯的吸收,促使其排出体外[4]。但是持续服用会带来诸多不良反应,如油性粪便、腹部不适、腹泻、直肠不适、头痛及疲乏等,甚至造成泌尿道感染[5]。因此,从天然产物中筛选得到更安全有效的胰脂肪酶抑制剂,成为预防和治疗肥胖的研究热点。
柚皮素(naringenin,NAR)是一种广泛存在于芸香科柑橘属植物中的天然二氢黄酮类化合物,多分布于葫芦巴、桑黄、荸荠、胡柚皮、华中冬青等植物和柚子等柑橘类水果中[6]。柚皮素因具独特的药理活性受到人们的广泛关注,它对多种疾病的治疗展现出可观的潜力,如降血压、抗糖尿病和降脂等[7]。据研究报道,柚皮素可以明显降低肥胖大鼠中的甘油三酯、胆固醇和游离脂肪酸的含量[8]。然而,柚皮素对胰脂肪酶活性的影响以及具体抑制机制还尚未报道。因此,本试验主要从酶学动力学、荧光猝灭以及分子对接3个方面研究柚皮素对胰脂肪酶的抑制机理,为开发天然降脂产品提供参考。
1 材料与方法
1.1 材料与试剂
猪胰腺脂肪酶(400 U/mg)、月桂酸4-硝基苯酯:美国Sigma Aldrich公司;Trition X-100:北京博奥拓达科技有限公司;柚皮素(纯度>98%)、二甲基亚砜、三羟甲基氨基甲烷(Tris):上海阿拉丁生化科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
UV-1800紫外可见光分光光度计:日本岛津公司;TP-144分析天平、UB-7 pH计:美国丹佛仪器有限公司;F-7100型荧光分光光度计:日本日立公司;HWS24电热恒温水浴锅:上海一恒科技有限公司;Legend Micro 17R离心机:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 柚皮素对胰脂肪酶活性的影响
柚皮素抑制胰脂肪酶活性的测定根据Qiu等[9]的方法稍加改动。胰脂肪酶溶解于0.1 mol/L Tris-HCl缓冲液(pH8.2)中。柚皮素溶解于含有10%二甲基亚砜的超纯水中。200 μL 不同浓度的柚皮素(0、0.3、0.5、0.8、1.0、2.0、4.0 mmol/L)、200 μL 胰脂肪酶溶液和 500 μL Tris-HCl缓冲溶液混合后于37℃孵育10 min。加入600 μL月桂酸4-硝基苯酯底物(0.8 mg/mL)在37℃反应20 min后,在沸水浴中终止反应10 min。空白溶液含有 700 μL Tris-HCl缓冲液、200 μL 胰脂肪酶溶液和600 μL月桂酸4-硝基苯酯底物。然后样品组和空白组均12 000 r/min离心6 min,取上清液,于405 nm波长下测定吸光度。奥利司他作为阳性对照。抑制率计算公式如下。

式中:A空白为空白组吸光度;A空白对照为空白对照组吸光度;A样品为样品组吸光度;A样品对照为样品对照组吸光度。
1.3.2 柚皮素对胰脂肪酶抑制的动力学分析
根据上述抑制胰脂肪酶活性的测定方法,进行动力学试验。可逆试验:固定底物浓度为0.8 mg/mL,不同浓度的柚皮素(0、1.0、2.5 mmol/L 和 4.0 mmol/L)分别与 0、3.0、4.0、5.0、6.0、7.0 mg/mL 和 8.0 mg/mL 浓度的胰脂肪酶混合。混合物和底物分别反应6、9、12、15、18、20、22、24 min 后 12 000 r/min离心 6 min,于 405 nm波长下测定吸光度。动力学试验:固定胰脂肪酶浓度为5 mg/mL,胰脂肪酶和不同浓度的柚皮素(0、1.0、2.5 mmol/L和4.0 mmol/L)混合。上述混合物与0.2、0.4、0.6、0.8、1.0 mg/mL 和 1.2 mg/mL 浓度的底物分别反应 6、9、12、15、18、20、22、24 min 后 12 000 r/min离心6 min,于405 nm波长下测定吸光度。通过双倒数作图,判断柚皮素抑制胰脂肪酶的抑制类型并求出酶抑制动力学常数。竞争性抑制分析方程式如下。
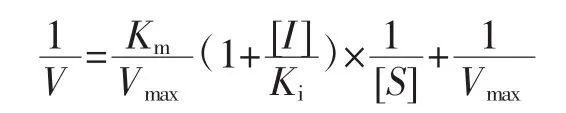
式中:V为酶反应速率,△吸光度/min;Vmax为最大酶反应速率,△ 吸光度/min;[S]为底物浓度,mg/mL;[I]为柚皮素浓度,mmol/L;Km为米氏常数;Ki为与游离酶的抑制常数。
1.3.3 荧光光谱分析
为判断柚皮素是否对胰脂肪酶的三级结构有影响,使用F-7100型荧光分光光度计扫描不同浓度柚皮素下胰脂肪酶荧光光谱,试验参考Du等[10]的方法并稍加修改。将0.2 mL不同浓度的柚皮素溶液(0.1、0.2、0.3、0.4、0.5、0.6、0.7 mol/L 和 0.8 mol/L)与 2.8 mL、10 mg/mL胰脂肪酶溶液混合。孵育5min后测定荧光强度。设置发射波长为300 nm~500 nm,激发波长280 nm,发射和激发的狭缝宽度固定在5 nm。
为进一步判断荧光猝灭的猝灭类型是静态猝灭还是动态猝灭,使用Stern-Volmer方程计算出Kq值[11],公式如下所示。

式中:F0和F分别为不存在和存在柚皮素时胰脂肪酶的荧光强度;Kq为猝灭速率常数,L/(mol·s);[Q]为柚皮素浓度,mol/L;τ0为无猝灭剂的荧光团荧光寿命,约为10-8s。
由于柚皮素和胰脂肪酶是静态猝灭,通过双对数回归图计算出柚皮素和胰脂肪酶复合物之间的结合位点数[12]。计算公式如下。
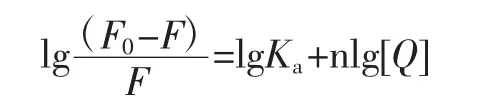
式中:n为结合位点;Ka为结合常数;F0和F分别为不存在和存在柚皮素时胰脂肪酶的荧光强度;[Q]为柚皮素浓度,mol/L。
通过同步荧光法检测柚皮素对胰脂肪酶的酪氨酸和色氨酸的影响。使用F-7100型荧光分光光度计在△λ=15 nm(酪氨酸)和△λ=60 nm(色氨酸)的波长间隔进行扫描。扫描△λ=15 nm时,设置发射波长为280nm,激发波长为265 nm~465 nm;△λ=60 nm时,设置发射波长为280 nm,激发波长为220 nm~440 nm。记录添加柚皮素(0~0.000 8 mol/L)后在胰脂肪酶氨基酸残基(酪氨酸和色氨酸)的同步荧光光谱。同步荧光柚皮素浓度(0~0.8 mol/L)。
1.3.4 分子对接模拟
利用分子对接软件Discover Studio 3.5预测柚皮素与胰脂肪酶的相互作用方式。从Chemical Book网站(https://www.chemicalbook.com)搜索小分子柚皮素构象。在“Small Molecules”模块下的“prepare ligands”进行小分子准备。胰脂肪酶的三维结构来源于蛋白质数据库(http://www.rcsb.org/pdb)(PDB ID:1LPB)。在进行对接前,去除蛋白质上的水分和配体,在“Macromolecules”模块下选择“prepare protein”进行蛋白准备。使用“From Current Selection”模块定义对接位点。蛋白与配体制备完成后选择“Dock Ligands”(CDOCKER)进行正式对接,并使用DS3.5获得二维构象图像。
1.4 数据统计
所有试验均重复3次,结果以平均值±标准差表示。用线性回归计算抑制动力学常数。荧光光谱使用Origin 9.0软件进行分析。
2 结果与讨论
2.1 柚皮素对胰脂肪酶的抑制作用
不同浓度的柚皮素对胰脂肪酶活性的抑制作用见图1。
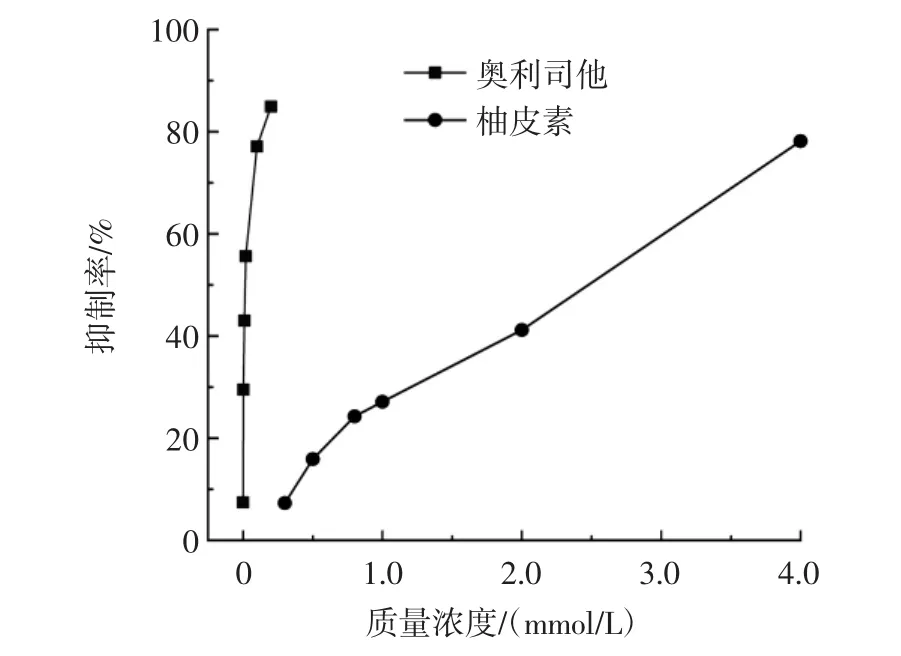
图1 柚皮素对于胰脂肪酶活性的抑制Fig.1 Inhibition of naringenin on pancreatic lipase activity
由图1可知,抑制率随着柚皮素或奥利司他浓度的增加而升高。柚皮素和奥利司他对胰脂肪酶抑制作用的半数抑制浓度分别为(2.413±0.160)mmol/L和(0.012±0.020)mmol/L。可见奥利司他在极低的浓度下抑制了酶的活性,推测奥利司他因为严重干扰正常的脂肪代谢,产生了一系列的副作用。虽然柚皮素对胰脂肪酶的抑制作用没有奥利司他强,但是它是一个无副作用天然产物,在开发抗肥胖产品方面能够起到重要的作用。
2.2 柚皮素对胰脂肪酶的抑制类型
酶活性的抑制通常有不可逆和可逆的抑制。不可逆抑制剂通过共价键与酶结合形成稳定的复合物并使酶失去活性,而可逆抑制剂通过非共价键和酶结合抑制了酶的活性[13]。柚皮素对胰脂肪酶的抑制作用类型结果见图2。

图2 柚皮素对胰脂肪酶的抑制类型Fig.2 Inhibitory types of naringenin on pancreatic lipase
由图2可知,所有线均通过原点,斜率随柚皮素浓度的增加而减小。柚皮素对胰脂肪酶的抑制作用呈浓度依赖性,柚皮素浓度越高,抑制活性越强。这表明柚皮素抑制胰脂肪酶的活性是通过降低其催化效率实现,而不是通过减少有效酶的数量。因此,柚皮素可逆地抑制胰脂肪酶的活性。
可逆性抑制可分为竞争性抑制、非竞争性抑制和混合竞争性抑制[13]。抑制类型由双倒数图上的交点确定[14]。柚皮素对胰脂肪酶双倒数图见图3。
由图3可知,所有直线在Y轴的正方向相交。Km和Vmax由公式计算得出,结果见表1。
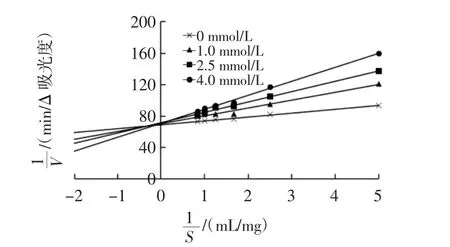
图3 柚皮素对胰脂肪酶双倒数图Fig.3 Lineweaver-Burk plot of naringenin on pancreatic lipase

表1 柚皮素对胰脂肪酶的Vmax和KmTable 1 Vmaxand Kmof naringenin on pancreatic lipase
由表1可知,随着柚皮素浓度的增加,Vmax保持不变,但Km增加。推测柚皮素对胰脂肪酶的抑制类型为竞争性抑制。表明柚皮素能与胰脂肪酶活性中心结合,改变胰脂肪酶与底物的亲和力。
2.3 荧光光谱试验
2.3.1 柚皮素对胰脂肪酶荧光猝灭效应
为进一步研究柚皮素与胰脂肪酶之间的相互作用,测定不同浓度柚皮素对胰脂肪酶的荧光光谱。一般来说,胰脂肪酶的氨基酸残基固有荧光的变化可以反映酶本身和周围环境的变化[15]。酶和抑制剂相互作用引起的发色团微环境变化可通过蛋白质的最大发射荧光强度进行评估[16]。不同浓度的柚皮素对胰脂肪酶的荧光猝灭见图4。
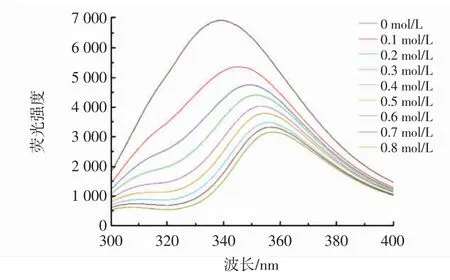
图4 不同浓度柚皮素对胰脂肪酶的荧光猝灭Fig.4 Fluorescence quenching of pancreatic lipase by naringenin at different concentrations
由图4可知,柚皮素浓度越高,对胰脂肪酶猝灭效果越强,胰脂肪酶的最大荧光发射波长由6 910 nm变为2 857 nm。可以预测,柚皮素与胰脂肪酶的相互作用会改变内源荧光的微环境。随着柚皮素浓度的增加,胰脂肪酶的最大发射峰从340 nm移动至358 nm,红移出现的原因可能是胰脂肪酶与柚皮素结合后,周围的氨基酸微环境(主要由色氨酸、酪氨酸和苯丙氨酸组成)发生变化,从而导致胰脂肪酶的极性增加,疏水性降低[17]。
2.3.2 荧光猝灭相关参数
由公式计算结果可知,柚皮素对胰脂肪酶的Kq值[2.21×1011L/(mol·s)]远大于2×1010L/(mol·s),表明柚皮素对胰脂肪酶的活性猝灭是由于柚皮素和胰脂肪酶形成了络合物而导致的静态猝灭。结合位点的数量(0.660 8)接近1,推测柚皮素和胰脂肪酶之间荧光存在一个结合位点[18]。
2.3.3 同步荧光作用
通过同步荧光法进一步研究了柚皮素对胰脂肪酶周围氨基酸残基微环境的影响,尤其是对酪氨酸和色氨酸的影响,分别在△λ=15 nm和△λ=60 nm处测量了酪氨酸和色氨酸的特征变化[19]。柚皮素对酪氨酸、色氨酸的同步荧光分别见图5和图6。
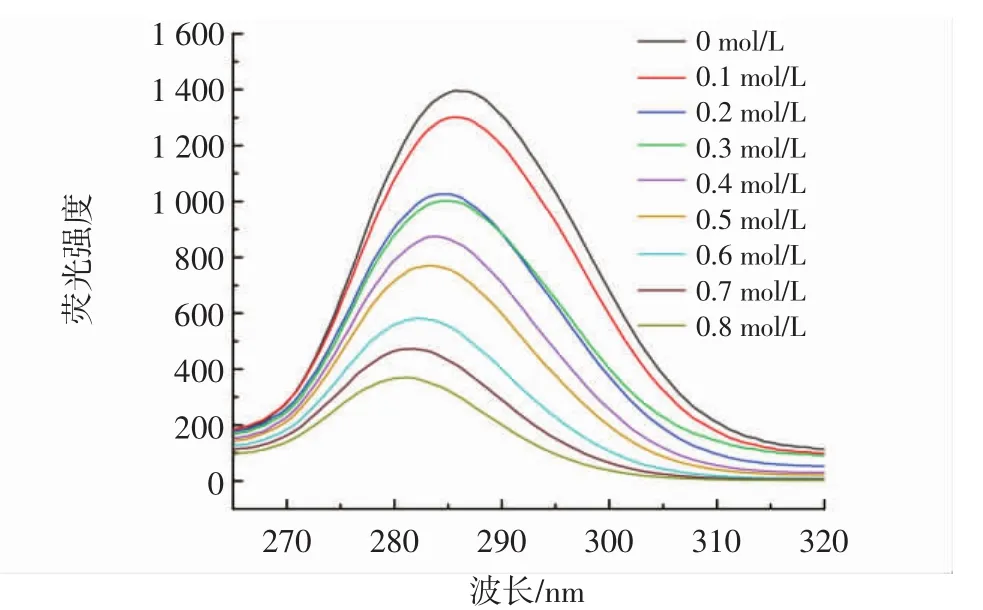
图5 不同浓度柚皮素对酪氨酸的同步荧光Fig.5 Synchronous fluorescence of naringenin on tyrosine at different concentrations
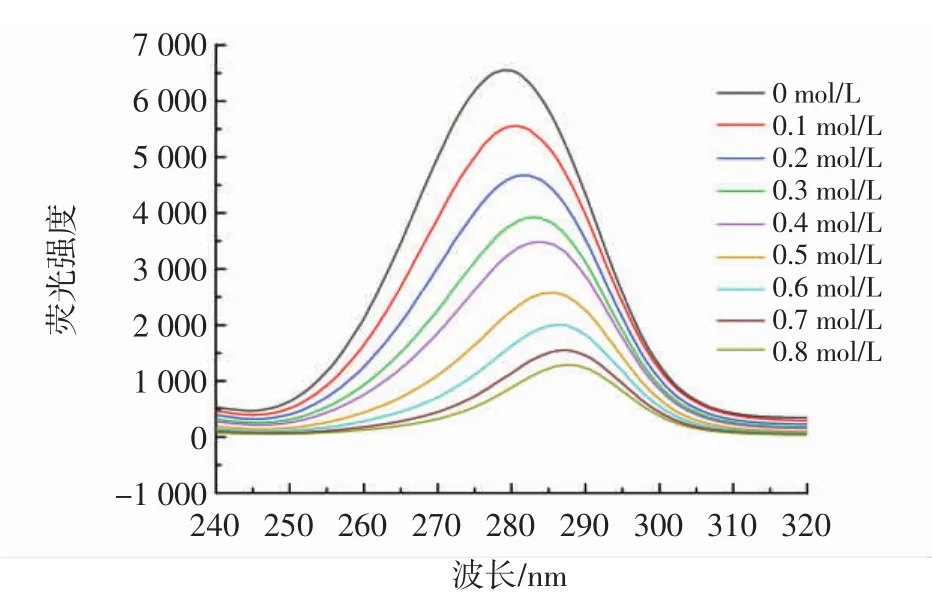
图6 不同浓度柚皮素对色氨酸的同步荧光Fig.6 Synchronous fluorescence of naringenin on tryptophan at different concentrations
由图5和图6可知,柚皮素降低了酪氨酸和色氨酸的荧光强度,表明柚皮素抑制胰脂肪酶的过程中,胰脂肪酶的酪氨酸和色氨酸参与了相互作用。另外,柚皮素存在时,在Δλ=15 nm处荧光强度从1 400下降到400,在Δλ=60 nm处荧光强度从6 500下降到500,Δλ=60 nm处荧光强度下降更明显,可以看出柚皮素对色氨酸的猝灭效果要强于对酪氨酸,表明结合过程对胰脂肪酶的色氨酸影响更大,柚皮素的结合位点更接近色氨酸[20]。色氨酸的最大发射波长发生红移,表明柚皮素的加入改变了色氨酸的微环境并降低了疏水性,酪氨酸的最大发射波长发生蓝移,疏水性增加,导致氨基酸残基较少暴露于溶剂中[21]。这些结果表明柚皮素改变了胰脂肪酶周围氨基酸残基的微环境,这可能也是胰脂肪酶活性降低的原因之一。
2.4 分子对接的结果分析
分子对接通常用于预测小分子配体与蛋白质结合在适当位置的构象。酶活试验显示,柚皮素竞争性地抑制了胰脂肪酶的活性,可以推测柚皮素和脂肪酶可能只有一个结合位点。为了深入了解柚皮素和胰脂肪酶的结合位点,进行了分子对接。柚皮素(蓝色)和奥利司他(黄色)与胰脂肪酶的分子对接见图7。
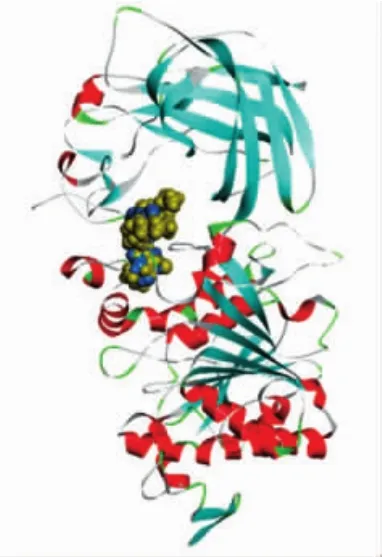
图7 柚皮素(蓝色)和奥利司他(黄色)与胰脂肪酶的分子对接Fig.7 Molecular docking of naringenin(blue)and orlistat(yellow)with pancreatic lipase
由图7可知,奥利司他进入胰脂肪酶的活性位点,柚皮素也对接在胰脂肪酶的活性位点,这证明柚皮素和奥利司他均能阻止底物和胰脂肪酶的结合,这与酶活性抑制试验结果(图1)一致。另外,对接结果的结合能量越低,表明配体与蛋白的结合作用更紧密,稳定性更强。因此,比较柚皮素和奥利司他与胰脂肪酶相互作用的结合能,进一步验证柚皮素抑制胰脂肪酶的能力,结果见图8和图9。
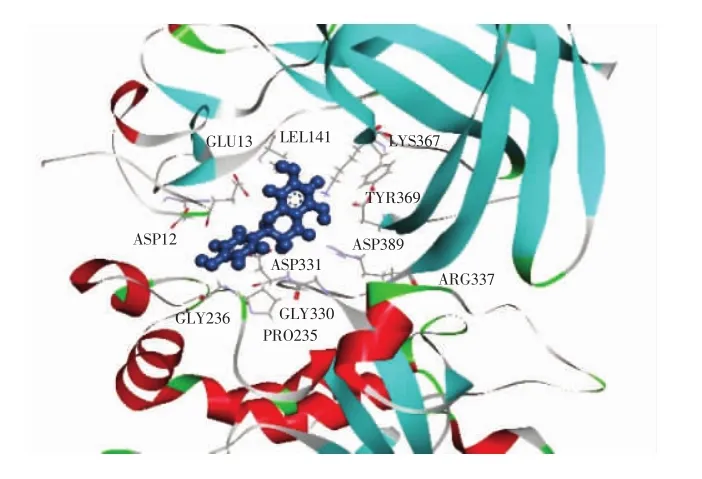
图8 柚皮素与胰脂肪酶对接局部细节图Fig.8 Partial diagram of naringenin docking with pancreatic lipase
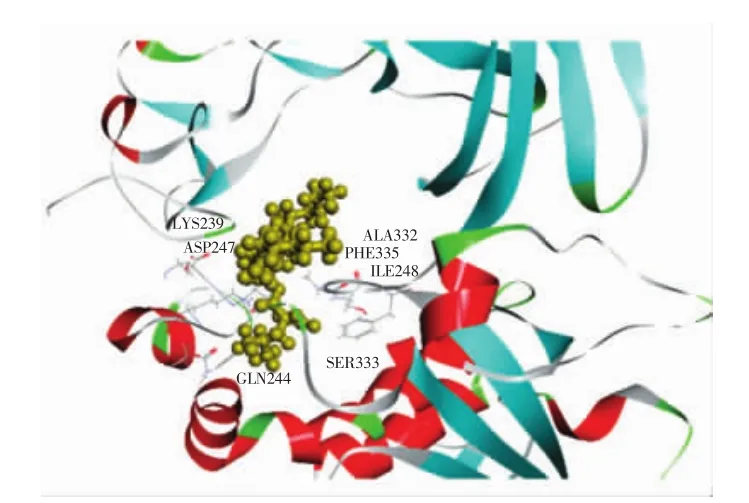
图9 奥利司他与胰脂肪酶对接局部图Fig.9 Partial diagram of orlistat docking with pancreatic lipase
通过DS分子对接软件计算得知,奥利司他作用胰脂肪酶的结合能为-44.77 kcal/mol(图9),而柚皮素与胰脂肪酶相互作用的结合能为-33.24 kcal/mol(图8)。奥利司他对胰脂肪酶的结合能低于柚皮素对胰脂肪酶作用的结合能,表明胰脂肪酶和奥利司他结合得更紧密和稳定,这个结果与2.1得到的抑制胰脂肪酶的活性试验结果一致。
通过对接显示二维分子对接模拟结果,进一步分析柚皮素和奥利司他与胰脂肪酶的相互作用关系,结果见图10和图11。

图10 柚皮素与胰脂肪酶相互作用的氨基酸残基Fig.10 Amino acid residues of pancreatic lipase interacting with naringenin
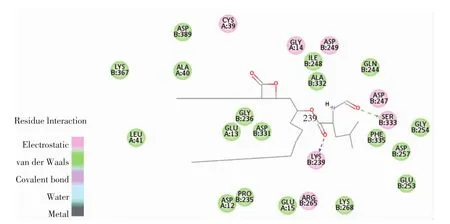
图11 奥利司他与胰脂肪酶相互作用的氨基酸残基Fig.11 Amino acid residues of pancreatic lipase interacting with orlistat
由图10可知,柚皮素被11个氨基酸残基(Gly330、Asp331、Gly236、Asp389、Arg337、Lys367、Pro235、Glu13、Asp12、Tyr369、Leu41)包围。由图11可知,奥利司他与胰脂肪酶上的25个氨基酸残基(Gly254、Asp257、Glu253、Asp247、Ser333、Phe335、Gln244、Asp249、Lys268、Gly14、Ile248、Ala332、Lys239、Arg265、Glu15、Cys39、Gly236、Asp331、Glu13、Pro235、Asp12、Asp389、Ala40、Lys367、Leu41)结合。其中 Lys367、Asp12、Asp331、Asp389、Pro235、Leu41、Gly236 和 Glu13 是柚皮素和奥利司他与胰脂肪酶结合时共用的氨基酸残基。这些残基通过二次键(氢键、范德华力、电荷或极性)与柚皮素和奥利司他相互作用。奥利司他通过与胰脂肪酶上的Ser333和Lys239形成2个氢键相互作用,并且通过范德华力与胰脂肪酶的Gly254、Asp257、Glu253、Phe335、Gln244、Lys268、Ile248、Ala332、Glu15、Gly236、Asp331、Glu13、Pro235、Asp12、Asp389、Ala40、Lys367 和Leu41氨基酸残基形成相互作用,达到稳定结合。柚皮素通过与胰脂肪酶的Lys367、Gly236和Arg337这3个氨基酸残基形成3个氢键,并且通过范德华力与胰脂肪酶的 Tyr369、Asp389、Leu41、Pro235 和 Gly330 氨基酸残基相互作用。柚皮素和胰脂肪酶的相互作用与奥利司他和胰脂肪酶的结合构象相似,表明柚皮素和奥利司他均可以在胰脂肪酶的活性位点上稳定结合。另外,柚皮素与胰脂肪酶的组合中形成了3个稳定相互作用的氢键,表明氢键可以增加胰脂肪酶的疏水性,使复合物的构象更加稳定[22],由此也证明了柚皮素抑制了胰脂肪酶的活性。
3 结论
体外酶试验结果表明,柚皮素对胰脂肪酶的抑制作用对应的IC50值为(2.413±0.160)mmol/L。酶动力学研究表明,柚皮素对胰脂肪酶作用的抑制类型为可逆竞争性抑制。荧光分析外光谱分析表明,随着柚皮素的加入,胰脂肪酶的结构发生了变化,从而降低酶的活性。同步荧光显示柚皮素对色氨酸的荧光猝灭更强,表明柚皮素的结合位点更接近色氨酸。分子对接发现柚皮素在胰脂肪酶的活性位点与其结合,阻止了底物和酶的结合,导致酶活性降低。胰脂肪酶在生物体消化吸收脂肪的过程中起着非常重要的作用,而柚皮素可以通过抑制胰脂肪酶的活性来影响人体的脂肪代谢,从而在抗肥胖方面起到一定作用,可为开发降脂功能食品提供参考。

