多发性骨髓瘤患者并发肾损害的危险因素及临床疗效分析
程家凤 张薇薇 郑茜茜 王晓培
多发性骨髓瘤(multiple myeloma,MM)是一种常见的浆细胞恶性肿瘤,因恶性浆细胞异常增殖并分泌大量单克隆免疫球蛋白而引起,其发病隐匿,临床表现多样,可出现贫血、骨质破坏、高钙血症、感染、肾损害等[1-2],其中,肾损害(renal impairment,RI)是新诊断MM患者常见的严重并发症,发生率可达20%~50%,其中2%~4%需要透析治疗[3-4]。部分MM患者的首发临床表现为肾脏损害,可能导致这部分MM患者的早期误诊,RI对MM患者的预后和生活质量有重要影响。有研究[5]显示,部分血清标志物如血钙、尿酸、β2-微球蛋白等与RI的发生具有相关性,本研究对60例初发MM患者临床特征进行回顾性分析,探究MM患者发生肾损害的危险因素,并通过绘制受试者工作特征(received operating characteristic curve,ROC)曲线评价各指标的预测价值,同时分析不同化疗方案对合并RI的MM患者临床疗效的差异及其对预后的影响,为临床提供参考。
1 资料与方法
1.1 一般资料 收集2014年2月至2021年8月于安徽理工大学附属医院首次确诊的MM患者临床资料,共60例。根据是否合并RI分为非RI组34例,RI组26例。
纳入标准:按国际骨髓瘤工作组(International Myeloma Working Group, IMWG) MM诊断标准[6]确诊为MM的患者。排除标准:①合并可引起肾损害的其他诱因,如药物等;②存在原发肾脏疾病;③合并可能引起肾损害的各种原发性,继发性(除mm外)肾脏疾病。
1.2 方法
1.2.1 分期及定义 采用Durie-Salmon(DS)分期体系[7]及国际分期体系(International Staging System, ISS)[8]进行分期。根据IMWG关于MM相关RI的诊断和处理建议将RI定义为肌酐≥ 176.8 μmol/L 或内生肌酐清除率<40 mL/min。
1.2.2 观察指标 收集患者初诊时临床资料,包括年龄、性别、实验室检查(血尿常规、血清总球蛋白、血清清蛋白、M蛋白、免疫球蛋白及轻链、β2微球蛋白、血清钙浓度、血尿酸、乳酸脱氢酶、血沉、24 h尿蛋白定量)、影像学检查(肾脏超声、CT、MRI、骨扫描等)及骨髓检查(骨髓细胞学、免疫表型、染色体核型分析),分析两组患者各指标是否存在差异。
1.2.3 治疗方案 合并RI且在本院接受治疗的老年患者(年龄>60岁)22例,按治疗方案分为含硼替佐米的联合化疗组和不含硼替佐米的传统化疗组。其中12例患者接受以硼替佐米为基础的化疗方案,包括VCD(硼替佐米、地塞米松、环磷酰胺)、PAD(硼替佐米、地塞米松、表柔比星)、PTD(硼替佐米、地塞米松、沙利度安)、BD(硼替佐米、地塞米松),硼替佐米按1.3 mg/m2皮下注射,第1、4、8、11天应用,有1例为周方案应用。10例采用传统化疗方案,包括TCD(沙利度安,地塞米松,环磷酰胺),MPT(马法兰,泼尼松,沙利度安),TD(沙利度安,地塞米松),VAD(长春新碱,表柔比星,地塞米松),MP(马法兰,强的松)。1例患者因肾衰竭行血液透析治疗,一疗程化疗后,患者肾功能部分缓解,停止透析,其他患者肾损伤未达治疗标准,未予特殊处理。
1.2.4 疗效评估及随访 诱导治疗3~4个疗程后按照中国多发性骨髓瘤诊治指南(2022年修订)[9]进行疗效评估,分为完全缓解、非常好的部分缓解、部分缓解,总体反应率为完全缓解率、非常好的部分缓解率、部分缓解率之和。根据IMWG关于MM相关RI诊断和处理建议[3]将抗骨髓瘤治疗后肾脏反应分为完全反应、部分反应和微小反应,总体反应率为完全反应率、部分反应率、微小反应率之和。总生存期(overall survival, OS)定义为自确诊至患者死亡或末次随访的时间间隔。
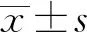
2 结果
2.1 两组患者临床特征比较 60例MM患者包括男性40例、女性20例,中位年龄69.5(37.0,88.0)岁。 DS分期Ⅲ期者在RI组中占88.46%,非RI组中占76.57%,差异有统计学意义(P<0.05),ISS分期Ⅲ期者RI组占80.76%,非RI组占50.00%,差异有统计学意义(P<0.05)。两组患者性别、免疫球蛋白分型、有无血尿、肾脏体积、骨质破坏程度、免疫表型、染色体核型比较,差异均无统计学意义(P>0.05)。见表1。
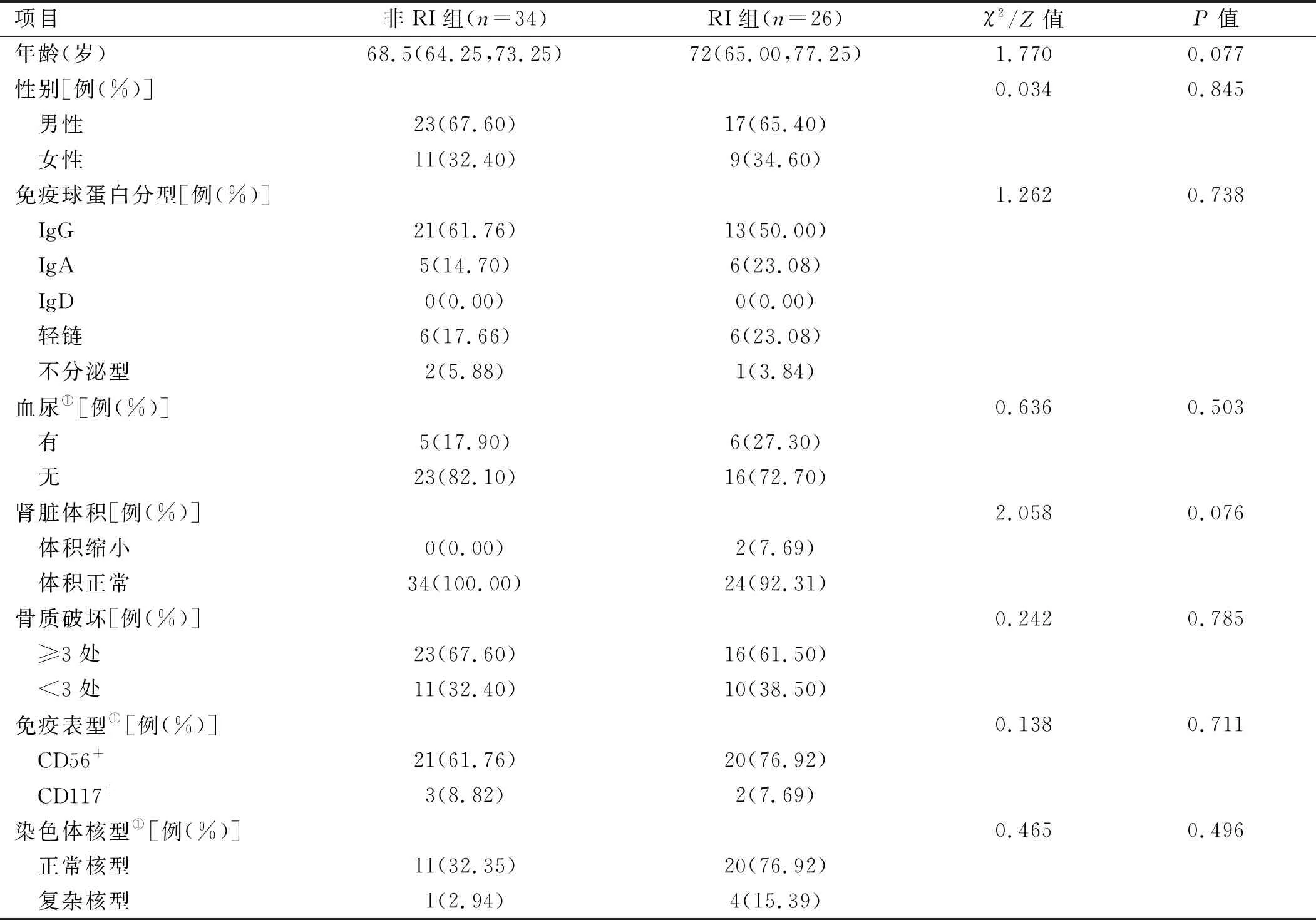
表1 MM患者合并RI组与非RI组一般资料比较
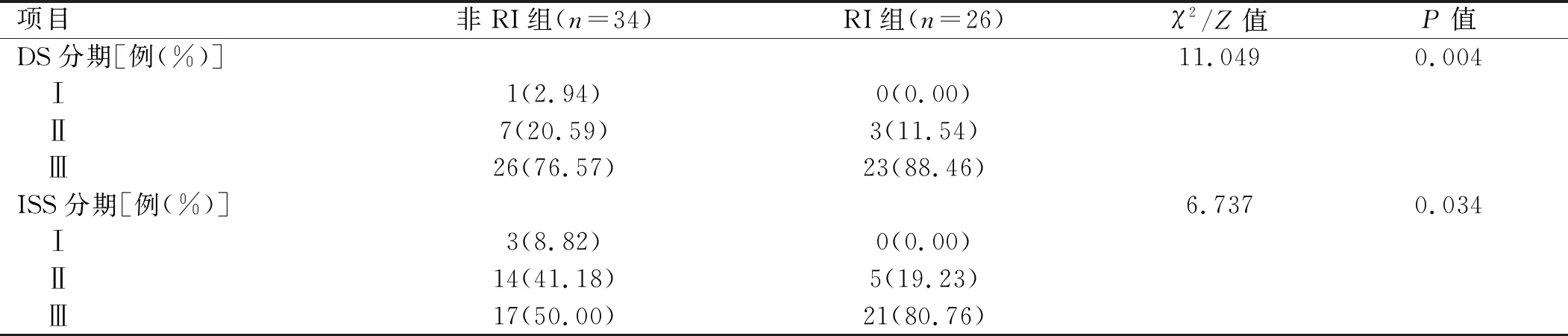
续表1
两组患者实验室检查资料比较结果显示,RI组白细胞、血钙、血尿酸、β2-微球蛋白水平均高于非RI组。见表2。

表2 MM患者合并RI组与非RI组实验室检查资料分析
以非RI组为阴性样本,RI组为阳性样本,进行ROC曲线分析,白细胞、血钙、血尿酸、β2-微球蛋白单独预测MM患者合并RI的曲线下面积分别为0.674、0.679、0.709、0.776,其临界值分别为白细胞>4.865×109/L,血钙>2.415 mmol/L,血尿酸>501.0 μmol/L,β2-微球蛋白>7.930 mg/L。见表3、图1。
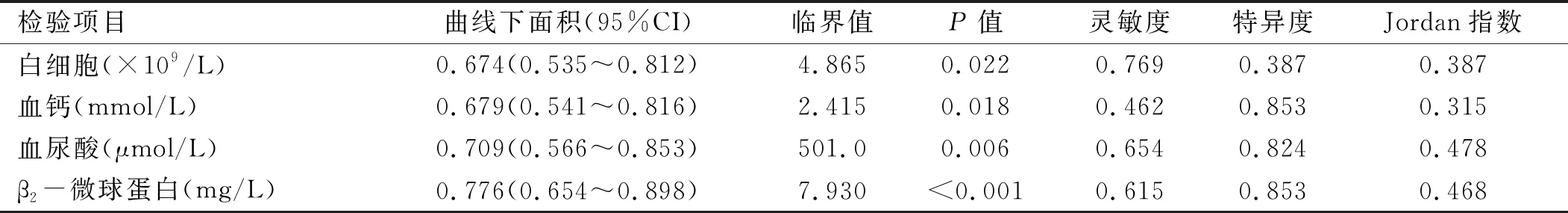
表3 MM患者合并RI危险因素ROC曲线分析结果
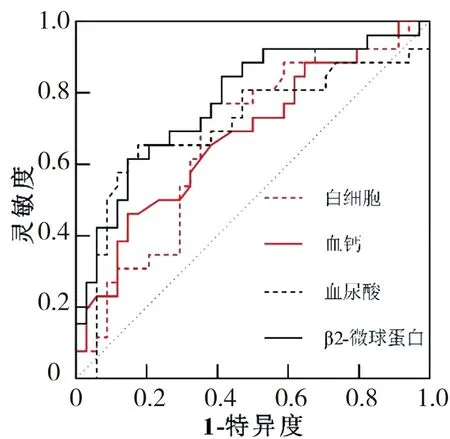
图1 白细胞、血钙、血尿酸、β2-微球蛋白预测MM患者合并RI的ROC曲线
将单因素分析结果P<0.05的指标纳入多因素logistic回归分析,由于DS分期及ISS分期与部分实验室检查结果相关,因此未纳入多因素分析。多因素分析结果发现β2-微球蛋白水平升高是MM患者合并RI的独立危险因素(P<0.05)。见表4。
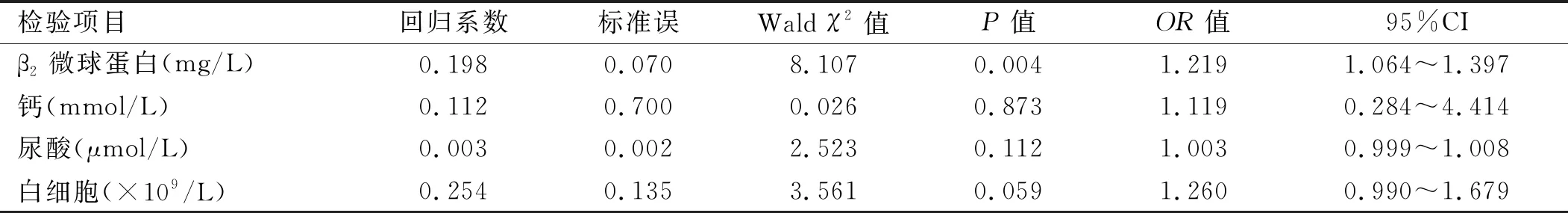
表4 多发性骨髓瘤多因素logistic回归分析
2.2 疗效及生存分析 自确诊之日起至2021年12月31日,RI组和非RI组中位随访时间分别为17.5个月和28个月, RI组中位OS估计值(20.0±5.7)月(95%CI:8.774~31.226),非RI组中位OS估计值(36.0±4.4)月(95%CI:27.356~44.644),RI组OS低于非RI组(P<0.05)。见图2。
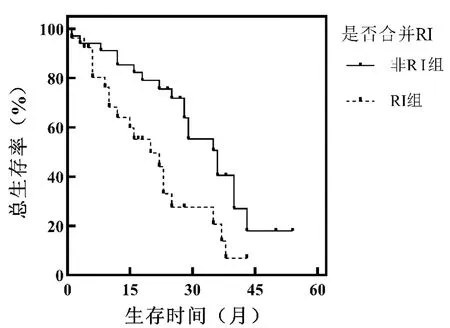
图2 非RI组与RI组患者生存曲线比较
22例老年MM合并RI患者,12例接受含硼替佐米的联合化疗方案(联合化疗组),10例接受不含硼替佐米的传统化疗方案(传统化疗组),两组患者中位OS估计值分别为(37.0±17.4)月(95%CI:2.894~71.406)和(10.0±0.8)月(95%CI:8.482~11.518),两组OS差异有统计学意义(P<0.05)。见图3。联合化疗组MM总体反应率为91.67%,RI总体反应率为91.7%,传统化疗组分别为30%、40%,差异均有统计学意义(P<0.05)。见表5。
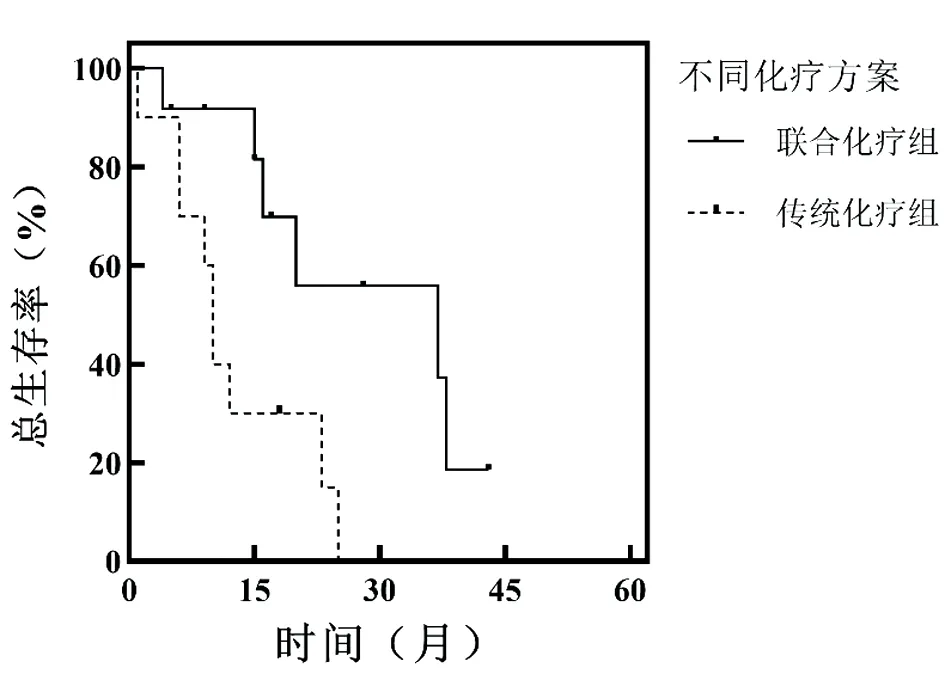
图3 联合化疗组与传统化疗组患者生存曲线比较
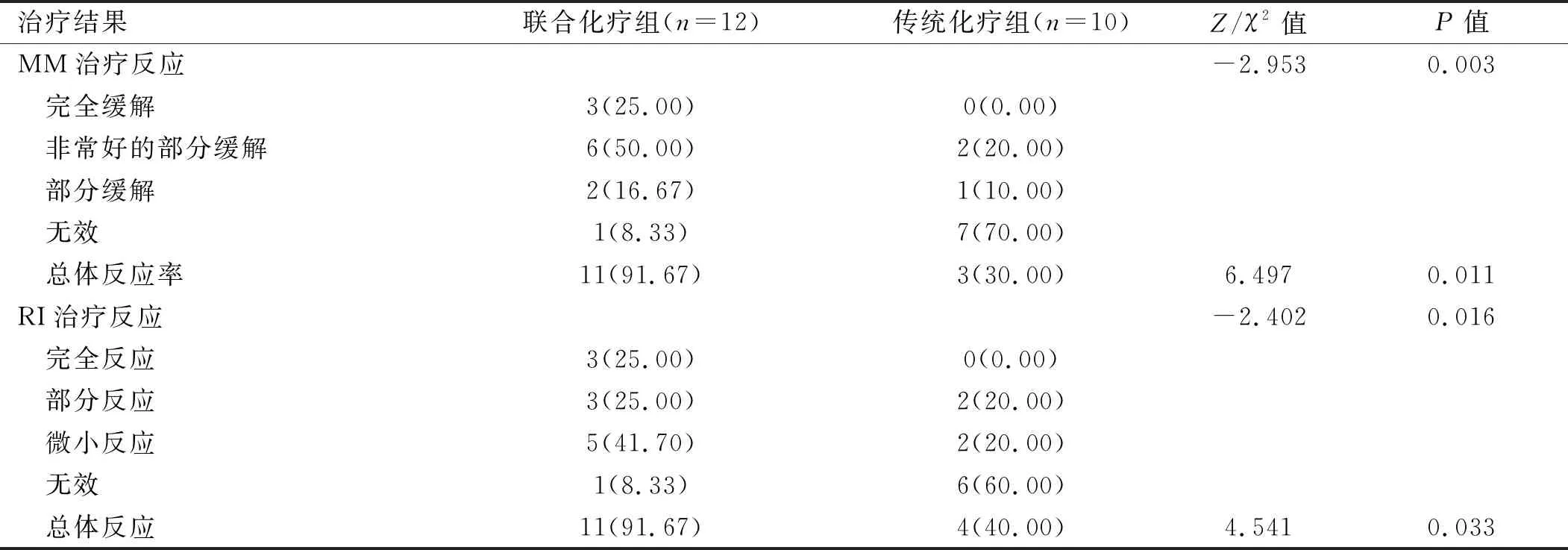
表5 年龄>60岁MM患者合并RI治疗反应分析[例(%)]
3 讨论
MM是由克隆性浆细胞异常增殖引起的一种血液系统恶性肿瘤,可累及肾脏、心脏、骨骼、造血系统等重要器官,其中肾脏损害是新诊断MM患者常见的并发症之一, RI发生率可达20%~50%[3],在传统化疗时代,RI的发生与较差的预后相关,中位生存期仅2年左右[10],随着新型抗骨髓瘤药物如蛋白酶体抑制剂、免疫调节剂等出现,MM合并RI患者的长期预后有明显改善,但RI的发生仍然与早期死亡风险增加有关[11-12]。本研究通过寻找MM患者发生RI的最佳预测指标、探究不同化疗方案对其临床疗效及预后的影响,可为MM合并RI的诊断和治疗提供有力的临床依据。
本研究中,合并RI的患者初诊时白细胞计数、血钙浓度、血尿酸、β2-微球蛋白水平较未合并RI的患者明显升高,ROC曲线分析提示上述指标预测RI发生的曲线下面积均>0.5,具有较好的临床预测价值。RI组患者白细胞计数较未合并RI患者明显升高,考虑可能与RI组患者免疫功能下降致感染发生率增加有关。血清钙水平异常升高与MM患者发生RI有一定相关性,与国内外研究结果一致[5,13]。血清钙水平升高可增强肾传入小动脉收缩能力,导致肾血流量减少,肾小球滤过率降低,从而引起肾前性氮质血症[14]。有研究发现,高钙血症引起的肾损伤是可逆的[15],另一项诊断MM相关性肾损伤的研究结果[5]也显示,血清钙水平得到成功控制时,肾功能可得到显著改善。因此,将血清钙水平控制在临界值以下,或许可一定程度上改善MM患者的肾功能损害。本研究发现,合并RI的MM患者尿酸水平显著升高。尿酸结晶可沉积于肾小管引起机械性小管阻塞、炎症发生,随时间进展可导致浸润性小管间质损伤从而引起肾功能损害[16]。已有研究发现,治疗前血尿酸水平升高与MM患者不良预后相关[17],而RI是MM预后不良特征之一,结合本研究血尿酸对MM患者合并RI的预测价值,在临床治疗中监测、控制血尿酸水平是有必要的。β2-微球蛋白是许多血液系统肿瘤尤其是MM肿瘤负荷的血清标志物[18-19],在MM患者ISS分期中起到重要作用[8]。MM患者恶性浆细胞异常增殖,使β2-微球蛋白合成及分泌增加,而β2-微球蛋白极易透过肾小球滤过膜,因此可较敏感的反应肾损伤。多项研究[5,13,20]显示,β2-微球蛋白与MM患者发生RI有相关性,本研究通过ROC曲线分析发现β2-微球蛋白>7.930 mg/L时发生RI的风险显著增加,且为独立危险因素。
本研究还发现,RI组患者有较高的DS分期和ISS分期,OS较未合并RI的患者明显缩短,因此,早期识别并治疗对合并RI的MM患者长期预后非常重要。
MM是一种临床和生物学异质性强的血液系统肿瘤,其预后与多种因素有关[21-22]。研究[23]表明,基于硼替佐米的治疗可以克服特定细胞遗传学异常对患者预后的不利影响。因此,随着新型抗骨髓瘤药物的出现,DS和ISS分期系统无法准确预测患者的预后[24]。2013年,R-ISS( Revised International Staging System)分期系统[25]被IMWG建议采用,用于预后评估。本组60例患者均进行了染色体核型分析,RI组和非RI组MM患者间的遗传学发展特征差异均没有显著差异,这与Nakaya等[26]的一项回顾性研究结果类似。
在早期传统治疗时代,MM伴RI患者的中位生存期较短,特别是高龄合并重度肾功能不全者早期死亡率明显较高。随着新型抗肿瘤药物的出现,MM合并RI患者的预后显著改善,在一项基于1 773例患者的大型回顾性研究[11]中,尽管老年患者数量不断增加,在过去10年中,合并严重RI的MM患者的OS有了明显改善(从1990~1994年的18个月到2005年的32个月),然而,出现严重RI的患者早期死亡风险仍然很高,尤其是老年人。硼替佐米是一种组织蛋白酶体抑制剂,通过抑制轻链的产生、抑制NF-KB(Nuclear Factor Kappa-B)活性、控制炎症反应来促进肾功能恢复。硼替佐米联合地塞米松因具有较好的耐受性和疗效而成为优选的一线治疗方案之一,在其基础上可添加第3种药物,这些药物包括环磷酰胺、沙利度胺、阿霉素或达雷妥尤单抗等[4,27]。国内有报道[28],含硼替佐米化疗方案在初发MM伴肾损害取得了良好的疗效。相对于年轻患者,老年患者合并症较多,分期较晚,治疗反应较差,面临更大的死亡风险。有研究[29]表明,含硼替佐米的化疗在老年患者中也取得良好治疗效果。本组资料中,MM合并RI的26例患者,其中22例大于60岁,本研究统计了硼替佐米联合化疗和传统化疗的2种方案对初发老年患者的诱导治疗反应,结果显示,在MM治疗反应、肾损害治疗反应及中位OS中,含硼替佐米的联合化疗组均显著优于传统化疗组,并且本组病例未出现严重不良反应引起治疗中断。因此对于老年MM肾损害患者,含硼替佐米的联合化疗相对于传统化疗无论从疗效、不良反应和耐受性方面均为更优选择。本研究为回顾性研究,且样本量较小,部分患者随访时间较短,后续仍需进行大样本、长期随访的研究进一步证实。
综上所述,合并RI的MM患者初诊时白细胞、血钙、血尿酸、β2-微球蛋白水平显著升高,对于RI的发生有一定预测价值,其中β2-微球蛋白水平升高为RI发生的独立危险因素,密切监测以上指标,早期诊断、规范治疗可一定程度上改善肾功能、减少病死率。对于老年MM合并RI患者,以硼替佐米为基础的化疗方案相对传统化疗可显著提高疗效、改善预后。

