氨苄青霉素与鸭疫里默氏菌噬菌体协同作用的研究
程龙飞,刘荣昌,陈红梅,万春和,傅光华,施少华,傅秋玲,黄 瑜
(福建省农业科学院畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心 福建省禽病防治重点实验室,福州 350013)
鸭疫里默氏菌(Riemerella anatipestifer, RA)是革兰氏阴性的小杆菌,主要侵害70日龄以下的各品种鸭和鹅,引起的病变主要表现为纤维素性心包炎、肝周炎、气囊炎、脑膜炎和关节炎等,俗称传染性浆膜炎[1]。该病呈世界性分布,严重影响水禽养殖业的健康发展。药物在该病的预防和治疗方面发挥了重要作用,但随着鸭疫里默氏菌耐药菌株的不断增多、多重耐药菌株的出现[2]、耐药机制的不断变迁等,药物的应用受到了很大的限制。传染性浆膜炎灭活疫苗已商品化,当疫苗株的血清型与流行菌株的血清型相同时,灭活疫苗可以提供有效的保护,而鸭疫里默氏菌有超过21种的血清型,一旦流行菌株的血清型改变,则免疫效果大打折扣。因此有必要研发传染性浆膜炎的新型防治方法。
噬菌体是细菌的病毒,可以作为生物控制剂,杀灭悬浮或生物膜中的细菌[3]。噬菌体在杀死其宿主菌的同时,不损伤宿主细胞、不影响宿主体内的大多数其他细菌,因为这一优点,噬菌体治疗法正在被越来越多的人关注和接受[4]。本研究以鸭疫里默氏菌RAf63为指示菌,从健康鸭粪中分离鉴定了鸭疫里默氏菌敏感的噬菌体RAP15,经形态学观察,结合分子特征,认为其应归属于I群尾病毒目长尾病毒科成员[5];测定了噬菌体RAP44的生物学特性,结果表明,该噬菌体潜伏期短,裂解量大,可以作为生物防治鸭疫里默氏菌病的候选噬菌体株[6];以皮下注射的方法将鸭疫里默氏菌人工感染樱桃谷鸭,同时皮下注射噬菌体,观察5 d,结果发现,5株噬菌体处理组均可使鸭的死亡数量减少,说明噬菌体对鸭疫里默氏菌病有一定的治疗效果[7]。据报道,噬菌体和抗生素具有协同作用[8],受此启发,本研究从体内和体外两个方面探讨氨苄青霉素与噬菌体的协同作用,为抗生素与噬菌体联合应用用于防治传染性浆膜炎奠定基础。
1 材料与方法
1.1 主要试剂及试验动物 胰蛋白胨大豆琼脂(tryptic soy agar, TSA)、胰蛋白胨大豆肉汤(tryptic soy broth, TSB)购自Dfico公司;96孔细胞培养板购自Thermo公司;100 mg/mL氨苄青霉素购自全式金公司;氨苄西林钠可溶性粉购自成都市坤宏动物药业有限公司;10日龄番鸭购自莆田温氏家禽有限公司。
1.2 菌毒株及培养方法 血清1型鸭疫里默氏菌RAf63,鸭疫里默氏菌噬菌体RAP8、RAP15、RAP33、RAP38、RAP49、RAP50、RAP57、RAP62(均是以鸭疫里默氏菌RAf63为指示菌,从健康鸭粪中分离并纯化),由福建省农业科学院畜牧兽医研究所禽病研究室保存。菌株冻干粉划线培养于TSA平板,37℃烛罐中培养20 h,挑单菌落接种于TSB,37℃振荡培养16 h。噬菌体采用双层平板法培养,挑噬斑纯化、计数[5]。每株噬菌体的效价均调整至1×1010PFU/mL。
1.3 AMP对RAf63最低抑菌浓度(minimum inhibitory concentration, MIC)的测定 采用微量稀释法。用TSB将AMP稀释至4096 μg/mL,在96孔细胞培养板上,以TSB将AMP作倍比稀释,共11孔,每孔终体积100 μL,第12孔为单纯的TSB为对照,每孔加10倍稀释的RAf63菌液100 μL,37℃、5%CO2培养箱中培养20 h,测定每孔的OD490值。做3个重复,取平均值判定MIC值。
1.4 AMP与RAP15合用对RAf63的生长抑制试验 参考文献[9]的方法适当改进,96孔细胞培养板上,第1孔加100 μL TSB稀释的AMP 128 μg/mL,后面每孔加100 μL TSB稀释的AMP 64 μg/mL,第1孔加RAP15 100 μL,混匀后倍比稀释至11孔,第12孔为不加噬菌体的对照,每孔加10倍稀释的RAf63菌液100 μL,即AMP终浓度均为32 μg/mL,噬菌体浓度不同。同样的方法,设置AMP终浓度分别为16、8 μg/mL和0 μg/mL的试验组和对照组。37℃、5%CO2培养箱中培养20 h,测定每孔的OD490值。每个试验组做3个重复,取平均值进行分析。
1.5 AMP对RAP15噬菌斑形成的影响试验 参考文献[9]的方法适当改进,铺双层平板,下层为TSA,上层为含RAf63和RAP15(约100个PFU)的0.7%琼脂[5],使整个平板中AMP的终浓度分别为32、16、8、0 μg/mL,每组做3个重复,37℃、5%CO2培养箱中培养20 h。观察噬菌斑的形态及大小,计算每组噬菌斑的平均数。
1.6 AMP对RAP15增殖的影响试验 参考文献[9]的方法适当改进,取RAP15(8×108PFU)和RAf63(3.2×1010CFU),加入TSB中,总体积为80 mL,平均分为4份,设定为4个试验组,加入AMP使其终浓度分别为32、16、8、0 μg/mL,37℃振荡培养10 h。每组加氯仿1 mL,上下振荡,静置5 min,取上层液体进行噬菌体计数。
1.7 AMP对噬菌体噬菌谱的影响试验 铺双层平板,下层为TSA,上层为含RAf63的0.7%琼脂[5],使整个平板中AMP的终浓度分别为32、16、8、0 μg/mL,待琼脂凝固后,将噬菌体分别滴加在不同平板上(50 μL/板),37℃、5%CO2培养箱中培养20 h,观察加样点是否出现噬菌斑,出现噬菌斑判断为具有裂解能力,否则判断为不能裂解。
1.8 AMP与RAP15对RAf63人工感染番鸭的治疗试验 60只10日龄番鸭,隔离饲养2 d后进行动物试验。每只左腿皮下注射0.5 mL RAf63菌液(细菌的含量为1×108CFU/mL),然后随机分为5组。试验1组、2组和3组,立即右腿皮下注射0.5 mL噬菌体RAP15(噬菌体的含量为2×109PFU/ mL),试验2组在每天的饮水中加入氨苄西林钠可溶性粉300 mg/L,试验3组和4组在每天的饮水中加入氨苄西林钠可溶性粉600 mg/L(厂家推荐用量),对照组不注射噬菌体也不添加药物。隔离饲养,观察7 d,统计鸭的死亡数并计算死亡率。
2 结果
2.1 AMP对RAf63的MIC 培养基中含有不同浓度AMP时,由细菌的生长情况可知,AMP浓度较高时,OD值始终处于较低的水平,当AMP浓度为32 μg/mL及以下时,OD值迅速上升。OD值越高,说明细菌的生长越好,将能够完全抑制细菌生长的AMP最低浓度即64 μg/mL判定为对RAf63的MIC(图1)。根据中国食品药品检定研究院制定的《抗菌药物药敏试验判断标准》判定,RAf63对AMP耐药。

图1 含不同浓度AMP培养液的(OD490值)Fig.1 OD490 value of culture medium containing AMP of different concentrations
2.2 AMP与RAP15合用对RAf63生长的影响 不同浓度AMP与不同效价的噬菌体RAP15合用,对RAf63生长的影响详见图2。从中可以看出,当AMP浓度为8 μg/mL及以下时,噬菌体RAP15稀释至2-8,培养液的OD值即开始快速上升,即不能抑制RAf63的生长;当AMP浓度为16 μg/mL和32μg/mL时,RAP15稀释至2-10,培养液的OD值才开始快速上升。说明当培养液中含有16 μg/mL或32 μg/mL的AMP时,更少的RAP15就可以抑制RAf63的生长,也就是说,AMP和RAP15联合,可以将RAP15对RAf63生长的抑制作用提高4倍。

图2 含不同浓度AMP和噬菌体培养液的OD490值Fig.2 OD490 value of culture medium containing AMP and phage of different concentrations
2.3 AMP对RAP15噬菌斑形成的影响 不同浓度AMP时,双层平板观察到的RAP15噬菌斑的形态、大小、数量均没有明显差别。
2.4 AMP对RAP15增殖的影响 培养液中含有不同浓度AMP,培养后各试验组子代噬菌体计数。结果可知,培养液中AMP浓度达到16 μg/mL和32 μg/mL时,子代噬菌体的数量明显增加,增加的幅度分别为12.2%和22.0%,AMP浓度为8 μg/mL时,对子代噬菌体的数量几乎没有影响(表1)。

表1 添加不同浓度AMP培养后子代噬菌体的计数结果Table 1 Count results of progeny phage under different concentration AMP
2.5 AMP对噬菌体裂解能力的影响 由AMP不同浓度时,各噬菌体对细菌RAf63的裂解性可知,AMP不能影响RAP15、RAP33、RAP49和RAP57对RAf63的裂解特性,当AMP浓度为16 μg/mL及以上时,RAP8、RAP38和RAP62即表现对RAf63裂解能力,当AMP浓度为32 μg/mL时,RAP50表现出对RAf63裂解能力(表2)。说明亚MIC浓度的AMP提高了部分噬菌体的裂解能力,拓宽了这些噬菌体的噬菌谱。
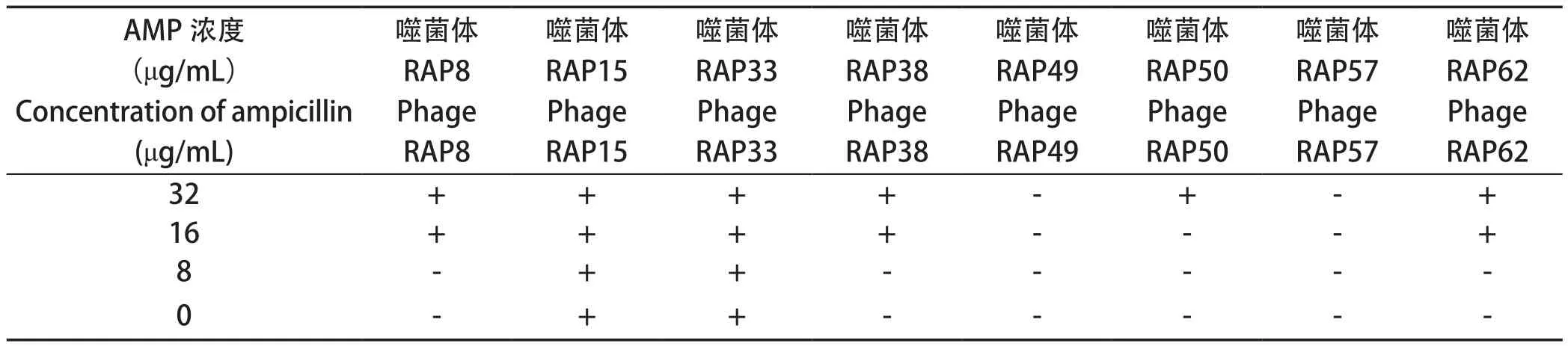
表2 不同浓度AMP时各噬菌体对RAf63的裂解能力Table 2 Lysis abilities to RAf63 of phage strains under different concentration AMP
2.6 AMP和噬菌体联合应用对鸭疫里默氏菌攻菌的治疗效果 攻击鸭疫里默氏菌RAf63后,采取不同治疗措施的各试验组,死亡数量不同。两个联合治疗组的死亡率,比单一噬菌体治疗组或单一AMP治疗组都低。推荐剂量的AMP与噬菌体联合应用比一半剂量AMP与噬菌体的联合应用效果更好一点(表3)。说明噬菌体和AMP或半剂量的AMP合用,均能提升对人工感染鸭疫里默氏菌的治疗作用。

表3 人工感染RAf63后各试验组的治疗效果Table 3 Therapeutic effect of each experimental group after artificial infection of RAf63
3 讨论
用噬菌体治疗细菌感染早在20世纪初就已取得过可喜的成果,由于大多数噬菌体的噬菌谱过于狭窄,使得其应用受到了很大的局限,后来随着抗生素的迅速发展,噬菌体的研究工作几乎处于停滞状态。抗生素可以抑制或杀灭病原菌,提高动物的生产性能,但其副作用也越来越显现,其应用也受到了越来越多的限制。可喜的是,抗生素的亚最小抑菌浓度已被证明能提高噬菌体的活性,被称为“噬菌体-抗生素协同作用”[10-11]。其可能的机理有两个方面,一方面是因为抗生素作用后,细菌形态发生了改变,如内酰胺类和氟喹诺酮类药物可以使伯克霍尔德菌拉伸呈丝状,暴露出更多的噬菌体结合受体,有利于更多噬菌体的吸附,从而导致噬菌体产量的增加并加速细胞的裂解;四环素则使细菌成簇聚集,增加了噬菌体横向穿过相邻细菌并感染的机会,从而加速其裂解作用[12]。另一方面,噬菌体可以破坏细菌生物膜[13],使得抗生素更好地发挥作用。抗生素与噬菌体的合用,不仅能提高治疗效果,还能减少抗生素的使用,具有很好的应用前景。
并不是所有的噬菌体和所有的抗生素都具有协同作用,不同的噬菌体只与部分抗生素具有协同作用,β-内酰胺类、氨基糖苷类、氟喹诺酮类、多粘菌素类和四环素类抗生素被研究较多,其中,β-内酰胺类和氟喹诺酮类抗生素与噬菌体的协同作用经常被发现[14]。氨苄青霉素已被证实,能与粪肠球菌噬菌体[15]和大肠杆菌噬菌体[11]产生协同作用。氨苄青霉素耐酸,内服或肌肉注射均易吸收,既可抗革兰氏阳性菌,又可抗革兰氏阴性菌。氨苄青霉素在动物养殖中广泛应用,但目前尚未见报道其是否与鸭疫里默氏杆菌噬菌体也具有协同作用。本研究针对这一未知领域开展试验,首先在体外培养时发现,亚MIC浓度的氨苄青霉素能使噬菌体RAP15对RAf63生长的抑制作用提高4倍,能使子代噬菌体的数量明显增加,说明在体外条件下,氨苄青霉素与RAP15具有协同作用。美中不足的是,本研究没有观察到亚MIC浓度的氨苄青霉素对噬菌斑大小和数量的影响,推测可能与RAP15形成的噬菌斑太小(直径小于1 mm)、不易计量有关,也可能与噬菌体本身的特点有关。另外,亚MIC浓度的氨苄青霉素可以使部分原先不能裂解RAf63的噬菌体获得裂解RAf63的能力,说明低于常规剂量的抗菌素和噬菌体的合用,可以拓宽噬菌体的噬菌谱,这一点很有意义,为噬菌体临床应用范围的拓宽提供了理论基础。其次,本研究进行了体内试验,将鸭疫里默氏菌RAf63人工感染番鸭,然后进行治疗试验。注射噬菌体RAP15的试验组,死亡率比对照组降低,注射噬菌体结合饲喂氨苄青霉素的试验组,死亡率更低,说明噬菌体RAP15和氨苄青霉素具有协同作用。本研究还对氨苄青霉素的用量进行了初步的探讨,发现氨苄青霉素减半后与噬菌体合用,比单一噬菌体治疗组的效果好,但比常规剂量组略差。综上所述,本研究从体内和体外两个方面均证明,氨苄青霉素和噬菌体具有协同作用,为今后传染性浆膜炎的预防和治疗提供了可能的新方案,在保证预防和治疗效果的情况下,也可能减少抗菌药物的使用,减少药物残留和环境压力,具有潜在的重要意义。

