菜用大豆荚壳中异黄酮的提取及抑菌作用研究
薛静文, 周谨文, 黄洁彦, 金千禧, 丁建英
(常熟理工学院 生物与食品工程学院, 江苏 常熟 215500)
菜用大豆, 俗称毛豆, 一般是指处于鼓粒期至初熟期之间, 其籽粒填充程度达到荚长80%~90%时采摘并专门鲜食嫩荚的蔬菜用大豆[1-2]。菜用大豆在我国有着5000多年的栽培历史, 因其有一定药用价值, 在早期作为药用植物, 而其食用习惯在我国也有着悠久的历史。菜用大豆中膳食纤维的含量远高于其他蔬菜, 比大家所熟知的芹菜杆的纤维含量还要高, 有着“蔬菜纤维冠军”的美誉[2]。其中, 还富含蛋白质、脂肪、矿物质和各种维生素, 以及皂甙、植酸、低聚糖等保健成分, 具有降血压、降血脂和强身健体、益气补虚的功效。我国已逐渐成为菜用大豆最大的生产国和出口国, 对于豆粒已经存在许多深加工, 而在荚壳方面, 除了作饲料之外, 其他方面的研究还比较少。
黄酮类化合物是一类广泛存在于自然界植物中的天然产物, 其中绝大多数黄酮类化合物会与葡萄糖结合成苷类, 而小部分黄酮类化合物则会以游离苷元的形式存在[3]。根据研究表明, 此类化合物具有多种活性功能, 包括抗癌、抗炎症、抗抑菌活性、抗氧化、降血脂、降血压等功效[4]。除此之外, 黄酮类化合物还可以调节人体的肠道菌群[5], 在食品加工中还对丙烯酰胺有一定的抑制作用[6]。
异黄酮是黄酮类化合物的一种, 主要存在于豆科植物中, 其结构与人体雌激素结构非常相似, 又被称为植物雌激素。大豆中存在的主要有染料木黄酮、黄豆苷元和大豆黄素3种异黄酮。其功效除一般黄酮拥有的功效外, 还在改善更年期综合征、延缓衰老、美容养颜, 以及畜牧生产和药物开发等方面均有很好的作用[7], 具有广阔的开发前景。
对于植物黄酮类化合物的提取, 主要有传统提取法和现代提取法[8], 这几种方法相辅相成, 各有优缺点, 且在实际工作中经常一起使用, 以此提高提取率。包括醇提法和水提法、微波辅助提取法、超声辅助提取法等, 其中超声辅助提取法是应用最为广泛的提取方法[9]。试验在此基础上, 将菜用大豆荚壳作为原料, 进行异黄酮提取研究, 并进行抑菌作用和抗氧化活性的研究, 为菜用大豆荚壳的废物利用提供研究基础, 也为利用果蔬废弃资源研制天然食品防腐剂提供依据[10]。
1 材料与方法
1.1 材料与仪器
新鲜菜用大豆(毛豆)、染料木素(分析标准品, HPLC≥98%), 上海源叶生物科技有限公司提供;无水氯化铝、无水乙醇、牛肉膏、蛋白胨、琼脂粉、氯化钠、1,1-二苯基-2-苦肼基(DPPH)、硫酸亚铁、过氧化氢溶液、水杨酸、抗坏血酸(维C)、活性炭(颗粒), 以上试剂均为分析纯。
高速中药粉碎机, 广州市旭朗机械设备有限公司产品;电热恒温鼓风干燥箱, 上海新苗医疗器械有限公司产品;RE-52型旋转蒸发仪, 上海亚荣生化仪器厂产品;HH-4型数显恒温水浴锅, 国华电器有限公司产品;高速台式离心机, 湖南湘仪实验室仪器开发有限公司产品;超声波清洗器, 昆山禾创超声仪器有限公司产品;生化培养箱, 上海一恒科学仪器有限公司产品;立式高压蒸汽灭菌锅, 上海申安医疗器械厂产品;TU-1901型双光束紫外可见分光光度计, 北京普析通用仪器有限公司产品。
1.2 试验方法
1.2.1 菜用大豆荚壳中异黄酮的提取工艺流程
(1)原材料处理。将新鲜的菜用大豆剥去豆粒, 收集豆荚, 清洗干净后先自然风干24 h, 再放入恒温干燥箱中烘干24 h, 烘干的过程温度不宜过高, 控制在60℃。干燥至恒质量后, 取出粉碎成粉末并过60目筛, 将粉末放入干净的密封袋中, 置于冰箱4℃下冷藏备用。
(2)异黄酮的提取。参考王桃云等人[11]的研究方法, 并进行了改进。准确称取5 g的菜用大豆荚壳粉末, 按照一定量的乙醇溶液, 在一定温度下超声提取一段时间, 然后以转速5000 r/min离心10 min, 取上清液, 再旋转蒸发进行浓缩, 温度控制在60℃, 最后加入活性炭并通过滤纸过滤, 得到最终提取液。异黄酮得率按公式(1)计算:

式中:P——样品中异黄酮得率, mg/g;
C——从标准曲线中计算得到的提取液质量浓度, mg/mL;
N——样品提取液总体积, mL;
k——稀释倍数;
m——称取粉末的质量, g。
1.2.2 最大吸收波长的确定
参考王桃云等人[12]的方法, 并进行了适当修改。首先分别准确量取染料木素标准液和提取液各1.0 mL放置于10 mL容量瓶中, 加入体积分数95%的乙醇定容至刻度线, 摇匀, 用紫外可见分光光度计在波长200~800 nm进行全波长扫描, 从而确定提取液的最大吸收波长为263 nm。
1.2.3 染料木素标准曲线的绘制
准确称取染料木素标准品3.4 mg, 先用体积分数95%的乙醇溶解后, 置于100 mL的容量瓶中, 再用体积分数95%的乙醇冲洗几次烧杯, 将液体倒入容量瓶中, 最后用体积分数95%的乙醇定容至刻度线, 摇匀。从中取出10 mL置于50 mL的容量瓶中, 用体积分数95%乙醇定容至刻度线, 即得到染料木素标准液, 质量浓度为6.8μg/mL。
准确量取已制备好的标准液0, 1.0, 2.0, 3.0, 4.0, 5.0 mL分别置于10 mL的容量瓶中, 用95%的乙醇定容至刻度线, 摇匀。用体积分数95%乙醇调零, 在波长263 nm处测定吸光度, 记录数据, 以溶液质量浓度为横坐标, 以吸光度为纵坐标绘制染料木素标准曲线[12]。
1.2.4 单因素试验
选定对菜用大豆荚壳中异黄酮提取产生影响的4个因素进行单因素试验, 分别为料液比、乙醇体积分数、超声时间和超声温度。
单因素试验设计水平见表1。

表1 单因素试验设计水平
1.2.5正交试验设计
为了进一步优化菜用大豆荚壳中异黄酮的提取工艺, 在单因素试验的基础上进行正交试验设计[13]。分别选择料液比、乙醇体积分数、超声时间及超声温度这4个因素的3个水平, 再通过L9(34)的正交表进行正交试验[14]。
正交试验因素与水平设计见表2。
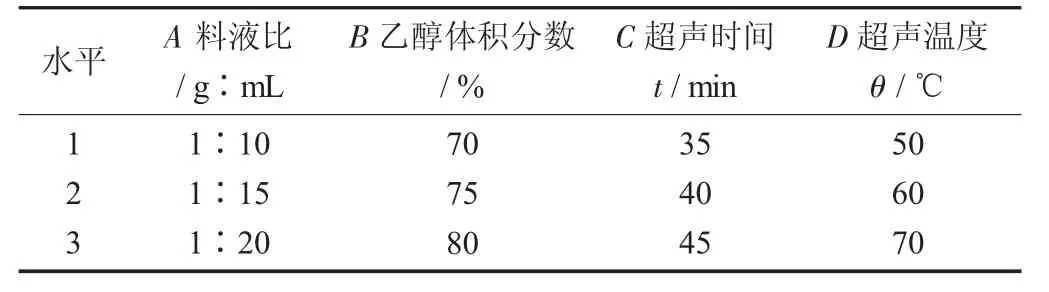
表2 正交试验因素与水平设计
1.3 抑菌与抗氧化性研究
1.3.1 抑菌试验
采用纸片法进行抑菌试验[15-16]。首先用打孔器打成直径为8mm的圆纸片, 包扎好后连同培养皿及试验所用到的器材一同灭菌。无菌操作台事先紫外灭菌30 min。点燃酒精灯并消完毒后, 在酒精灯旁打开灭好菌的培养基, 将培养皿中倒入15~20 mL的牛肉膏蛋白胨培养基, 盖上盖, 待其冷却凝固之后, 再将培养基上加入制备好的菌悬液200μL, 用酒精灯灼烧过的涂布棒将菌液涂布均匀, 待其完全吸收。用灼烧过的镊子取出事先在提取液中浸泡过一夜的纸片(共3片)以及在蒸馏水中浸泡过的纸片(1片), 在火焰旁微微干燥过后, 整齐地放在一个培养皿上, 盖上盖, 待纸片上的液体被完全吸收, 放入恒温培养箱中37℃下培养24 h后, 观察并测量抑菌圈直径。
1.3.2 对DPPH自由基的清除作用
由于DPPH自由基存在单个电子, 而其醇溶液又呈现紫色, 并且在波长517 nm处有强吸收, 加入抗氧化剂之后, 因为电子进行了配对而导致溶液颜色变浅, 吸光度变小, 因此可以利用这个原理来测定对DPPH自由基的清除能力。
参考王蔚新等人[17]的研究, 并进行了适当修改:配置不同质量浓度的提取液(0.2, 0.4, 0.6, 0.8, 1.0 mg/mL), 分别量取2.0 mL于试管当中, 加入0.2 mmol/L的DPPH溶液2.0 mL, 充分摇匀, 避光静置30 min。用无水乙醇调零, 在波长517 nm处测得吸光度A2;用无水乙醇代替DPPH溶液, 作为对照测其吸光度A3;取相同体积DPPH溶液和无水乙醇混合, 测其吸光度A1。按照上述相同步骤, 将抗坏血酸作为参照物, 测定其吸光度。进行平行试验, 减少误差。对DPPH自由基清除率按公式(2)计算:

式中:A2——提取液和DPPH溶液的吸光度;
A3——提取液和无水乙醇的吸光度;
A1——无水乙醇和DPPH溶液的吸光度。
1.3.3 对羟基自由基的清除作用
在Fenton反应中, Fe2+催化分解H2O2, 产生羟基自由基, 其具有高活性。在该反应体系中加入水杨酸, 水杨酸有效捕捉羟基自由基并反应生成2,3-二羟基苯甲酸羟基化合物, 该化合物在波长510 nm处有强吸收。如果往该体系中加入可以清除羟基自由基的物质, 使得化合物含量减少, 其吸光度也随之降低。利用吸光度值的变化测得对羟基自由基的清除能力。
参考王蔚新等人[17]的研究, 并进行了适当修改:配置不同质量浓度的提取液(0.2, 0.4, 0.6, 0.8, 1.0 mg/mL), 分别量取2.0 mL于试管当中, 先加入9 mmol/L FeSO4溶液和8.8 mmol/L H2O2溶液各2.0 mL, 充分摇匀, 静置5 min。然后再加入9 mmol/L水杨酸溶液2.0 mL, 充分摇匀, 放置于水浴锅中于37℃下恒温水浴30 min。用蒸馏水调零, 于波长510 nm处测得吸光度A2;用蒸馏水代替提取液为空白对照测其吸光度A1;用蒸馏水代替H2O2测其吸光度A3。按照上述相同步骤, 将抗坏血酸作为参照物, 测定其吸光度。进行平行试验, 减少误差。对羟基自由基清除率按公式(3)计算:

式中:A2——加入提取液和H2O2溶液的吸光度;
A3——加入提取液和蒸馏水的吸光度;
A1——加入蒸馏水和H2O2溶液的吸光度。
2 结果与分析
2.1 最大吸收波长
根据1.2.2的方法对染料木素和菜用大豆荚壳中异黄酮进行紫外吸收光谱扫描。
染料木素紫外吸收光谱扫描图见图1, 菜用大豆荚壳中异黄酮紫外吸收光谱扫描图见图2。
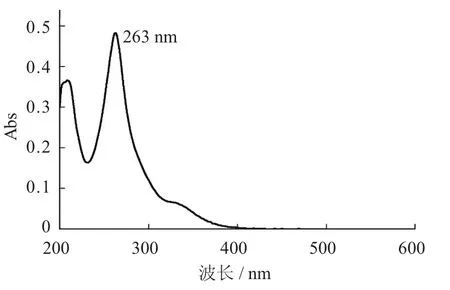
图1 染料木素紫外吸收光谱扫描图
由图1和图2可知, 染料木素在波长263 nm处有最大吸收波长, 而菜用大豆荚壳中异黄酮在波长267 nm处有最大吸收波长, 两者十分接近, 因此选择263 nm作为测定菜用大豆荚壳中异黄酮含量的波长。

图2 菜用大豆荚壳中异黄酮紫外吸收光谱扫描图
2.2 染料木素标准曲线
按照1.2.3的方法进行试验, 得到染料木素标准曲线。
染料木素标准曲线见图3。

图3 染料木素标准曲线
由图3可知, 线性回归方程为Y=0.1533X-0.0008, R2=0.9991, 线性关系良好。
2.3 单因素试验结果与分析
2.3.1 料液比对菜用大豆荚壳中异黄酮得率的影响
选择料液比1∶5, 1∶10, 1∶15, 1∶20, 1∶25, 1∶30(g∶mL)进行研究, 按照乙醇体积分数为85%, 温度为40℃下超声提取30 min。
料液比对菜用大豆荚壳中异黄酮得率的影响见图4。

图4 料液比对菜用大豆荚壳中异黄酮得率的影响
由图4可知, 当料液比为1∶15时, 菜用大豆荚壳中异黄酮得率最高。料液比低于1∶15时, 无法完全溶解粉末, 使异黄酮完全溶出;料液比高于1∶15时, 粉末已被完全溶解, 异黄酮完全溶出, 随着料液比的增加会使其他杂质也溶解于乙醇中, 导致异黄酮得率降低[18]。因此, 选择1∶10, 1∶15, 1∶20(g∶mL)作为正交试验的料液比范围。
2.3.2 乙醇体积分数对菜用大豆荚壳中异黄酮得率的影响
选择乙醇体积分数65%, 70%, 75%, 80%, 85%, 90%进行研究, 按照料液比为1∶20, 温度为40℃下超声提取30 min。
乙醇体积分数对菜用大豆荚壳中异黄酮得率的影响见图5。

图5 乙醇体积分数对菜用大豆荚壳中异黄酮得率的影响
由图5可知, 当乙醇体积分数为75%时, 菜用大豆荚壳中异黄酮得率最高。乙醇体积分数低于75%时, 随着体积分数的上升异黄酮得率也逐渐提高;当乙醇体积分数高于75%时, 异黄酮得率随着体积分数上升而逐渐降低, 原因可能是菜用大豆荚壳中异黄酮的极性与75%乙醇的极性相近[11], 且过高的浓度可能破坏了溶解出的异黄酮, 使得率降低。因此, 选择70%, 75%, 80%作为正交试验的乙醇体积分数范围。
2.3.3 超声时间对菜用大豆荚壳中异黄酮得率的影响
选择超声时间25, 30, 35, 40, 45, 50 min进行研究, 按照料液比为1∶20, 乙醇体积分数为85%, 超声温度为40℃下进行提取。
超声时间对菜用大豆荚壳中异黄酮得率的影响见图6。

图6 超声时间对菜用大豆荚壳中异黄酮得率的影响
由图6可知, 超声时间为25~40min时, 菜用大豆荚壳中异黄酮得率快速提高, 且在40 min时到达最高, 之后随着时间的增加, 异黄酮得率反而下降。原因可能是超声波具有较强的机械剪切作用, 使得异黄酮裂解, 结构被破坏, 含量减少[11];而且过长的时间可能会使溶解的杂质增多, 降低了异黄酮的纯度, 得率降低。因此, 选择35, 40, 45 min作为正交试验的超声时间范围。
2.3.4 超声温度对菜用大豆荚壳中异黄酮得率的影响
选择超声温度30, 40, 50, 60, 70, 80℃进行研究, 按照料液比为1∶20, 乙醇体积分数为85%, 超声提取30 min。
超声温度对菜用大豆荚壳中异黄酮得率的影响见图7。

图7 超声温度对菜用大豆荚壳中异黄酮得率的影响
由图7可知, 超声温度为30~60℃时, 菜用大豆荚壳中异黄酮得率随着温度上升而逐渐提高, 并在60℃时达到最高, 之后随着温度的上升, 异黄酮得率逐渐下降。原因可能是温度的上升使得溶剂渗透作用加强, 分子扩散运动加快, 异黄酮的溶出量也随之增多;但是, 过高的温度反而会影响稳定性, 使异黄酮的结构被破坏, 进而导致异黄酮得率降低。因此, 选择50, 60, 70℃作为正交试验的超声温度范围。
2.4 正交试验结果与分析
L9(34)正交试验分析见表3。
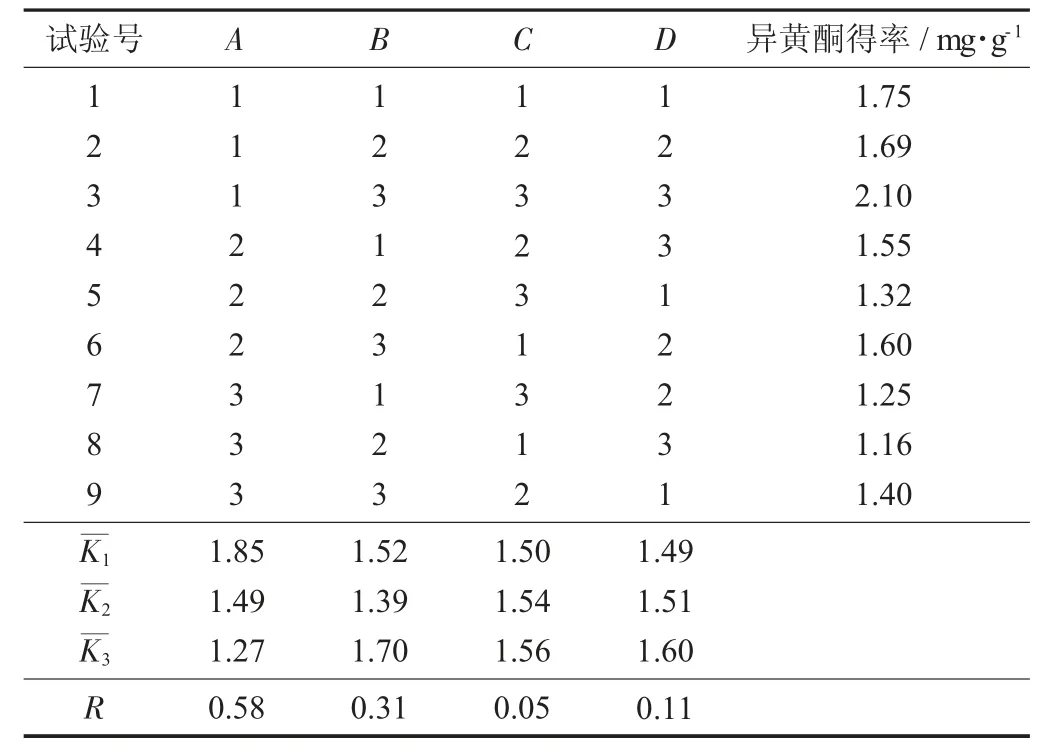
表3 L9(34)正交试验分析
由表3可知, 这4个因素均对菜用大豆荚壳中异黄酮得率有影响, 其中料液比对异黄酮得率影响最大, 而超声时间对异黄酮得率影响最小, 影响的顺序为A>B>D>C, 即料液比>乙醇体积分数>超声温度>超声时间。最佳工艺条件组合为料液比1∶10(g∶mL), 乙醇体积分数80%, 超声时间45 min, 超声温度70℃。在此条件下进行验证试验, 得到菜用大豆荚壳中异黄酮得率为2.39 mg/g, 低于大豆荚壳中异黄酮的含量, 为3.5 mg/g[11]。
2.5 抑菌作用结果与分析
菜用大豆荚壳中异黄酮提取液对2种菌的抑菌圈直径见表4。

表4 菜用大豆荚壳中异黄酮提取液对2种菌的抑菌圈直径/mm
表4中数据为平行3次, 共6组数据的平均值且均已减去8 mm纸片的直径。由表4可知, 菜用大豆荚壳中异黄酮提取液对大肠杆菌和金黄色葡萄球菌均有一定的抑制作用。其中, 大肠杆菌的抑菌圈直径大小为3.83±1.77 mm, 金黄色葡萄球菌的抑菌圈直径大小为11.50±2.75 mm, 抑菌效果良好。对照组浸泡蒸馏水的纸片未出现抑菌圈。
根据革兰氏染色法可将细菌分为革兰氏阴性菌和革兰氏阳性菌, 大肠杆菌为革兰氏阴性菌, 金黄色葡萄球菌为革兰氏阳性菌。经过上述分析可以推断出, 菜用大豆荚壳中异黄酮提取液对革兰氏阳性菌的抑制作用高于革兰氏阴性菌。
2.6 抗氧化性结果与分析
2.6.1 对DPPH自由基的清除效果
菜用大豆荚壳中异黄酮提取液和维C对DPPH自由基的清除效果见图8。

图8 菜用大豆荚壳中异黄酮提取液和维C对DPPH自由基的清除效果
由图8可知, 维C和菜用大豆荚壳中异黄酮提取液在对DPPH自由基的清除上都有较好的效果, 且清除率与浓度呈正相关趋势。此外, 在不同质量浓度下, 异黄酮提取液对DPPH自由基的清除率均小于维C, 但仍有良好的效果, 在质量浓度为1 mg/mL时, 菜用大豆荚壳中异黄酮提取液对DPPH自由基的清除率为86.97%, 与黄福气等人[18]报道的酱油渣异黄酮纯化物对DPPH自由基的89.18%清除率相近。
2.6.2 对羟基自由基的清除效果
菜用大豆荚壳中异黄酮提取液和维C对羟基自由基的清除效果见图9。

图9 菜用大豆荚壳中异黄酮提取液和维C对羟基自由基的清除效果
由图9可知, 维C和菜用大豆荚壳中异黄酮提取液在清除羟基自由基上都有着较好的效果, 且清除率与浓度呈正相关趋势。当质量浓度为0.2~0.6 mg/mL时, 异黄酮提取液的清除率略低于维C;当质量浓度达到0.8 mg/mL时, 异黄酮提取液对羟基自由基清除率超过了维C;在质量浓度为1 mg/mL, 菜用大豆荚壳中异黄酮提取液对羟基自由基的清除率为68.96%, 高于李超峰等人[19]报道的银杏果外种皮总黄酮57.85%的羟基自由基的清除率, 清除效果良好。
3 结论
以菜用大豆荚壳为原材料, 利用超声波辅助提取其中的异黄酮, 通过单因素试验和正交试验优化了提取工艺, 并对得到的异黄酮提取液进行了抑菌和抗氧化性研究, 得到菜用大豆荚壳中异黄酮的最大吸收波长为263 nm, 最佳提取工艺条件组合为料液比1∶10(g∶mL), 乙醇体积分数80%, 超声时间45 min, 超声温度70℃。该条件下提取得到菜用大豆荚壳中异黄酮的得率为2.39 mg/g。在抑菌试验中, 菜用大豆荚壳中异黄酮提取液对大肠杆菌和金黄色葡萄球菌的抑菌圈平均直径分别为3.83±1.77 mm和11.5±2.75 mm, 有一定的抑菌作用。在抗氧化性研究中, 当质量浓度为1 mg/mL时, 菜用大豆荚壳中异黄酮提取液对DPPH自由基和羟基自由基的清除率分别为86.97%和68.96%, 说明其具有良好的抗氧化性。
研究结果表明, 在菜用大豆荚壳中含有一定量的异黄酮, 并且在抑菌和抗氧化方面均有不错的效果。这为利用果蔬废弃资源研制天然食品防腐剂提供了理论依据。

