一种野外采集臭虫种群实验室驯化饲养方法的研究*
李 静 阎 婷 周小洁 佟 颖 曾晓芃
(北京市疾病预防控制中心,北京 100013)
臭虫属于半翅目(Hemiptera)臭虫科(Cimicidae),是一类专吸动物血液的无翅昆虫,在人居环境中嗜吸人血,人体被臭虫叮咬后会出现皮肤红肿、瘙痒等症状(Goddardetal.,2009)。此外,在热带臭虫Cimexhemipterus体内和粪便中均发现了与人类疾病相关的五日热巴尔通体(Leulmietal., 2015);实验室条件下温带臭虫C.lectularius可以携带克氏锥虫Trypanosomacruzi,并能够在小鼠间传播恰加斯病( Salazaretal., 2015)。
20世纪40—50年代,臭虫危害较为严重,随着DDT等化学杀虫剂的使用,臭虫的发生数量大大降低。20世纪90年代臭虫危害复现,进入21世纪,臭虫在51个国家和地区再猖獗,我国臭虫危害也有明显上升趋势(Wangetal., 2013, 2015)。由于臭虫的历史危害及近期再猖獗严重,使得针对臭虫的各项研究愈发得到各界重视,而许多如臭虫生态学、抗药性、药效等研究的基础是臭虫种群的实验室维持与饲养,长期驯化后的实验室敏感种群不能完全代表野外种群的生理状态与习性。但野外臭虫种群在实验室条件下的维持、饲养与驯化的难度较大,与试虫采集数量、血源供应、饲养环境等因素密切相关,逐渐成为限制许多研究的因素。为此,本研究建立一种臭虫种群的实验室快速驯化饲养方法,为臭虫的相关研究奠定基础。
1 材料与方法
1.1 试虫
温带臭虫C.lectularius2020年9月采自北京市海淀区某集体宿舍。
1.2 设备耗材
人工气候箱(三洋MLR-351 H)、加热循环槽(bluepard MP-5 H)、玻璃标本缸(直径约20 cm,高约30 cm)、玻璃果酱瓶(180 mL,高约9.0 cm,底部直径约5.6 cm,口径约6.6 cm)、小鼠固定夹、Parafilm薄膜、玻璃喂血器(Montesetal.,2002)、定性滤纸(80 g/m2)。
1.3 饲养条件确定
通过Pubmed、Web of Science、中国知网数据库,以“bed bug”“artificial feeding”“臭虫”为关键词进行检索,对检索结果进行手工筛选,获取涉及臭虫饲养方法的文献,将文献中相关饲养条件进行比较分析,确定饲养环境、容器等参数,然后开展后续实验。
1.4 饲喂方法
小白鼠饲喂:用固定夹将小白鼠(KM系,体重为35~40 g雌鼠)固定,用腹部供臭虫吸血。人工膜饲喂:采用无菌脱纤维兔血(Solarbio)经水浴加热后使用薄膜喂血器喂血。
1.5 试虫分组
将上述野外采集的臭虫分为对照组与实验组,对照组一直采用活体小白鼠饲喂;实验组驯化时每次优先采用人工膜饲喂,随后用小白鼠补充,以确保种群正常繁殖。每次喂血期间每隔1 h记录试虫的饱血情况,以观察臭虫腹部血液充盈、没有可见的浅色区域为饱血标准。计算不同时间的臭虫饱血率(%),即饱血试虫数占喂血试虫总数的百分比。对照组和实验组各重复3次,每个重复30只试虫。
1.6 统计分析
采用 WPS Office表格对实验数据进行统计,计算对照组和实验组臭虫饱血率的平均数。
2 结果
2.1 环境参数
2.1.1温湿度 文献表明,实验室饲养的温度主要介于26~28 ℃,相对湿度为40%~70%(表1)。因此,综合考虑不同研究中所选取的温湿度、饲养设备的维护与稳定性,本研究将臭虫饲养的温湿度设置为26 ℃,50%RH。
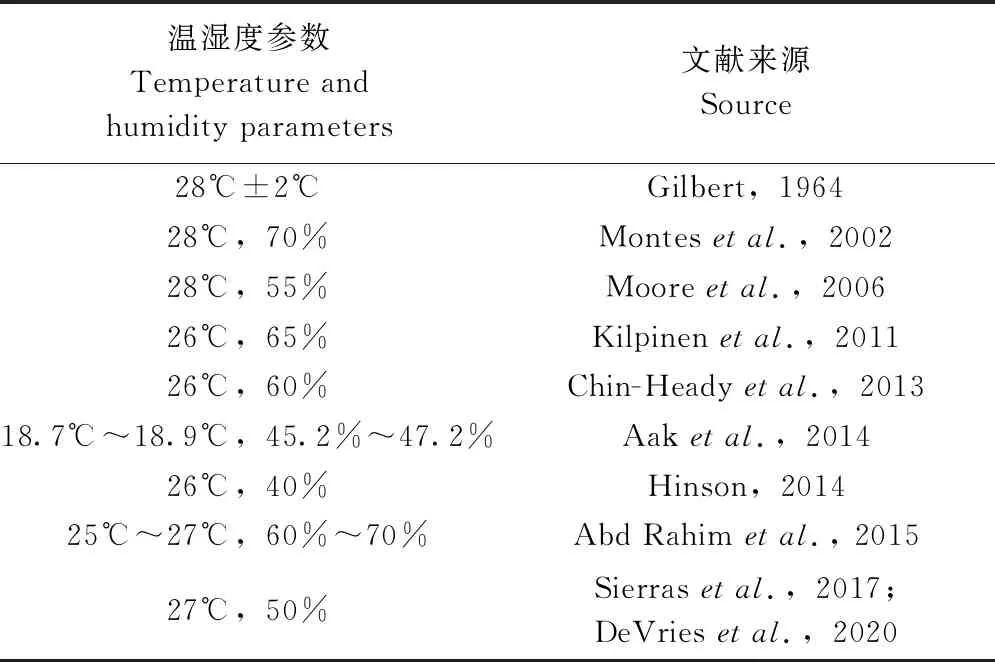
表1 不同文献中臭虫饲养的温湿度参数
2.1.2光周期 关于臭虫实验室饲养的光照条件主要为12 L∶12 D(表2)。因此,将臭虫饲养的光周期设置为12 L∶12 D。

表2 臭虫人工饲养的光照条件
2.2 饲养容器
在国外的文献中,臭虫人工饲养多使用果酱瓶或塑料瓶等小型容器,纱网封口,臭虫透过纱网吸血(Gilbertetal.,1964; Montesetal.,2002; Chin-Headyetal.,2013)。参照Feldlaufer等(2014)的描述,本研究采用金属盖果酱瓶作为饲养容器,将不锈钢编织网(80目)用免钉胶固定在金属盖内,将裁减到适宜尺寸的长方形滤纸折叠后放入罐内(图1)作为臭虫栖息点。本研究利用商品化果酱瓶加以改进后进行实验,完全达到了臭虫的吸血、繁殖以及有效防止低龄若虫逃逸的目的。根据观察,每个饲养罐中臭虫密度维持在200只左右可达到较好的吸血与繁殖状态。

图1 臭虫饲养罐
2.3 驯化方式
臭虫饲养主要有活体动物饲喂和人工膜饲喂2种方式(Aaketal., 2014;Montesetal., 2002;王磊等,2016),前者主要使用实验用小白鼠,后者采用人工膜系统配合兔血、鸡血、羊血和牛血等血源。按照本研究驯化策略,对照组臭虫一直采用活体小白鼠饲喂;实验组试虫每次先采用人工膜饲喂,发现F0~F1代臭虫基本不吸血,然后用小白鼠饲喂,虽然吸血率较低,但可维持种群的正常繁殖。从F2代开始,1龄若虫开始取食人工膜血,便以F2代的3~4龄若虫为实验对象,以饱血率为指标,比较小白鼠供血、人工膜与小白鼠混合供血两种喂血方式的吸血情况。结果显示,以人工膜饲喂时,在5 h后臭虫饱血率维持在72.84%±4.62%,至6 h并不再继续取食,6 h后改为小白鼠持续饲喂至24 h;20 h时吸血率达到92.84%±3.04%,且至24 h不再吸血。对照组试虫的F2代以活体小白鼠为血源,在5 h后饱血率为51.11%±10.86%,20 h饱血率可达到93.33%±2.72%,同样至24 h不再吸血(图2)。

图2 野外采集臭虫种群F2代(3~4龄若虫)不同喂血方式饱血率比较
3 讨论
3.1 环境参数
臭虫生活史与环境温度有重要关系,其不同温度下发育时间存在较大差异性,23 ℃时生活史周期为46 d,28 ℃时生活史周期为31 d(姜志宽等,2012),不同研究中饲养温度多为26~28 ℃,光周期多为12 L∶12 D。本研究中臭虫饲养环境温度和光周期的参数主要来源于参考文献。相对湿度低时不利于臭虫的生长发育,但相对湿度过高时,易导致饲养罐内孳生霉菌。综合不同来源文献中臭虫饲养环境参数,本研究将温度设定为26 ℃,相对湿度50%,光周期为12 L∶12 D。
3.2 饲养容器
本研究最初用圆柱状玻璃标本缸作为饲养容器,将野外采集的臭虫移至折叠的滤纸条上,放入标本缸内,将小白鼠用可折叠的网状固定夹固定后放入玻璃标本缸中供臭虫吸血。连续观察吸血情况发现,使用该喂血方式臭虫基本不吸血,10 d后野外采集的臭虫死亡率达30%。对于野外采集的臭虫种群,其寄主由人转换到小白鼠,加之采集的虫量有限,在空间相对大的昆虫饲养缸中,臭虫吸血效率极低,甚至无法完成吸血,因此,该容器并不适合于野外臭虫种群前期在实验室驯化饲养。
为此,本研究转为使用国外文献中最为常用的果酱瓶,并对瓶盖加以改进。参考文献中的饲养容器(Feldlauferetal., 2014),将尼龙纱网更换为不锈钢纱网(80目,丝径0.1 mm,孔径0.21 mm),并将之粘固在金属盖内,同时使用硅胶垫圈(厚度1 mm)加固。既避免了在试虫转移过程中附着在纱网上的臭虫逃逸,又能避免使用固定夹进行小白鼠活体喂血时鼠爪破坏尼龙网而引起的臭虫逃逸。研究最后选用的饲养容器为180 mL果酱瓶,在该容器中饲养臭虫种群数量既能满足实验需要,又便于饲养罐的日常清理和试虫挑选。
3.3 驯化方式
在寄主搜索过程中,寄主源物质如CO2、挥发性气味和寄主体温能够对臭虫起到定向吸引作用(Marx,1955)。研究表明,CO2本身或与人类的气味和热量相结合,是臭虫最重要的宿主觅食线索(Marx, 1955; Andersonetal., 2009; Wangetal., 2009)。臭虫的饲养方式主要有活体动物和人工膜饲喂两种方式。在70份臭虫实验室饲养的调查报告中,50%采用人工膜供血,23%采用实验室动物,10%采用人体作为血液来源,7%采用人工膜和自然饲养相结合的方式,还有10%未描述其饲养方法(Aaketal., 2014)。因此,寄主的改变是野外采集的臭虫种群在实验室驯化饲养的主要影响因素,这也部分解释了野外采集臭虫在前2代无法准确定位人工喂血器的原因。采用活体饲喂,具有血源易得、血液新鲜等优点,但由于小白鼠备皮、固定等操作方式,导致臭虫吸血情况不稳定,且可能有不符合动物福利和伦理审查等问题。而人工膜饲喂法具有操作方便、效果稳定、易标准化等优点。本研究主要采用较为普遍的脱纤维兔血作为人工膜血源与活体小白鼠两种喂血方式进行比较分析,野外采集到的F0代试虫采用人工膜喂血时,基本不吸血,这可能与寄主的突然改变有关,进而采用小白鼠活体饲喂,饱血率也相对较低,F1也存在上述现象。实验室人工饲养时间短的野外采集臭虫种群,采用人工膜饲喂吸血效果不佳(Kilpinenetal.,2011),也有文献报道在实验室用活体动物和人工膜饲喂,臭虫均可正常繁殖(Montesetal.,2002;Chin-Headyetal.,2013)。以1%肝素抗凝的人血和活鼠为血源饲喂的臭虫,随着时间的推移,其生命周期与死亡率没有显著差异(Aaketal., 2014),但这些实验所用臭虫种群均已在实验室内驯化养殖2年以上。
本研究中,野外臭虫种群F0和F1代在实验室无法使用人工膜饲喂,但从F2代开始逐步接受人工膜饲喂方式,且在6 h内饱血率可达到72.84%±4.62%,而以小白鼠为血源的对照组在6 h内饱血率仅为54.44%±12.45%。这可能与小白鼠被吸血时的身体震颤影响臭虫取食有关,但是随着时间延长至24 h其饱血率可达到93.33%±2.72%。因此,为了确保种群驯化效果,本研究从F2代开始采用混合饲喂的方式,即首先用人工膜饲喂(时间大约4 h),然后用小白鼠针对不适应人工膜的臭虫个体进行补充喂血。通过该方式使得该种群的整体饱血率与单纯用小白鼠供血的对照组基本保持一致。需要指出的是,由于脱纤维动物血液静置易产生溶血和红细胞沉淀,经多次实验证明,臭虫在饲喂4 h后饱血率基本保持不变。因此,在人工饲喂中观察饱血率的时间上限为4 h。
根据本研究中饱血率实验结果可知,野外臭虫F0和F1代最好使用小白鼠进行活体饲喂;对于不同的野外种群,需要持续用小白鼠饲养的代数取决于种群的特点,本研究结果是针对该种群,可以为其他研究者提供参考思路。虽然F2代的3~4龄若虫采用人工饲喂在6 h内的吸血率显著高于采用活体小白鼠饲喂,但连续活体饲喂20 h后臭虫饱血率可达92.84%±3.04%。因此,在野外臭虫种群的实验室驯化初期,采用小白鼠进行连续活体饲喂,后续采用活体饲喂与人工膜饲喂混合饲养,并逐步过渡到纯人工膜饲喂的方式,有助于快速稳定地完成野外臭虫种群的实验室驯化。
- 寄生虫与医学昆虫学报的其它文章
- GW4869与Pitstop2抑制发热伴血小板减少综合征病毒胞间传播的效果观察*
- 埃及伊蚊肽聚糖识别蛋白PGRP-S2的克隆及原核表达*
- 滇西南山地农耕区小兽多样性空间分布格局及与寄生蚤关系*
- HIV/AIDS患者人芽囊原虫与蓝氏贾第鞭毛虫混合感染病例分析
- WHO—ECAMM标准在疟原虫感染效能检测中的应用研究
- AN ALTERNATIVE CELLULAR MODEL FOR GENETIC VARIATIONS OF JAPANESE ENCEPHALITIS VIRUS IN THE TRANSMISSION PROCESS BETWEEN VERTEBRATES AND MOSQUITOES*

