水分胁迫对发草种子萌发和幼苗生长的影响
孟思宇,李晓青,魏小星,刘文辉,张永超,鲍根生
(青海省青藏高原优质牧草种质资源利用重点实验室 / 青海大学畜牧兽医科学院, 青海 西宁 810016)
近年来,由于全球气候变暖和人类活动等因素的综合作用造成青藏高原高寒湿地面积呈持续缩减[1-2]。同时,青藏高原特殊的地理环境和生态系统的脆弱性成为退化高寒湿地修复主要限制因素[3-4],而适应湿地环境的草种匮乏是现阶段高寒湿地植被修复的瓶颈问题[5-6]。可见,从原湿地草地群落筛选出对高寒湿生环境适应性较强的乡土草种是实现高寒退化湿地植被修复的有效途径。
发草(Deschampsia caespitosa)系禾本科发草属多年生草本植物,是青藏高原高寒湿地和高寒沼泽重要的乡土草种[7],成为退化高寒沼泽湿地植被恢复的重要生态型草种[8]。国外有关发草研究起步较早,发现发草对非生物逆境(冷冻、干旱、贫瘠土壤、水淹、重金属)表现出较强适应性[9-11];同时,发草也表现出耐牧、抗虫和抗病能力[12-13]。相比之下,国内有关发草研究较少,主要集中于种子萌发特性、种子繁殖技术、栽培驯化和适生地植物群落特征等方面[7,14-17]。另外,国外研究发现发草是一种表型可塑性较强的植物,这与发草植株形态、生理、生长发育及繁殖特性等相关[9-10,12,18]。表型可塑性是植物同一基因型在不同环境中表现出不同表型差异的特性,表型差异是植物应对不同生物和非生物逆境的关键生存策略[19-20]。其中,土壤水分是植物种子萌发和幼苗生长阶段所经历的最普遍的环境胁迫之一,成为影响植物种群更新潜力和扩张能力的外部关键限制因素[21-22]。
Evans 和Etherington[23]研究发现采自湿地环境的种子对水分胁迫非常敏感,而干旱区植物种子表现出较强的干旱适应能力。Ludewig 等[24]研究也发现湿润区和干旱区生境的种子在水分胁迫条件下出现明显差异。可见,种子成熟环境的水分条件对植物种子萌发和幼苗生长表现出较强的生态生理特性的可塑性。然而,有关不同采集地发草种子如何响应水分胁迫及地理生境对发草种子萌发特性是否存在可塑性等方面的研究尚未开展。
基于此,本研究以四川省和青海省5 个不同采集地的发草种子为研究对象,采用不同浓度PEG-6000模拟水分胁迫的方法研究水分胁迫对发草种子萌发和幼苗生长影响,旨在明晰水分胁迫对发草种子萌发和幼苗定植的影响,确定不同采集地发草种子萌发的基础水势,进而为利用发草修复和治理青藏高原退化高寒湿地提供基础数据。
1 材料与方法
1.1 试验种子来源
2014 年8 月至9 月中旬发草种子成熟季节在青海省西宁市大通县水滩地、四川省松潘县高寒灌丛及红原县高寒湿地采集发草种子(表1),采集标准为发草是采集地草地群落优势种(盖度高于50%),每个种群随机采集30 株单株。带回实验室并置于4 ℃冰箱备用。
1.2 试验设计
1.2.1种子处理
随机挑选部分大小均匀、籽粒饱满的不同采集地发草种子,用1%次氯酸钠溶液消毒5 min,随后用蒸馏水冲洗数次,晾干备用。
1.2.2不同渗透势PEG-6000 溶液配制
参照Michel 和Kaufmann 方法[25],将PEG-6000配制成渗透势分别为-0.2、-0.4、-0.6、-0.8、-1.0 和-1.2 MPa 的处理液,以添加蒸馏水为对照,在直径12 cm 灭菌培养皿内放置双层定性滤纸[双圈牌,通用电气生物科技(杭州)有限公司],然后在不同处理的培养皿中分别添加不同渗透势处理液,对照组加入5 mL 蒸馏水。随机挑选50 粒消毒的不同采集地发草种子摆放于培养皿内,5 次重复,称量每皿的初始重量。将供试培养皿置于人工气候箱(RTOP,杭州拓普仪器有限公司)内,在25 ℃(前期试验中发草种子最适温度)、相对湿度80%、10 h 光照/14 h黑暗条件下进行发芽试验,每隔24 h 依据初始培养皿重量补充适量蒸馏水。每日定时观察种子发芽情况,种子胚根长2 mm 视为发芽种子,直至3 d 内未出现发芽种子。统计不同采集地发草种子发芽数量,计算发芽率(germination rate, GR)和发芽势(germination energy, GE)。同时,从每皿内随机挑选5 株幼苗测量幼苗高度和胚根长度。其中,发芽率和发芽势计算公式如下:

1.3 种子萌发水势模型
种子萌发速率与渗透势主要参照Bradford[26]方法:

式中:θH指特定种子种群水势常数(MPa·h),Ψ指发芽试验中设定水势,Ψb(g)指达到发芽分数g时所需的基本水势或临界阈值,tg指达到发芽分数g所需时间。同种种子种群Ψb(g)值呈正态分布,其中,中位数Ψb(50)、标准偏差σΨb被认为是该种子种群的特征值,上述特征值可通过重复概率分析方程计算[26-27]。


1.4 统计分析
采用单因素方差分析方法检测不同渗透势对同一采集地发草种子发芽率、发芽势、幼苗高度和胚根长度的影响。其中,不同渗透势为固定变量,种子发芽(发芽率和发芽势)和幼苗形态(幼苗高度和胚根长度)特性为响应变量。为满足变量方差齐性和正态分布要求,发芽率和发芽势采用对数转化,幼苗高度和胚根长度采用反正弦转化。所有数据利用SPSS 19.0 进行分析。
2 结果
2.1 渗透胁迫对不同采集地发草种子发芽率和发芽势的影响
渗透胁迫显著影响发草种子发芽率和发芽势(表2)。水分充足环境中发草种子发芽率和发芽势最高;而随着渗透胁迫增加,发草种子发芽率和发芽势快速降低;其中,QH1、QH2、QH3 和SC1 种子在-0.8 MPa 渗透环境中发芽率为0,SC2 种子发芽率仅为5.13%。随渗透胁迫增加至-1.0 MPa,SC2 种子发芽率为0;渗透胁迫增加至-0.6 MPa 时,不同采集地发草种子发芽势均为0 (图1)。不同采集地发草种子在相同渗透胁迫环境中发芽率和发芽势存在显著差异(表2) (P< 0.05),水分充足条件下各采集地发草发芽率和发芽势均表现为QH1 > SC2 >QH2 > QH3 > SC1,轻度渗透胁迫(-0.2、-0.4 MPa)环境下QH1 和SC2 发草发芽率和发芽势较高,发芽率显著高于QH2、QH3 和SC1 发草(P< 0.05);重度渗透胁迫(≥ -0.6 MPa)环境下不同采集地发草发芽率和发芽势差异不显著(P> 0.05)。
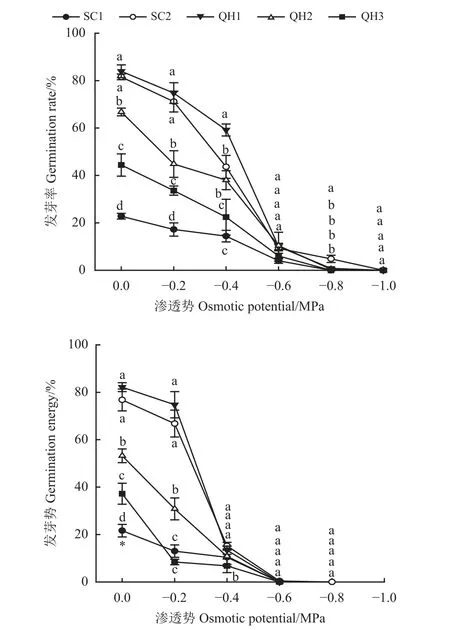
图1 不同采集地发草种子在不同渗透胁迫条件下发芽率和发芽势的变化Figure 1 Effects of different values of osmotic potential on seed germination rate and germination energy of Deschampsia caespitosa collected from five provenances
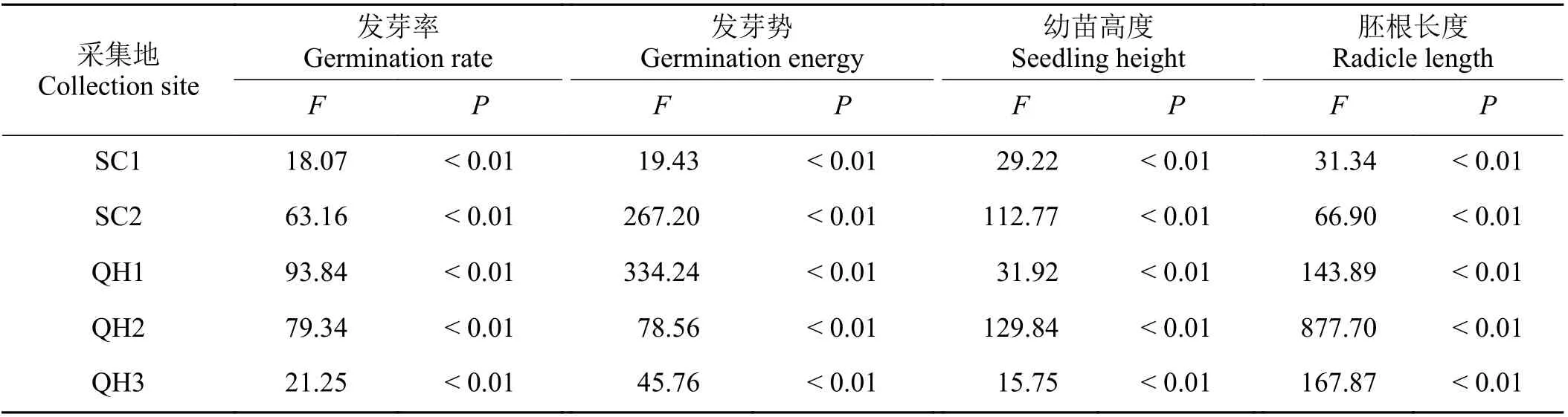
表2 不同渗透势对同一采集地发草种子发芽率、发芽势、幼苗高度和胚根长度影响的单因素方差分析Table 2 One-way analysis of variance results for seed germination rate, seed germination energy, seedling height, and radicle length of Deschampsia caespitosa collected from five provenances under different values of osmotic potential
2.2 渗透胁迫对不同采集地发草幼苗高度和胚根长度的影响
不同渗透胁迫显著影响发草幼苗高度和胚根长度(表2)。水分充足条件下,SC2 发草幼苗高度最高,而QH2 发草幼苗高度显著低于其他采集地发草幼苗高度(图2) (P< 0.05);随渗透胁迫增加,SC1、SC2 和QH1 发草幼苗高度快速降低,而QH2 和QH3 发草幼苗高度缓慢降低。在水分充足环境中SC2 胚根最长,而QH3 胚根最短;随渗透胁迫程度增加,SC2 发草胚根长度快速变短;在轻度胁迫环境中(≤ -0.4 MPa) QH1、SC1 和SC2 胚根长度显著大于QH2 和QH3 (P< 0.05),而渗透水势超过-0.4 MPa 后胚根长度快速降低且在-0.8 MPa 水势条件下胚根长度为0。
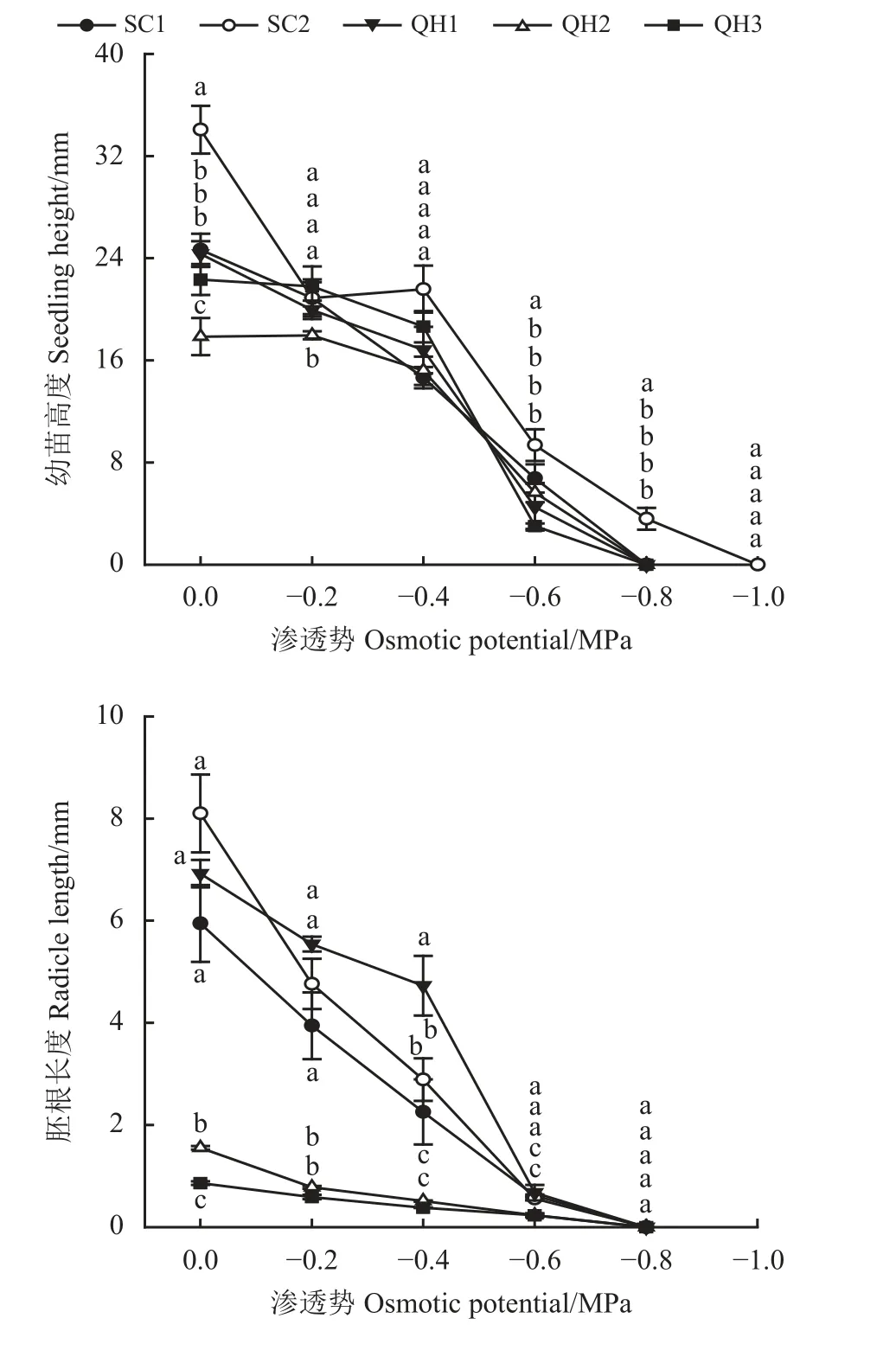
图2 不同采集地发草种子在不同渗透胁迫条件下幼苗高度和胚根长度变化Figure 2 Effects of different values of osmotic potential on seedling height and radicle length of Deschampsia caespitosa collected from five provenances
2.3 不同渗透势条件下发草种子萌发进程模型
低渗透势条件下(≤-0.6 MPa),水分拟合模型能准确预测SC1、QH1、QH2 和QH3 发草种子萌发进程(图3);而渗透势低于-0.8 MPa 时,水分模型能准确拟合SC2 种子萌发进程。另外,SC2 和QH1 发草种子Ψb(50)较低,分别为-0.44 和-0.51 MPa;而SC1 发草种子Ψb(50)最高(-0.05 MPa) (表3)。
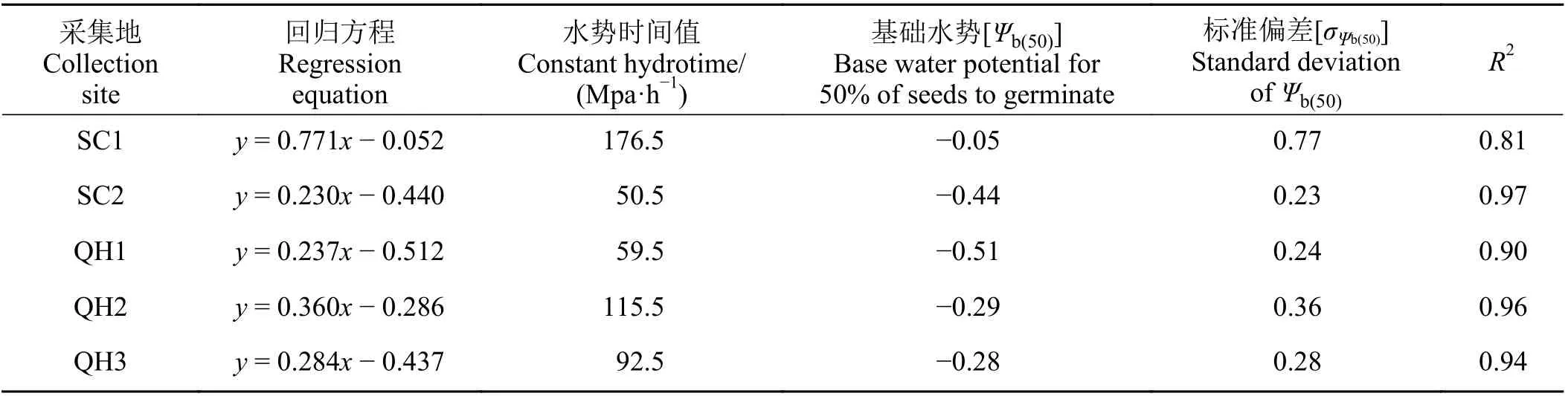
表3 基于水势模型估计不同采集地发草种子萌发的基础水势Table 3 Seed germination parameters for response of Deschampsia caespitosa collected from five provenances to water potential based on hydrotime model analysis
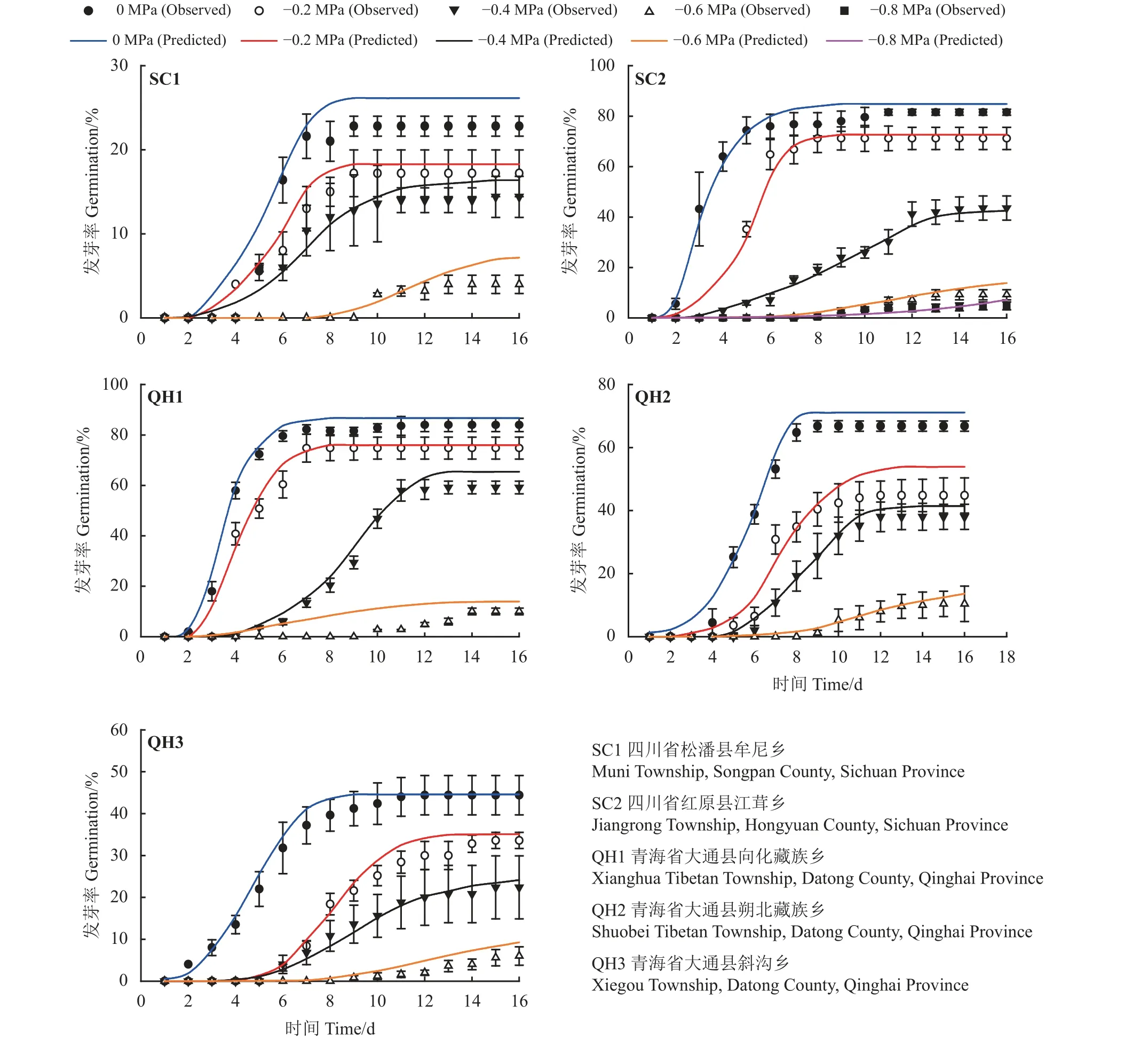
图3 不同采集地发草种子在不同渗透势条件下预测(线)和实测(点)萌发进程模拟Figure 3 Predicted (line) and observed (dot) germination time course of the response of Deschampsia caespitosa collected from five provenances to water potential
3 讨论
水分是影响植物种子萌发和幼苗定植的最关键非生物因素之一,也是决定植物种群稳定和扩张的内部驱动力[28-29]。大量研究结果表明,随着水分胁迫加剧,种子萌发数量会持续降低;同时,幼苗生长和根系发育也会被严重抑制,并最终造成植物种群存活率快速降低[30]。本研究发现,随着水分胁迫程度增加,供试发草种子发芽率、发芽指数、幼苗高度和胚根长度快速降低。尤其渗透胁迫大于-0.4 MPa 条件下,发草种子发芽特性和幼苗生长被严重抑制;当渗透胁迫超过-1.0 MPa 时,种子不能萌发。上述结果说明发草种子对水分胁迫较为敏感,轻度干旱易造成种子休眠,而重度干旱易造成发草种子永久休眠。造成这种现象原因主要为:发草生境主要为高寒草原、林地、河边和沼泽地带,生境内土壤含水量充盈是发草种子成功萌发的主要条件[12]。另外,发草植株在营养生长阶段保持较高的水分利用效率和较低的蒸腾速率,而这一过程将延续至生殖生长阶段,水分可能是影响发草成功形成种子的关键影响因子[31]。然而,雷舒涵等[32]对甘肃天祝地区采集发草种子水分胁迫研究发现,随水分胁迫程度增加,发草种子萌发率呈先增加后降低变化;造成这种差异原因主要与水分胁迫设定梯度相关,两个研究中轻度水分胁迫PEG 浓度分别为-0.1 和-0.2 MPa,从而推测发草抗旱能力较弱。另外,张睿昕等[14]研究发现在遭遇干旱和高温条件下,发草发芽率快速降低;徐秀丽[33]研究也发现滨发草(Deschampsia littoralis)在低温条件下能保持较高发芽率。这也为发草主要分布在高寒草甸、沼泽地和林地,而干旱草原和荒漠地带未曾出现发草种群提供直接证据。同时,上述研究也证实中低温度和水分充足是发草种子萌发的最适条件。
植物生长和种子形成环境对种子萌发能力存在调控作用[34],其中,土壤水分含量可调控种子萌发和决定幼苗存活能力[35-36]。Evans 和Etherington[23]研究发现种子萌发特性与种子形成环境的土壤含水量密切相关,干旱环境成熟的植物种子在土壤水分亏缺条件保持较高发芽率;而湿润环境成熟的种子在土壤水分亏缺条件下不能发芽。Lima 和Meiado[37]研究也发现土壤水分含量对仙人掌(Pilosocereus catingicola)种子发芽特性具有显著影响,表现为湿润环境中形成种子对干旱胁迫更为敏感;进一步证明不同生境对种子萌发特性具有较强的可塑性[38-39]。本研究发现四川省和青海省采集5 份发草种子发芽率存在明显差异(图1),根据左大康[40]按照年降水量对全国干湿地区的划分标准(年降水量 < 200 mm为干旱地区,200~400 mm 为半干旱地区,400~800 mm 为半湿润地区,年降水量 > 800 mm 为湿润地区),本研究结果表现为湿润区SC1 (降水量860 mm)和干旱区QH3 (降水量150 mm)发草种子发芽率最低,而半湿润区(降水量均值586 mm)种子发芽率较高。这表明采集地降水量过高或干旱条件均能抑制发草种子萌发,说明土壤含水量是发草种子萌发关键影响因素,而适度土壤含水量却能加速种子萌发进程。由此可见,不同生境对种子萌发特性具有一定可塑性,但对种子发芽能力调控能力表现出种间异质性[23,41]。
众多研究证明水势模型可准确预测植物种子萌发进程,已成为不同水分胁迫下种子萌发进程预测的经典方法[42-43]。基于不同水分胁迫梯度,水势模型可预测种子萌发Ψb(50)、水势时间和标准偏差等关键种子萌发指标,进而预测不同采集地植物种子萌发必备的基本参数值[26]。本研究也证明水势模型能较好地模拟不同采集地发草种子发芽进程,这一研究结果与其他植物种子利用水势模型预测种子萌发过程一致[36,44]。不同水分胁迫下发草种子萌发形成水势模拟进程与不同水势条件种子萌发率变化结果高度相似。例如,采集于SC2 和QH1 发草种子在不同水分胁迫条件下维持较高发芽率,而这与SC2 和QH1 发草种子具有较低的Ψb(50)和较短发芽周期结果相吻合;说明SC2 和QH1 发草种子萌发对水分要求不高,轻度干旱条件下种子能成功萌发。同时,SC1 发草种子发芽Ψb(50)较高且发芽周期较长也与SC1 在不同水分胁迫下发芽率较低结论一致,说明SC1 发草种子萌发对水分要求较高,充足水分条件下种子能快速萌发,而干旱条件下种子将进入生理休眠状态贮存于土壤,形成长久性种子库。另外,本研究初步通过构建水势模型来预测不同水分胁迫对发草种子萌发进程的影响,通过分析水势模型相关参数来预测种子萌发进程,进而深刻解读种子萌发过程中所涵盖的生态学和生物学意义[3,45]。这将进一步深刻理解水分在发草种子萌发过程的关键作用和揭示采集地生境在发草种子进程调控及萌发特性的可塑性。
4 结论
综上所述,本研究发现不同采集地发草种子萌发对水分胁迫敏感性存在差异。其中,水涝(SC1)或干旱环境(QH3)不利于发草种子萌发,而降水量介于400~800 mm 半湿润环境(SC2、QH1 和QH2)是发草种子萌发的理想生境;这一研究结果为发草主要分布区为高寒林地、沼泽等湿生环境提供直接证据。同时,也证明水分是影响发草种子成功萌发和种群快速建植的关键限制因子。另外,水势模型预测不同采集地发草的基础水势也将为利用发草对不同退化湿生草地开展植被恢复提供基础数据。

