玉米中ClassⅠ和ClassⅡNAS蛋白之间的BiFC互作研究
肖克,周晓今,陈茹梅,逄森*
1.中国农业大学理学院应用化学系,北京100193;
2.中国农业科学院生物技术研究所,北京100081
矿质元素作为植物营养成分虽然所需量不多,但对植物的生长和发育必不可少。在多种植物必需矿质元素中,需求量较大的铁元素在光合作用、呼吸作用和叶绿素生物合成等反应中起重要生理作用,也是铁结合蛋白的重要辅助因子[1]。虽然土壤中并不缺铁,但是铁易被氧化,所以其在土壤中的溶解度较低,难以被植物吸收和利用[2]。因此植物进化出两种方式进行铁吸收。机制Ⅰ主要存在于非禾本科植物中:酸化土壤中的铁元素由铁还原酶(ferric-chelation reductase-oxidase,FRO)将Fe3+还原为Fe2+,再经铁调节转运蛋白(iron-regulated transporter,IRT)吸收进入植物体内[3]。禾本科植物主要利用机制Ⅱ吸收铁元素:依靠麦根酸转运蛋白(MAs efflux transporter 1,TOM1)将麦根酸(mugineic acid,MA)分泌至土壤中用以螯合铁元素,形成的Fe3+-MA螯合物被黄色条纹/黄色条纹样转运蛋白(yellow stripe/yellow stripe like,YS/YSL)运输至根细胞内[4-6]。
铁元素在植物体内的运输需要螯合物辅助[7]。烟草胺(nicotianamine,NA)是一种内源性金属螯合剂,其具有促进金属离子在韧皮部和木质部转运的作用[8-9]。NA可防止铁的沉降,并在铁运输到各个器官的过程中起到至关重要的作用[10],同时NA通过螯合作用可以有效阻碍游离的Fe2+与过氧化氢反应产生大量的羟基自由基,最大限度地减少铁的毒性[11]。同时,NA也是合成MA的前体物质[12]。此外,NA能够有效地逆转抗营养因子的影响,是人和其他动物对食物中铁吸收的最佳促进剂之一[13-14],NA还可以有效地介导哺乳动物小肠对于铁元素的摄取[15]。因此,NA和Fe2+-NA对植物中铁营养的吸收利用具有重要作用。
NA是最早在烟草中发现的一种非蛋白氨基酸[16],其合成首先由L-甲硫氨酸与ATP形成腺苷甲硫氨酸(S-adenosyl-L-methionine,SAM),随后三分子SAM在烟草胺合成酶(nicotianamine synthase,NAS)催化作用下合成为NA[17]。NAS基因最早在大麦中被发现,其广泛分布于高等植物中,且在禾本科植物中以多基因家族形式存在[18]。水稻、大麦和小麦基因组中分别鉴定到了3、9、21个NAS家 族 成员[18-20],玉 米 中 发 现9个基 因 编 码NAS。此外,禾本科植物的NAS在进化上可分化为两个亚家族——ClassⅠ和ClassⅡ。已有研究推测两个亚家族NAS分别调节Fe的吸收和运输,但具体生理功能尚不清楚[21-23]。NAS蛋白的活性可直接影响植物体内NA的合成,从而影响植物对铁的摄取和体内分布[24]。NAS基因已被认为是提升作物微量营养素含量的重要靶点[9,25]。因此,进一步了解NAS的调控机理对于植物铁营养强化具有重要价值。
通过NAS家族成员的蛋白序列比对发现,ClassⅡZmNAS具有特异的N端可变结构域,但已有研究显示,该N端可变结构域并不参与调节ZmNAS的亚细胞内定位[23]。因此探究ClassⅡ成员N端可变结构域的功能具有重要的研究意义。目前尚未有关于NAS蛋白互作的报道,本研究聚焦于N端可变结构域是否对蛋白互作产生影响,通过玉米叶肉细胞原生质体瞬时转化和BiFC技术研究两个亚家族(ClassⅠ和ClassⅡ)成员间的相互作用,以期为阐明禾本科作物玉米NAS家族蛋白功能提供基础依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 玉米B73自交系种子由中国农业科学院生物技术研究所提供;玉米种子经过表面消毒,于28℃温室,在蛭石中萌发4 d,再将幼苗置于28℃黑暗培养箱中进行培养,并于三叶期分离叶片原生质体。
1.1.2 试验试剂RNA提取试剂盒、cDNA第一链的合成试剂盒、B载体试剂盒和大肠杆菌感受态细胞DH5α购于北京全式金生物公司;KOD高保真酶购于东洋纺公司;琼脂糖胶DNA回收试剂盒购于上海博彩生物科技有限公司;大提质粒试剂盒购于Promega公司。
转化玉米原生质所需的试剂:①W5缓冲液:0.2 mol·L-1MES 2.0 mL,2.0 mol·L-1NaCl 15.4 mL,2.0 mol·L-1KCl 0.5 mL,1.0 mol·L-1CaCl225.0 mL,加ddH2O定容到200.0 mL。②MMg缓冲液:0.2 mol·L-1MES 2.0 mL,2.0 mo·lL-1MgCl20.75 mL,0.8 mol·L-1甘 露 醇50 mL,加ddH2O定 容 至100.0 mL。③酶解液:称取1.46 g甘露醇,0.3 g纤维素酶R10和0.08 g离析酶R10,加0.2 mol·L-1MES 2.0 mL和2 mol·L-1KCl 0.2 mL,用ddH2O定容至20.0 mL,并调节pH至5.7。在55℃水浴中孵育10 min,然后冷却至室温。加入0.2 mL 1 mol·L-1CaCl2,20 mg的BSA,再用0.45 μm的滤器过滤后使用。
1.1.3 配制LB培养基 称取10.0 g氯化钠、10.0 g胰蛋白胨和5.0 g酵母提取物,若配制固体培养基需另外加入15.0 g琼脂粉,随后加蒸馏水溶解并定容至1.0 L,配制好后,高温高压灭菌(121℃,15 min),然后加入Amp/Kan抗生素(每100 mL培养基加入100 μL)。
1.1.4 载 体pRTL2-GFP、pRTL2-YFPN(pYFPN)和pRTL2-YFP(CpYFPC)载体由中国农业科学院生物技术研究所提供。引物合成及测序工作由北京博迈德生物科技有限公司完成。
1.2 方法
1.2.1 生物信息学分析 根据已知的ZmNAS基因,并通过MaizeGDB(www.maizegdb.org)中找出ZmNAS1;1(GRMZM2G385200)、ZmNAS1;2(GRMZM 2G312481)、ZmNAS2;1(GRMZM2G030036)、Zm-NAS2;2(GRMZM2G124785)、ZmNAS3(GRMZM2G 478568)、ZmNAS4(GRMZM2G439195)、ZmNAS5(GRMZM2G050108)、ZmNAS6;1(GRMZM2G7044 88)、ZmNAS6;2(AC233955.1_FGT003)基因的全长CDS序列,利用DNAMAN7.0软件进行翻译及进行NAS家族各成员蛋白结构域比对;通过SWISS-MODEL对NAS家族蛋白三级结构进行预测。
1.2.2ZmNAS家族代表基因克隆 以三叶期玉米B73野生型植株为材料,进行液氮速冻研磨,利用RNA提取试剂盒提取总RNA,通过电泳和吸光度检测RNA的浓度,以RNA为模板反转录成cDNA,cDNA合成反应程序:42℃孵育30 min,85℃加热5 s,降温至4℃后取出,置于-20℃保存。以cDNA为模板,通过ZmNAS1、ZmNAS3和ZmNAS3∆N基因的特异上游引物和下游引物(表1),扩增得到目的基因的开放阅读框序列。应用电泳检测PCR扩增序列,切取含目的片段的琼脂糖,利用DNA回收试剂盒回收开放阅读框序列,并以其为模板,应用表1中同源重组末端的引物PCR扩增得到目的片段。回收目的条带与B载体连接,转化大肠杆菌感受态细胞DH5α,涂布在含有氨苄青霉素抗性(ampicillin resistance,Amp)的平板中,在合适的条件下培养,挑单克隆摇菌,PCR验证后,送往北京博迈德基因技术有限公司进行测序[26]。
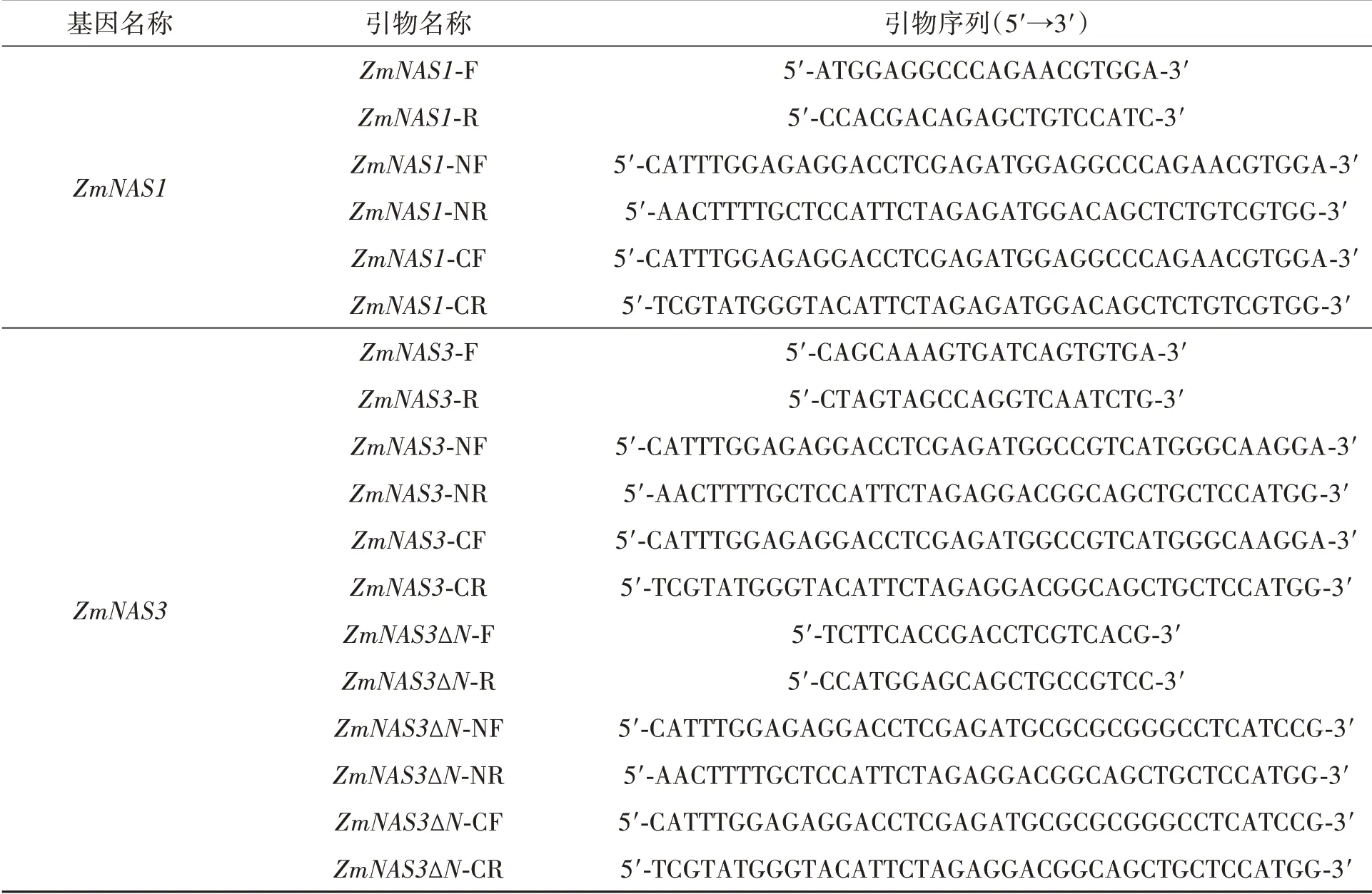
表1 PCR扩增所用引物Table 1 Primers used in PCR
1.2.3 BiFC载体的构建 应用XhoⅠ和XbaⅠ酶切pYFPN和pYFPC载体,电泳验证后并回收骨架载体片段,利用Infusion方式将载体骨架与含有同源重组末端的DNA序列重组连接,将连接产物转化大肠杆菌DH5α感受态细胞,之后加入LB培养基(无抗)中,活化菌液,涂在LB培养基(Amp抗性)中,适宜条件下培养12~16 h,挑取单克隆培养,随后酶切并测序验证。将构建成功的pZmNAS1-YFPN、pZmNAS1-YFPC、pZmNAS3-YFPN、pZmNAS3-YFPC、pZmNAS3∆N-YFPN和pZmNAS3∆N-YFPC载体(图1)质粒浓度定容至1 000~1 200 ng·μL-1[27]。
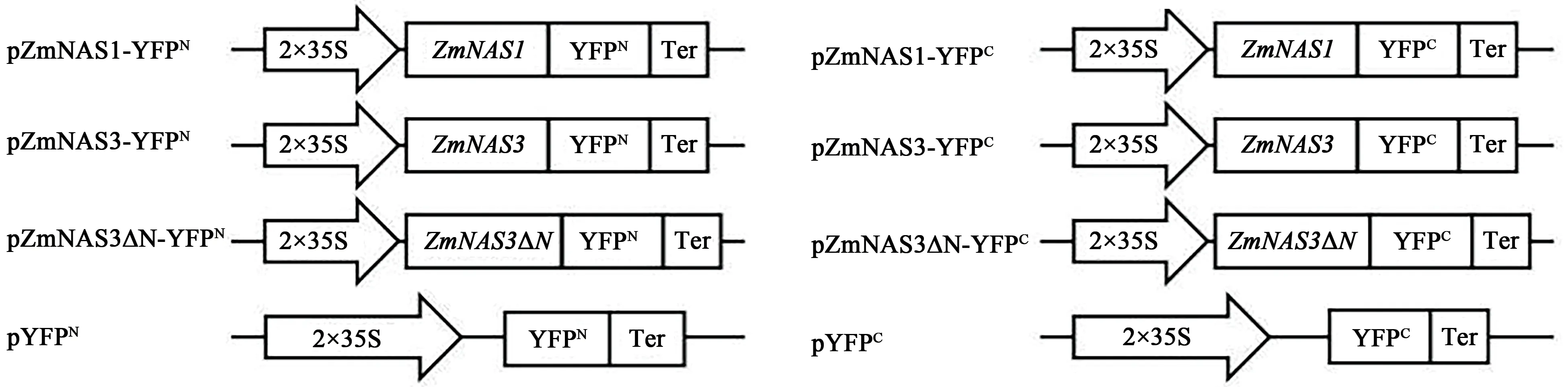
图1 载体构建示意图Fig.1 Diagram of vector construction
1.2.4 玉米原生质的制备将玉米黄化苗V3期的第二片真叶中部5~7 cm切成0.5~1.0 mm的细丝,放入酶解液中,抽真空30 min,置于黑暗条件下28℃摇床(30 r·min-1)中酶解反应4 h以上,将酶解产物过滤(350目)至50 mL离心管中,加入W5缓冲液(等体积),轻柔混匀,低温离心(300 r·min-1)2 min,弃上清,再加入3 mL W5缓冲液(4℃)轻柔混匀后,静置于冰上30 min,弃上清,后加入MMg缓冲液重悬细胞,镜检观察细胞状态,置于冰上待用[27]。
1.2.5 玉米原生质的转化将构建好的载体质粒分别组合加入2 mL的离心管中,加入10倍体积的刚制好的原生质体,轻柔混匀;加入等体积的40% PEG-Ca2+溶液(现配制)继续轻柔混匀,孵育30 min;加入2倍体积的W5缓冲液轻柔混匀,离心(300 r·min-1)2 min,弃上清;加入1 mL的W5缓冲液,黑暗孵育12~16 h[27]。
2 结果与分析
2.1 ZmNAS蛋白结构分析
ZmNAS家 族 可 被 分 为ClassⅠ(NAS1-1、NAS1-2、NAS2-1、NAS2-2、NAS6-1和NAS6-2)和ClassⅡ(NAS3、NAS4和NAS5),如图2所示,Zm-NAS家族蛋白序列之间同源性较高,其中ClassⅡ的ZmNAS包含1个特有的N端可变结构域。因此,本研究筛选出可以代表ClassⅠ的ZmNAS1和ClassⅡ的ZmNAS3,探究ZmNAS家族ClassⅠ和ClassⅡ蛋白结构的区别,以及ClassⅡZmNAS具有特异的N端结构域对蛋白结构的影响。利用Swiss-Model对ZmNAS1、ZmNAS3和ZmNAS3∆N(删除ZmNAS3特有的N端可变结构域)的结构进行了建模预测,发现它们的结构高度相似。此外,根据其相互包裹形成类似底物催化口袋的空间结构(图3),推测其可能通过形成二聚体的结构发挥酶活性的作用。

图2 玉米NAS家族成员的蛋白序列比对Fig.2 Alignment of protein sequences of ZmNAS family members
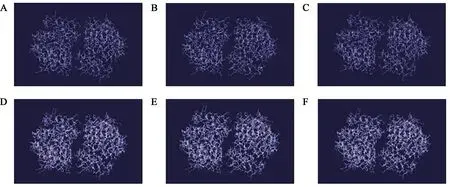
图3 ZmNAS蛋白结构分析Fig.3 ZmNAS protein structure analysis
2.2 ZmNAS家族代表基因克隆
依据MaizeGDB玉米基因组数据库中的Zm-NAS1和ZmNAS3基因序列,设计扩增全长CDS和ZmNAS3∆N的引物。通过琼脂糖凝胶电泳检测PCR扩增条带,结果如图4所示,电泳ZmNAS1、ZmNAS3和ZmNAS3∆N基因条带的大小与预测的开放阅读框序列长度相近。随后将目的条带切胶回收,并连接到B载体上进行测序分析,ZmNAS1、ZmNAS3和ZmNAS3∆N克隆正确且测序结果显示其核苷酸序列与玉米B73参考序列一致。
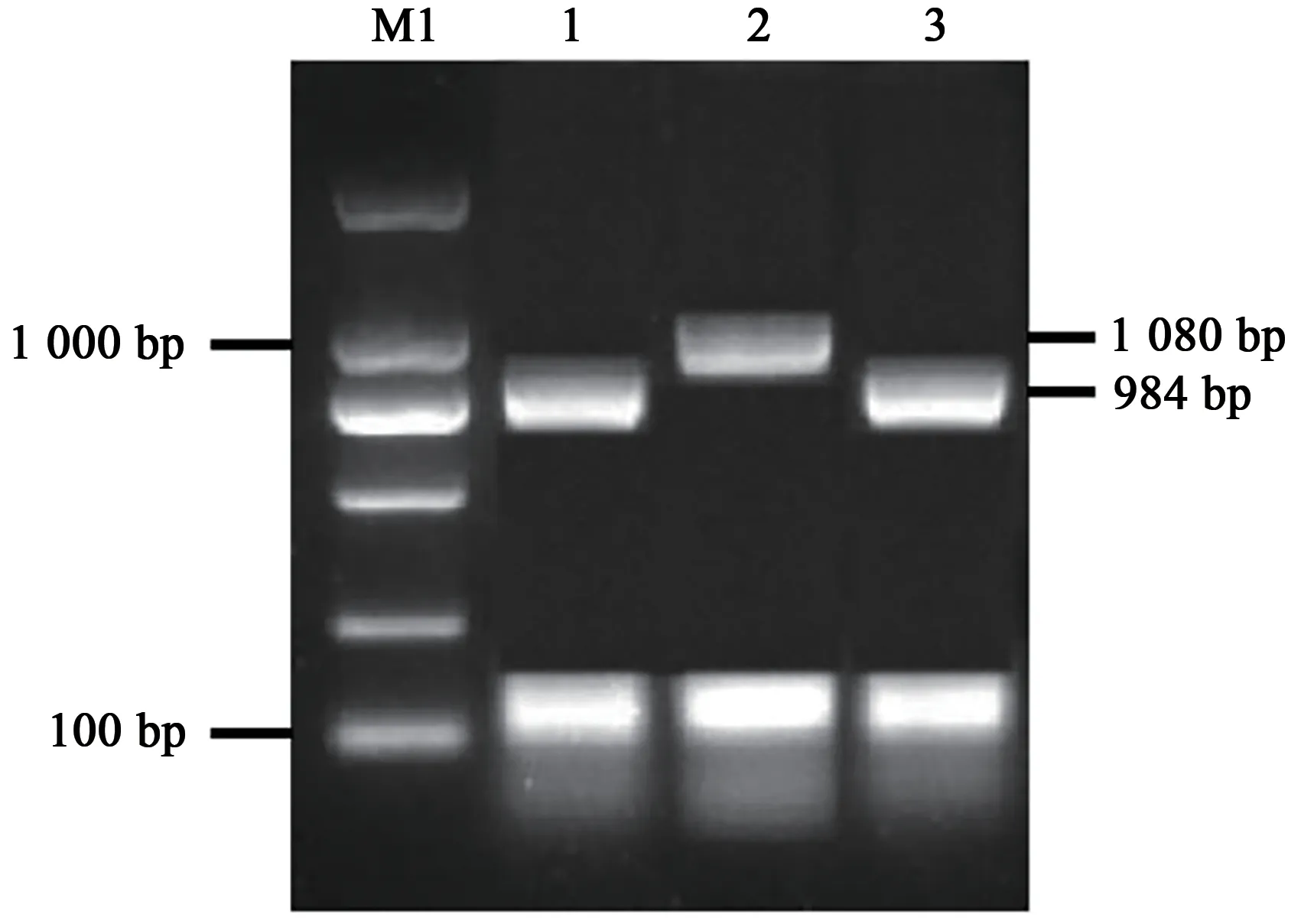
图4 ZmNAS1、ZmNAS3和ZmNAS3∆N基因的克隆Fig.4 Genes clone of ZmNAS1、ZmNAS3 and ZmNAS3∆N
2.3 BiFC融合载体的构建及验证
应 用Infusion方 法,构 建ZmNAS1-YFPN、ZmNAS1-YFPC、ZmNAS3-YFPN、ZmNAS3-YFPC、ZmNAS3∆N-YFPN和ZmNAS3∆N-YFPC的载体。应用XhoⅠ和XbaⅠ酶切得到4 000 bp左右骨架条带和984 bp(ZmNAS1)、1 080 bp(ZmNAS3)、984 bp(ZmNAS3∆N)的条带(图5)。载体的测序结果表明,成功构建出了BiFC融合表达载体。
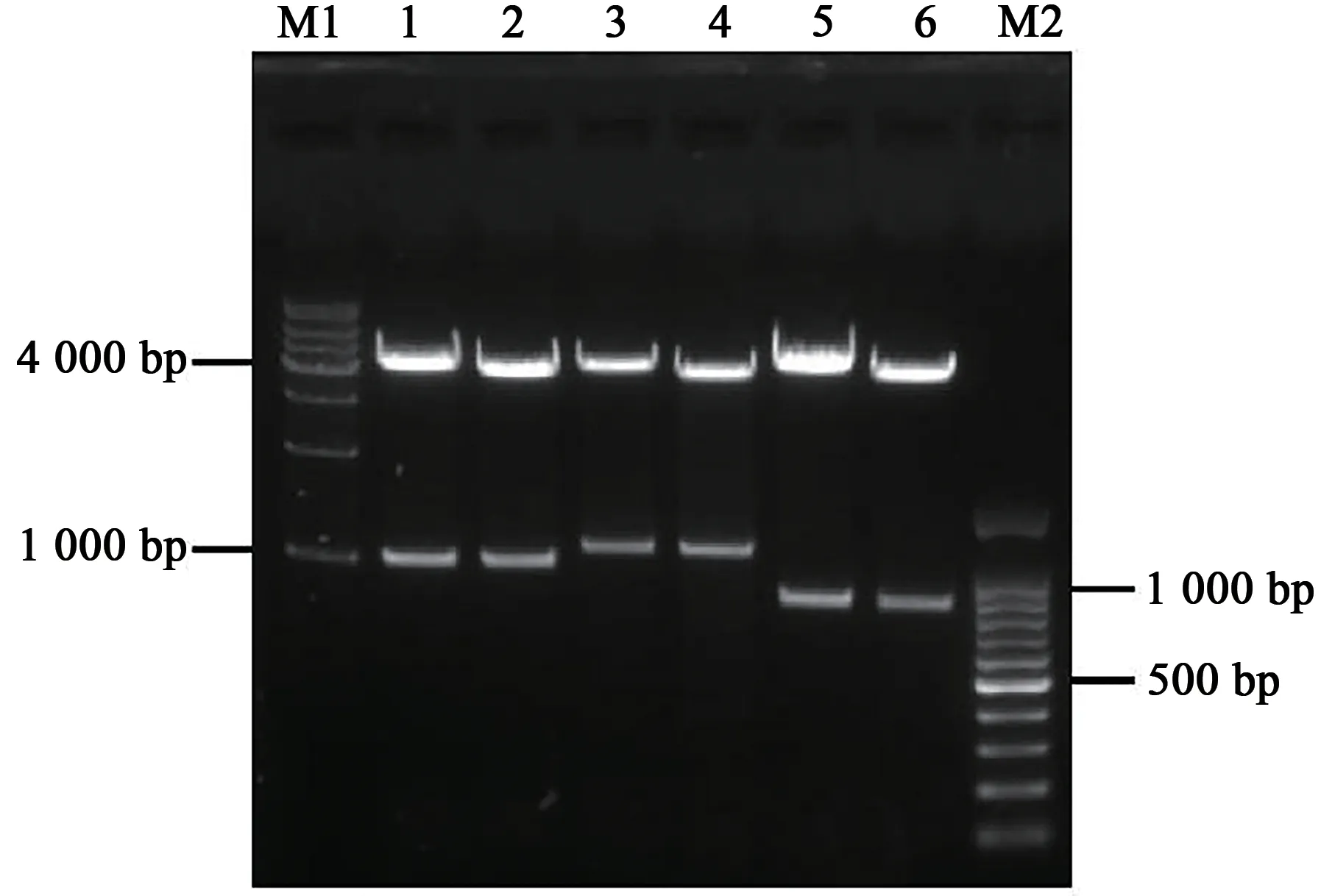
图5 载体酶切验证Fig.5 Enzyme digestion verification of vectors
2.4 BiFC检测蛋白互作
ZmNAS1、ZmNAS3和ZmNAS3∆N分别与YFPN和YFPC融合表达的载体相互组合共转化玉米叶肉细胞原生质体进行瞬时表达,通过激光共聚焦显微镜观察YFP荧光信号,设置pYFPC、pZm-NAS1-YFPN共转化和pYFPN、pZmNAS1-YFPC共转化为阴性对照。结果如图6所示,阴性对照组未检测到荧光信号,而pZmNAS1-YFPN和pZmNAS1-YFPC共转化、pZmNAS3-YFPN和pZmNAS3-YFPC共转化、pZmNAS1-YFPN和pZmNAS3-YFPC共转 化、pZmNAS1-YFPC和pZmNAS3-YFPN共 转 化、pZm-NAS3∆N-YFPC和pZmNAS3-YFPN共 转 化、以 及pZmNAS3-YFPC和pZmNAS3∆N-YFPN共转化均可在细胞质中检测到YFP荧光信号。BiFC结果表明,ZmNAS1和ZmNAS3蛋白可形成异源二聚体,同时NAS1和NAS3各自也可以形成同源二聚体。此外,ZmNAS3∆N只能与ZmNAS3蛋白互作,而不能与ZmNAS1互作,且不能形成同源二聚体。以上结果表明,ClassⅡ家族蛋白的N端结构域对于异源二聚体的形成较为关键。
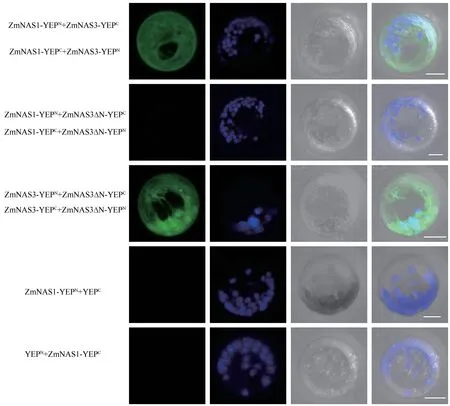
图6 ZmNAS1、ZmNAS3和ZmNAS3∆N的互作分析Fig.6 Analysis to interactions between ZmNAS1,ZmNAS3 and ZmNAS3∆N
3 讨论
NA在植物中普遍存在,而且对于保持植物体内金属稳态发挥重要的作用,缺乏NA合成会导致叶片黄化和植株育性降低等问题[9,28]。NA的生物合成途径为L-甲硫氨酸首先被活化为SAM,SAM在NAS的作用下合成为NA[17]。NAS基因广泛存在于各种作物中,包括玉米、水稻、小麦和大麦等,且由多基因家族编码并存在功能冗余的现象[17,21,23]。禾本科植物的NAS在进化上分化为ClassⅠ和ClassⅡ两个亚家族[21]。研究表明,ClassⅠNAS基因优先在根和茎组织中表达,ClassⅡNAS基因主要在叶片中表达,且ClassⅠ和ClassⅡZmNAS功能的划分与其互补表达调控有关[18]。
目前对于ClassⅡ亚家族NAS蛋白的研究相对较少,本研究发现ClassⅡZmNAS蛋白具有特异的N端可变结构域,且不参与调节NAS的细胞内定位。因此本研究主要探究N端可变结构域是否对蛋白互作产生影响,研究证实了ClassⅡZmNAS蛋白的N端可变结构域参与ZmNAS蛋白之间的互作。已有研究发现,很多蛋白通过二聚体的形式发挥功能,如亮氨酸拉链(basic leucinezipper,bZIP)家族转录因子通过二聚化、磷酸化修饰或与其他蛋白之间的相互作用,改变其与DNA结合的特异性、亲和力,并影响其对下游基因的激活[29]。拟南芥隐花色素(cryptochromes,CRY)的二聚化对其起始蓝光信号转导至关重要,光解酶同源区(photolyase homologous region,PHR)结构域是隐花色素CRY发生同源二聚化的区域,且光激活的CRY是以二聚体发挥生理功能的[30]。E3泛素连接酶(plastid protein sensing RING E3 ligase 1,PPSR1)的表达和功能研究表明,番茄E3泛素连接酶PPSR1能够以同源二聚体形式存在,进而参与番茄果实中类胡萝卜素的生物合成[31]。基于以上研究背景推测ZmNAS家族蛋白也可能以二聚体的形式发挥功能。
NAS家族蛋白在植物维持铁稳态方面发挥重要的作用,探究蛋白之间的相互作用关系具有一定的研究价值[32]。本研究通过BiFC技术发现ClassⅠZmNAS1和ClassⅡZmNAS3蛋白可以形成同源和异源二聚体,但删除ZmNAS3的N端可变结构域后,ZmNAS3∆N只能与ZmNAS3蛋白互作且无法自身互作,表明N端结构域对于异源二聚体的形成较为关键且完整的ZmNAS蛋白结构对于同源二聚体的形成同样重要。本研究结果后续应通过酵母双杂交技术进行验证[33],通过Pulldown和Co-IP等实验进一步验证NAS家族ClassⅠ和ClassⅡ之间的相互作用,为探索其互作位点提供了参考。同时,本研究为进一步探究ClassⅠ和ClassⅡ的NAS之间是否存在生理互作,以及NAS之间的互作对于NA/MA合成和代谢会产生何种影响提供了前期的依据。
综上所述,本研究对ZmNAS两个亚家族(ClassⅠ和ClassⅡ)成员的蛋白质结构进行了生物信息学预测,提示两个家族的ZmNAS之间可能形成同源或者异源二聚体。进而,在玉米叶肉细胞原生质体中对两个亚家族ZmNAS成员间的互作关系进行了BiFC验证。结果表明ZmNAS1和ZmNAS3蛋白可以形成同源和异源二聚体,且该蛋白自身结构完整性影响同源二聚体的形成。此外,ClassⅡ亚家族蛋白的N端可变结构域对于异源二聚体的形成较为关键。本研究结果为探究ClassⅡNAS蛋白的N端可变结构域对其功能的影响是否促进作物吸收转运铁元素的机理奠定了理论基础。

