二硫键影响GH11木聚糖酶稳定性研究进展
李秀婷, 朱唯嘉, 吴秋华, 卢宏运, 丁 泽, 杨卯宸
(1.北京工商大学 食品营养与人类健康高精尖创新中心, 北京 100048;2.北京工商大学 食品与健康学院, 北京 100048;3.北京工商大学 北京市科协食品营养与安全专业智库基地, 北京 100048)
近年来,低聚木糖作为一种调节肠道微生物组成、降低血浆胆固醇水平的高效益生元,深受人们青睐[1]。低聚木糖(xylooligosaccharides,XOS)是由2~7个木糖分子通过糖苷键连接形成的功能性低聚糖[2]。与其他低聚糖相比,XOS具有更高的效价比、更好的酸、热稳定性以及更高的选择性增殖肠道双歧杆菌等特点[3],在健康食品领域应用前景广阔。许多研究者高度关注XOS的工业化生产及应用,尤其是利用生物酶技术制备XOS已成为研究热点。糖苷水解酶(glycoside hydrolase, GH)11家族木聚糖酶具有底物特异性强、催化效率高、分子质量小(约20 kDa)等特点,在低聚木糖的生产中具有明显优势[4-6]。Zhuo等[4]发现了高度催化碱处理玉米芯,反应生成特异性产物XOS,产量高达440.7 mg/L的木聚糖酶rXyn162;但该酶存在热稳定性差的缺点,随着温度升高,rXyn162残余酶活急剧下降,80 ℃下残余酶活仅23%,限制了其在工业应用中的推广。Ayadi等[5]发现一株具有较高酶活性(630 U/mg)的天然木聚糖酶XYNII,但其在60 ℃下迅速失活,半衰期仅为2 min。为了满足工业高温、极端pH值和高有机溶剂等极端条件对具有优越性质木聚糖酶的需要,采用定点突变或定向进化对木聚糖酶进行分子改造已成为XOS工业化生产领域的研究热点[6-10]。
许多研究证实,二硫键作为一种共价相互作用力,可通过降低酶结构的构象熵来减少酶结构变化,以提高酶的稳定性[11-13],表现为酶最适温度提高、半衰期延长、pH值稳定范围变宽等。Cai等[12]在木聚糖酶XynZF-2的C端引入一个二硫键(A52C-T205C),突变体pH值稳定范围变宽,由原来的5.0~7.0变为 3.0~9.0。Teng等[14]在酸性木聚糖酶PjxA的N端构建两个二硫键(T2C-T29C、S27C-S39C)获得突变体DB-s1s4,其最适温度较PjxA提高20 ℃,较引入单二硫键的突变体PjxA-DB高5 ℃,达70 ℃。结合木聚糖酶的结构特点,在恰当的位置采用定点突变等技术引入不同数目的二硫键,可显著改善木聚糖酶的稳定性[15]。本文拟从GH11木聚糖酶分子的结构及其对酶热稳定性的影响,二硫键引入的常用策略,酶不同区域构建不同数量二硫键对GH11木聚糖酶稳定性影响进行分析,希望为GH11木聚糖酶的稳定性研究提供参考。
1 GH11木聚糖酶的结构及其对酶热稳定性的影响
1.1 GH11木聚糖酶的结构特点
酶结构是探索酶稳定机理、挖掘酶功能特性以及酶理性设计的基础。图1展示了GH11木聚糖酶的结构,由图1可知,GH11木聚糖酶结构呈右手半握状,由一个α-螺旋和两个相互平行的β-折叠组成,β-折叠A和B构成了木聚糖酶三维结构的Fingers和Palm,Cord区连接β-折叠B6和B9,Thumb区连接β-折叠B7和B8。与GH10木聚糖酶相比,GH11木聚糖酶的底物结合域较宽、结合能力较强、底物选择较专一,具有广泛的酸碱适应性及较高的酶活性[16-18]。然而,由于大多数GH11木聚糖酶属于中温木聚糖酶,均存在稳定性差的问题,限制了其在工业生产实际中的应用。目前的研究已经证实,GH11木聚糖酶是一类高度同源的水解酶。尽管位于催化裂隙的氨基酸残基在一级序列和三级结构上均具有高度保守性,但微小的序列和空间结构差异也会导致酶学性质显著改变,其中,大多性质的变化集中体现在催化速率、最适pH值、最适温度及稳定性等方面。Ayadi等[5]在GH11木聚糖酶XYNII中将两个丝氨酸变为苏氨酸,构建两个突变酶S80T和S149T,突变酶在60 ℃下保温5 min,其残余酶活为60%,是野生型(32%)的两倍;Zhang等[10]将GH11木聚糖酶SoxB的N端两个氨基酸Asn、Ser分别变为Gly、Pro,70 ℃下,突变体半衰期(87 min)是野生型(3.6 min)的24倍。由此可知,在酶分子结构分析基础上,利用蛋白质工程技术,选择合适的突变策略改变酶分子的一级序列和三维结构,可达到改善GH11木聚糖酶稳定性的目的。
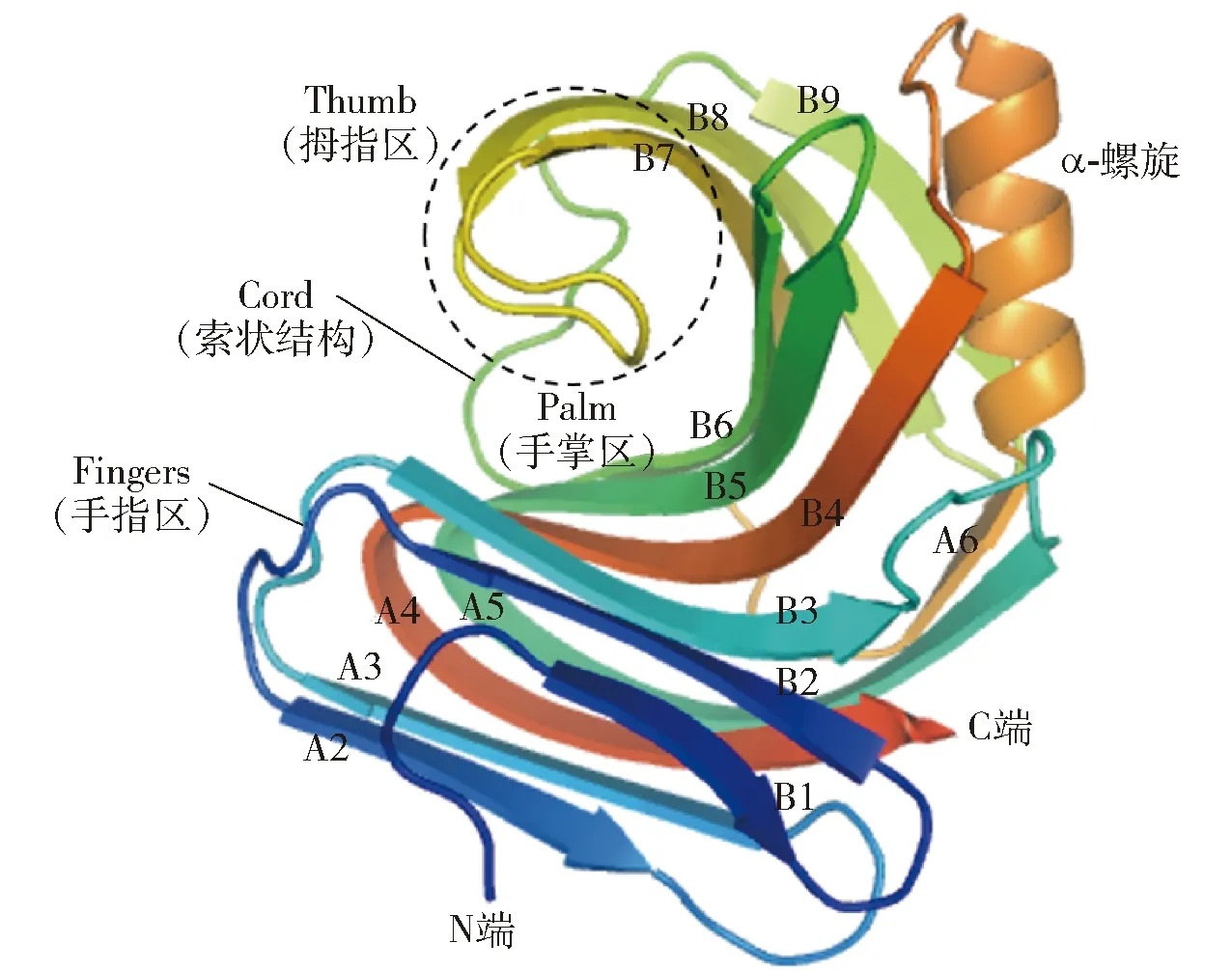
图1 GH11木聚糖酶结构组成Fig.1 Structure of GH11 xylanase
1.2 氢键作用、疏水作用及二硫键三种作用力对酶热稳定性的影响
目前,许多研究者对GH11木聚糖酶的分子改造进行了大量的探索,成功改善了酶的热稳定性。研究发现,分子内部相互作用力如氢键相互作用力、疏水相互作用力、二硫键等在提高酶热稳定性方面发挥着重要作用。Ayadi等[5]将木聚糖酶TRX II中第80位氨基酸Ser替换为Thr,构建突变酶S80T,60 ℃下保温5 min,突变酶S80T可保持45%的酶活力,而TRX II仅保留32%的酶活力;通过对木聚糖酶TRX II和S80T进行结构比较发现,Thr80和Ile84之间形成了氢键,Ile84靠近活性中心E85,氢键作用使得位于活性中心的β-折叠更加稳定,突变酶S80T在较高温度下保持酶活性,热稳定性得到改善。为提高木聚糖酶XynCDBFV的热稳定性,Han等[8]运用定点突变的方法,构建4个突变体N88G、S90T、S89H、Q87R,突变体的耐热性均有较大提高,在最适温度60 ℃下孵育1 h,4个突变体的活力均保持在50%以上,而相同条件下,XynCDBFV的活力保留率仅为20.94%;研究运用分子动力学模拟和结构分析探讨了突变体的耐热机制,发现突变位点与周围氨基酸形成了氢键相互作用,4个单一突变体中与Q/R87、D215的氢键作用力比XynCDBFV中的氢键相互作用力强,增强了酶结构的稳定性。Vogt等[19]通过比较16个具有不同热稳定性的蛋白质家族含有的氢键数量发现,超过80%的家族热稳定性与氢键数量、分子极性表面存在的氢键密度相关。由此可知,酶热稳定性与分子内氢键相互作用密切相关。表1总结了3种作用力对酶热稳定性的改善效果[5,8,11,14,20-23]。
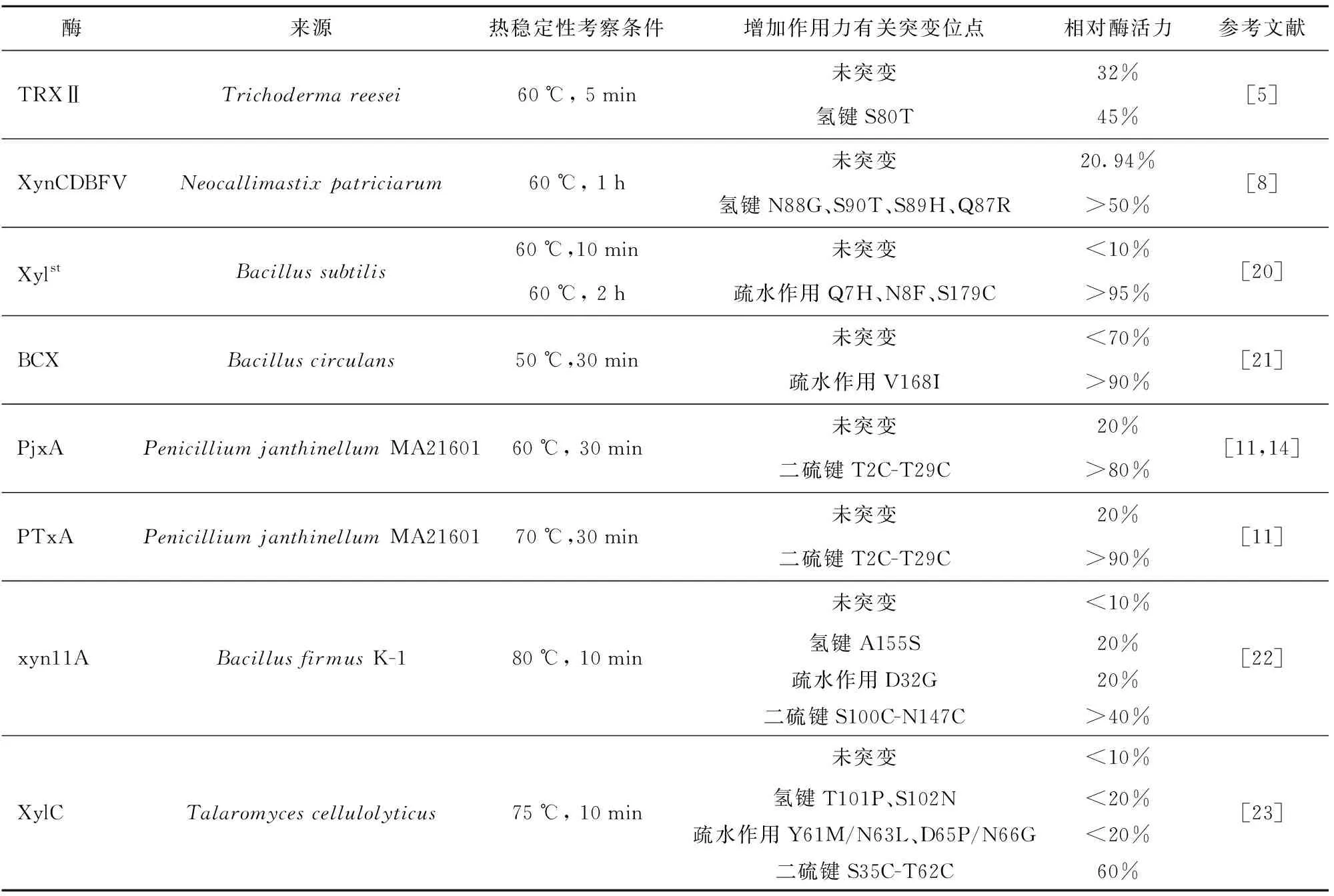
表1 氢键作用、疏水作用及二硫键作用对酶热稳定性的影响
Miyazaki等[20]运用随机点突变、饱和突变和DNA改组相结合的方法,筛选出一个含有Q7H、N8F和S179C这3个氨基酸突变的耐热突变体Xylst,与野生酶相比,60 ℃下Xylst可在2 h内保持完整活性而野生酶在5 min内失活,同时Xylst的最适温度较野生酶提高了10 ℃,为65 ℃。比较野生型与突变木聚糖酶的三维结构发现,突变位点氨基酸与邻近氨基酸残基形成疏水簇,增强了酶内部及酶分子间的联系,使得酶结构更加紧凑,有利于酶在高温下保持自身结构稳定,从而提高酶的热稳定性。Kim等[21]运用定点突变的方法,将木聚糖酶BCX中氨基酸Val168突变为疏水氨基酸Ile,突变酶V168I与BCX相比,其热稳定性显著提高,50 ℃下保温30 min,V168I酶活力可保持在90%以上,而BCX酶活性则降低到70%以下。突变酶V168I氨基酸Ile侧链甲基的增加,增强了BCX分子内部的疏水相互作用力,从而增强了BCX的局部结构稳定性,提高了BCX的热稳定性。Bhat等[24]通过将天然GH11木聚糖酶N-末端的前6个残基RTITNN进行突变,引入芳香族氨基酸、半胱氨酸、脯氨酸等疏水氨基酸,通过均方根偏差、旋转半径和溶剂可及表面积等参数对GH11木聚糖酶及其突变株的结构和热稳定性进行了分析,发现突变酶与野生酶相比,均方根偏差降低,旋转半径减小,溶剂可及表面积减小,说明突变酶结构刚性增加。Ruller等[25]研究发现,保持蛋白结构的稳定可在一定程度上提高酶的热稳定性。由此可知,疏水相互作用力在增强酶的结构刚性、提高酶的热稳定性方面具有一定作用。
Xiong等[11]运用定点突变的方法在木聚糖酶PTxA的N端构建二硫键(T2C-T29C),PTxA的N端刚性增强,其在60 ℃下的半衰期为53.6 min,提高为野生型酶(30 s)的107倍。Turunen等[13]在木聚糖酶XYNII中引入二硫键S110C-N154C,突变酶在65 ℃下的半衰期由不足1 min增加到14 min。Teng等[14]在酸性木聚糖酶PjxA的N端构建二硫键T2C-T29C,获得突变体PjxA-DB,60 ℃下孵育30 min,残余酶活由突变前的20%提高到80%以上。二硫键的引入对木聚糖酶的稳定性具有一定的改善作用。
1.3 二硫键可显著提高GH11木聚糖酶的稳定性
较多研究证实,3种作用力均对木聚糖酶热稳定性具有改善作用,但其改善效果不同(表1)。Sutthibutpong等[22]研究了疏水相互作用、氢键相互作用、二硫键对木聚糖酶xyn11A热稳定性的影响:80 ℃下孵育10 min,含二硫键S100C-N147C的突变体酶活力可保持在40%以上;而增加疏水相互作用的突变D32G和增加氢键相互作用力的突变A155S,酶活力降至20%,野生型木聚糖酶酶活力降至10%以下。由此可知,构建二硫键S100C-N147C得到的突变体具有最高的热稳定性。Watanabe等[23]通过在木聚糖酶XylC的N端进行定点突变以改善其热稳定性,设计了9个突变位点(S35C、N44H、Y61M、T62C、N63L、D65P、N66G、T101P、S102N),并考察了单一突变与组合突变对XylC的热稳定性的影响。研究发现,同时含有上述9个突变位点的突变酶XylCmt9具有最高的热稳定性。通过解析XylCmt9的晶体结构,结合所有突变酶的酶学特性发现,除XylCmt9外,在XylC的N末端引入二硫键的组合突变酶S35C-T62C,相比于其他增加氢键相互作用的突变酶(T101P、S102N)和增加疏水相互作用的突变酶(Y61M/N63L、D65P/N66G),其热稳定性显著提高,75 ℃下孵育10 min,S35C-T62C能够保持60%的酶活力,而其余单一或组合突变均低于20%。晶体结构分析发现,二硫键使得XylCmt9的N端Cα-Cα、Cβ-Cβ距离较XylC缩短,N端结构变得紧密,结构熵值降低,酶结构更加稳定。同时研究还发现,由于引入的二硫键使得酶结构变得紧密,促进了其他氨基酸间氢键和疏水相互作用力增加[26],如在XylCmt9中,观察到N44H突变的His44的侧链与Gly64主链的Nδ1和O原子形成了新的氢键,使得同时含有9个突变的突变酶XylCmt9具有最高的热稳定性。Kazlauskas等[27]研究发现,二硫键与蛋白质的折叠过程密切相关,其键能远大于其他次级键,为12 552 J/mol,在维持结构稳定性方面具有优势;因此,引入二硫键对改善酶稳定性具有十分显著的作用。基于GH11木聚糖酶的结构特点,采用合适的策略在GH11木聚糖酶中构建二硫键,对提高GH11木聚糖酶的稳定性具有十分重要的意义。
2 GH11木聚糖酶中引入二硫键的常规策略
二硫键是蛋白质分子两个半胱氨酸间-SH被氧化而形成在硫原子间的共价键,对蛋白质结构的稳定有着非常重要的作用[28]。通常可基于蛋白质结构分析,识别可能形成二硫键的两个位点,并将该位点氨基酸突变为半胱氨酸,即可成功引入二硫键[29]。研究表明:通过对特定GH11木聚糖酶的结构进行分析,选择合适的引入二硫键策略,成功构建二硫键是提高木聚糖酶热稳定性的重要途径之一[4,30];不恰当的二硫键引入方式或在不合适的结构区域构建二硫键,不仅难以达到改善酶的热稳定性的效果,甚至会对酶分子结构的稳定产生负面影响[27]。因此,选择适当的二硫键构建策略十分重要。目前引入二硫键的常规策略有:氨基酸替换、定点突变和基于程序计算设计二硫键等。
2.1 氨基酸替换
一般来说,不同来源的GH11木聚糖酶基因在编码其蛋白质的一级序列上具有一定差异性。研究表明:将耐热性较差的木聚糖酶氨基酸片段替换为耐热性较高的含二硫键的氨基酸序列,可在一定程度上改善其热稳定性。由于氨基酸替换引入二硫键的相应位点依据可靠,且具有易于操作,直接快速等特点,因而,该策略较为常用且成功率高。高树娟等[31]将米曲霉(Aspergillusoryzae)源木聚糖酶AoXyn11A的N端37个氨基酸替换成耐热木聚糖酶EvXyn11TS含有二硫键的42个氨基酸,在木聚糖酶AoXyn11A中引入一个二硫键(Cys5-Cys32),获得耐热杂合突变酶AEx11A。与野生型AoXyn11A相比,突变酶AEx11A最适温度提高了25 ℃,达到75 ℃,且在70 ℃的半衰期提高了197倍,为197 min。Yin等[32]将耐热木聚糖酶EvXyn11TS含二硫键的62个氨基酸片段替换中温木聚糖酶AoXyn11的N末端57个氨基酸,在AoXyn11的N端引入二硫键(Cys5-Cys32)[33],AoXyn11最适温度提高25 ℃,达到75 ℃,且半衰期由45 ℃条件下的52 min提高到70 ℃的60 min。Sun等[34]将褐色高温单孢菌(Thermomonosporafusca)源耐热木聚糖酶TfxA的含二硫键N端氨基酸序列替换黑曲霉(Aspergillusniger)源木聚糖酶AnxA的N端相应位置的氨基酸序列,构建杂合突变酶ATx,在70 ℃和pH值5.0的条件下保温2 min,ATx残余酶活为72%,而野生酶AnxA仅为42%;且ATx具有较宽的pH值稳定范围(3.0~10.0),N端替换突变酶ATx表现出较好的热稳定性及酸碱稳定性。许多研究表明,通过氨基酸替换引入二硫键,对酶的稳定性具有一定的作用。
2.2 定点突变
定点突变是酶改造的常用方法,该方法通过比较不同性质酶的氨基酸序列,准确改变一个或多个氨基酸,从而改变酶的性质[19]。相比于氨基酸替换的方法,定点突变法可有针对性的改变某个或某几个氨基酸来构建二硫键,避免了许多不必要的氨基酸突变,其更具准确性、高效性。许多研究者利用定点突变技术在GH11木聚糖酶热稳定性的改造方面做了大量的探索。Li等[15]通过突变中温木聚糖酶AoXyn11A中的两个氨基酸为半胱氨酸,构建了二硫键(S108C-N152C),50 ℃条件下含二硫键突变酶AoXyn11AT的半衰期为71 min,约为野生酶AoXyn11A(25 min)的3倍。Fenel等[30]运用定点突变技术,在木聚糖酶XYNII的N端引入二硫键(T2C-T28C),突变体XYNII-Y5在65 ℃条件下的半衰期由原酶的40 s提高到20 min,相较原酶提高30倍。Tang等[35]突变木聚糖酶Xyn2的两个氨基酸Phe和Gln为Cys,引入二硫键(F14C-Q52C),60 ℃下突变体半衰期提高为原酶的2倍(10.7 min)。研究表明:通过突变GH11木聚糖酶分子上的两个氨基酸为半胱氨酸,使得两个半胱氨酸间形成二硫键,实现酶分子中二硫键的引入,可在一定程度上改善酶的稳定性。
2.3 基于程序计算设计二硫键位点
随着计算机技术的不断发展,利用计算机程序来预测并设计二硫键作为一种直接、简便的方法[36],受到了越来越多研究者的青睐。运用计算机程序计算,可量化构建二硫键的影响因素,从而为二硫键的设计提供参考。计算机辅助设计二硫键区别于氨基酸替换和定点突变法,最大的特点在于,可不进行不同酶间的结构与性质等的比较,利用程序计算的方法直接探索酶结构中可能形成二硫键的位点。该方法对于一些结构与性质关系还未知或仅有初步了解的GH11木聚糖酶,挖掘其潜在的可形成二硫键的相应位点,从而实现成功构建二硫键十分具有优势。Dani等[37]根据形成二硫键前后构建位点B因子变化、二硫键周围空间变化等参数评估,完善了用于预测二硫键形成位点的自动化建模程序MODIP,可排除对二硫键形成不利的因素;Dombkowski和Craig开发了Disulfide by Design (DBD) 软件和一个在线网站 (http:∥cptweb.cpt.wayne.edu/dbd2/),以辅助预测可能形成二硫键的残基对位点,通过分析键能、二面角、键距、键几何形状和B因子值,来识别潜在的二硫键[29,38];Jeong等[39]利用二硫键设计程序DBD分析XynA的氨基酸序列,识别可能形成二硫键的氨基酸位点,发现含有S100和N150的区域与热稳定性有关[40];将这两个残基突变为半胱氨酸构建了二硫键,65 ℃下,突变酶的半衰期由7 min增加到25 min,通过引入额外的二硫键,显著改善了XynA的热稳定性。
利用计算机模拟技术,结合特定参数变化,分析引入二硫键前后酶结构变化,可对引入二硫键的效果进行检验。均方根偏差(root mean square deviation, RMSD)为蛋白质在一定的温度和特定的时间从原来构象到高温下Cα原子的位移范围[32],通过RMSD值检测构建二硫键前后氨基酸的柔性变化,可考察热稳定性的改善效果[38-39]。Define secon-dary structure of proteins(DSSP)算法作为蛋白质二级结构可变性评估的一种算法,可预测酶的热稳定性[32,40]。Zheng等[41]在来源于Candidaboidini的甲酸脱氢酶(CboFDH)中构建二硫键,圆二色谱分析和分子动力学模拟表明,含有二硫键的异构体降低了蛋白质结构整体的RMSD,从而增强了蛋白质的刚性。Yagi等[17]将来源于StreptomycesolivaceoviridisE-86的GH11木聚糖酶SyXyn11本身含有的二硫键断裂,形成突变体SyXyn11C5T,突变酶SyXyn11C5T的RMSD值大于野生型SyXyn11,表明SyXyn11C5T的刚性小于SyXyn11,二硫键断裂后,SyXyn11C5T热稳定性降低;同时,利用DSSP程序分析发现,SyXyn11C5T的解链速度较SyXyn11快,进一步表明SyXyn11本身存在的N端二硫键可在高温下赋予该酶优越的稳定性。
3 GH11木聚糖酶不同区域引入一个二硫键对其稳定性的影响
在GH11木聚糖酶合适位点或区域引入二硫键,可降低蛋白质骨架的构型熵,以增强酶的结构稳定性[18,42-45]。研究表明,催化残基所在的Palm区对酶结构的解折叠具有较强抵抗力,其结构具有一定刚性,而除Palm区外,位于GH11木聚糖酶Fingers区N端区域和靠近Thumb区的α-螺旋区域(图1)具有较强灵活性,故在酶N端及α-螺旋区域引入二硫键,对蛋白质的结构稳定性具有十分重要的作用[46-48]。图2以里氏木霉(Trichodermareesei)源GH11木聚糖酶XYNⅡ(PDB ID:1xyp)为模型分别展现了N端(a)及α-螺旋区(b)引入二硫键的位置[30,46]。
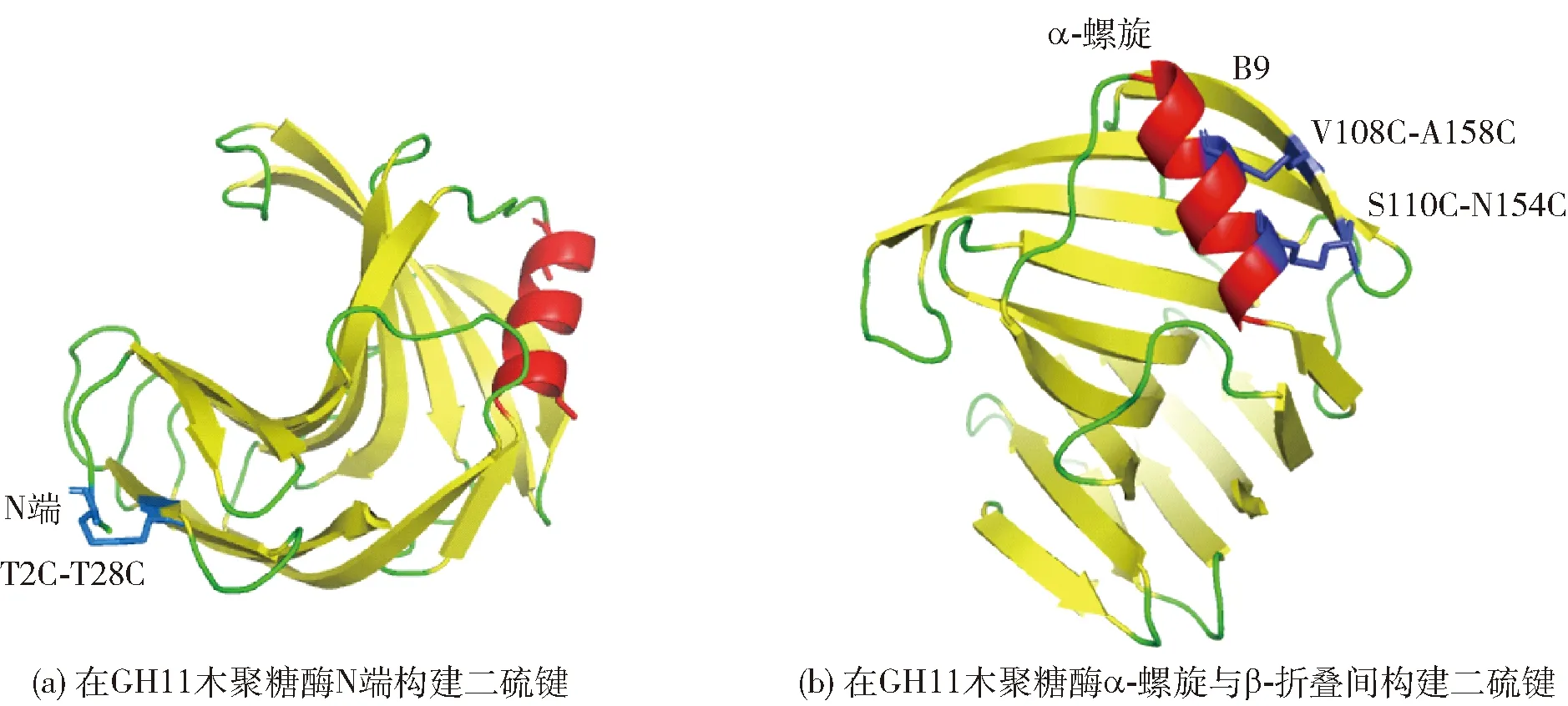
蓝色代表构建的二硫键。图2 XYNⅡ中构建二硫键的不同区域Fig.2 Different regions of constructing disulfide bonds in XYNⅡ
3.1 GH11木聚糖酶N端二硫键对其稳定性的影响
N端位于GH11木聚糖酶Cord区的对立面,即从N端初始氨基酸延伸至β-折叠B3处,包括A和B共5或6个β-折叠[46],共同参与构成GH11木聚糖酶结构Fingers区(图1)。β-折叠B是GH11木聚糖酶催化裂缝的组成部分,参与底物的结合和产物的释放,β-折叠A则位于催化裂缝背面、木聚糖酶表面。在木聚糖酶N端引入二硫键,可以将相邻β-折叠紧密结合,有效阻止木聚糖酶结构的解折叠[25,47,49],与GH11木聚糖酶的稳定性密切相关[7]。
许多研究通过在N端不同β-折叠片上引入二硫键,考察二硫键对酶稳定性的影响。Tang等[35]在木聚糖酶Xyn2的B2与B3间引入二硫键(F14C-Q52C),60 ℃下突变体半衰期提高为原酶的两倍(10.7 min)。Fan等[50]在木聚糖酶T-Xyn的N端A区与B区(A3与B3)间引入二硫键T38C-S50C,与原酶相比,突变酶最适温度降低15 ℃,为55 ℃,且引入二硫键后突变体在高于55 ℃时酶活力急剧下降到60%以下,而原酶残余酶活在65 ℃时还可保持80%以上。二硫键T38C-S50C未赋予该酶改善的热稳定性,但提高了酶的pH值稳定性,在pH值4.0下保温30 min,突变酶残余酶活可达80%,而原酶T-Xyn不足60%。Xiong等[51]在木聚糖酶TRXⅡ的N端A区和B区β-折叠区分别引入二硫键,构建两个突变体T2C-T28C和T7C-S16C,突变体均表现出较高的稳定性。与T2C-T28C相比,T7C-S16C具有较差的稳定性,推测B1与B2间的二硫键(T7C-S16C)允许蛋白质结构在高温下部分展开,T2C-T28C表现出对酶热稳定性更突出的贡献。因此,在N端A区和B区β-折叠片引入二硫键可有效提高酶的稳定性,重要的是,相比于N端B区,N端A区引入二硫键对酶热稳定性具有更突出的改善效果。Wang等[52]在疏棉状嗜热丝孢菌(Thermomyceslanuginosus)源木聚糖酶TLX的N末端初始氨基酸与A2间引入二硫键Q1C-Q24C,突变酶在70 ℃下半衰期提高了20倍,其热稳定性显著增强;Fenel等[30]在XYNII木聚糖酶相似区域引入二硫键T2C-T28C,65 ℃下半衰期由40 s提高到25 min;Teng等[14]在木聚糖酶PjxA的N末端与A2间引入二硫键T2C-T29C,突变体PjxA-DB的最适温度为65 ℃,较原酶提高了15 ℃,同时引入二硫键后PjxA-DB酶活力由原酶的888.6 U/mg提高到2 871.6 U/mg。 研究表明:N端β-折叠A片位于木聚糖酶表面且远离催化中心,在此区域引入二硫键,尤其是N末端氨基酸与A2间(2和28位氨基酸、5和32位氨基酸附近),通过增强酶蛋白表面刚性且间接影响酶和底物的结合与催化,可以提高其结构稳定性,有利于实现酶的稳定性及催化活性的双重提高。表2总结了GH11木聚糖酶N端引入二硫键对其稳定性的影响[14,30-31,33,35,50-51,53-58]。
3.2 GH11木聚糖酶α-螺旋与β-折叠间二硫键对其稳定性的影响
α-螺旋位于木聚糖酶Palm区对立面,与中温木聚糖酶相比,嗜热木聚糖酶TLX和PVX在α-螺旋与β-折叠B7间均含有一个天然二硫键C110-C154,两条主链间(α-螺旋与β-折叠B7)的距离减少了0.5 Å[59],有利于该区域形成更紧凑的结构,以防止β-折叠片展开,使木聚糖酶结构更加稳定。此外,Tian等[60]在木聚糖酶XynB的α-螺旋与其相邻β-折叠B7间引入二硫键S98C-N145C后,XynB在65 ℃下的半衰期提高5倍,由10 min增加到50 min。同时,在α-螺旋上突变一个氨基酸A153E,将该酶在65 ℃下的半衰期进一步提高到60 min。由此表明,在中温木聚糖酶α-螺旋与β-折叠B7间引入二硫键,可以提高中温木聚糖的稳定性。
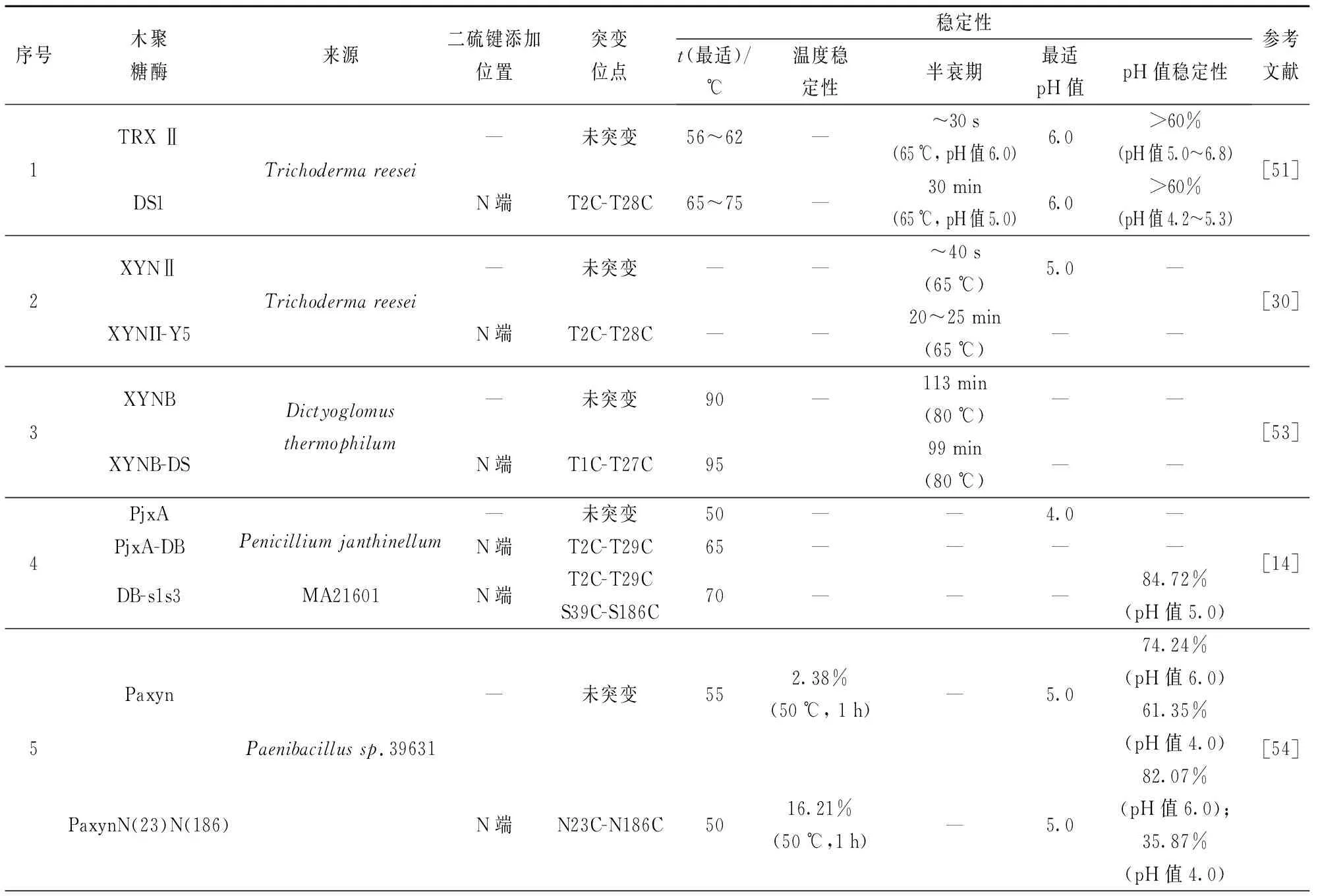
表2 GH11木聚糖酶N端引入二硫键对其稳定性的影响
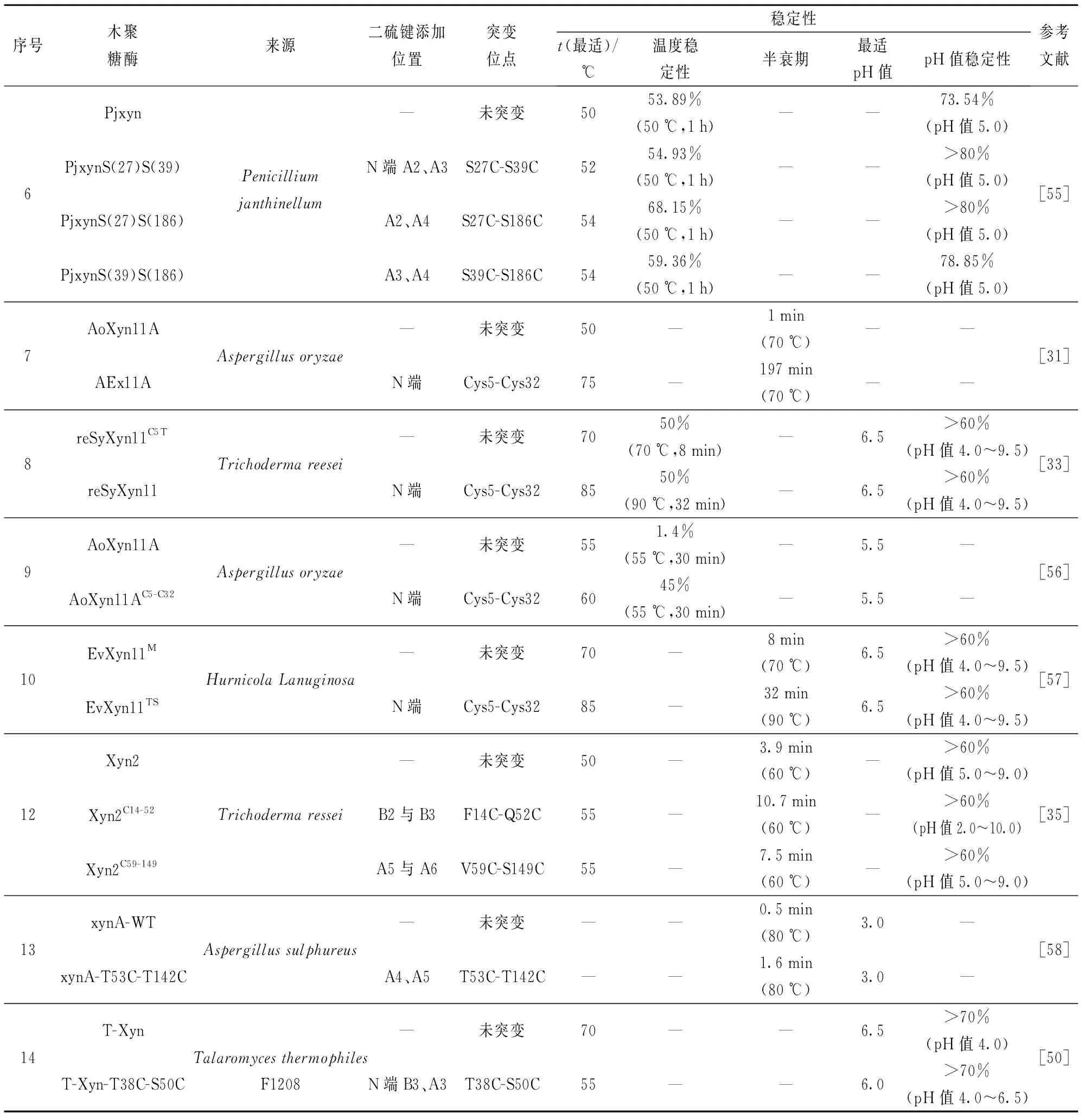
续表2
许多研究关注到α-螺旋与B9之间引入二硫键以改善酶的稳定性(表3)。Yang等[61]在木聚糖酶XYNB-TB的α-螺旋与B9间引入二硫键,与不含二硫键的XYNB-TB相比,突变体表现出更好的耐酸性和热稳定性,pH值稳定范围变宽,由XYNB-TB的4.0~9.0变为3.0~9.0,在70 ℃半衰期提高了7.5倍,由20 min(XYNB-TB)增加至150 min。Xiong等[51]在木聚糖酶TRXⅡ的α-螺旋与β-折叠B9不同位置添加二硫键,获得3个突变体DS2(S110C-N154C)、DS3(V108C-A158C)和DS4(L105C-Q162C),表现出不同的酸稳定性,DS4的pH值稳定范围低于其余突变体及原酶,DS2的pH值稳定范围偏碱,DS3的pH值稳定范围偏酸,突变酶的半衰期有不同程度的提高,表明三者热稳定性均改善。由此可知,在木聚糖酶的α-螺旋与B9之间引入二硫键不仅可以提高热稳定性,还能改变pH值稳定性范围。

表3 GH11木聚糖酶α-螺旋与β-折叠间构建二硫键对其稳定性及催化性质的影响
在木聚糖酶的α-螺旋与B9之间引入二硫键对酶活性及底物亲和力也产生一定影响。木聚糖酶XYNB-TB构建了一个二硫键S109C-N153C[61],其酶活力由883.36 U/mg减小为523.33 U/mg,Km由28.75 g/kg增加为33.60 g/kg,二硫键构建后酶活力下降且底物亲和力减弱。同样的结果在木聚糖酶XYNII和XynB发现[13,60],可能原因是B9折叠片与Cord区相连,B9折叠片结构变化可能会影响Cord区的柔性。在木聚糖酶的α-螺旋与B9之间引入二硫键,可以增强α-螺旋与B9折叠片的结构刚性,间接降低Cord区的柔性,在底物进入酶的催化裂缝后,限制酶构象变化,不利于酶与底物的结合与催化。
3.3 GH11木聚糖酶其他区域二硫键对其稳定性的影响
C端主要位于木聚糖酶β-折叠A3区域,该区域结构具有较强柔性,与N端相比,C端影响酶稳定性的相关研究较少。尽管C端位于木聚糖酶解折叠的末端,但其对酶热稳定性的贡献不容忽视。Cai等[12]在木聚糖酶XynZF-2的C端添加二硫键,其最适温度提高了15 ℃,即由45 ℃提高到60 ℃,50 ℃保温30 min,突变酶残余酶活由原酶的50%提高到90%,且pH值稳定范围由5.0~7.0提高到3.0~9.0,酶pH值稳定性增强,这与Kumar的研究相似[59]。Gruber等[62]将来源于Thermomyceslanuginosus的耐热木聚糖酶晶体结构与其同源已知结构的GH11木聚糖酶进行了比较,发现该耐热酶的热稳定性与C端含有二硫键C122-C166有关。以上结果表明,在木聚糖酶C端引入二硫键可以在一定程度上改善酶的热稳定性。
Cord区位于木聚糖酶催化裂缝的侧翼部分,连接β-折叠B6和B9,与α-螺旋、Thumb、Fingers相连,通过分子动力学模拟及酶分子晶体结构分析,证明Cord区具有一定灵活性[63]。木聚糖酶Cord区域的二硫键较多存在于中温木聚糖酶中,如木聚糖酶AKX、ANX和XynC[64-65],表明Cord区二硫键对热稳定性贡献较小。Michaux等[65]解析出木聚糖酶XYL1的晶体结构,研究了Cord区域二硫键对木聚糖酶XYL1酸碱稳定性的影响,发现其二硫键不是影响酶酸碱稳定性的关键因素。综上可知,Cord区域二硫键对木聚糖酶的稳定性具有较小影响。一定程度上,Cord区构建二硫键并不是稳定酶结构的最优选择。
较多研究证实,在GH11木聚糖酶N端、α-螺旋与β-折叠间以及C端引入二硫键对于该酶的稳定性均有不同程度的改善效果,尤其是在N端的A区、α-螺旋与B7、B9间引入二硫键时,对酶热稳定性的影响显著。值得注意的是,GH11木聚糖酶N末端氨基酸及A2间(2和28位氨基酸、5和32位氨基酸附近)的相应位点,相较于α-螺旋以及C端,其位于酶结构表面且远离酶的催化中心,在此成功引入二硫键后,不仅对酶稳定性的改善效果突出,甚至可实现酶稳定性及催化活性的双重提高;在α-螺旋与B9间引入二硫键,虽可在改善酶热稳定性的同时改变pH值稳定范围,但由于B9与Cord区相连,且靠近酶的催化中心,引入二硫键可能会产生影响酶与底物结合的构象变化,进而降低该酶活性。由此可知,在GH11木聚糖酶的分子改造过程中需根据实际情况选择合适的引入二硫键的策略。尽管有研究表明:GH11木聚糖酶C端引入二硫键对酶的稳定性具有一定改善作用,但相关研究数据较少,对比分析较为困难,需通过更多更系统的结构分析以及实验验证,才能有望更全面、深入地了解GH11木聚糖酶不同区域引入二硫键对其稳定性的影响。
4 GH11木聚糖酶中引入多个二硫键对其稳定性的影响
在木聚糖酶的N端、C端及α-螺旋处单个二硫键的引入可以增强酶的稳定性,越来越多的研究表明通过在相同或不同区域构建多个二硫键,在一定程度上可以增强二硫键对酶稳定性的改善效果。Teng等[14]在嗜酸木聚糖酶PjxA的N端构建两个二硫键形成突变酶,与原酶PjxA(不存在二硫键)和含一个二硫键突变酶PjxA-DB相比,含两个二硫键的突变酶热稳定性提高;在60 ℃下保温30 min,突变体DB-s1s4残余酶活为59.23%,高于突变体PjxA-DB(50%)。Paes等[66]在木聚糖酶Tx-xyl的N端与C端之间、β-折叠B9与α-螺旋之间均构建了一个二硫键,在酶最适温度(75 ℃)下,突变酶半衰期增加了10倍(从18 min增加到180 min)。
引入二硫键前后的酶空间结构变化表明,引入额外的二硫键导致未折叠多肽的构型链熵降低,说明每个二硫键均对该酶热稳定性有贡献[42]。Wakarchuk等[46]通过比较引入单个、2个、3个二硫键对酶稳定性的影响发现,69 ℃下具有2个或3个二硫键的组合突变体能在20 min内保持活性,而含单个二硫键的突变体则失去活性。Xiong等[51]在木聚糖酶TRX Ⅱ的α-螺旋与β-折叠间、N端各引入一个二硫键,突变体DB1(T2C-T28C,S110C-N154C)在65 ℃下半衰期大于56 h,是原酶TRX Ⅱ(30 s)的5 000倍,并拓宽了pH值稳定范围(由5.0~6.8变为5.0~9.2),但DB3(T7C-S16C,S110C-N154C)对酶热稳定性提高不显著。由此可见,不同的二硫键组合对酶的热稳定性提升程度不同,表明多个二硫键对酶稳定性的改善具有协同作用,而非累积作用[25-26]。
5 结论与展望
随着GH11木聚糖酶的结构及稳定作用机制研究的逐步深入,引入二硫键作为可降低酶分子构象熵以提高酶稳定性的方法,在拓宽大多稳定性差的GH11木聚糖酶的工业应用范围,尤其是高效生产功能性低聚木糖等方面得到了广泛的关注。研究表明,GH11木聚糖酶的N端、C端及α-螺旋与β-折叠间构建二硫键对酶的稳定性至关重要。通过氨基酸替换、定点突变等方法成功引入二硫键可有效改善酶热稳定性;在酶蛋白结构中的同一区域或多个区域构建二硫键,可通过多个二硫键间的协同作用,进一步提升酶的热稳定性[46-67]。然而,不同木聚糖酶具有不同的结构特点,相同的改造策略应用至不同的木聚糖酶可能产生不同的效果,结构相似的木聚糖酶其应用特性也有较大差异。同时,实际生产对于酶的功能特性需求差别很大,如何设计选用适当的构建二硫键方法提升酶稳定性,以适应高温或酸碱等工业生产条件一直是研究者高度关注的内容。目前,尽管通过热稳定性改造研究已对GH11木聚糖酶的结构与稳定机制有了初步了解,获得了热稳定性有所改善的木聚糖酶,但由于酶分子改造过程中所造成的催化活性降低以及底物特异性等变化的原因并未厘清,使得酶不能很好地兼具良好的稳定性和较高的催化活性,制备功能性低聚木糖的工业生产和实际应用陷入瓶颈[39,61]。进一步深入系统地研究二硫键在改善GH11木聚糖酶热稳定性方面的策略,通过综合分析酶蛋白分子不同区域引入二硫键对其稳定性的影响,在为酶分子改造提高稳定性的相关研究积累实验数据的同时,深入分析酶催化活性以及底物特异性、催化效率等变化的机理,有望为酶分子改造工程获得高稳定性的、适用于功能性低聚糖工业生产应用的GH11木聚糖酶提供科学参考。

