同一猪场的2株基因重组猪繁殖与呼吸综合征病毒的遗传演化分析
魏春华 , 何 乐 , 徐 叶 , 林志锋 , 刘 辰 , 柳开隆 , 杨小燕 , 刘建奎
(1. 龙岩学院生命科学学院 , 福建 龙岩 364000 ; 2. 福建省家畜传染病防治与生物技术重点实验室 , 福建 龙岩 364000 ; 3. 福建农林大学动物科技学院 , 福建 福州 350002)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种危害世界养猪业的重要传染性疾病,主要引起母猪的繁殖障碍及仔猪呼吸道疾病[1-2]。PRRS最早于1987年在美国报道[3],随后该病迅速蔓延至其他养猪业国家,造成了巨大的经济损失,1996年郭宝清等证实PRRS在我国存在,随后迅速传播至各个省份,成为我国规模化养猪场的主要疫病之一[4]。2006年暴发的高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV)给我国养猪业造成巨大的经济损失[5]。2012年我国出现新的流行毒株,因其与流行于美国的NADC30同源性高,且存在与NADC30相同的不连续131个氨基酸缺失,因此将该类毒株命名为类NADC30 PRRSV,流行病学调查表明,类NADC30毒株已成为国内猪场流行的优势毒株[6-10]。由于类NADC30毒株基因组的高度变异性且与不同类型的毒株发生了重组,导致现有的商品化疫苗不能对其产生良好的免疫保护,我国PRRS防控面临新的挑战[11-17]。
根据其抗原性和病毒基因组的差异,PRRSV分为2个基因型:PRRSV-1(欧洲型)和PRRSV-2(北美型)。PRRSV基因组全长为15 kb左右,含有至少10个开放阅读框(Open reading frame,ORF),即ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5a和ORF5~7。基于Shi等建立的PRRSV基因分型标准,PRRSV-2分为9个谱系(Lineage)[18]。目前,我国猪场主要流行的毒株为谱系1(类NADC30毒株)、谱系3(类QYYZ毒株)、谱系5(类VR2332毒株)和谱系8(类JXA1毒株和类CH-1a毒株)。由于PRRSV变异快,毒株多样化,其基因组常常会出现重组现象,因此有必要监测PRRSV流行动态,同时监控新毒株的出现。本试验在福建省某规模化猪场临床病料中分离得到2个基因组发生高度变异和重组的PRRSV,为了进一步了解毒株的分子遗传特征,对分离毒株全基因组测序并使用分子生物学软件对其进行遗传演化分析和重组分析,以期为PRRS的防控提供参考。
1 材料与方法
1.1 样品来源及细胞 2017—2018年采集某规模化猪场临床症状为体温升高、食欲不佳,伴有严重呼吸系统症状的疑似PRRSV感染猪的血液、肺脏、淋巴结等组织样品,置于-80 ℃冰箱保存。稳定高效表达猪CD163的MARC-145细胞(MARC-145CD163)由福建省家畜传染病防治与生物技术重点实验室构建并保存。
1.2 主要试剂 RNA提取试剂盒和普通琼脂糖凝胶DNA回收试剂盒,均购自天根生化科技有限公司;pEASY-Blunt Simple Cloning Vector,购自北京全式金生物技术有限公司;Superscript Ⅲ reverse transcriptase和Platinum®pfx DNA polymerase,均购自Invitrogen公司;山羊抗鼠IgG荧光抗体(FITC标记),购自美国Sigma公司;PRRSV荧光定量RT-PCR检测试剂盒,购自青岛立见生物科技有限公司;PRRSV N 蛋白单克隆抗体(MAb)由福建省家畜传染病防治与生物技术重点实验室制备并保存。
1.3 病毒分离 将无菌采集的病猪肺脏、淋巴结等组织样品剪碎,按1∶10的质量体积比加入DMEM溶液充分研磨,加入10%双抗,反复冻融 3次,12 000 r/min离心10 min,上清液用0.22 μm滤器过滤,-80 ℃保存备用。血液样品经8 000 r/min离心10 min,取上清用0.22 μm滤器过滤,-80 ℃保存备用。
将过滤后的病料上清液和血清混合,分别接种于长满单层的MARC-145CD163细胞和MARC-145细胞,PBS洗涤后加入适量的DMEM维持溶液,37 ℃ 5% CO2条件下培养,每天观察细胞病变(Cytopathic effect,CPE)。当CPE达到80%左右收毒,反复冻融3次,3 000 r/min 离心10 min后取上清,-80 ℃保存备用。
1.4 间接免疫荧光法(Indirect immunofluorescence assay,IFA)检测 将PRRSV接种于6孔培养板中长成单层的MARC-145CD163细胞(每孔放1张细胞爬片),37 ℃吸附1 h,PBS洗涤3次后,加入3 mL MARC-145CD163细胞DMEM维持液,培养48 h。利用4%多聚甲醛固定,PBS洗涤3次后每孔加入200 μL PRRSV N蛋白鼠源MAb(1∶800),37 ℃孵育1 h,PBS洗涤后加入FITC标记的山羊抗小鼠IgG(1∶1 600)孵育1 h,PBS洗涤后以中性树脂封片,于激光共聚焦显微镜下观察并拍照。
1.5 PRRSV全基因组质粒的构建 参照参考文献[19]的方法,根据VR2332、CH-1a、JXA1、NADC30、QYYZ、GM2毒株的序列设计5对重叠基因片段简并引物,用于扩增PRRSV全基因组序列。按照RNA提取试剂盒操作说明书进行病毒液RNA提取,以制备的cDNA为模板进行PRRSV全基因各片段PCR扩增,反应结束用1%琼脂糖凝胶鉴定。将回收纯化的PCR产物连接到pEASY-Blunt Simple Cloning Vector上转化至大肠杆菌DH5α感受态细胞,阳性重组菌液送往北京睿博兴科生物技术有限公司测序。
1.6 基因组遗传变异分析及重组分析 运用生物学软件DNASTAR 7.0和MEGA 6.0对分离毒株全基因组测序结果进行拼接,分析其基因组特性并构建遗传进化树。使用Simplot 3.5.1软件[参数设置:核苷酸替代模型为Kimura-2-Parameter,核苷酸转换(Transition)和颠换(Transversion)速率比(T/t)为2.0,Window为200 bp,Step为20 bp]和重组分析软件Recombination Detection Program v.4.24(RDP 4.24)中的7种重组算法(RDP、GENECONV、BOOTSCAN、Max Chi、Chimaera、SISCAN和3Seq)对可能的重组事件进行检测和分析。
2 结果
2.1 PRRSV的分离 将过滤后的病料上清液和血清混合,接种于MARC-145CD163细胞4 d后,可产生细胞聚集成丛、变圆等典型CPE。对分离获得的病毒用PRRSV N蛋白单抗进行检测,结果显示被感染的细胞可以被抗PRRSV的特异性单抗所识别,呈现特异性的绿色荧光,而未感染的对照细胞无特异性绿色荧光,结果显示成功分离到2株PRRSV(图1),将2株PRRSV分别命名为FJDJQ-2017(GenBank登录号:MG011719)和FJDJQ-2018(GenBank登录号:MN862433)。而将过滤后的病料上清液和血清混合,接种到MARC-145细胞,传至8代,没有CPE产生,IFA鉴定结果为阴性。
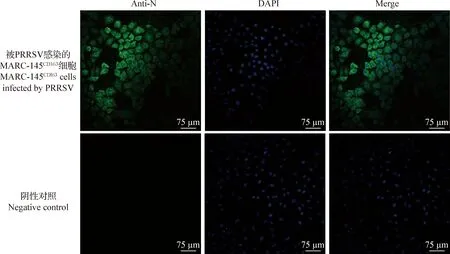
图1 分离株PRRSV在MARC-145CD163细胞的间接免疫荧光鉴定Fig.1 IFA identification of PRRSV isolate in MARC-145CD163 cells
2.2 2株PRRSV的全基因组特征分析 2个PRRSV基因组长度(去除polyA后)均为15 016 bp,基因组之间的核苷酸同源性仅为85.8%,与谱系1的代表毒株NADC30、FJZ03和CHsx1401的核苷酸同源性为87.8%~92.7%,与谱系3的代表毒株QYYZ、GM2和FJFS的核苷酸同源性为82.8%~84.8%,与谱系5的代表毒株VR2332、BJ-4和RespPRRS MLV的核苷酸同源性为84.9%~85.1%,与谱系8的代表毒株JXA1、HuN4、TJ和CH-1a的核苷酸同源性为83.4%~84.9%,而与欧洲代表毒株LV同源性较低,仅为60.2%~60.5%。
为了进一步了解FJDJQ-2017和FJDJQ-2018毒株的基因组特性,将2个毒株与参考毒株NADC30、FJZ03、QYYZ、FJFS、VR2332、BJ-4、JXA1和HuN4进行序列比对。2个毒株ORF1a基因核苷酸序列长度为7 119 bp,编码2 372 aa,其核苷酸同源性为83.7%,与参考毒株的核苷酸同源性为77.9%~93.5%。ORF1a基因编码的非结构蛋白Nsp1~Nsp8中变异程度较大的是Nsp1β和Nsp2,变异程度较小的是Nsp1α和Nsp6。2个毒株ORF1b基因核苷酸序列长度为4 374 bp,编码1 458 aa,相对ORF1a基因较保守,其核苷酸同源性为89.3%,与参考毒株的核苷酸同源性为85.2%~95.1%。与VR2332和CH-1a相比,FJDJQ-2017和FJDJQ-2018毒株的Nsp2基因在aa 322~432、aa 483和aa 504~522处存在不连续131 aa(111+1+19)的缺失,缺失模式与NADC30相同。
ORF2~ORF7基因编码PRRSV的结构蛋白,氨基酸序列同源性分析表明,GP3和GP5蛋白变异最大。GP5蛋白中Q13和R151与PRRSV毒力相关,与VR2332毒株相比,FJDJQ-2017和FJDJQ-2018均存在R151K突变。与VR2332毒株相比,在中和表位(aa37~45)FJDJQ-2017与谱系3代表毒株均存在H38Y和L39S的突变。此外,与其他代表毒株相比,FJDJQ-2017与谱系3代表毒株存在几处独有的氨基酸突变:F25S、H38Y、L39S、A92S、L117F、A128V、L152I和R199H(图2)。

图2 PRRSV GP5氨基酸序列分析Fig.2 Alignment of the amino acid sequences of GP5 in PRRSV灰色区域:预测的抗原区域;黑色框:谱系3 PRRSV和 FJDJQ-2017毒株GP5蛋白重要氨基酸变异位点Grey area:Predicted antigenic regions;Black box:Important amino acid changes between lineage 3 PRRSV and FJDJQ-2017 strain in GP5
2.3 遗传进化分析 为进一步了解所分离2株PRRSV的遗传情况,将2株PRRSV 全基因组和ORF5基因分别与国内外代表毒株构建系统遗传进化树。基于全基因组所构建的遗传进化树显示,FJDJQ-2017和FJDJQ-2018同属于谱系1的进化分支,为类NADC30毒株(图3A)。基于ORF5基因构建的遗传进化树显示,FJDJQ-2018属于谱系1的进化分支,为类NADC30毒株,而FJDJQ-2017属于谱系3的进化分支,为类QYYZ毒株(图3B),表明FJDJQ-2017可能为重组毒株。

图3 分离株与参考毒株全基因组(A)和ORF 5基因(B)的系统进化树分析Fig.3 Phylogenetic tree analysis of PRRSV isolated and reference strains based on the complete sequences (A) and ORF 5 gene (B)●:本试验分离株;下同●:The strains isolated in this study. The same as below
2.4 重组分析 为了解2个毒株的重组情况,使用SimPlot 3.5.1软件和RDP 4.24软件进行重组分析,结果显示FJDJQ-2017毒株和FJDJQ-2018毒株均由3个谱系毒株重组而来,其中FJDJQ-2017分离株是以类NADC30毒株为主要亲本毒,以类QYYZ毒株和类VR2332毒株为次要亲本毒发生重组而来;而FJDJQ-2018毒株是以类NADC30毒株为主要亲本毒,以类QYYZ毒株和类JXA1毒株为次要亲本毒发生重组而来。FJDJQ-2017基因组中检测到4个可靠的重组断裂点,分别位于ORF2(nt 12 200)、ORF3(nt 13 168)、ORF4(nt 13 519)和ORF7(nt 15 080)基因中,4个断裂点将其分为5个基因区域,A (nt 1~12 200)、B(nt 12 201~13 168)、C(nt 13 169~13 519)、D(nt 13 520~15 080)和E(nt 15 081~15 521)。通过分段构建遗传进化树的方法进一步验证重组事件,结果显示,A和E基因区域位于类NADC30毒株分支,B和D基因区域位于类QYYZ毒株分支,而C基因区域位于类VR2332毒株分支,由此证实FJDJQ-2017是由3个谱系(谱系1、 3和谱系5)重组而来的变异毒株(图4)。
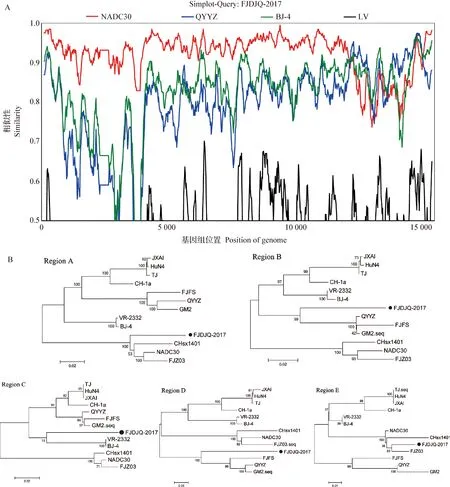
图4 FJDJQ-2017分离株全基因组重组分析Fig.4 Recombination analysis of FJDJQ-2017 isolate based on whole genomeA:FJDJQ-2017分离株全长基因重组分析; B:FJDJQ-2017分离株不同基因区域进化树分析A:Recombination analysis of FJDJQ-2017 isolate full-length genome; B:Phylogenetic tree analysis based on different gene regions of FJDJQ-2017 isolate
FJDJQ-2018基因组存在6个断裂点,分别存在ORF1a[nt 1 290(Nsp1β)、nt 4 197(Nsp2)、nt 7 002(Nsp7)和 nt 7 330(Nsp7)]和ORF1b[(nt 8 781(Nsp9)和nt 9 728(Nsp9)]中,6个断裂点将其分为7个基因区域,A(nt 1~1 290)、B(nt 1 291~4 197)、C(nt 4 198~7 002)、D(nt 7 003~7 330)、E(nt 7 331~8 781)、F(nt 8 782~9 728)和G(nt 9 729~15 080),通过分段构建遗传进化树的方法进一步验证重组事件,结果显示,A和E基因区域位于类JXA1毒株分支,B、D和G基因区域位于类NADC30毒株分支,而C和F基因区域位于类QYYZ毒株分支,由此表明FJDJQ-2018是由3个谱系(谱系1、 3和谱系8)重组而来的变异毒株(图5)。

图5 FJDJQ-2018分离株全基因组重组分析Fig.5 Recombination analysis of FJDJQ-2018 isolate based on whole genomeA:FJDJQ-2018分离株全长基因重组分析; B:FJDJQ-2018分离株不同基因区域进化树分析A:Recombination analysis of FJDJQ-2018 isolate full-length genome; B:Phylogenetic tree analysis based on different gene regions of FJDJQ-2018 isolate
3 讨论
猪繁殖与呼吸综合征病毒是单股正链有囊膜的RNA病毒,主要引起仔猪呼吸道症状以及怀孕母猪的繁殖障碍。自1987年以来,PRRS每年给世界养猪业带来了巨大的经济损失[3,5]。2012年以来流行的类NADC30毒株,使PRRSV更加复杂多样,其典型特征是易与其他毒株发生重组[6-9]。2017—2018年福建某规模化猪场母猪流产症状极为严重(流产率约为20%),且有PRRS的部分临床症状。为了查出疫病传播源头,本试验采集流产胎儿的肺脏、肾脏、淋巴结等病料组织和血清进行病毒分离及全基因组扩增,结果证实引起疫病的病原为3个谱系重组的PRRSV。
流行病学调查显示,2013年之后福建省规模化猪场存在HP-PRRSV、经典毒株、类NADC30 PRRSV和疫苗株等多种毒株,加之频繁的跨省或省内的生猪贸易,导致猪场存在多个毒株,甚至同一猪体内同时存在2个差异较大的毒株,为病毒的基因重组创造了条件[10,12-17,20]。基因重组是PRRSV进化的重要机制之一,在PRRSV复制能力、毒力、免疫耐受和病原诊断中发挥重要作用[21-23]。近年来,类NADC30毒株与我国田间毒株发生了广泛的重组,包括野毒株(谱系3、5和谱系8毒株) 和疫苗毒衍生株(JXA1 P80)。最近也报道类NADC30毒株与多个谱系的毒株发生重组,SCcd17和SCN17重组方式为L1+L5+L8,SD17-38、SCcd16和SCya17重组方式为L1+L3+L8,SD重组方式为L1+L8(疫苗株),而FJLIUY来源于4个谱系间的重组(L1+L3+L5+L8)[24-28]。本试验在某规模化猪场分离到2株PRRSV,为了明确该毒株的分子特性,对分离株进行了全基因组序列分析。2株PRRSV全基因组核苷酸同源性仅为85.8%,基因组相似性差异比较大,与美洲型代表毒株苷酸同源性为82.8%~92.7%。基于Nsp2基因分析显示,2个毒株均含有131(111+1+19) aa的不连续缺失,具有类NADC30毒株的特征,表明其属于谱系1毒株。基于PRRSV全长基因组构建的遗传进化树也表明2个毒株属于谱系1,基于ORF5基因的进化树分析表明FJDJQ-2017属于谱系3,而FJDJQ-2018属于谱系1。基因重组分析证实,FJDJQ-2017分离株和FJDJQ-2018分离株均为3个谱系毒株重组而来,即FJDJQ-2017分离株是以类NADC30毒株为主要亲本毒作为病毒骨架,以类QYYZ毒株和类VR2332毒株为次要亲本毒发生重组而来的变异毒株;而FJDJQ-2018分离株是以类NADC30毒株为主要亲本毒作为病毒骨架,以类QYYZ毒株和类JXA1毒株为次要亲本毒发生重组而来的变异毒株。不同的重组模式是否会导致毒株的致病性发生改变还需进一步研究。
由于类NADC30 PRRSV的基因序列与国内的毒株差异较大,现有商品化疫苗不能对其产生良好的交叉保护性,导致其在猪场流行[11-17]。不同类型的类NADC30重组毒株频繁出现,进一步证实PRRSV的遗传多样性,导致猪场防控PRRS的形势更加严峻。本试验分离的2个毒株不能感染MARC-145细胞,这可能与近年来PRRSV的变异导致其细胞嗜性发生一定改变有关。CD163能有效介导宿主细胞对PRRSV的内吞作用,在PRRSV侵入宿主细胞及其复制过程起着重要作用,因此本试验使用构建的MARC-145CD163细胞,成功分离到2株PRRSV毒株。
目前,PRRSV减毒活疫苗已成为防控PRRS的有效手段。本试验中2个PRRSV分离株是从商品化的减毒活疫苗免疫过的猪场中分离得到的。序列分析表明,2个毒株(FJDJQ-2017和FJDJQ-2018)与猪场使用疫苗株的核苷酸同源性较低且亲缘关系较远,可能是在长期的免疫压力下造成了猪场不同谱系的PRRSV发生了基因重组,产生了新的变异毒株,从而使疫苗产生的抗体失去了对新毒株的免疫保护。鉴于PRRSV毒株存在较高的重组概率,猪场在防控PRRS时不能单纯依靠疫苗,更应加强猪场的生物安全措施,尤其在引种时需进行PRRSV抗原和抗体检测,避免引入新的毒株。

