马氏珠母贝黏液糖蛋白组成及其体外抗癌活性研究
欧阳彤,余 蔚,尚壮壮,任鼎鼎,伍 彬,2,郑惠娜,2,3
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.国家贝类加工技术研发分中心(湛江),广东省水产品加工与安全重点实验室,广东省海洋生物制品工程实验室,广东 湛江 524088;3.广东海洋大学深圳研究院,广东 深圳 518108)
马氏珠母贝(Pinctada martensii),又称合浦珠母贝、珍珠母,是我国南海最重要的海水养殖珍珠贝类[1]。然而,产珠后的珠母贝贝壳、脏器及黏液等资源未获得充分利用。为了进一步提高此部分资源的开发利用,增加珍珠产业的附加值,诸多学者对马氏珠母贝产珠后的副产物进行了深入研究。司蕊等人[2]研究指出,马氏珠母贝肉蛋白质含量丰富且必需氨基酸含量高,富含牛磺酸、微量元素锌(Zn)和硒(Se)。叶植波等人[3]率先以马氏珠母贝黏液为原料并从中提取出天然牛磺酸,为天然牛磺酸提取提供了新思路。课题组前期对马氏珠母贝黏液糖蛋白的抗氧化活性进行了研究,结果表明马氏珠母贝黏液糖蛋白对羟自由基有较强的清除能力[4]。此外,马氏珠母贝贝肉所具有的抗衰老、抗氧化、降血压、护肝醒酒、促进创面愈合等显著生理功能活性作用的成分被一一验证,阐明了马氏珠母贝产珠后副产物的高附加值应用潜力[5]。
糖蛋白广泛存在于生物体内,是一种由寡糖链与蛋白质共价结合所形成具有特定功能活性的一类结合蛋白,糖链结构为糖蛋白的功能核心,不同种类的寡糖链及与蛋白质的结合方式组成了生物体内酶、激素、凝集素、载体、抗体等,并且生物体中超过50%蛋白质具有糖基化修饰[6-8]。Go H等人[9]在研究糖蛋白过程中发现,从食物物料中通过分离手段得到的糖蛋白仍能表现出显著的抗氧化、抗肿瘤生理活性,同时指出生物体内的糖蛋白可能具有功能的独立性和稳定性。得益于生物组学、糖生物学和分离纯化技术的发展,将生物体内糖蛋白提取纯化后并进行结构鉴定和活性评价已成为了生物功效成分提取的新方向[10-11]。糖蛋白的来源分为植物源性与动物源性,由于植物源性糖蛋白提取中存在着药理活性不确定因素,使得其在中药材等方面的应用较局限,而动物源糖蛋白的提取多被作为提升实际生产过程中产生的副产物的附加值手段之一[12-13]。在打造“蓝色粮仓”的当下,越来越多海洋生物源糖蛋白的生理活性被发现和验证,徐伟良等人[14]以大鲵皮肤黏液为原料通过分离纯化手段提取出了糖蛋白纯品,并通过细胞试验发现该糖蛋白具有显著的抗肺癌活性。对马氏珠母贝黏液糖蛋白进行分离纯化、结构分析,并通过体外细胞试验初步确定马氏珠母贝黏液糖蛋白具有抗癌活性组分,研究结果为进一步提升马氏珠母贝副产物附加值提供新思路和理论支持。
1 材料与方法
1.1 材料与试剂
马氏珠母贝来源于广东省雷州市珍珠贝养殖场,将黏液分离出来,于4℃下以转速6 000 r/min离心10 min,取上清液分装于塑料瓶中,于-30℃下冻藏备用。Sephadex G-150柱层析,北京博奥拓达科技有限公司提供;美国USA进口透析袋,截留分子量为1 000 Da,上海桥星贸易有限公司提供;SDSPAGE凝胶快速配制试剂盒、彩色预染蛋白Marker(6.5~270 kDa)、SDS-PAGE蛋白上样缓冲液 (5×)、SDS-PAGE电泳液(Tris-Gly,Powder)、考马斯亮蓝染色液,上海碧云天生物技术有限公司提供;MTT,上海源叶生物科技有限公司提供;南美胎牛血清、DMEM basic、0.25% Trpsin-EDTA,美国Gibco公司提供;Dimethyl sulfoxide,美国Sigma公司提供;乙二胺四乙酸二钠盐、二水、碳酸氢钠、无水乙醇、氯化钠、冰乙酸、D-无水葡萄糖、苯酚、硫酸、异丙醇、溴化钾、二甲基亚砜,均为分析纯。
1.2 仪器与设备
RC-6 plus型落地式高速冷冻离心机、ND 2000C型超微量紫外可见分光光度计,美国Thermo Fisher Scientific公司产品;Advantage A10型超纯水器,德国默克化工技术有限公司产品;Q10A型电陶炉,广东新功电器有限公司产品;Quintix1102百分之一天平、Quintix224万分之一天平,德国赛多利斯科学仪器有限公司产品;Cool Safe 100-4型真空冻干系统,丹麦LABOGENE产品;HL-2型数字恒流泵、BS-100A型自动部分收集器,上海青浦沪西仪器厂产品;AP-9925型真空泵,天津奥特赛恩斯仪器有限公司产品;KQ-500DE型数控超声波清洗机,昆山市超声仪器有限公司产品;Mini PROTEAN型电泳槽、Power Basic型电泳仪,美国BIO-RAD公司产品;NSP-300型水平旋转仪,泰州诺米医疗科技有限公司产品;TENSOR 27型傅里叶红外光谱仪,德国BRUKER公司产品;SQ510C型高压灭菌锅,日本YAMATO公司产品;DHG-9070A型精密鼓风干燥箱,中国BIOBASE公司产品;BC-J160型二氧化碳细胞培养箱、SW-CJ-FD型净化工作台、HHS-11-1型电热恒温水浴锅,上海博讯实业有限公司产品;DM0412型低速离心机,北京大龙兴创实验仪器股份公司产品;XD型细胞培养用显微镜,宁波舜宇仪器有限公司产品;Synergy HT型酶标仪,美国BioTek公司产品。
1.3 试验方法
1.3.1 马氏珠母贝黏液糖蛋白的粗提
将马氏珠母贝黏液解冻,透析24 h,采用30%的聚乙二醇浓缩4 h,然后采用直接醇沉法对透析、浓缩后的马氏珠母贝黏液进行粗提[5],取适量黏液于烧杯中,加入90%的乙醇溶液至乙醇的体积分数为70%,缓慢搅匀后于4℃冰箱中静置18 h,弃去上清液,将沉淀物于4℃下以转速7 000 r/min离心15 min,取沉淀暴露在空气中至乙醇味消散,真空冷冻24 h得糖蛋白粗品DAS。
1.3.2 糖蛋白的分离纯化
采用Sephadex G-150柱层析法对透析、醇沉后的糖蛋白粗品进行分离纯化[5]。层析柱规格为φ1.6 cm×60 cm;将糖蛋白粗品溶于超纯水,于4℃下以转速12 000 r/min离心10 min,过0.22 μm的水系微孔滤膜,调节可溶性蛋白含量为6~8 mg/mL,每次上样4 mL。以质量分数0.05%的NaCl洗脱液为流动相,以1 mL/min的流速进行纯化,每管收集5 mL,于波长280 nm处测定吸光度并绘制分离纯化曲线,对出现的峰进行分开收集,真空冷冻干燥24 h,得糖蛋白纯化品。
1.3.3 SDS-PAGE电泳
使用10%的分离胶和5%的浓缩胶,将胶板固定于电泳槽的凹槽内,使电泳胶完全浸泡于电泳液中,调整样品蛋白质量浓度至1 mg/mL[5],上样10 μL,彩色预染蛋白分子量标准品上样7 μL,调节电压为120 V,电泳1~2 h,待条带跑至电泳胶底部关闭电源,将电泳胶完整取出,振荡染色2 h,脱色5~6 h至条带清晰可见,将脱色后的电泳胶进行拍照,采用Gel-Pro Analyzer 4.0软件计算分子质量分布。
1.3.4 糖含量、氨基酸测定
总糖含量测定采用苯酚硫酸法[15-16]。以葡萄糖含量(mg)为横坐标,吸光度(A) 为纵坐标,绘制标准曲线。测得标准曲线方程为Y=3.069X+0.062 4,R2=0.982 5。分别取0.5 mg/mL的粗品,0.3 mg/mL的纯化品1.0 mL于2只试管中,按相同步骤测定吸光度,代入标准曲线计算样品糖含量,见公式(1):

式中:w——样品的糖含量,%;
m1——样品的糖的质量,g;
M——样品有效成分的质量,g。
样品水解氨基酸测定采用GB 5009.124—2016[17]。
1.3.5 红外光谱测定
红外光谱测定采用溴化钾压片法[18]。取适量溴化钾、糖蛋白纯化品分开置于洁净的玻璃皿上,放入红外线快速干燥器烘2~3 h直至烘干,按糖蛋白样品∶溴化钾=1∶100的比例置于玛瑙钵体中研磨成面粉状且无晶体的细粉,用压片机制成透光性良好的薄片,每种样品设置3个平行,1组空白,采用傅里叶红外光谱仪测定糖蛋白样品的红外图谱。
1.3.6 糖蛋白的体外抗癌活性检测
采用四氮唑蓝还原(MTT)法测定糖蛋白对人肝癌细胞(HepG2)、小鼠肺癌细胞(LLC) 的抑制率。即细胞经传代培养至倍数生长期后,制成细胞悬液,细胞计数后调节细胞浓度为5×104mL-1,种于96孔板,按质量浓度梯度设置3个平行,培养12 h待其贴壁后,加入一定质量浓度梯度的糖蛋白溶液,最终质量浓度梯度为0.5,1.0,2.0,4.0,6.0 mg/mL,作用24 h后,每孔加入5 mg/mL的MTT溶液20 μL,继续培养4 h,弃去上清液,每孔加入100 μL裂解液DMSO,小心振荡10 min,在酶标仪上测定各孔在波长490 nm处的吸光度,按公式(2) 计算糖蛋白纯化品对HepG2、LLC细胞的增殖抑制率,分析糖蛋白的生物活性作用。

1.3.7 试验数据分析
数据采用Excel 2019软件进行数据处理和绘图,采用SPSS Statistics 26.0软件进行方差(ANOVA)显著性(p<0.05) 以及回归Probit分析。
2 结果与分析
2.1 Sephadex G-150柱层析法纯化结果
珍珠贝黏液经过透析除盐、乙醇沉淀后得到糖蛋白粗品,再通过Sephadex G-150进行分离纯化,洗脱曲线在波长280 nm处呈现2个吸收峰,分别收集2个吸收峰的洗脱液,真空冻干后得糖蛋白纯化品MP-FI、MP-FII。
DAS的Sephadex G-150柱层析洗脱曲线见图1。

图1 DAS的Sephadex G-150柱层析洗脱曲线
2.2 SDS-PAGE电泳图谱分析
MP-FI和MP-FII的电泳图见图2。

图2 MP-FI和MP-FII的电泳图
由图2可知,MP-FI在6.7,18.0,34.0,39.0,164.0 kDa处出现明显的条带,其中含量最高的蛋白组分分子量在39 kDa附近。与余蔚等人[4]研究得到的245 kDa糖蛋白分子量存在差异,可能是黏液批次和分离纯化条件不同所导致。MP-FI中除了含量较高的39 kDa的蛋白组分,还含有其他杂蛋白,通过一步分离纯化方法较难到单一的糖蛋白纯化品。MP-FII在SDS-PAGE上形成的条带较淡,可能含有分子量小于6.5 kDa的蛋白或其他低分子肽,其中较明显的蛋白条带出现在121 kDa附近。
2.3 糖含量、氨基酸组成分析
结构决定功能,糖肽键是由糖分子中碳原子上连接的醇羟基与氨基酸氨基脱水缩合或羟基脱去一分子水所形成,是糖蛋白的功能活性中心[19]。根据糖链与氨基酸连接方式和位点的不同可以将糖蛋白分为O-糖基化糖蛋白和N-糖基化糖蛋白,且可形成糖肽键的氨基酸残基主要为天冬氨酸(Asp)、丝氨酸(Se)r、苏氨酸(Th)r等,其中丝氨酸与苏氨酸与糖链分子以O-连接方式连接,而天冬氨酸与糖链分子主要通过C-N共价连接方式进行连接[20-21]。试验测得MP-FI有效成分的总糖质量分数为12.59%±0.34%,可溶性蛋白的质量分数为78.33%±5.30%;MP-FII有效成分的总糖质量分数为11.06%±0.15%,可溶性蛋白的质量分数为69.88%±5.27%。
氨基酸组成及百分含量(%,n=2) 见表1。
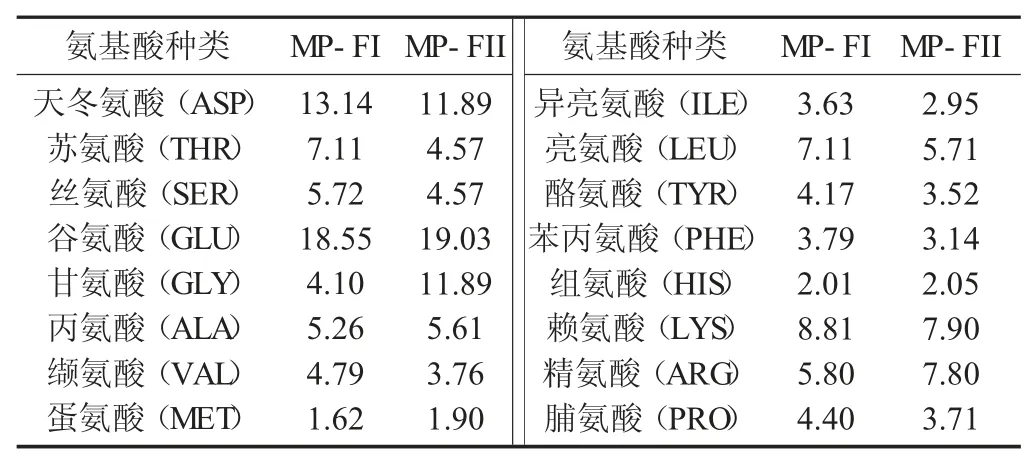
表1 氨基酸组成及百分含量(%,n=2)
由表1可知,MP-FI和MP-FII氨基酸种类丰富,均含有16种水解氨基酸,其中包含7种必需氨基酸:苏氨酸(THR)、缬氨酸(VAL)、蛋氨酸(MET)、异亮氨酸(ILE)、亮氨酸(LEU)、苯丙氨酸(PHE)、赖氨酸(LYS),MP-FI和MP-FII中必需氨基酸的含量分别占水解氨基酸总量的36.86%和29.92%。近年来研究发现,具有抗癌活性的蛋白肽具有相似的赖氨酸、组氨酸及精氨酸的组成成分[22]。有研究发现癌症细胞具有大量吸取必需氨基酸的特征[23-24]。
2.4 红外光谱测定结果
采用傅里叶红外光谱法对纯品MP-FI、MP-FII的二级结构组成进行分析。
MP-FI、MP-FII的红外光谱图见图3。
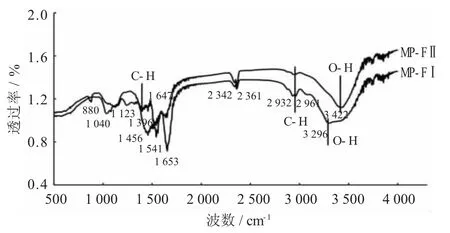
图3 MP-FI、MP-FII的红外光谱图
由图3可知,对比MP-FI与MP-FII 2种纯化品的红外光谱曲线,在酰胺I带(1 600~1 700 cm-1)、酰胺III带(1 220~1 330 cm-1)2种纯化品存在明显差异,说明MP-FI与MP-FII二级结构存在差异。其中MP-FI在1 653 cm-1处具有强特征吸收峰,说明其二级结构主要为α螺旋,根据Zhao Z K等人[25]在应用FTIR测定蛋白质结构中指出蛋白质分子中α折叠数量与分子内氢键数量呈正相关,可推测出MP-FI样品分子结构中含有更多的氢键;同时,在1 541 cm-1处出现特征吸收峰代表在MP-FI中的N-H弯曲振动与C-N伸缩振动。MP-FII在1 647 cm-1处出现特征吸收,说明其二级结构中存在无规则卷曲,且MP-FII在1 456 cm-1出现特征吸收峰,代表着其结构内的C-H(O)C-O弯曲伸缩振动[26]。MP-FI、MP-FII在2 342,2 361,2 961 cm-1均出现吸收峰且频率相似,说明2种纯化蛋白具有相似的结构,而在3 296,3 422 cm-1处的吸收峰(O-H)、2 961 cm-1处的吸收峰(C-H) 和1 396 cm-1处的吸收峰(C-H)均为糖类的特征吸收峰,说明了MP-FI、MP-FII肽链结构存在差异,且MP-FI在1 040 cm-1处的吸收峰表示其糖链结构中存在β-型糖苷键结构[27]。
2.5 体外抗癌活性
MP-FI、MP-FII对HepG2的抑制率见图4,MPFI、MP-FII对LLC的抑制率见图5。
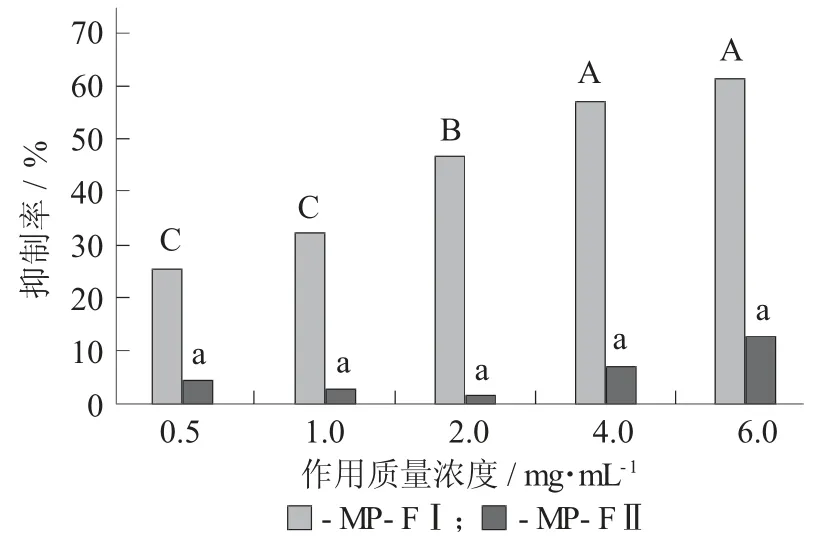
图4 MP-FI、MP-FII对HepG2的抑制率
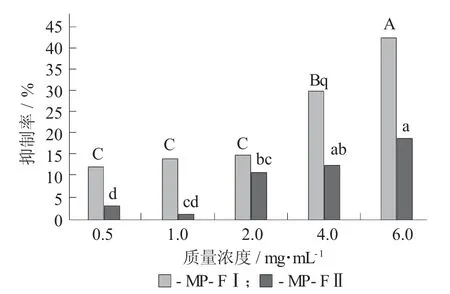
图5 MP-FI、MP-FII对LLC的抑制率
由图4可知,糖蛋白纯化品MP-FI对人肝癌(HepG2) 细胞表现出明显的增殖抑制作用。随着质量浓度的增大,MP-FI对HepG2的抑制率逐渐增大,在1~4 mg/mL表现出明显的剂量相关性(p<0.05),当MP-FI质量浓度达6 mg/mL时,对HepG2的抑制率高达61.56%,IC50值为2.7 mg/mL。MP-FII在0.5~6.0 mg/mL质量浓度范围内对HepG2的生长表现出一定的抑制作用,但无显著性差异(p>0.05)。由图5可知,MP-FI对小鼠肺癌(LLC) 细胞表现出明显的增殖抑制作用,在低质量浓度(0.5~2.0 mg/mL)范围内无显著性差异(p>0.05),在2~6 mg/mL的质量浓度范围内表现出明显的剂量相关性(p<0.05),当MP-FI质量浓度达6 mg/mL时,对LLC的抑制率达42.23%,IC50值为12.1 mg/mL。总体分析可知糖蛋白纯化品MP-FI的抗癌活性明显强于MP-FII(p<0.05)。
细胞大量积累自由基是导致其发生癌变的主要原因之一,且研究发现,发生癌变的细胞内含有更多的自由基,而这些自由基通过损伤细胞内部的DNA使正常良性肿瘤细胞进一步发展成为恶性癌细胞,具有清除自由基的物质能够对癌细胞产生抗性作用[28]。在前期的研究中,证实了马氏珠母贝黏液糖蛋白具有显著的抗氧化清除自由基的能力[5],MP-FI与MP-FII对2种癌细胞的抑制作用可能与其所具有的体外抗氧化活性密切相关。
3 结论
MP-FI和MP-FII含有的氨基酸种类丰富,含有较高的与抗癌功能活性相关的赖氨酸和精氨酸。MP-FI的分子量分布集中为6.7~39 kDa。MP-FI、MP-FII的化学结构与化学组成存在差异,且根据MP-FI特征吸收峰确定了其存在区别于MP-FII的α螺旋二级结构,MP-FI和MP-FII均具有多糖的特征吸收峰,其中MP-FI中具有β-型糖苷键的结构。MP-FI、MP-FII均具有一定的抗癌活性,且MP-FI对HepG2、LLC的抑制作用明显高于MP-FII。研究结果可为进一步利用马氏珠母贝黏液开发具有抗癌活性功能的制品提供理论基础依据。

