肿瘤相关因子TSHR与甲状腺乳头状癌的相关性
刘 俊 ,叶 静 ,王 科,钟 玲 ,魏雪梅
1.成都三六三医院耳鼻咽喉头颈外科(成都610041);2.成都大学附属医院耳鼻咽喉头颈外科(成都 610081)
甲状腺乳头状癌(thyroid carcinoma,TC)是我国常见的恶性肿瘤,现在其主要治疗方法是以手术治疗为主[1],同时给予碘131治疗。随着对甲状腺乳头状癌研究的深入,该疾病发病的分子生物学机制逐渐成为了热点。有研究指出[2],甲状腺乳头状癌的发病可能与多种基因如BRAF、P53等基因的突变和表达水平变化有密切关系。但是作为甲状腺疾病相关基因,TSHR因子在甲状腺乳头状癌组织中的表达对其发生、发展、转归的研究并不十分多见。因此,对甲状腺乳头状癌的相关基因TSHR的检测对于防治甲状腺乳头状癌,改善疾病预后具有重要意义。
1 对象与方法
1.1 研究对象及材料
1.1.1 研究对象 选取2017年3月至2018年3月就诊于本院的甲状腺乳头状癌病人,并随机抽取其中符合要求的病人30 例,纳入标准:①符合甲状腺癌诊疗规范(2018 年版),并通过成都三六三医院病理科行病理活检确定诊断;②病人自入院初未经过其他治疗(如核医学碘131治疗)等;③年龄18岁以上,具有良好的依从性,并签署知情同意书;本研究通过了伦理学审议(伦理审查号:JN.No20200630c0240731[119])。排除标准:①经检查发现其他恶性肿瘤,或已接受其他治疗等;②已经发生远处转移的病人;③病人拒绝参与实验。
1.1.2 实验材料BCA试剂盒购自碧云天生物技术研究所;总mRNA提取试剂盒购自天根生物公司;反转录试剂盒购自Themo fisher公司;荧光定量PCR引物合成自上海生工公司(TSHR上游引物序列为5'-GCTTTCAGG TAAACCAATGA-3'下游引物为5'-AAGGGCCAGTGA CACTGGTTTGAGA-3'。BRAF上游引物为5'-TCGTC AATCGGTC-3'下游引物为5'-CGGCTTGCATT);荧光定量PCR 试剂盒购自大连Takara 公司;TSHR 及BRAF 一抗抗体购自美国Santa Cruz公司。
1.2 研究方法
1.2.1 实验取材 纳入对象行手术治疗切除甲状腺乳头状癌及周围组织,标本送病理科进行活检,确定甲状腺乳头状癌癌组织病灶及未被肿瘤侵犯的组织,并将组织各分为两份,分别置于-80 ℃冰箱及RNA 保护液中保存。
1.2.2 检测mRNA 表达水平 使用天根总mRNA 提取试剂盒分别提取各标本总mRNA,经凝胶电泳紫外荧光显色观察28s RNA及18s RNA条带清楚,且28s RNA大约为18s RNA 量的两倍,说明RNA 完整性较好视为RNA 完整性良好(见图1)。并通过紫外分光光度计确定OD260/OD280在1.8~2.1 之间的RNA 视为合格样本。确定合格的样本在定量后使用Themo公司逆转录试剂盒逆转录为cDNA,并置于-20 ℃长期保存。

图1 琼脂糖凝胶电泳检测RNA完整性Figure 1 Integrity of RNA tested by agarose gel electrophoresis
使用联排PCR 管,每管加入解冻后的cDNA 溶液1 μL,无菌去离子水7 μL,正反链引物各1 μL,荧光染料10 μL,并置于RT-qPCR 仪中,以50 ℃2 min,95 ℃10 min,(95 ℃15 s,60 ℃1 min)×40 循环,95 ℃15 s,60 ℃1 min,95 ℃15 s的程序运行,得到结果与内参对比后得出△Ct后进行分析。
1.2.3 检测蛋白质表达量 取约1 g 解冻后组织加入1%PMSF,研磨裂解沉淀后,14 000 r/min离心10 min取上清液,-20 ℃保存,并使用BCA试剂盒及酶标仪测定样本蛋白质含量并统一定量后置于-20 ℃保存。取15 μL 组织总蛋白加入等量loading buffer,100 ℃水浴30 min,行恒压电泳后转至PVDF 膜,并加入5 mL TBST,一抗2 μL,脱脂奶粉0.4 g 配置的封闭液,混匀30 min 后4 ℃孵育过夜。次日清洗PVDF 膜后曝光显像。
1.3 数据分析 采用SPSS 18.0 对实验结果进行分析,正态分布计量资料采用ˉX±S表示,两个样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺乳头状癌与正常组织中mRNA的表达
2.1.1 TSHR mRNA在正常组织与甲状腺乳头状癌组织中的表达差异 正常组织中TSHR mRNA的△Ct值为11.783±0.21,而甲状腺乳头状癌组织中TSHR mRNA的△Ct值为8.189±0.42(见图2),甲状腺乳头状癌组织中TSHR的mRNA表达较正常组织升高,差异具有统计学意义(P<0.05)。

图2 TSHR mRNA在正常组织与甲状腺乳头状癌组织中的表达Figure 2 Expressions of TSHR mRNA in normal tissue and PTC tissues
2.1.2 BRAF mRNA 在正常组织中与甲状腺乳头状癌组织中的表达差异 正常组织中BRAF mRNA的△Ct值为7.478±0.35而甲状腺乳头状癌组织中BRAF mRNA的△Ct值为5.216±0.47(见图3),甲状腺乳头状癌组织中BRAF的mRNA表达较正常组织升高,且差异具有统计学意义(P<0.05)。

图3 Braf mRNA在正常组织与甲状腺乳头状癌组织中的表达Figure 3 Expressions of Braf mRNA in normal tissue and PTC tissues
2.2 甲状腺乳头状癌组织与正常组织中的蛋白表达
2.2.1 TSHR 蛋白在正常组织中与甲状腺乳头状癌组织中的表达差异 正常组织中TSHR 蛋白TSHR/β-actin相对灰度值为0.955±0.12,甲状腺乳头状癌组织中TSHR/β-actin 相对灰度值为1.452 ± 0.09(见图4,图5),甲状腺乳头状癌组织中TSHR蛋白表达较正常组织升高,且差异具有统计学意义(P<0.05)。

图4 TSHR 蛋白在正常组织中与甲状腺乳头状癌组织中的表达Figure 4 Expressions of TSHR protein in normal tissue and PTC tissues

图5 TSHR 蛋白在正常组织与甲状腺乳头状癌组织中的表达柱状图Figure 5 Bar chart of expressions of TSHR protein in normal tissue and PTC tissues
2.2.2 BRAF 蛋白在正常组织中与甲状腺乳头状癌组织中的表达差异 正常组织中BRAF 蛋白BRAF/β-actin 相对灰度值为1.721 ± 0.09,甲状腺乳头状癌组织中BRAF/β-actin相对灰度值为2.012 ± 0.13(见图6,图7),甲状腺乳头状癌BRAF 蛋白较正常组织升高,且差异具有统计学意义(P<0.05)。

图6 BRAF 蛋白在正常组织中与甲状腺乳头状癌组织中的表达Figure 6 Expressions of BRAF protein in normal tissue and PTC tissues
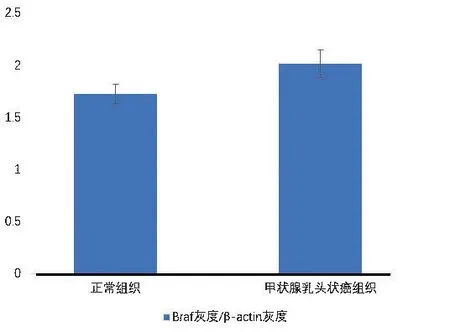
图7 TSHR 蛋白在正常组织中与甲状腺乳头状癌组织中的表达柱状图Figure 7 Bar chart of expressions of TSHR protein in normal tissue and PTC tissues
2.2.3 BRAF 基因与TSHR 基因表达的相关性 将QPCR 分析所得TSHR与BRAF基因表达结果通过SPSS 18.0 进行相关性双变量分析后,发现TSHR表达与BRAF表达呈正相关,r 值为0.799(见图8),且差异具有统计学意义(P<0.05)

图8 TSHR与Braf 蛋白表达相关性散点图Figure 8 Correlation between THSR and Braf protein
将Western-bolting 分析所得TSHR与BRAF基因表达结果通过SPSS 18.0进行相关性双变量分析后,发现TSHR表达与BRAF表达呈正相关,r 值为0.904(见图9),且差异具有统计学意义(P<0.05)

图9 TSHR与Braf mRNA表达相关性散点图Figure 9 Correlation between THSR and Braf mRNA
3 讨论
甲状腺癌是最常见的内分泌肿瘤之一,约占全身恶性肿瘤总病例的1%,是近年来发病率增长较快的实体肿瘤[3]。有报道指出,全球2018 年估计新发567 000例,死亡41 000 例,其发病趋势在世界范围内快速上升[4]。在我国,甲状腺癌亦是常见的恶性肿瘤,其发病率亦快速上升[5-6]。而甲状腺乳头状癌则是甲状腺癌中最常见的类型[7]。有报道指出,甲状腺乳头状癌的发病可能与辐射、激素水平、碘摄入量等因素有关[4,8-9],但其发病的分子生物学机制并没有被完全揭示。
随着分子生物学技术的进步及对甲状腺乳头状癌研究的不断深入,有报道指出甲状腺乳头状癌与多种基因如BRAF、P53等基因的突变和表达差异有密切关系[10-12]。其中TSHR基因突变与甲状腺乳头状癌发生、发展及转归的关系逐渐引起人们的关注[13]。作为甲状腺疾病的相关因子,TSHR基因的变异与表达的变化与以Graves 病、桥本氏甲状腺炎为代表的众多甲状腺疾病有关[14-15]。作为调控甲状腺细胞代谢的关键因子,TSHR基因的表达受到多种基因的表达调控[16-19]。在作用机制上,TSHR 作为G 蛋白偶联受体家族成员,对甲状腺细胞分化起到了重要的调节作用,TSH与TSHR相偶联,激活异源三聚体G 蛋白介导TSHR 信号,同时引发cAMP级联反应,进而控制了甲状腺乳头状癌相关基因的表达并影响了甲状腺肿瘤及相关疾病的发展[20-21]。同时有研究认为,甲状腺乳头状癌中,RASSF1A、P16启动子甲基化率明显增高[22],此时促甲状腺激素TSH与位于甲状腺表面的TSHR相结合,引发TSHR表达变化,引发碘摄入及甲状腺素合成变化,进而影响甲状腺乳头状癌的发生、发展。
传统的观点认为,TSHR作为抑癌因子,对甲状腺乳头状癌尤其是合并甲亢的乳头状癌的进展起到了抑制的作用[14,24-25],这与本次实验结果中甲状腺乳头状癌组织中TSHR表达量较正常组织明显升高相悖。但同时有报道认为,甲状腺乳头状癌病人TSHR基因表达较正常病人高[19,26-27]。上述研究认为,甲状腺乳头状癌病人THSR基因高表达可能与甲状腺肿物导致甲状腺功能亢进有关,同时该现象可能与BRAF基因的高表达相关[28-30]。这些观点,与本研究中甲状腺乳头状癌组织中TSHR与BRAF表达呈正相关关系的结论相同。但其并未对合并甲亢的甲状腺乳头状癌出现的上述情况做详细解释,同时其未对甲状腺乳头状癌组织中TSHR的进行相关检测。本研究认为,甲状腺乳头状癌中THSR高表达可能是由于甲状腺恶性肿瘤的发生及进展刺激了TSHR被动表达,进一步引起上述表现。
甲状腺乳头状癌的发生、发展受到了多基因的调控。但对于TSHR基因,更多的研究着眼于TSHR启动子甲基化率[31]及外周血中TSHR-mRNA表达[32]与甲状腺乳头状癌的相关性。目前为止,仅有极少研究对TSHR基因在甲状腺乳头状癌组织和正常组织中的表达变化进行研究[33],且上述少量研究并未通过Westen-Bolting 等分子生物学方法对TSHR基因在甲状腺乳头状癌组织中表达进行精确的定量[31]。于此,我们采取Q-PCR及Western-Bolting方式对TSHR基因进行检测,并将检测结果与肿瘤相关因子BRAF基因的表达进行比较。实验结果表明:甲状腺乳头状癌组织中TSHR表达量较正常组织明显升高,同时,甲状腺乳头状癌组织中TSHR表达与作为参考基因的BRAF表达亦呈正相关关系,进一步揭示了TSHR基因在甲状腺乳头状癌组织中发生、发展中起到的作用。
4 结论
甲状腺乳头状癌细胞中TSHR 因子的表达水平较正常组织显著升高,且与BRAF 的表达呈正相关关系,其成因可能与甲状腺乳头状癌的进展刺激TSHR 的被动表达有关,以致进一步引起TSHR的高表达。
(利益冲突:无)

