妊娠期糖尿病患者胎盘组织中Apelin和APJ的表达及其对滋养层细胞胰岛素抵抗和行为的影响
刘莎莎,赵 云,孙国强,陈菲菲
(1.湖北省妇幼保健院产科,湖北 武汉 430070;2.湖北省妇幼保健院妇产科,湖北 武汉 430070)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种以患者妊娠期间不同程度糖耐量异常为特征的代谢性疾病[1]。随着生活节奏的加快和高龄产妇的增加,GDM的发病率呈逐年升高趋势[2]。GDM严重影响母婴健康,其不仅导致不良妊娠结局的发生,还使患者及其后代远期发生2型糖尿病(type 2 diabetes mellitus,T2DM)和其他类型代谢综合征的风险明显增加[3-5]。尽管GDM的 发 生 机 制 尚 未 完 全 阐 明,但 研 究[6-7]证 实:GDM与T2DM相 似,即 胰 岛 素 抵 抗(insulin resistance,IR)和糖代谢紊乱在GDM的发生进展中发挥重要作用。同时,研究[8]表明:上述代谢异常能够损伤滋养层细胞的增殖和侵袭等功能,而后者是导致胎盘组织病理改变和不良妊娠结局的重要诱导因素。Apelin作为血管紧张素Ⅱ1型受体相关蛋白(angtiotensinⅡtype 1 receptor associated protein,APJ)的内源性配体,广泛表达于中枢神经系统、心血管系统和胎盘等组织器官中[9]。研究[10-11]显示:在T2DM肥胖患者的外周血和皮下脂肪组织中Apelin/APJ表达明显增加,进一步研究证实其可能通过增加葡萄糖的利用而提高胰岛素的敏感性,即Apelin/APJ系统能改善T2DM患者的IR。但GDM患者Apelin/APJ的表达及其是否参与GDM患者胎盘组织的IR和对滋养层细胞功能的影响尚不明确。腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)途径是经典的能量代谢信号通路,其不仅能够调节脂肪细胞的增殖和分化,还能参与胰岛素信号的传导,放大和调控IR并发挥作用,从而介导T2DM的 发 生[12-13]。同 时,AMPK在GDM患 者胎盘组织中呈异常低表达,并与高糖(high glucose,HG)条件下滋养层细胞的功能损伤有关[14]。因此,本研究检测Apelin和APJ在GDM患者胎盘组织中的表达,探究其对滋养层细胞IR和增殖及侵袭功能的影响,进一步阐明GDM的发病机制,以期为GDM的治疗提供新的靶点和可能性。
1 资料与方法
1.1 一般资料选择2019年5月—2020年5月于湖北省妇幼保健院产科定期产检且住院行剖宫产术分娩的孕产妇60例作为研究对象,进行回顾性分析。根据是否患有GDM将研究对象分为2组:GDM组30例,糖 耐 量 正 常(normal glucose tolerance,NGT)组30例。术中取出胎盘后,立即由脐带附着处中央部位取约1 cm×1 cm×1 cm胎盘绒毛组织,30 min内运回实验室保存于液氮中,进行后续相关实验。所有受试者或家属均签署书面知情同意书,且本研究经本院伦理委员会批准。
1.2 纳入和排除标准纳入标准:①GDM组为根据第9版《妇产科学》的GDM诊疗标准诊断为GDM的患者,即在孕24~28周空腹接受75 g葡萄糖耐量试验(oral glucose tolerance test,OGTT),空 腹 血 糖≥5.1 mmol·L-1和(或)OGTT-1 h血糖≥10.0 mmol·L-1和(或)OGTT-2 h血 糖≥8.5 mmol·L-1的孕产妇。②NGT组为年龄和孕周等与GDM组患者相匹配的NGT者,即在孕24~28周空腹接受75 g OGTT,空腹血糖<5.1 mmol·L-1和(或)OGTT-1 h血糖<10.0 mmol·L-1和(或)OGTT-2 h血糖<8.5 mmol·L-1的孕产妇。排除标准:①孕产妇年龄<20岁或>35岁;②妊娠期并发糖尿病的患者,OGTT-空 腹 血 糖≥7.0 mmol·L-1和(或)OGTT-2 h血糖≥11.1 mmol·L-1和(或)糖化 血 红 蛋 白(glycated hemoglobin,HbA1c)>6.5%;③妊娠并发心脑血管、肺、肝和肾等器官疾病,妊娠并发甲状腺疾病等其他并发症者;④非自然妊娠或多胎妊娠者;⑤早产和宫内生长受限等不良妊娠结局者。
1.3 细胞、主要试剂和仪器人绒毛膜滋养层细胞系HTR-8/SVneo(HTR-8)购自美国模式培养物研 究 所 (American Type Culture Collection,ATCC)。DMEM培养基和1%青-链双抗溶液(美国Hyclone公司),胎牛血清(fetal bovine serum,FBS)(浙江天杭生物科技股份有限公司),兔抗Apelin和兔抗APJ抗体(美国Santa Cruz公司),TRIzol裂解液、反转录试剂盒和SYBR Premix EX TaqⅡKit(日本TaKaRa公司),兔抗胰岛素受体底物1(insulin receptor substrate 1,IRS1)和磷脂酰 肌 醇3-激 酶 (phosphatidylinositol 3-kinase,PI3K)抗 体(美 国Cell Signaling Technology公司),兔抗胰岛素受体底物2(insulin receptor substrate 2,IRS2)、葡萄糖转运蛋白4(glucose transporter 4,GLUT4)、 磷 酸 化PI3K(phosphorylated PI3K,p-PI3K)、磷酸化AMPK(phosphorylated AMPK,p-AMPK)和AMPK抗体(美国Proteintech公司),牛血清白蛋白(北京索莱宝生物科技有限公司),5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)试剂盒(美国Thermo公司),辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥生物科技有限公司),Transwell小室(美国Corning Costar公司),BCA蛋白定量试剂盒、RIPA细胞裂解缓冲液和蛋白酶抑制剂(上海碧云天生物技术有限公司)。实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)引物由生工生物(上海)股份有限公司设计并合成。CO2细胞培养箱(美国Thermo Fisher Scientific公司),PCR仪(9902型)(美国Applied Biosystems公司),倒置光学显微镜(DXM1200型)(日本Nikon公司)。
1.4 细胞培养和分组常规复苏HTR-8细胞后,采用含10%FBS和1%青-链双抗溶液的DMEM培养基于37℃、5%CO2的细胞培养箱中培养。待细胞生长至融合80%~90%时,弃上清,采用0.25%胰蛋白酶消化传代,每3 d按1∶3传代1次。取处于对数生长期的HTR-8细胞,按4×105mL-1细胞密度接种于6孔细胞培养板中,并按细胞处理方式的不同分为对照组(DMEM培养基中葡萄糖含量为5 mmol·L-1)、Apelin组(DMEM培 养 基 中 加 入10 μg·L-1Apelin[15])、HG组(DMEM培养基中葡萄糖含量为25 mmol·L-1),HG+Apelin组(HG培 养基 中 加入10 μg·L-1Apelin)和HG+Apelin+anti-APJ组(HG培 养 基 中 加入10 μg·L-1Apelin与40 μg·L-1中和抗体anti-APJ)。各组细胞置于37℃、5%CO2培养箱中培养36 h后用于后续实验。
1.5 免疫组织化学法检测2组研究对象胎盘组织中Apelin和APJ阳性表达率将胎盘组织样本置于4%多聚甲醛溶液中固定24 h,常规石蜡包埋,切片至4 μm后,二甲苯和梯度酒精脱蜡至水,柠檬酸钠进行抗原修复,双氧水封闭过氧化物酶,山羊血清封闭抗体,加入一抗:兔抗Apelin(1∶300),兔抗APJ(1∶300),4℃孵育过夜,随后加入辣根过氧化物酶标记的二抗(1∶500),37℃孵育30 min,加入DAB试剂显色,苏木精复染,再次使用梯度酒精和二甲苯脱水,中性树脂封片,显微镜下观察并拍照,计算胎盘组织中Apelin和APJ蛋白阳性表达率。其中细胞核为蓝色,细胞质中Apelin和APJ的阳性表达为棕黄色或黄褐色。Apelin或APJ阳性 表达率=Apelin或APJ阳 性细胞数/总细胞数×100%。
1.6 RT-qPCR法检测2组研究对象胎盘组织中Apelin和APJ mRNA表达水平TRIzol裂 解液裂解细胞后提取胎盘绒毛组织中总RNA,紫外分光光度计测量总RNA浓度,按照反转录试剂盒说明书方法将RNA反转录为cDNA,并以其为模板按照PCR试剂盒说明书进行反应,PCR反应条件:95℃预 变性15 min,94℃变性10 s,55℃退火30 s,72℃延伸32 s,共40个循环。以β-actin为内参,采用2-ΔΔCt法计算目的基因mRNA表达水平。实 验 单 独 重 复3次。PCR引 物 序 列:Apelin,F 5′-CTGCAGTGTGGCCTGTACAAGGCGCTC-3′,R 5′-AAGCGCCCGGCGCTTGAGCCTT-3′;APJ,F 5′-CTCATATAAGTGTCAGGGCCAAG-3′,R 5′-GAGAAGCGTCAGCGCCCTTGGCC-3′;β-actin,F 5′-TGGCACCCAGCACAATGAA-3′,R 5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。
1.7 Western blotting法检测2组研究对象胎盘组织和各组HTR-8细胞中IR相关蛋白表达水平和蛋白磷酸化水平采用含蛋白酶抑制剂的RIPA裂解缓冲液于冰上提取胎盘组织样本和各组HTR-8细胞中总蛋白,BCA法蛋白定量,加热变性后凝胶电泳分离,冰水中转移至PVDF膜上,置于含5%牛血清白蛋白于室温下抗体封闭2 h,TBST缓冲液充分洗涤后,加入一抗:Apelin(1∶500)、APJ(1∶500)、IRS1(1∶800)、IRS2(1∶800)、GLUT4(1∶800)、p-PI3K(1∶1 000)、PI3K(1∶1 000)、p-AMPK(1∶1 000)、AMPK(1∶1 000)和β-actin(1∶2 000),4℃孵育过夜,TBST缓冲液洗涤,随后加入辣根过氧化物酶标记的二抗(1∶5 000),室温下孵育2 h,加入ECL化学发光液,采用Image J软件分析蛋白条带灰度值,以β-actin为内参,计算目的蛋白表达水平和蛋白磷酸化水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。实验单独重复3次。
1.8 EdU荧光染色法检测各组HTR-8细胞EdU阳性表达率取生长状态良好的各组HTR-8细胞,常规消化后,按每孔2×104个接种至24孔细胞培养板,弃原培养液,4%多聚甲醛室温下固定15 min,加入50 mmol·L-1EdU试剂37℃孵育2 h,0.5 mL 1×Hoechst 3342染色液染核后,荧光显微镜观察并拍照。其中细胞核为蓝色荧光,EdU阳性细胞核为红色荧光,采用Image J软件分析荧光强度,计算EdU阳性表达率。EdU阳性表达率=EdU阳性细胞数目/总细胞数×100%。实验单独重复3次。以EdU阳性表达率反映细胞增殖情况。
1.9 Transwell小室实验检测各组HTR-8侵袭细胞数取生长状态良好的HTR-8细胞按每孔3×104个接种于预先采用BD基质胶包被的Transwell上室中,下室加入含10%FBS的DMEM培养基。孵育24 h后,取出上室,擦拭未穿出的细胞后,4%多聚甲醛固定20 min,0.5%结晶紫染色。每组随机选取5个视野显微镜观察并拍照,计数各组侵袭细胞数。实验单独重复3次。
1.10 统计学分析采用SPSS 21.0和GraphPad Prism 5.0软件进行统计学分析。2组研究对象一般临床特征、胎盘组织中Apelin和APJ蛋白及mRNA表达水平、AMPK mRNA表达水平、各组HTR-8细胞中IR相关蛋白表达水平、细胞EdU阳性表达率和侵袭细胞数均符合正态分布,以-x±s表示,2组间样本均数比较采用独立样本t检验,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。2组研究对象胎盘组织中Apelin和APJ mRNA表达水平与AMPK mRNA表达水平的相关性采用Pearson相关分析,Apelin和APJ阳性表达率组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组研究对象主要临床特征与NGT组比较,GDM组 孕 产 妇 年 龄 [(31.50±4.16) 和(33.26±2.91)岁]、孕 次[(2.03±1.25)和(2.00±0.77)次]、孕前体质量指数(body mass index,BMI)[(28.20±3.72) 和 (28.18±3.51)kg·m-2]、产 前BMI[(26.92±2.50)和(27.74±3.19)kg·m-2]、收 缩 压[(106.21±18.62)和(111.49±17.16)mmHg]、舒 张 压[(72.17±6.14)和(70.32±8.31)mmHg]、孕周[(38.12±0.78)和(38.02±0.76)周]、胎 盘 质 量[(598.11±24.056)和(587.04±33.17)g]和外周血Apelin水平[(0.42±0.02)和(0.40±0.05)ng·L-1]差异均无统计学意义(P>0.05),OGTT-空腹血糖[(4.22±0.31)和(5.32±0.51)mmol·L-1]、OGTT-1 h血 糖[(8.11±0.72)和(9.65±1.29)mmol·L-1]、OGTT-2 h血 糖[(7.20±0.56)和(8.24±1.66)mmol·L-1]、IR指数(1.03±0.09和3.37±0.11)和HbA1c(5.05%±0.32%和5.51%±0.53%)均明显升高(P<0.01)。
2.2 胎盘组织中Apelin和APJ阳性表达率及蛋白表达水平免疫组织化学法检测结果显示:Apelin和APJ在2组研究对象胎盘组织的滋养层细胞胞质中广泛表达。与NGT组(62.13%和57.19%)比较,GDM组研究对象胎盘组织中Apelin和APJ的阳性表达率(23.41%和16.55%)均明显降低(P<0.05)。Western blotting法检测结果显示:与NGT组比较,GDM组研究对象胎盘组织中Apelin和APJ蛋白表达水平均明显降低(P<0.05)。见图1和2。
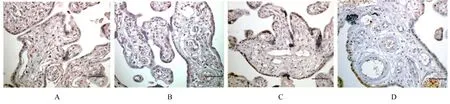
图1 2组研究对象胎盘组织中Apelin和APJ阳性表达情况(免疫组织化学,Bar=100 μm)Fig.1 Positive expression of Apelin and APJ in placenta tissue of subjects in two groups(Immunohistochemistry,Bar=100 μm)
2.3 胎盘组织中Apelin和APJ mRNA表达水平及其与AMPKmRNA表达水平的相关性RT-qPCR检测结果显示:与NGT组比较,GDM组研究对象胎盘组织中Apelin和APJ mRNA表达水平明显降低(P<0.05)。见 图3。与NGT组(4.07±0.843)比较,GDM组研究对象胎盘组织中AMPK mRNA表达水平(1.03±0.222)明显降低(P<0.05)。Pearson相关分析结果显示:胎盘组织中Apelin和APJ mRNA表达水平与AMPK mRNA表达水平均呈正相关关系(R2=0.148,P<0.05;R2=0.275,P<0.05)。见图4。
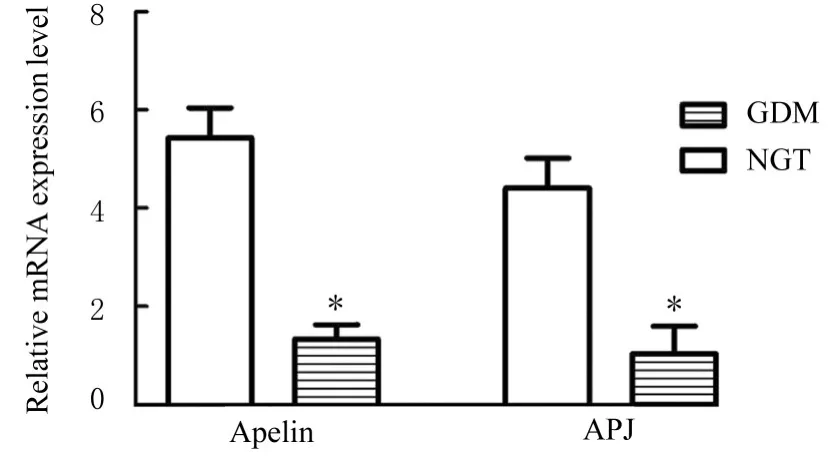
图3 RT-qPCR法检测2组研究对象胎盘组织中Apelin和APJ mRNA表 达 水 平Fig.3 Expression levels of Apelin and APJ mRNA in placenta tissue of subjects in two groups detected by RT-qPCR method
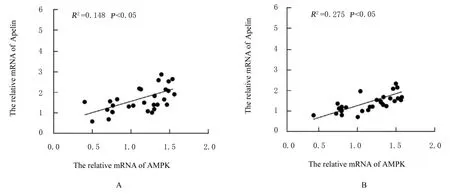
图4 Pearson相关分析法分析GDM患者胎盘组织中Apelin(A)和APJ(B)mRNA表达水平与AMPK mRNA表达水平的相关性Fig.4 Correlations between expression levels of Apelin(A)and APJ(B)mRNA and expression level of AMPK mRNA in placenta tissue of GDM patients analyzed by Pearson correlation analysis method
2.4 各组HTR-8细胞中IR相关蛋白表达水平和磷酸化水平Western blotting法检测结果显示:与对照组比较,Apelin组细胞中Apelin、APJ、IRS1、IRS2和GLUT4蛋 白 表 达 水 平 及p-PI3K/PI3K和p-AMPK/AMPK比 值 明 显 升 高(P<0.05);HG组 细 胞 中Aplein、APJ、IRS1、IRS2和GLUT4蛋白表达水平及p-PI3K/PI3K和p-AMPK/AMPK比值明显降低(P<0.05);HG+Apelin组和HG+Apelin+anti-APJ组 细 胞 中APJ、IRS1、IRS2和GLUT4蛋白表达水平及p-PI3K/PI3K和p-AMPK/AMPK比 值 明 显 降 低(P<0.05),Apelin蛋白表达水平差异无统计学意义(P>0.05)。与HG组 比 较,HG+Apelin组 和HG+Apelin+anti-APJ组细胞中Apelin蛋白表达水平差异无统计学意义(P>0.05),HG+Apelin组细胞中APJ蛋白表达水平明显升高(P<0.05),HG+Apelin+anti-APJ组细胞中APJ蛋白表达水平明显降 低(P<0.05),HG+Apelin组 细 胞 中IRS1、IRS2和GLUT4蛋白表达水平及p-PI3K/PI3K和p-AMPK/AMPK比值明显升高(P<0.05);HG+Apelin+anti-APJ组细胞中上述各指标差异无统计学意义(P>0.05)。见图5。
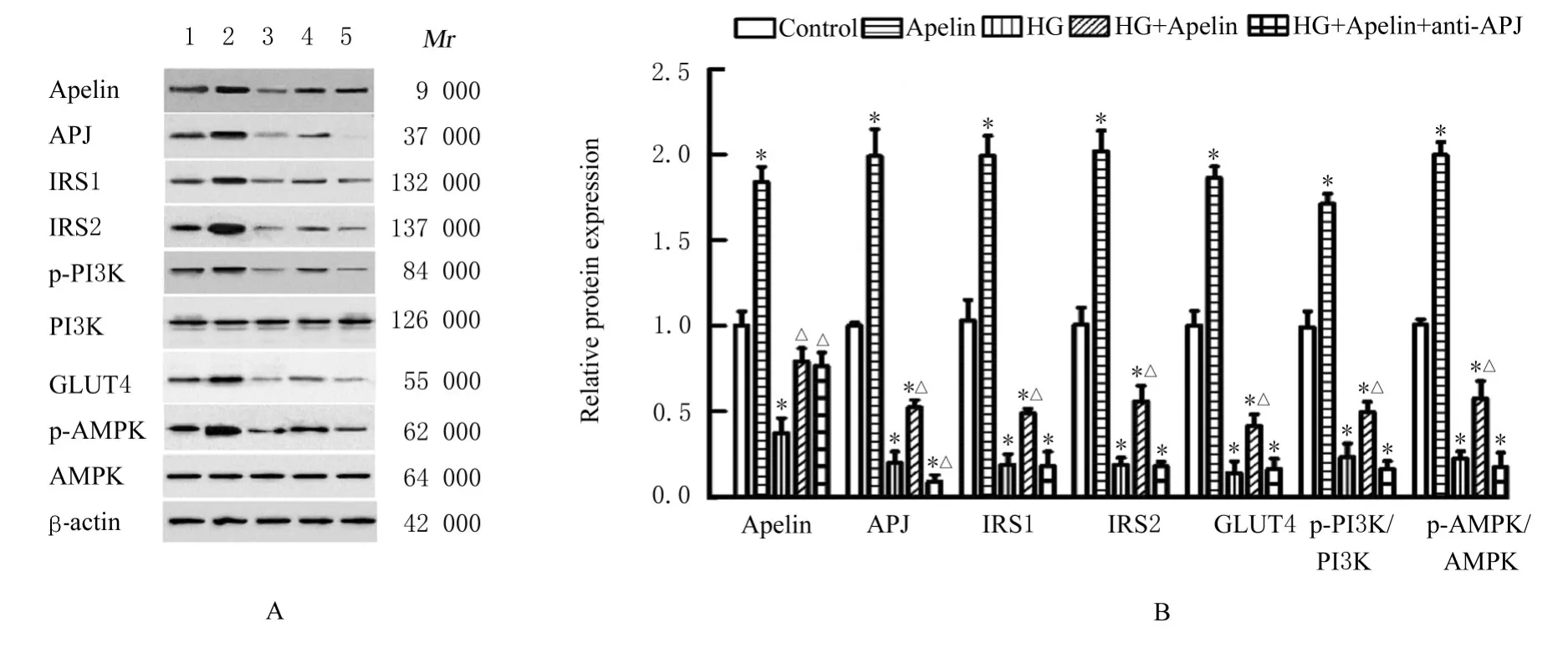
图5 各组HTR-8细胞中IR相关蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A)and histogram(B)of expressions of IR related proteins in HTR-8 cells in various groups
2.5 各组HTR-8细胞EdU阳性表达率与对照组比较,Apelin组细胞EdU阳性表达率明显升高(P<0.05),HG组、HG+Apelin组 和HG+Apelin+anti-APJ组细胞EdU阳性表达率均明显降低(P<0.05);与HG组比较,HG+Apelin组细胞EdU阳性表达率明显升高(P<0.05),HG+Apelin+anti-APJ组细胞EdU阳性表达率差异无统计学意义(P>0.05)。见图6和7。
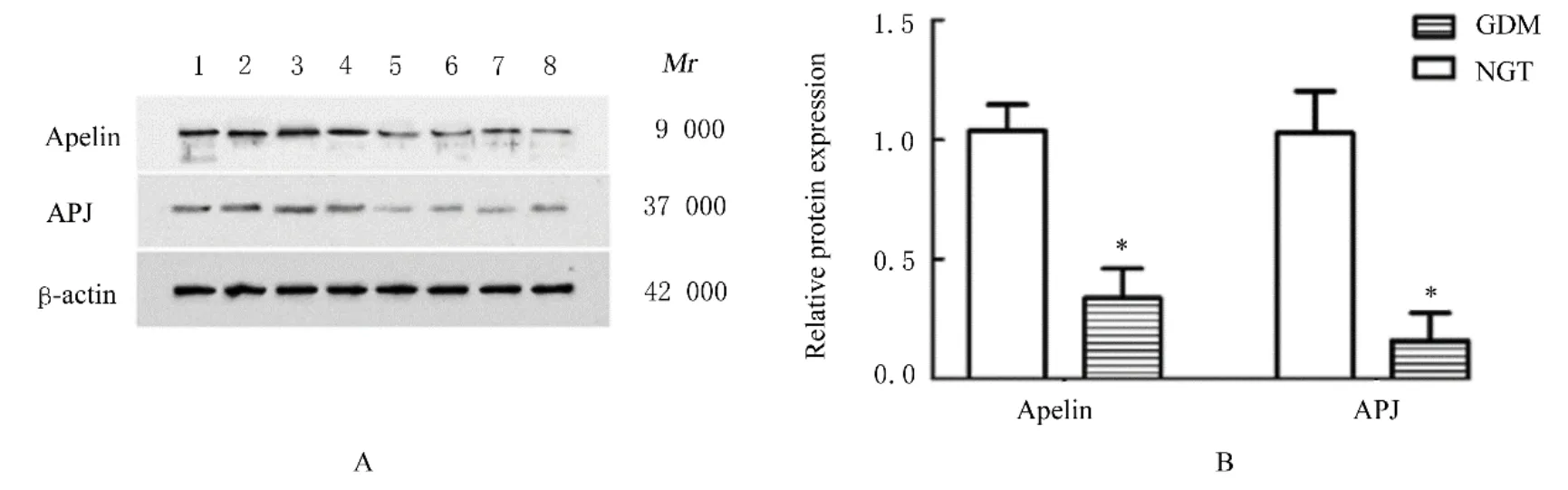
图2 Western blotting法检测2组研究对象胎盘组织中Apelin和APJ蛋白表达电泳图(A)和直条图(B)Fig.2 Electrophoregram(A)and histogram(B)of expressions of Apelin and APJ proteins in placenta tissue of subjects in two groups detected by Western blotting method

图6 各组细胞EdU染色阳性表达情况(Bar=100 μm)Fig.6 Positive expression of EdU staining of cells in various groups(Bar=100 μm)
2.6 各组HTR-8细胞中侵袭细胞数Transwell小室实验结果显示:与对照组比较,Apelin组侵袭细胞数明显升高(P<0.05),HG组、HG+Apelin组和HG+Apelin+anti-APJ组侵袭细胞数均明显降低(P<0.05);与HG组比较,HG+Apelin组HTR-8侵袭细胞数明显升高(P<0.05),HG+Apelin+anti-APJ组侵袭细胞数差异无统计学意义(P>0.05)。见图8和9。

图8 Transwell小室实验检测各组细胞侵袭情况(结晶紫,Bar=50 μm)Fig.8 Invasion of cells in various groups detected by Transwell chamber assay(Crystal violet,Bar=50 μm)
3 讨 论
研究[10]表明:Apelin/APJ系统可能通过调节组织中葡萄糖的代谢而影响包括GDM在内的代谢性疾病,但其具体作用机制尚未完全阐明。本研究结果显示:GDM患者胎盘组织中Apelin及其受体APJ和AMPK均异常低表达;进一步的研究表明:外源性给予Aplein不仅能改善HG环境中HTR-8细胞IR,还能保护HTR-8细胞的增殖和侵袭能力,可能是通过上调AMPK蛋白表达而发挥作用。
研究[16]显示:GDM患者外周血中Apelin水平与健康对照者比较无明显差异,与本研究结果相似,均显示在GDM患者和NGT研究对象外周血中Apelin水平差异无统计学意义,可能与Apelin广泛表达于心脑血管等器官组织和内皮细胞中从而使两者在血液循环中较难存在差异性变化有关。VAUGHAN等[15]发现:Aplein和APJ在胎盘组织中表达,且可能参与调节胎盘血流量和糖脂代谢。本研究结果显示:与NGT组比较,GDM组患者胎盘组织中Aplein和APJ mRNA及蛋白表达水平均明显降低,提示胎盘组织中Aplein和APJ的表达可能是GDM发生的影响因素。细胞中能量代谢的关键分子AMPK,同样在GDM胎盘组织中呈异常低表达,且在T2DM诱导的心肌细胞损伤的研究[17]中显示:Apelin能够通过AMPK途径改善HG诱导的心脏缝隙连接蛋白43水平的降低。在多囊卵巢中也发现Aplein可通过激活AMPK与PI3K/蛋白激酶B(protein kinase B,Akt)信号通路,增加胰岛素样生长因子1诱导的颗粒细胞中类固醇的生成[18]。因此,AMPK途径可能作为细胞中Aplein发挥糖脂代谢的下游通路。本研究中Pearson相关分析结果显示:在GDM胎盘组织中Apelin及其受体APJ mRNA表达水平与AMPK mRNA表达水平呈正相关关系,进一步证实两者在异常的糖代谢中可能存在相互作用。

图7 各组HTR-8细胞EdU阳性表达率Fig.7 Positive expression rates of HTR-8 cells in various groups
在胰岛素信号传递系统中,IRS1/2是作为起始步骤,激活下游PI3K/Akt途径和以GLUT4为主的葡萄糖转运体的易位,最终促进葡萄糖的吸收和利用[19]。而上述蛋白被广泛认为是胰岛素介导葡萄糖利用的重要调控因子,常被用来衡量组织或器官的胰岛素敏感性水平[20]。同时,AMPK的活化也能促进GLUT4的膜易位[21]。本研究结果显示:外源性给予Aplein能明显促进HG环境下HTR-8细胞中胰岛素信号分子IRS1/2及GLUT4的表达和PI3K的磷酸化水平,但阻滞APJ受体表达后,Aplein对上述蛋白的促进作用被抑制,提示在HTR-8细胞中Apelin的促胰岛素敏感作用需通过与其受体APJ结合,而该作用可能与Aplein和APJ可上调AMPK的磷酸化水平有关。
滋养层细胞作为胎盘组织的重要组成细胞,其正常生物学功能的维持对胎盘形成和发育至关重要,而滋养层细胞的增殖和侵袭能力是胎盘发挥正常作用所必备[3]。妊娠期间,母体或母胎界面分泌多种细胞因子或蛋白以促进滋养层细胞的增殖、分化和侵袭,但在GDM中,HG环境能明显影响滋养层细胞的增殖、分化和侵袭功能。彭海燕等[22]发现:HG环境可能通过下调滋养层细胞中的腺苷单磷酸活化蛋白激酶α1亚基的表达抑制其增殖活性;TAO等[23]认为:HG能通过下调胎盘生长因子的表达,降低其对滋养层细胞中活性氧的调控作用,从而增强HG环境对细胞增殖和侵袭能力的抑制作用。本研究结果显示:HG能明显抑制滋养层细胞的增殖和侵袭功能,但Apelin能通过与APJ受体相互结合改善此现象。
综上所述,Apelin及其受体APJ在GDM患者胎盘组织中的表达明显降低,而外源性给予Apelin可通过上调AMPK信号通路的表达改善滋养层细胞的IR,并促进HG环境下滋养层细胞的增殖和侵袭能力。Apelin和APJ有望作为改善GDM患者胎盘组织IR和糖代谢的候选靶点,为改善GDM患者的预后提供新的策略和研究方向。

图9 各组HTR-8细胞中侵袭细胞数Fig.9 Number of invasion cells of HTR-8 cells in various groups

