代谢相关脂肪性肝病与病毒感染疾病相关性研究进展
池肇春
池肇春,青岛市市立医院消化内科 山东省青岛市 266011
0 引言
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)是与肥胖、胰岛素对抗(insulin resistance,IR)和代谢综合征紧密相关的一种代谢疾病,虽然MAFLD被认为是代谢综合征的肝脏表现,但有多种因素可以加速疾病的进展.这些危险因素包括饮食、生活方式、遗传特性、药物摄入、男性性别和特殊感染等.
代谢相关脂肪性肝炎(metabolic associated steatohe-patitis,MASH)患者经常表现出肠道功能失调和肠屏障通透性增加.这可能导致致病原相关分子模式(pathogen associated molecular patterns,PAMPs)易位,其中最重要的是脂多糖(Lipopolysaccharides,LPS).值得注意的是,几种传染病如新型冠状病毒(corona virus disease 2019,COVID-19)、肝炎病毒感染也可直接或间接导致肝脏脂质积聚和炎症从而加重MAFLD,并相互作用加重肝脏疾病.据报道最多见的感染因素是幽门螺杆菌、丙型肝炎病毒(hepatitis C virus,HCV)、冠状病毒和人体免疫缺陷病毒(human immunodeficiency virus,HIV).本文就MAFLD与病毒感染疾病的相关性研究进行评述.
1 冠状病毒与代谢相关脂肪性肝病
与新冠肺炎相关的肝损害,其患病率从14%-50%以上.在多系列病人的研究中,检测到的主要生化改变为20%患者呈现氨基转移酶增高,氨基转移酶的升高通常是为期短暂的.其次是10%的病例出现胆红素略有增加.另一方面,胆汁淤积的其他指标,如γ-谷氨酰基转移酶(γ-glutamyl transferase,γ-GT)和碱性磷酸酶(alkaline phosphatase,ALP)的升高相对较少.在严重新冠肺炎患者中,低白蛋白血症通常是一种比较常见的发现;然而,它并没有伴随着其他显示肝衰竭的数据发生.迄今为止,尚无报告COVID-19感染继发严重急性肝损害的病例报告.
在临床上与COVID-19感染和肝损害有关的主要因素是肺受累导致缺氧、静脉充血伴肝脂肪变性、免疫细胞作用、药物性肝损害、合并凝血障碍和细胞因子风暴.MAFLD本身可能是由于持续的脂肪毒性、慢性炎症状态、代谢综合征、氧化应激反应和免疫反应所致,也可能是其他同时存在的代谢紊乱,这些代谢紊乱将加重新冠肺炎的临床进程.患者也可能会因持续感染新冠肺炎造成的损害而加重先前的肝病.
1.1 COVID-19引起MAFLD肝损伤的发病机制 新冠肺炎患者肝损害的机制复杂,其中病毒或免疫系统对肝细胞的作用及药物的肝毒性作用尤为突出.包括几种损伤机制: (1)一旦COVID-19在肠道内发生可直接引起细胞损伤,同时病毒还可通过门静脉流向肝脏,并通过血管紧张素转化酶2受体(angiotensin converting enzyme 2 receptor,ACE2 receptor)在肝细胞内复制病毒而直接引起肝损害,而库普弗细胞试图对抗这种损伤也会引发局部炎症而导致肝脏损伤;(2)慢性肝病伴新冠肺炎患者肝细胞缺氧可能导致ACE2受体和缺氧诱导因子(hypoxia inducible factors,HIFs)表达增加,HIFs是由缺氧激活的转录因子家族.这种改变可能进一步加重代谢疾病,如加重MAFLD的进展;(3)系统和肝脏的先天免疫失调.肠细胞中的ACE2受体易发生病毒易位到肝脏,具有通过网状系统进行病毒循环的潜能.由于细胞因子的产生而引起炎症,它激活先天免疫细胞,致使严重新冠肺炎感染患者的炎症标志物升高;⑷肝脏的脂类生成和分解可驱动天然免疫激活,可直接触发和放大肝脏炎症.
最近的研究表明,COVID-19病毒可能与位于肝细胞上的ACE2受体结合,尤其是在胆管细胞中,后者的表达更为丰富.健康肝脏可检测到低水平的ACE2 mRNA,而肝硬化时ACE2 mRNA水平上调34倍,ACE2蛋白水平升高97倍.在与受体结合并进入细胞后,产生新的病毒RNA并合成组装和释放新病毒颗粒所需的结构蛋白.相反,ACE2受体在肝细胞中的表达很少,这可以解释缺乏出现典型的病毒性肝炎的分析数据和组织学特征.
在肾素-血管紧张素系统(renin-angiotensin system,RAS)中,AngⅡ与其受体[AngⅡ1型受体(AT1R)]相连,而Ang(1-7)与巨噬细胞活化综合征1(macrophage activation syndrome 1,MAS1)癌基因结合,导致血管舒张,减少炎症、细胞增殖、肥大和纤维化.AngⅡ可激活肝细胞核苷酸结合寡聚化结构域样受体家族,含3个嘧啶结构域(NOD-like receptor family,pyrin domain containing 3,NLRP3)炎性小体,诱导caspase-1依赖的细胞凋亡,促进-1β和白细胞介素-18的大量释放,从而支持肝脏炎症、三酰甘油沉积和胰岛素对抗的过程,触发MAFLD的进展和加重肝损害.
在一些严重的情况下,过度觉醒已经发生了亲炎症的免疫系统,其后果可能比病毒本身的细胞病变更具致命性.然而,在新冠肺炎的背景下,这种免疫功能失调在肝脏上的后果还不清楚.
严重新冠肺炎患者常出现肝脏实验室参数改变.感染COVID-19的患者通常也会出现肝脏脂肪变性,而MAFLD将会加重新冠肺炎.COVID-19可诱导PAMP从肠道转移到肝脏,启动Kupffer细胞和星状细胞活化,从而促进急性炎症反应.此外,在细胞因子风暴期间,肝脏可能会受到细胞因子的破坏或继发性打击.直到今天,胆管细胞是唯一已知的表达病毒进入受体ACE2的细胞,目前认为,新冠肺炎期间MAFLD进展的可能原因之一是与ACE2在小肠肠细胞上的高表达有关.这可能会导致肠通透性增加和病原体相关分子模式(pathogen associated molecular patterns,PAMPs)转运到肝脏.因此,肝细胞因子风暴是对COVID-19和MERS-CoV感染的全身炎症反应,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素2(interleukin-2,IL-2)、白细胞介素6(interleukin-6,IL-6)、干扰素(interferon,IFN)-α、IFN-β、IFN-γ和趋化因子配体(chemokine ligand,CCL)2的释放,加剧了肝脏炎症,并促进MAFLD的进展.
在小鼠模型中研究指出,肝脏脂肪变性通过核因子κB蛋白(nuclear factor kappa-B,NF-κB)活化和下游细胞因子生成引起炎症.MAFLD和MASH患者血清IL-6和C反应蛋白(C-reactive protein,CRP)水平均明显高于健康对照组.此外,在MAFLD和MASH患者中,调节单核细胞/巨噬细胞迁移和浸润的趋化因子配体2/单核细胞趋化蛋白-1(chemokine ligand 2/monocyte chemoattractant protein-1,CCL2/MCP-1)也被发现增加.研究表明,MAFLD的特点是全身炎症程度较低,且与健康人相比,晚期肝纤维化患者的全身循环功能障碍指标明显增高,促炎细胞因子如TNF-α、IL-6、IL-8、MCP-1、干扰素-γ诱导蛋白10(interferon gamma induced protein 10,IP-10)、巨噬细胞炎性蛋白(macrophage inflammatory protein,MIP)-1b水平明显增高.另一方面,在新冠肺炎患者中,出现高度炎症,被描述为高细胞分裂症或“细胞因子风暴”,免疫亢进,甚至在某些情况下,已被报道出现继发性淋巴组织细胞增生症.据报道,新冠肺炎患者的细胞因子之一是IL-1B,它是下游的最终效应,这是已知的肝细胞死亡机制.除IL-1B外,其他细胞因子在新冠肺炎中也有增加,包括IL-6、IP-10、TNF、IFN-γ、血管内皮生长因子、巨噬细胞炎性蛋白(macrophage macrophage inflammatory protein,MIP)-1α和1β.患有新冠肺炎的肥胖患者比非肥胖的COVID-19患者表现出更明显的炎症特征.地塞米松对严重新冠肺炎患者因为它能够抑制细胞因子的产生及其有害作用,因此可降低病死率.对于包括肝纤维化患者和新冠肺炎患者在内的MAFLD患者而言,对“急性慢性炎症”过程的可能影响,包括对地塞米松等皮质激素产生不同的抗炎反应的可能性值得进一步研究.
新冠肺炎与代谢疾病(如MAFLD)的另一个汇合点是内皮功能障碍.肝脂肪变性患者的内皮功能障碍已被描述.健康人比活检证实的MAFLD患者具有更好的内皮功能,这在一定程度上解释了该人群心血管疾病风险增加的原因.内皮功能障碍引起血栓前状态导致新冠肺炎患者的血管闭塞和微血栓形成.此外,内皮功能障碍可导致一氧化氮不足并导致血管收缩,是致使患者血栓发生率增高的原因.最后,参与肝纤维化的一些途径是决定MAFLD患者预后的关键事件,在新冠肺炎患者中可能起着重要的作用.其中重要作用的是RASS参与了肝纤维化的发展,血管紧张素Ⅱ在星状细胞中诱导成纤维前表型,在肝硬化的病理生理过程中起着重要的作用,提示COVID-19可促进肝纤维化影响肝病预后 .
1.2 MAFLD可能促进细胞因子风暴综合征 观察研究表明,MAFLD合并COVID-19感染时血液中有较高水平的炎症标记物(C-反应蛋白、铁蛋白和D-二聚体)、中性粒细胞/淋巴细胞比率的增加以及炎症细胞因子和趋化因子的增加,这些与疾病严重程度和预后不良有关.
先天免疫反应失调可能是新冠肺炎肝损伤的一个方面,致使患者血清CRP、淋巴细胞、中性粒细胞和细胞因子水平异常等炎症标志物的激活.暴发性和致命性高细胞分裂素血症可导致包括肝脏在内的组织和多器官损伤或衰竭.炎症反应可引起肝肿大、血清转氨酶升高、黄疸和肝性脑病.
先天免疫细胞丰富的肝脏,适应性反应的功能状态可能影响COVID-19感染的临床严重程度.脂肪肝的存在由于功能状态降低可能影响免疫适应性反应.此外,MASH的存在与细胞因子、氧化应激、线粒体功能障碍、内质网应激和NOD样受体家族pyrin域3(NOD like receptor family pyrin domain containing 3,NLRP 3)炎症小体激活有关.因此,新冠肺炎患者的MASH可以促进病毒诱导的细胞因子风暴综合征(cytokine storm syndrome,Css)发生.通过肝脏释放多种炎症介质,导致发生严重的新冠肺炎.肝脏中含巨噬细胞数量最多,是一种强大的细胞因子产生者.肝巨噬细胞由不同的细胞群组成,包括以吞噬细胞为主的常住巨噬细胞(kupffer cells,KCs)和骨髓来源的单核细胞.巨噬细胞在肝脏疾病的发生发展中起着重要的作用.促炎巨噬细胞促进MAFLD的进展,并决定疾病的严重程度.极化过程将肝巨噬细胞分化为亚表型,由细胞因子、生长因子、脂肪酸、前列腺素和病原体分子组成微环境的信号.巨噬细胞亚表型根据对不同的炎症信号的反应可分为M1和M2两类.巨噬细胞被Toll样受体(toll-like receptors,TLR)配体和辅助性T淋巴细胞1(helper T lymphocyte 1,Th1)免疫因子激活和刺激,介导宿主以防御细菌、病毒或原生动物等病原体.因此,M1巨噬细胞通过高水平的促炎细胞因子的表达来启动炎症过程,并产生大量的活性氧和氮物种.M2巨噬细胞具有抗炎作用,促进组织修复和重塑,但与M1巨噬细胞相比具有吞噬活性和表达不同的趋化因子谱.
同样,在肝损伤的不同阶段,常驻杀伤细胞(killer cells,KCs)和募集的单核巨噬细胞在炎症、纤维化和纤维溶解过程中都有重要的调节作用.认为MAFLD患者肝巨噬细胞的极化状态可被M1型巨噬细胞扭曲,从而促进炎症抑制M2型巨噬细胞,最后导致新冠肺炎发生.
研究认为,肠道微生物失调是肝巨噬细胞产生促炎细胞因子的一种强有力的激活剂.肠道微生物失调是微生物群的一种扰动,它促进微生物和微生物产物进入门静脉循环(代谢性内毒素血症).肠道微生物群在MAFLD的进展中起着关键作用,导致MASH和肝纤维化发生.这表明来自不同器官的分子介质,特别是脂肪组织和肠道,参与了触发炎症途径的过程,炎症途径可能随后发展为纤维化,最终发展为肝硬化和癌变.小肠中ACE 2高表达,新冠肺炎患者粪便中存在较高的病毒载量,提示ACE在病毒感染和炎症中起着重要作用.它与新冠肺炎患者中常见的胃肠道症状与肝损伤标志物有关,表明肝脏病原体相关分子模式增加,这可能是Css扩增的一个原因.肠道微生物群影响肺部疾病的作用已得到充分讨论,肠道微生物群可能对冠状病毒疾病的感染具有保护作用,这可能解释了为什么一些新冠肺炎患者是无症状的.新冠肺炎患者消化道症状的严重程度随着呼吸道症状和肝脏损害的加重而加重,目前尚不清楚这是否会导致高水平的细胞死亡或增加肠道屏障的通透性.然而,肠道症状与肝损害标志物相关,这支持了病原体相关分子模式(PAMP向肝脏传播的理论.这一过程可以通过“触发”免疫系统的过度活动来增加新冠肺炎的严重性.MAFLD患者的危险性增加可能是由于肠道感染COVID-19,导致严重新冠肺炎的全身免疫功能障碍有关,这一过程也可能是肥胖、2型糖尿病(type2 diabetes mellitus,T2DM)甚至IBD发病风险增加的原因之一,此与肠道微生物群、肠道炎症和屏障完整性紊乱有关.由于代谢性疾病,肠-肝轴改变可能导致严重的新冠肺炎进展.
研究发现MAFLD增加了严重新冠肺炎的风险,这与以前的研究是一致的.MAFLD患者过多的游离脂肪酸进入肝脏,然后启动Kupffer细胞.由于MAFLD患者肝脏先天免疫紊乱,Kupffer细胞的极化状态由抗炎M2向促炎M1转变,从而增加TNF-α、IL-6其他细胞因子的产生.研究表明白细胞介素-6参与了细胞因子“风暴”,这种“风暴”可能是新冠肺炎病恶化的主要原因.因此,推测这可能是MAFLD加重新冠肺炎的机制之一.
1.3 MAFLD对新冠肺炎患者预后的影响 代谢疾病是影响新冠肺炎严重程度的危险因素,COVID-19合并代谢性疾病(即肥胖和糖尿病)患者的死亡率明显高于对照组.
在几份报告中,已经观察到有脂肪肝的新冠肺炎患者与无脂肪肝的患者相比,患严重急性脂肪肝的风险增加了4倍.MAFLD患者发生肝生化异常的可能性较高,呼吸疾病进展的风险也较高,住院期间肝损伤较多,病毒消失时间较长.目前认为代谢相关脂肪性肝病的存在可能是出现新冠肺炎症状、严重和进展性的危险因素.
Sachdeva等人的一项综合分析显示,即使在对肥胖进行调整后,MAFLD与严重新冠肺炎的风险也会增加.在MAFLD患者中,新冠肺炎的进展似乎与年龄有关.一项多中心的初步分析报告,60岁以下的MAFLD患者与无MAFLD的患者相比,严重型MAFLD的新冠肺炎的患病率高出2倍以上,而在多变量分析中,老年MAFLD患者与疾病的严重程度无关,值得进一步研究.
MAFLD肝纤维化的存在,会增加新冠肺炎恶化的风险(机械通气、急性肾损伤和高死亡率).纤维化4记分(fibrosis 4 score,FIB-4)或代谢相关脂肪性肝病纤维化记分(MAFLD fibrosis score,MFS)增高的MAFLD患者更有可能患有严重的新冠肺炎.因此,MAFLD患者可能容易发生COVID-19感染及其并发症.目前对MAFLD和新冠肺炎之间的联系还不完全清楚,特别是因为在大多数情况下,缺乏有关感染前肝脏疾病病史的信息.有待进一步的研究.到目前为止,需要更多的研究来了解MAFLD的遗传倾向对新冠肺炎的易感性和严重程度的影响,特别是住院风险和死亡率,其中还包括与肥胖、血脂异常和T2DM的关系.
2 乙型肝炎与代谢相关脂肪性肝病
根据MAFLD的定义,乙肝病毒(hepatitis B virus,HBV)与MAFLD(HBV-MAFLD)的结合将成为MAFLD的一个重要亚型.研究结果表明,HBV-MAFLD患者的代谢特征与单纯MAFLD相似,可能由于HBV感染的存在致使MAFLD的脂肪变性程度较低有关,但MAFLD的炎症和纤维化程度较高.
HBV-MAFLD是亚洲国家MAFLD的一种特殊亚型.研究发现,HBV感染前后MAFLD患者的代谢成分无明显差异.肝脂肪变性与HBV感染的关系尚不清楚.表明,乙肝病毒X蛋白通过激活过氧化物酶体增殖物激活受体γ、甾醇调节元件结合蛋白1和肝脂肪酸结合蛋白1诱导肝脏脂肪沉积,提示乙肝病毒本身可能导致肝脏脂肪变性.几项大规模的样本研究显示,HBsAg与未来MAFLD的风险呈负相关.结果表明,伴随HBV感染导致的脂肪变性程度较低.提示MAFLD的新定义对HBV感染与脂肪肝的相关性影响不大,即HBV感染与MAFLD脂肪变性程度较低有关.但HBV感染单独增加了炎症和纤维化的风险.乙肝病毒感染使晚期纤维化的几率增加至少3倍,炎症增加4倍.这一结果提示HBV感染是MAFLD纤维化的独立危险因素.因此,对于MAFLD合并HBV感染的患者,需要对这两种肝病进行更密切的监测和干预,因为两种致病风险的存在可能会加速疾病的进展.
随着MAFLD在HBV感染最常见的地区的流行率迅速上升,大量人群有可能出现2种伴随性肝病,这可能会对HCC、肝硬化和死亡的风险产生协同效应.因此,严重肝脂肪变性与慢性乙型肝炎患者导致更严重的肝纤维化和更高的肝癌风险有关.
在一大型多种族多中心队列研究中发现,在MAFLD患者中,伴发的脂肪性肝炎并没有增加不良结果的风险.最近的各种研究表明,肥胖大流行已在西方世界以外蔓延到乙型肝炎流行地区,导致慢性乙型肝炎患者脂肪肝疾病的发病率增加.慢性乙型肝炎患者合并脂肪变性的临床相关性一直存在争议,因为包括Meta分析在内的几项研究无法确定脂肪变性是不良反应的危险因素.造成这些矛盾结果的原因之一可能是与HBV感染的脂肪效应有关.研究发现,乙型肝炎和脂肪变性患者的HBsAg清除率也可能增加3倍.这种复杂的相互作用可能导致低估HBV的脂肪形成效应,从而使对慢性乙型肝炎患者脂肪肝疾病的临床相关性研究复杂化.
另一个观察发现有14%的脂肪肝患者不符合MAFLD标准.这可能反映出乙肝相关脂肪变性或所谓的瘦型脂肪肝病.与无脂肪肝的慢性乙型肝炎患者相比,这些患者的不良结果风险没有增加.这些发现进一步证明代谢功能障碍的重要性,而不是脂肪肝本身具有不良结果.
鉴于代谢健康在慢性乙型肝炎患者中的重要性,建议对疾病管理采取多学科方法.这包括检查和治疗代谢性共病和提供生活方式干预方案.此外,为了防止因慢性乙型肝炎而导致的疾病进展,早期抗病毒治疗在这一人群中的作用值得商榷.MAFLD的回归、代谢健康的改善或早期治疗对慢性乙型肝炎患者肝脏相关的结果是否有利,尚有待确定.
总之,研究表明,MAFLD与CHB患者的肝受损、肝细胞癌有着独立的联系.在MAFLD患者中,伴发的脂肪性肝炎不影响不良结局的风险.这些发现为新的MAFLD标准在CHB中的临床应用提供了第一证据,并强调了代谢健康在这些患者中的重要性.
3 丙型肝炎
丙肝病毒进入肝细胞是由清道夫受体B 类Ⅰ型(secavenger receptor class B type 1,SR-BI)、分化簇(cluster of differentiation,CD)81和连接蛋白1(claudin 1,CLDN 1)介导的.在人类和黑猩猩中CD81的细胞外大环区高度保守,这可能与HCV感染具有种属特异性的特性有关.HCV还被证明与其核衣壳核心结合在二酰甘油酰基转移酶-1(diacylglycerol acyltransferase-1,DGAT1)上,进一步强调了HCV感染与肝细胞脂质代谢之间的密切联系.
全世界约有2.5%的人口感染丙型肝炎病毒.这些病例中有70%伴有肝脏脂肪变性,约20%患有肝硬化.同时存在的慢丙肝(chronic hepatitis C,CHC)和MAFLD被证明会导致疾病进展或阻止有效的治疗.与无CHC的高危患者相比,患有CHC的患者患2型糖尿病的风险高11倍.此外,患有CHC似乎也增加了在没有易感因素的患者中患2型糖尿病的风险.慢性HCV感染期间的肝脂肪变性可促进坏死、炎症和纤维化.此外,“HCV相关代谢异常综合征”的存在被认为是型肝炎患者存在代谢综合征特征的一个可能的分子基础.
3.1 HCV相关性脂肪变性的分子机制 各种研究表明,肝脏中过多的脂质是维持HCV生命周期的关键.根据一些证据,HCV可能直接导致肝细胞脂质积聚.有几种机制与HCV相关脂肪变性的发展有关(图1).
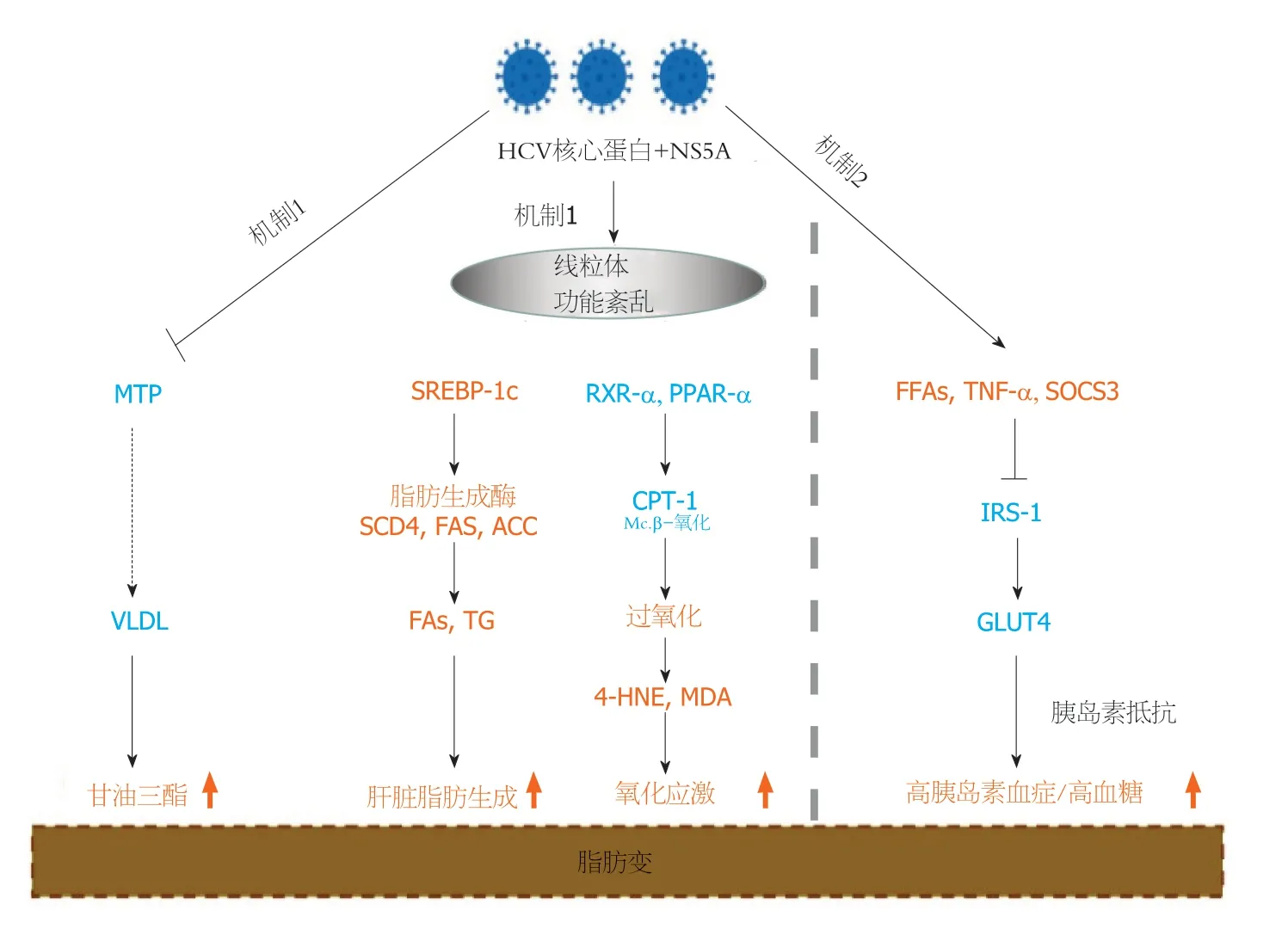
图1 丙型肝炎病毒对肝脏脂肪变性的影响.橘色和蓝色分别表示上调和下调.HCV: 丙型肝炎病毒;MTP: 微粒体三酰甘油转运蛋白;VLDL:极低密度脂蛋白;SREBP-1c: 甾醇调节元件结合蛋白1c;SCD4: 甾醇辅酶4;FAS: 脂肪酸合成酶;ACC: 乙酰辅酶A羧化酶;PPAR-α: 过氧化物酶体增殖物激活受体α;CPT-1: 肉碱棕榈酸转移酶-1;4-HNE: 4-羟基壬烯醛;MDA: 丙二醛;FFA: 游离脂肪酸;TNFα: 肿瘤坏死因子α;SOCS3: 细胞因子信号转导抑制因子3;IRS-1: 胰岛素受体;Mc.β-oxidation: 线粒体β-氧化;GLUT-4: 葡萄糖转运体4型;;NS5A: HCV非结构蛋白5A;RXR-α: 维甲酸核内受体α.Citation: Siphepho PY,Liu YT,Shabangu CS,Huang JF,Huang CF,Yeh ML,Yu ML,Wang SC.The Impact of Steatosis on Chronic Hepatitis C Progression and Response to Antiviral Treatments.Biomedicines 2021;17;9: 1491.
3.1.1 HCV病毒蛋白直接参与肝细胞内三酰甘油的积累: G-3型丙肝患者脂肪变性较多见,强调HCV核心蛋白和非结构蛋白5A(nonstructural protein5A,NS5A)在干预脂质代谢中的作用.这些蛋白质抑制微粒体三酰甘油转移蛋白(triacylglycerol transfer protein,MTP),MTP是一种负责极低密度脂蛋白(very low-density lipoprotein,VLDL)组装的酶,从而导致肝细胞中三酰甘油的积累,结果导致脂肪变.线粒体功能障碍还可能通过激活甾醇调节元件结合蛋白(sterol sterol regulatory element binding protein,SREBP 1c)信号通路或抑制维甲酸X受体α(retinoic acid X receptor α,RXR-α)和过氧化物酶体增殖物激活受体α(peroxisome peroxisome proliferator activated receptor α,PPAR-α),作为脂肪酸β-氧化的关键调节因子,与HCV患者的脂肪变性有关.HCV核心蛋白上调SREBP-1c,从而激活甾醇辅酶A脱氢酶4(sterol sterol CoA dehydrogenase 4,SCD4)、乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)和脂肪酸合成酶(fatty fatty acid synthase,FAS),从而促进肝脏中脂肪酸的产生和三酰甘油的积累.该蛋白进一步抑制RXR-α和过氧化物酶体增殖物激活受体α(peroxisome proliferation activated receptor-α,PPAR-α),它们是调控线粒体肉碱棕榈酰基转移酶1(carnitine carnitine palmitoyl transferase 1,CPT-1)的转录因子,CPT-1是一种催化脂肪酸进入线粒体进行β氧化的酶.因此,由于CPT-1被下调,导致线粒体功能障碍和脂质氧化激活过氧化物酶体和雌激素受体(estrogen receptor,ER).结果产生的过氧化产物4-羟基壬烯醛(4-hydroxynonenal,4-HNE)和丙二醛(malondialdehyde,MDA),加重了氧化应激,导致脂肪变性发生.
3.1.2 肝脏脂肪变性与胰岛素对抗的密切联系: 在肝脏胰岛素抵抗中,肝脏葡萄糖的清除受到损害,后来由于胰腺分泌胰岛素的增加而得到补偿;然而,这不仅导致高胰岛素血症,而且导致过度刺激脂肪生成,最终导致脂肪变性.IR可能是由于过量的游离脂肪酸(free fatty acids,FFAs)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)或细胞因子信号抑制因子3(Cytokine signal inhibitor 3,SOCS 3)导致胰岛素受体底物信号通路1(insulin receptor substract-1,IRS-1)的下调所致.其中丙型肝炎病毒核心蛋白再次涉及到促进FFA吸收.这会抑制葡萄糖转运体4型(glucose transporter type 4,GLUT-4)摄取葡萄糖,从而增加血糖和胰岛素水平,导致脂肪变.虽然在HCV患者中这一确切的机制仍不清楚,但已经提出的一些观点表明,HCV核心与NS5A蛋白之间存在着相互作用,以及参与调节脂质代谢的其他因素,其详细机制有待进一步证实.
3.2 HCV基因型特异性脂肪发生的分子机制 脂肪变性对CHC进展的影响似乎是基因型特异性的,脂肪变性主要与宿主因素(肥胖、糖尿病、高血压和代谢综合征)(G-1/2)和病毒蛋白(G-3)感染有关.考虑到HCV脂肪变性与MAFLD模式的相似性,HCV相关脂肪发生可能通过以下步骤发生: 脂肪底物增加,新生脂肪生成增加,脂肪底物氧化减少,肝脂肪底物向血流输出减少.此外,这些类似MAFLD的脂肪形成机制也适用于所有HCV基因型,其中G-3 CHC似乎通过MTP、PPAR-α、SREBP-1c及磷酸和张力素同源物(磷酸酶-张力蛋白基因,(phosphatase and tensin homologue gene,PTEN)的显著变化,扩增了与MAFLD相关的脂肪性分子机制所致.与G-1/2相反,G-3CHC患者MTP和PPAR-α活性明显降低,并分别下调了脂质生成和β-氧化的输出.另外,G-3 CHC通过PTEN失活而比G1更有效地激活SREBP-1c,从而导致新的脂肪生成.这些G-3CHC放大的脂肪形成机制可能是由于该基因型核心蛋白氨基酸序列的特殊差异所致.另一方面,HCV相关脂肪变性“代谢型”的致病机制仍不明确.然而,最近的研究表明胰岛素对抗、肥胖和脂肪细胞因子的失调可能是其中的因素.
此外,氧化损伤对CHC的组织学和代谢特征的影响在非G-3中更为明显,CHC感染的患者在这组中经历了更严重的脂肪变性.因此,胰岛素对抗和氧化应激被认为是这组脂肪变性的独立危险因素.此外,一项研究中的基因表达分析揭示了G-1与G-3肝脏相比,如何诱导某些脂肪性途径增加脂肪酸降解和降低胆固醇输出.
事实上,在87%的G-3和56%的G1型HCV患者中,发现脂代谢调节因子碳水化合物反应元件结合蛋白(carbohydrate carbohydrate response element binding protein,ChREBP)在G1感染的肝脏中显著表达,碳水化合物反应元件结合蛋白在脂类稳态中的确切作用仍存在争议,该蛋白的过度表达维持了胰岛素信号的敏感性,并诱导了脂肪酸调节的乙酰辅酶A羧化酶的表达,同时,敲除该基因可改善肥胖小鼠的肝脏脂肪变性和胰岛素对抗.
3.3 HCV相关性脂肪变性与肝外表现 HCV与多种肝外疾病有关,包括代谢紊乱,如代谢综合征、动脉粥样硬化、糖尿病和胰岛素对抗.CHC通常与脂肪变性相关,这反过来又与代谢综合征有关,代谢综合征是一种宿主相关因子,可显著加速CHC肝纤维化的进展.代谢综合征影响发达国家约33%的人口,其中33%的代谢综合征患者出现MASH.胰岛素对抗被认为是MAFLD/MASH和代谢综合征之间的关键致病因素,显然,由此可见CHC与代谢综合征,MAFLD和代谢综合征以及MAFLD和CHC之间的联系已经建立起来.
如上所述考虑到代谢综合征是心血管疾病(cardiovascular disease,CVD)和T2DM的一个既定危险因素,MAFLD和CHC与CVD和T2D的发病率增加有关.脂肪堆积和肝纤维化可能是MAFLD、HCV或HIV患者发生T2DM和CVD的常见决定因素.
MAFLD患者的类似并发症已被进一步研究证实.Mets分析显示合并MAFLD患者的高CVD风险可能是由FFAs共同引起的纤维化分期、脂肪变性程度或氧化应激的增加所致.HCV感染同样被认为是T2DM和CVD相关并发症的潜在危险因素.丙型肝炎病毒核心蛋白上调TNF-α和细胞因子信号转导抑制因子3,分别引起胰岛素对抗受体-1/胰岛素对抗受体-2(IRS-1/IRS-2)的磷酸化和泛素化,阻止其与胰岛素受体的结合,进一步阻断其激活.胰岛素对抗时通过蛋白激酶B(protein kinase B,PKB)调节多种代谢功能作用,包括脂解、蛋白质和糖原合成、糖异生和葡萄糖转运体-4.最后,胰岛素对可能通过激活胞内丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(参与心脏和血管疾病的发病机制)而导致T2DM患者引起高血糖和CVD.
3.4 抗病毒治疗对HCV相关脂肪变性、肝外表现的影响 针对病毒复制机制的无干扰素的二丙酮醇直接抗病毒药(direct-acting/antiviral/agents,DAA)已经取代了丙型肝炎治疗中基于IFN的治疗,成功地治愈了大量的患者,包括那些高风险的肝癌患者或相关疾病,如肾功能不全、冠心病和代谢综合征.虽然DAAs显著提高了HCV感染患者的治疗效果,但在此治疗后肝脂肪变性对持续病毒应答率(sustained virological response,SVR)影响机制尚不清楚.然而,已经提出的是DAAs和SVR对HCV脂肪变性的影响.大量研究表明,HCV感染上调了甾醇调节元件结合蛋白(SREBP-1c),同时下调了MTP和肉碱棕榈酰基转移酶1(CPT-1),这两种元素可促进脂肪生成、VLDL-C分泌和线粒体β-氧化的调节.因此,根据Kawagishi等人的研究,通过DAA法疗根除HBV应成功下调SREBP 1c,同时上调MTP和CPT-1.因此,脂肪生成减少,VLDL分泌增加.这就进一步论证了DAAs根除HCV是如何影响肝脏脂肪变性和动脉粥样硬化风险的.结果表明,SVR24h受控衰减参数(controlled attenuation parameter,CAP)的总体变化显著升高,而且这些变化与脂肪变性的基线值呈负相关,因此,重度脂肪变性患者的CAP值下降,而较低的脂肪变性患者的CAP值升高.由于降低MTP而导致VLDL分泌受损,已被认为可导致HCV患者低胆固醇血症和三酰甘油水平下降,结果DAA治疗成功地减少了大多数患者的脂肪变性和肝脏炎症.
除了脂肪变性的改善外,DAAs还与胰岛素对抗减轻有关,从而显著减少了CHC的两种主要的肝外表现:即T2DM和CVD.在研究SVR对HCV患者DAA治疗后颈动脉粥样硬化程度的影响时,报告指出获持续病毒应答率(SVR)后9-12 mo颈动脉内膜中层增厚减少.可见HCV感染患者的HCV清除率与心血管疾病的减轻有关.
总之,虽然有人认为肝脂肪变性通过Janut酪氨酸激酶/信号传导及转录激活蛋白(janus tyrosine Kinase/Signal transducer and activator of transcription,JAK/STAT)信号传导缺陷对IFN基础治疗后的SVR产生负面影响,但无IFN DAA治疗却明显改善了脂肪变性.研究证实,以G-3 HCV感染患者脂肪变性的显著变化与获得SVR最为明显,因此,进一步明确了HCV不同基因型的分子通路可能会提高干扰素和无干扰素DAA治疗的成功率.
4 人体免疫缺陷病毒与代谢相关脂肪性肝病
HIV是一种单链RNA病毒,属于病毒科,分为HIV-1和HIV-2.每天约有14000人感染艾滋病毒.HIV感染者脂肪肝发生率高达48%.与未感染的患者相比,伴有炎症和纤维化.除了代谢诱导剂外,多个HIV特异性因素包括病毒本身、肠-肝轴和高活性抗逆转录病毒治疗,被认为有助于HIV感染者发生MAFLD.
抗HIV治疗促进MAFLD的发展,即摄入核苷类逆转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIS)、非核苷类逆转录酶抑制剂和蛋白酶抑制剂,往往伴随着脂肪营养不良,这一过程最终导致脂肪细胞储存缺乏,过多的脂肪酸和三酰甘油导致脂肪肝发生.
NRTIS,特别是胸苷类似物,可引起低脂联素血症、高三酰甘油血症和脂肪营养不良.同时也具有线粒体毒性,可导致活性氧的生成和脂肪酸的β氧化,引起微囊状肝脂肪变性.另一方面,摄入蛋白酶抑制剂聚异戊二烯(polyisoprene,PIs),会通过抑制葡萄糖转运体(glucose transporter,GLUT 4)而导致胰岛素抵抗.利托那韦(Ritonavir)能诱导小鼠SREBP-1和SREBP-2易位,促进脂肪生成和胆固醇生物合成的转录因子,可能与脂肪肝的发生发展有关.高效抗逆转录病毒治疗(highly active anti-retroviral therapy,HAART)还能改变与脂肪营养不良相关的生长激素分泌,胰岛素抵抗以及诱导的脂肪营养不良,可导致体脂再分布和脂肪肝发生.
5 人巨细胞病毒与代谢相关脂肪性肝病
人巨细胞病毒(human cytomegalovirus,CMV)CMV感染与发生MAFLD的代谢危险因素之间的相关性似乎与性别和体重指数(body mass index,BMI)有关.CMV感染似乎只与女性的代谢综合征有关.正常体重的CMV免疫球蛋白G(immunoglobulin G,IgG)血清阳性女性的血脂异常和代谢综合征的人巨细胞病毒感染患者发生MAFLD的患病率较高.CMV可通过新生脂肪生成和氧化应激促进MAFLD发生.体外分析表明,CMV感染的人成纤维细胞乙酰辅酶A羧化酶(acetyl coenzyme A,ACC)活性增加,ACC是新生脂肪生成途径中的第一个限速酶,受SREBP-1c的调控.表达CMV衍生调节即刻早期蛋白IE2(由基因UL122编码)的小鼠SREBP-1c基因和蛋白表达增加,与肝脏脂肪变性有关.感染CMV的成纤维细胞表现出有增加质量和线粒体膜电位的压力增高,这可能引起氧化应激,诱发高三酰甘油和高脂肪酸血症发生,从而导致MAFLD的进展.
6 结语
由于非酒精脂肪性肝病改名定义为《代谢相关脂肪性肝病》,明确了其核心是脂质代谢、胰岛素抵抗、肥胖、免疫紊乱、菌群失调相关性疾病,新的命名可以更好的定义MAFLD患者群体,并有助于患者的疾病分型;新的命名论证了MAFLD的高度异质性,提出了MASH新药研发和肝纤维化无创诊断的临床研究对策.修订后的名称的预期效益可与先前的建议相媲美.首先,向包容性诊断标准的转变即代谢功能障碍的存在,而不是没有其他疾病--更好地反映了我们对主要驱动MAFLD的潜在代谢功能障碍的了解.第二,这个术语应该更好地定义MAFLD患者的数量,从而改进患者的分型,为个性化的医学和更好的临床试验铺平道路.第三,这个定义没有提及酒精,避免了酒精性肝病的诊断和MAFLD之间的竞争,减少了羞辱患者的风险.随着定义上的改变和研究的开展与深入,将会给MAFLD及其与系统疾病的相关性带来新的认识与结果,期待MAFLD新贡献,为MAFLD的诊治提出更多可行的新策略,奋斗谱新篇,一起向未来.

