基于气道炎症及Th1/Th2免疫通路探究抗支糖浆对雾化烟草提取物环境哮喘模型小鼠的影响
云靖婷,胡晓阳,李志军,孙爽
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001;3.哈尔滨医科大学大庆校区,黑龙江 大庆 163711)
哮喘,又名支气管哮喘,是由多种炎症细胞和细胞组分参与的慢性气道炎症性疾病,主要表现为喘息、气促、胸闷、咳嗽等,且会随时间变化而加重,伴有可逆性呼气气流受限[1-4]。哮喘的发病机制复杂,多项研究表明,哮喘的发生与气道炎症、免疫调节机制密切相关,这二者是导致气道高反应性的重要因素,也是目前哮喘机制研究的重点[5-6]。近年来,随着空气质量下降、饮食卫生问题频发等,哮喘发病人数逐年增多。虽然多数患者经过药物治疗后可以缓解,但仍会影响患者的生活质量,目前临床常用的吸入性糖皮质激素(ICS)及长效β2受体激动剂有明显副作用,而中医治疗哮喘有较大优势,所以探究哮喘的影响因素与发病机制进而寻找治疗哮喘更加有效的方法尤为重要[7-10]。
抗支糖浆由《金匮要略》中的经典古方射干麻黄汤衍化,经过多年临床经验总结而成,为黑龙江中医药大学附属第二医院医疗机构制剂,本药基于射干麻黄汤宣肺清热、化痰平喘之功,依据哮喘的特点和病因病机,对其进行加减化裁,成此良药,诸药配伍,共奏宣肺疏风、化痰止咳、清热平喘之功。抗支糖浆具有较好的抑制气道炎症和免疫调节作用,但其具体的疗效机制仍需进一步探索[5]。本实验建立雾化烟草提取物环境哮喘模型小鼠,观察小鼠一般状态,对其肺组织进行病理学检查,统计肺泡灌洗液(BALF)中细胞的分类及计数,选择辅助性T细胞1/辅助性T细胞2(Th1/Th2)以及半胱氨酰白三烯受体(CysLTRs)所介导的炎症通路作为研究对象,用ELISA法、Western Blot法和RT-PCR法检测相关生理生化指标,以探究抗支糖浆的相关作用机制与影响,为临床用药提供依据。
1 实验材料
1.1 实验动物
清洁级健康雌性昆明小鼠90只,体质量(20±2)g,由黑龙江中医药大学实验动物中心提供,动物合格证号:SCXK(辽)2015-0001。所有小鼠均采用黑龙江中医药大学实验动物中心提供的全营养颗粒饲养,自由饮水,昼夜节律正常,实验操作遵守《实验动物管理条例》。
1.2 实验药物
抗支糖浆(组成:炙麻黄、苦杏仁、石膏、鱼腥草、射干、僵蚕、地龙、拳参、炙百部、桑白皮、黄芩、虎杖、芦根、平贝母、甘草),由黑龙江中医药大学附属第二医院配置生产,生产批号为黑药制字z20131020,规格为250 mL/瓶。
1.3 实验仪器与试剂
酶联免疫检测仪(DG5031),上海珂淮仪器有限公司;包埋机(JB-P5),武汉俊杰电子有限公司;病理切片机(RM2016),上海徕卡仪器有限公司;正置光学显微镜(NikonEclipseE10),日本尼康;高速台式离心机(X-22R),美国贝克曼仪器有限公司;自制玻璃雾化箱40 cm×30 cm×25 cm。
ELISA试剂盒,安迪生物科技(上海)有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术研究所;PCR试剂盒,Roche公司;鸡卵清蛋白OVA、氢氧化铝,美国Sigma公司;孟鲁司特纳咀嚼片,杭州默沙东制药有限公司。
2 实验方法
2.1 实验分组
将雌性小鼠90只随机分为9组,空白组(A组)、模型组(B组)、模型+抗支糖浆低剂量组(C组)、模型+抗支糖浆高剂量组(D组)、模型+孟鲁司特组(E组)、模型+雾化烟草提取物组(F组)、模型+雾化烟草提取物+抗支糖浆低剂量组(G组)、模型+雾化烟草提取物+抗支糖浆高剂量组(H组)、模型+雾化烟草提取物+孟鲁司特组(I组),每组10只。
2.2 建模及给药方法
称取5 mg OVA,溶于50 mL生理盐水,配置成致敏液。称取5 g OVA,溶于100 mL生理盐水中,得5% OVA溶液,雾化激发备用。称取烟叶20 g,加入100 mL蒸馏水,开启真空泵,调节流速,点燃烟叶,使其燃烧的烟雾过水,待20 g烟叶完全燃尽后,得烟草提取物溶液(质量浓度为20%,甲醛浓度为1.056 μg/mL,符合污染大气标准),雾化备用。
除空白组外,其余各组于实验第0、7和14天给予每只小鼠腹腔+双大腿皮下注射致敏液共0.2 mL致敏。空白组则以生理盐水代替致敏液注射,部位及注射剂量与其余各组相同。实验第1~27天,模型+雾化烟草提取物组、模型+雾化烟草提取物+抗支糖浆低剂量组、模型+雾化烟草提取物+抗支糖浆高剂量组、模型+雾化烟草提取物+孟鲁司特组,4组小鼠置于自制雾化箱内,烟草提取物溶液甲醛浓度1.056 μg/mL雾化吸入,3 h/d,连续27 d。其余组不予任何处理。实验第21~27天,除空白组外,其余各组将小鼠置于自制雾化箱中,以5%(m/v)OVA进行雾化吸入激发,45 min/d,连续7 d,观察并记录小鼠哮喘发作情况;空白组以生理盐水代替OVA雾化激发。给药组于实验第21天开始进行药物干预,给药剂量按动物体表面积比值换算,在雾化激发前0.5 h给药。
2.3 取材
末次雾化结束24 h内处死小鼠,切开其颈部及前胸正中皮肤,分离气管,并结扎右主支气管,在左侧主支气管处进行气管插管,进行支气管肺泡的灌洗。针管抽取0.5 mL生理盐水,缓慢注入后保留20 s回抽,重复3次,每只小鼠收集肺泡灌洗液(BALF)1.2 mL,4 ℃保存,1 500 r/min离心10 min,沉淀物涂片固定;取上清液保存于-80 ℃的环境中,作为待测样品;分别剪取右肺上叶组织与右肺下叶组织各100 mg,放入冻存管中标记,立即置液氮保存;取右肺中叶在4%多聚甲醛中室温固定,用以病理组织检查。
2.4 检测指标及方法
2.4.1 一般状况
观察记录动物模型整体状态,判断是否有异常,包括体质量、皮毛、活动情况、精神状态、睡眠、进食与饮水及二便等,分析相关原因,判断造模是否成功及药物作用效果。
2.4.2 HE染色观察肺组织病理情况
处死小鼠后取下肺组织块投入预先配制好的10%福尔马林固定液中固定24 h,采用70%、80%、90%、100%的梯度酒精与二甲苯使组织块脱水透明,经浸蜡包埋后对其进行切片与贴片,再经由脱蜡、脱色与染色等过程,用中性树胶封片,待树胶干后,即可观察。
2.4.3 BALF中白细胞的分类及计数
将收集到的肺泡灌洗液1 500 r/min 离心10 min,去上清后沉淀制备细胞悬液,分别取细胞悬液和0.4%台盼蓝染液按9∶1的比例混匀,取10 μL混合液加入血细胞计数板进行活细胞计数。用Hank’S液调整细胞悬液的浓度为4×105/mL,取50 μL的细胞悬液制备细胞涂片并干燥固定,先后滴加瑞氏染液与磷酸盐缓冲液,染色5 min后流水冲去染液,待涂片自然干燥后镜检。
2.4.4 ELISA法检测相关指标
在板条中设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL,样本孔先加待测样本10 μL,再加样本稀释液40 μL,而后每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min,取出进行重复洗板5次后每孔加入底物A、B各50 μL,37 ℃避光15 min,最后每孔加入终止液50 μL,15 min内在450 nm波长处测各孔的OD值。
2.4.5 Western Blot检测CysLTR1的蛋白表达水平
混匀Western及IP细胞裂解液,取1 000 μL加入苯甲基磺酰氟(PMSF)10 μL,取100 mg肺组织置于含有PMSF的裂解液中,匀浆机粉碎组织后裂解30 min,12 000 r/min离心10 min提取蛋白。配制分离胶后配制5%浓缩胶,灌胶后插入齿梳,水平放置等待胶凝。根据所测蛋白的浓度计算25 μg蛋白的溶液体积为上样量,置入100 ℃水浴锅中进行蛋白变性。浓缩胶凝固后,电泳跑浓缩胶至出分离胶,按照目的蛋白分子量大小切取分离胶进行转膜,再经TBST洗涤两次后将膜封闭于封闭液中,经一抗、二抗孵育后将ECL发光液滴于PVDF膜上,使发光液与蛋白充分反应。
2.4.6 RT-PCR检测CysLTR1的基因表达水平
取100 mg肺组织加入裂解液中充分匀浆,加入0.2 mL氯仿,12 000 r/min离心15 min,记录上清液体积,加入与上清液等体积的异丙醇充分混匀,12 000 r/min离心10 min,弃上清,加入1 mL预冷的75%DEPC乙醇洗涤沉淀,10 000 r/min离心10 min,弃上清,将沉淀溶于40 μL 1‰DEPC水中提取RNA。将提取的RNA在20 μL反应体系中逆转录为cDNA。在DEPC预处理的管中加入OligodT 1 μL,6 000 r/min离心2 min,置入PCR仪,70 ℃金属浴10 min,最后4 ℃直到结束,依次加入5×反转录酶Buffer 4 μL、dNTP(2.5 mmol/L)4 μL、0.1 mol/L DTT 2 μL、Rnase Inhabitor 1 μL、M-mLV 1 μL,短暂离心后置入PCR仪进行荧光定量PCR测定。
2.5 统计学方法
3 结果
3.1 一般状态
空白组小鼠的毛色正常,毛质光泽柔顺,动作协调,反应敏捷,呼吸顺畅,正常进食饮水,二便正常,体质量增长稳定,状态健康。其余组小鼠在雾化刺激前呼吸顺畅,雾化开始后则相继出现咳嗽喘促、呼吸频率加快,口鼻分泌物增多等表现,甚至有腹部抽动,挠抓口鼻,咳喘剧烈等情况,模型组、模型+雾化烟草提取物组症状加重明显。经药物干预后,各组症状均有明显减轻,仅少数有蜷卧懒动情况。
3.2 HE染色结果
空白组支气管及肺泡结构正常,连续、清晰,壁无明显增厚,极少量炎症细胞浸润。模型组与模型+雾化烟草提取物组支气管周围、黏膜层、肺泡壁和血管周围发现较多炎症细胞浸润,其中EOS、MAC、LYM增多明显;支气管壁增厚,气道上皮被破坏,有脱落死皮,管腔有黏液栓;基底膜形态不规则,黏膜有充血水肿现象,部分肺泡壁变薄或断裂,间距增宽,体积明显变小甚至萎缩,腔内有炎性细胞。药物干预后病理变化减轻明显,支气管黏膜充血较少,水肿及炎性细胞浸润有不同程度改善,分泌物明显减少,见图1。

图1 各组小鼠肺组织HE染色(×400)
3.3 BALF中细胞的分类及计数
与空白组相比,模型组、模型+雾化烟草提取物组白细胞总数、EOS绝对计数,EOS、LYM、NEU各组所占百分比比例增多,MAC占比虽减少,但绝对计数增加明显(P<0.05)。与模型组相比,模型+雾化烟草提取物组白细胞总数、EOS绝对计数,LYM、NEU、EOS所占百分比比例均增加,MAC所占百分比虽减少,但绝对计数增加明显(P<0.05)。抗支糖浆高低剂量组、孟鲁司特组与模型组、模型+雾化烟草提取物组的统计结果相比,白细胞总数、EOS绝对计数,EOS、LYM、NEU各组所占百分比比例降低(P<0.05),MAC占比虽有所增加,但绝对计数降低(P<0.05)。抗支糖浆高低剂量组与孟鲁司特组相比,白细胞总数、EOS绝对计数,MAC、EOS、LYM、NEU各组占比差异均无统计学意义(P>0.05),见表1。
表1 各组BALF中白细胞总数、EOS绝对计数及细胞分类
3.4 抗支糖浆对BALF中IL-4、IL-5、IL-13、IFN-γ、LTD4的影响
与空白组相比,其余各组IL-4、IL-5、IL-13、LTD4含量均增多,而IFN-γ含量减少(P<0.05)。与模型组相比,模型+雾化烟草提取物组小鼠肺泡灌洗液中IL-4、IL-5、IL-13、LTD4的含量增多,IFN-γ的含量减少(P<0.05)。孟鲁司特组、抗支糖浆高低剂量组与模型组、模型+雾化烟草提取物组相比,IL-4、IL-5、IL-13、LTD4的含量减少,IFN-γ的含量增多(P<0.05)。抗支糖浆高低剂量组与孟鲁司特组的结果相比,IL-4、IL-5、IL-13、LTD4、IFN-γ含量差异无统计学意义(P>0.05),见表2。
表2 各组小鼠肺泡灌洗液中IL-4、IL-5、IL-13、IFN-γ、LTD4测定比较
3.5 CysLTR1蛋白表达检测结果
模型组、模型+雾化烟草提取物组CysLTR1的蛋白表达水平,较空白组增多(P<0.05)。与模型组相比,模型+雾化烟草提取物组CysLTR1的蛋白表达水平升高(P<0.05)。孟鲁司特组、抗支糖浆高低剂量组CysLTR1的蛋白表达水平较模型组、模型+雾化烟草提取物组减少(P<0.05)。抗支糖浆高低剂量组CysLTR1的蛋白表达水平与孟鲁司特组差异无统计学意义(P>0.05),见图2、图3。
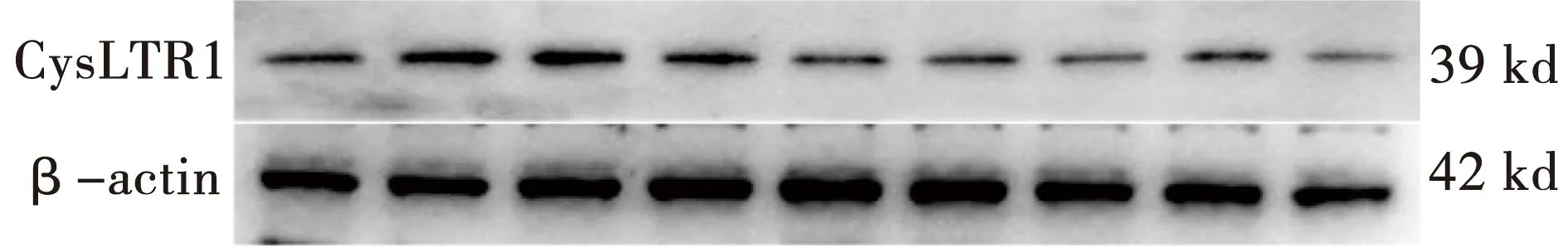
图2 CysLTR1、β-actin的蛋白条带图

注:与A组比较,#P<0.05;与B组比较,*P<0.05。
3.6 CysLTR1mRNA相对表达量检测结果
模型组、模型+雾化烟草提取物组CysLTR1 mRNA相对表达量,较空白组增多(P<0.05)。与模型组相比,模型+雾化烟草提取物组的CysLTR1的蛋白表达水平升高(P<0.05)。孟鲁司特组、抗支糖浆高低剂量组CysLTR1 mRNA相对表达量较模型组、模型+雾化烟草提取物组减少(P<0.05)。抗支糖浆高低剂量组CysLTR1mRNA相对表达量与孟鲁司特组差异无统计学意义(P>0.05),见表3。

表3 各组小鼠CysLTR1mRNA相对表达量的比较
4 讨论
抗支糖浆有清热解毒、宣肺止咳、清肺化痰之功效,临床应用十数年,疗效显著。有研究发现,抗支糖浆对儿童咳嗽变异性哮喘及小儿支气管哮喘的治疗效果良好[11-13]。
研究发现,烟草烟雾暴露已成为儿童支气管哮喘发病的重要因素之一,此外,有研究结果表明,妊娠期妇女吸烟,也可以成为儿童与青少年哮喘发病的重要危险因素[14-16]。有研究提示,烟草烟雾能够影响包括健康人群呼吸道的免疫系统,与多种呼吸道疾病如鼻炎、鼻窦炎及哮喘等的发生、发展密切相关[17]。烟草烟雾不仅会导致哮喘发生,还会加重哮喘症状,吸烟患者的症状较不吸烟的患者更严重[18],更有研究表明,烟草烟雾暴露可能会导致哮喘患者对糖皮质激素治疗不敏感[19]。因此本实验建立烟雾哮喘模型,以模拟空气污染时哮喘发作情况。
哮喘常由免疫异常引起,但其免疫调节机制尚不明确。Th1/Th2在人体免疫方面有着很大的作用,两者的平衡与免疫功能关系密切,Th1/Th2失衡目前被认为是哮喘最重要的病机之一。CysLTRs通道是哮喘气道炎症的重要通道之一,CysLTRs通过与靶细胞上CysLTR1结合,聚集并活化炎症细胞,增加血管渗透性及气道黏液分泌导致哮喘,Th1/Th2失衡会导致哮喘CysLTRs介导的炎症通路的气道炎症形成,二者相互影响。Th1细胞主要分泌IFN-γ,Th2细胞主要分泌IL-4、IL-5、IL-13,其中IFN-γ与IL-4相互拮抗,可抑制IL-4mRNA的转录水平。气道炎症发生时,IL-4水平增加与IFN-γ水平减少,可反映Th1/Th2失衡。IL-4和IL-13可增强单核细胞和巨噬细胞CysLTR1的表达,并在气管平滑肌细胞中促进CysLTR1的产生。有研究表明IFN-γ能上调支气管上皮细胞CysLTR1及CysLTR1mRNA的表达,增强LTs对呼吸道的炎症效应[20-22]。
实验结果显示,抗支糖浆可以改善雾化烟草提取物环境哮喘模型小鼠的一般状态,降低炎性细胞数量,减少黏膜下水肿及黏液的分泌,减轻气道炎症,改善呼吸道高反应。抗支糖浆与孟鲁司特均可调节Th1/Th2免疫平衡状态,下调CysLTR1mRNA的表达干预CysLTR1介导的哮喘CysLTs炎症作用达到防治雾化烟草提取物环境哮喘的目的。

