脂肪来源间充质干细胞在自身免疫性疾病中的应用进展
李悦华,李青峰,谢 芸
上海交通大学医学院附属第九人民医院整复外科,上海 200011
自身免疫性疾病(autoimmune diseases,AIDs)是指患者体内的免疫系统对自身抗原产生免疫应答反应引起的一系列疾病[1]。大多数AIDs 的特点是产生大量的自身抗体,这些抗体与宿主体内的抗原结合,形成免疫复合物并沉积在组织中,从而引起下游靶器官的损伤与功能障碍。自身抗体引起的炎症反应主要是通过结合白细胞上的Fc受体介导的[2-3],同时自身抗体也可以被相关补体激活,直接介导疾病中的组织损伤[4]。在疾病的发展阶段,遗传因素和环境因素可相互作用,共同促进自身免疫反应的发展,导致组织炎症和损伤,最终发展为一种具有多器官和多系统损伤的慢性疾病[5]。
现阶段,临床中大部分AIDs 的治疗主要是采用以糖皮质激素和非甾体类抗炎药为主的非特异性免疫疗法来抑制疾病的发展。然而,对于使用单一或联合方案的药物治疗,如果患者反应不佳或无法耐受,则需要考虑其他具有潜在疗效的治疗方案[6],例如干细胞移植、生物制剂等。其中,间充质干细胞(mesenchymal stem cells,MSCs)治疗是最有前景的治疗策略之一[7]。
随着MSCs 的发现,人们对它的理解不断加深。在过去几十年中,对MSCs 的初步研究主要集中在它的自我更新与分化能力上,但随着对其免疫调节功能的发现,基于MSCs 的研究方向已从最初的再生医学转向AIDs[8]。脂肪作为MSCs 的重要来源之一,已被运用到多种AIDs 的治疗中。因此,本文就脂肪来源间充质干细胞(adipose-derived mesenchymal stem cells,AD-MSCs)的生物学特性及其在AIDs 中的应用进展进行了总结与讨论。
1 AD-MSCs的生物学特性
AD-MSCs 具有类似于骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)的生物学特性,如高度自我更新、体外复制及定向分化,同时又可表现出归巢行为,趋向于损伤、炎症及肿瘤部位[9]。但与BM-MSCs 相比,AD-MSCs 也具有自身特点:首先在取材方面,脂肪组织中含有的MSCs 是骨髓的100~1 000 倍,且来源丰富,获取方法更加简单方便,同时对供体产生的损伤较小[10];其次在功能方面,AD-MSCs 可通过旁分泌方式产生大量的趋化因子和生长因子等,作用于周围细胞发挥不同的生物学功能[11]。
1.1 AD-MSCs的分离及表面标志物
目前,尚没有标准的方法提取分离AD-MSCs,大多数情况下研究人员会采用ZUK等[12]提出的方法处理脂肪组织。从脂肪组织提取分离AD-MSCs 的过程中会获得大量的血管基质组分,主要包括4 种细胞亚群:内皮祖细胞亚群(CD31+CD34+CD45-)、成熟内皮细胞亚群(CD31+CD34-)、周细胞亚群(CD146+CD90+CD31-CD34-)和动脉外膜外脂肪基质细胞亚群(CD34+CD45-CD31-CD146-)[13]。其中周细胞亚群所占比例最小(<1%),通常被认为是AD-MSCs 的前体细胞[14],细胞表面具有CD73、CD90 和CD105 等间质细胞标志物。同时,该类细胞表面没有(或者较少)人类白细胞抗原(HLA)-DR和共刺激分子CD40、CD80/CD86 的表达,使其处于相对免疫赦免状态[15],这为免疫性疾病的治疗提供了研究基础。
1.2 AD-MSCs的免疫调节功能及机制
随着对AD-MSCs研究的不断深入,人们发现ADMSCs可调节多种免疫细胞的功能,包括B淋巴细胞、T淋巴细胞、自然杀伤细胞(natural killer cell,NK细胞)、单核细胞衍生的树突状细胞和中性粒细胞[16]。免疫调节的主要途径包括:①直接细胞间接触。与淋巴细胞混合培养时,AD-MSCs可通过细胞间的直接接触达到抑制异体淋巴细胞增殖的目的。AD-MSCs还可以直接激活调节T细胞,降低TH1细胞的增殖并促进白细胞介素-10(interleukin-10,IL-10)的表达及释放[17]。ADMSCs与巨噬细胞共同培养可诱导其M2表型极化,下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-1β、干扰素γ(interferon-γ,INF-γ)和IL-12等因子的表达[18]。②间接细胞间通信。在一定的环境下ADMSCs可释放多种可溶性因子,包括具有抗炎特性的细胞因子,脂肪因子和具有抗氧化、促血管生成、抗凋亡、具有神经营养和生长作用的因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、肿瘤坏死因子-β1(tumor necrosis factor-β1,TNF-β1)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophagecolony stimulating factor,GM-CSF)等。一些研究显示从AD-MSCs的条件培养基中收集的可溶性介质可通过旁分泌途径调节免疫反应[19]。③细胞外泌体。AD-MSCs产生的外泌体由蛋白质、脂质、DNA、mRNA、micro-RNA、tRNA和长链非编码RNA等多种成分组成[20]。外泌体可被运送到靶细胞的细胞质中发挥相关免疫调节作用[21]。
2 AD-MSCs治疗AIDs的应用进展
与传统免疫抑制疗法相比,AD-MSCs 的移植治疗可以对AIDs 患者的不同病理环境产生特异性的反应,引起局部免疫抑制,达到延缓疾病进展、缓解病情的目的。
2.1 系统性红斑狼疮
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种常见的AIDs。目前认为该病的发病机制主要是由于患者自身的T 细胞、B 细胞功能异常,产生大量抗体以及相关免疫复合物在体内出现异常沉积[22]。临床治疗中,通常采用以糖皮质激素为主、联合免疫抑制剂的治疗方法。多数情况下,轻症患者可获得良好的治疗效果,但重症和耐药的患者预后仍不理想。
2011 年,CHOI 等[23]首次使用第一代NZB×NZW 小鼠研究了长期连续输注AD-MSCs对SLE的治疗效果,并确定疾病发作前输注AD-MSCs 是最佳的治疗窗口。2019年,WEI等[24]在SLE 小鼠身上进行了类似的研究,并发现在AD-MSCs 治疗组中SLE 小鼠脾脏中辅助性T 17(T helper type 17,Th17)细胞、血清IL-17 浓度以及肾脏IL-17 表达水平显著降低,从而抑制了体内的炎症反应。为了进一步寻找更好的临床方案,有研究将低分子肝素与AD-MSCs 联合使用治疗SLE小鼠模型,观察到两者的联合治疗可显著改善小鼠疾病活动性,比单纯AD-MSCs 治疗具有更高的抗炎和抗纤维化作用,可能成为未来临床治疗SLE 的候选方式之一[25]。近2 年,有Ⅰ期临床试验对标准治疗无效的难治性SLE患者进行了同种异体的AD-MSCs 全身治疗(2×106个/kg),并在干预后随访观察12个月。结果表明,同种异体AD-MSCs 输注可以有效减少尿蛋白排泄和疾病活动的发生,且未造成严重不良事件;同时疾病活动评分显示,在干预后6 个月,患者获得最大治疗效果[26]。但AD-MSCs 治疗SLE的有效性和安全性需要更多的临床试验进一步验证。
2.2 类风湿关节炎
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵蚀性、对称性多关节炎为主要表现的慢性AIDs。该病的基本病理表现主要为关节滑膜的慢性炎症、血管翳形成,并逐渐出现关节软骨和骨质破损,最终导致关节畸形和功能丧失。目前,没有治愈RA 的有效方法。通常对患者的治疗是从使用皮质类固醇开始,待症状得到控制并稳定后再使用甲氨蝶呤等能改善疾病的抗风湿药物,但长期使用这些药物可能会使患者产生耐药性,导致治疗效果不佳。
2011 年,ZHOU 等[27]测试了人源AD-MSCs 治疗胶原诱导的关节炎小鼠(collagen-induced arthritis,CIA)的效果。结果发现,AD-MSCs 在小鼠体内不仅可以抑制炎症介质的产生,减少Th17细胞的扩增,同时会诱导IL-10 和抗原特异性的调节性T 细胞(regulatory T cells,Tregs)的产生,从而缓解小鼠关节的炎症症状。此外,GARIMELLA 等[28]进一步探究了AD-MSCs 对CIA 小鼠模型中破骨细胞的体外形成和病理性骨丢失的影响。实验中观察到AD-MSCs可以显著抑制核因子κB(nuclear factor-κB,NF-κB)的受体激活剂诱导的破骨细胞生成,降低CIA发病时有关临床症状的发生率和关节病变程度,同时保护了骨小梁结构以预防小鼠的关节和全身性骨丢失。最近,有一项Ⅰ/Ⅱa期的临床试验评估了单次静脉输注自体AD-MSCs 治疗活动性RA 的有效性和安全性。结果表明,随访到第52 周,试验组患者的关节内炎症得到缓解,关节功能明显改善,且未发生急性或长期严重不良事件[29]。这些研究数据进一步支持了AD-MSCs可作为有效治疗RA的临床选择之一。
2.3 1型糖尿病
1 型糖尿病(type 1 diabetes mellitus,T1DM)是一种早发性糖尿病,通常是由于患者体内的胰岛β细胞被自身免疫系统破坏,胰岛素产生不足,营养物质代谢发生异常而发生的一种AIDs。临床中,胰岛素注射是常规的治疗方法,但无法防治相关的并发症,如神经病变、肾病、视觉和心血管问题等[30]。近些年,AD-MSCs 在替代损伤的胰岛细胞以弥补出现的功能缺陷方面展现出巨大的前景[31]。
2018 年,DANG 等[32]分离和扩增出人源ADMSCs 治疗T1DM 小鼠,并分为低剂量(1×106个/只)和高剂量(2×106个/只)静脉输注2 组。移植后,每周监测AD-MSCs 治疗组和安慰剂组的血糖水平、葡萄糖和胰岛素耐受性、胰腺结构变化和胰岛素水平。结果表明,治疗56 d后,安慰剂组、低剂量组和高剂量组的死亡率分别为50%、66%和0。此外,与其他组相比,高剂量组的血糖水平较低。该研究提示,高剂量AD-MSCs 注射可能是临床治疗T1DM 的潜在有效方案。在另一项研究中,HASHEMI 等[33]研究了腹腔和静脉输注鼠源AD-MSCs 及其条件培养基(conditioned medium,CM)治疗T1DM 小鼠的效果。结果发现,腹腔和静脉注射AD-MSCs 和CM 均可降低血糖,恢复胰岛功能。但在腹腔注射组中抗炎细胞因子水平高于静脉注射组,提示腹腔注射AD-MSCs和CM可能比全身给药更有效。
在最近的一项前瞻性临床试验中[34],1组新近发病的T1DM 患者接受了为期6 个月的同种异体ADMSCs 和胆钙化醇的联合治疗研究。结果发现,治疗组患者的空腹C肽含量与糖化血红蛋白水平明显低于基线水平,并提示这种联合治疗对新近发病的T1DM患者的β细胞有保护作用。在另一项临床试验中,研究人员对20 例T1DM 患者展开了同种异体和自体AD-MSCs 与BM-MSCs 联合输注治疗。3 个月后发现,2 组的糖化血红蛋白和C 肽含量持续改善,谷氨酸脱羧酶抗体降低,平均胰岛素需求量降低,未观察到不良反应。同时发现,与同种异体来源相比,自体来源的联合治疗能更好地长期控制血糖水平[35]。AD-MSCs 已初步被证明可有效治疗T1DM,但哪一种治疗手段更加安全有效需要更多的临床试验进一步探索。
2.4 炎症性肠病
炎症性肠病(inflammatory bowel disease,IBD)是一种特发性累及回肠、直肠、结肠的免疫性疾病,主要分为结肠炎(ucerative colitis,UC)和克罗恩病(Crohn's disease,CD)。CD 最常见的并发症为肛周瘘管,与之相关的治疗最初侧重于外科手术,但术后肛门失禁的发生率相对较高。现有的药物治疗如英夫利昔单抗等生物制剂通常也无法使瘘管完全闭合,而AD-MSCs在治疗CD及并发症方面展现出了巨大的应用价值[36-39]。
在最近的一项Ⅰ期临床试验中,研究者使用递增剂量的方式评估了局部注射自体AD-MSCs 治疗CD并发瘘的安全性和疗效。试验中有10 例患者被依次纳入3 个剂量组:1×107个/mL、2×107个/mL、4×107个/mL。随访发现,有3 例患者的难治性瘘道在第8 周完全愈合,且在注射8 个月后仍保持着疗效,无复发[37]。此外,在另一项多中心研究中评估了低剂量(1×107个/mL)与高剂量(3×107个/mL)同种异体AD-MSCs 治疗CD 肛瘘的安全性和可行性。随访发现,低剂量组的2 例患者在第4 个月和第6 个月时瘘口完全闭合,高剂量组的1 例患者在第8 周时瘘口完全闭合。所有患者的手术效果均持续到第8 个月。治疗过程中没有出现与异基因脂肪干细胞治疗相关的不良事件。结果表明,同种异体AD-MSCs 也是治疗CD 肛周瘘的一种可选择性方法,但需要有更大队列的临床试验进一步证明[40]。随后,另一项Ⅱ期临床试验对低剂量(1×107个/mL)与高剂量(2×107个/mL)AD-MSCs治疗与CD无关的复杂肛瘘的安全性和有效性进行了评估。结果发现,69.2%患者的瘘口完全闭合,未有严重不良反应发生。2 组之间未观察到显著差异[41]。以上研究均表明,AD-MSCs对复杂肛周瘘具有一定疗效,但何种来源以及注射多少剂量ADMSCs具有更好的疗效,未来仍需要进一步探究。
2.5 系统性硬化
系统性硬化(systemic scleroderma,SS)是一种较罕见的AIDs,患者多为30~50岁女性,且高达68%的患者会发生残疾事件。该病的突出特征是患者体内异常的免疫系统激活与成纤维细胞和内皮细胞功能障碍共存,从而导致血管破坏、内脏器官和皮肤进行性纤维化[10]。该疾病的症状较为复杂,临床中始终缺少有效的治疗方案。
不同来源的MSCs已在纤维化动物模型中被证明能够发挥抗纤维化作用[42-44]。最近有研究对比了同种或异种BM-MSCs和AD-MSCs治疗博来霉素诱导SS小鼠的效果,发现同种或异种AD-MSCs在减少皮肤纤维化方面表现出更佳的治疗效果。研究者猜测这可能与ADMSCs增加了皮肤和肺组织中基质金属蛋白酶1/金属蛋白酶组织抑制剂1(matrix metalloproteinase 1/tissue inhibitors of metalloproteinase 1,MMP1/TIMP1)的比率有关[45]。
在临床前研究治疗SS 模型的基础上,有研究测试了对SS患者的局部皮肤注射自体AD-MSCs与透明质酸混合溶液的治疗效果[46]。大部分患者的皮肤纤维化得到显著改善,所有患者均表现出局部疾病进展停滞。此外,临床上也逐渐使用脂肪组织移植来改善SS 的皮肤症状,如局部轮廓不规则以及手部外形改变与功能活动受限等。 例如, 有研究采用COLEMAN方法[47]收集处理脂肪用于治疗10例女性SS 患者的面部和手部。结果显示,患者的口周皮肤弹性、面部动作、手部活动范围和手部疼痛均得到了大幅度的改善,且未发生任何并发症[48]。同时,也有其他研究[49-51]表明,采用脂肪组织联合AD-MSCs输注也取得了令人满意的疗效。
2.6 银屑病
银屑病(psoriasis)是一种常见的慢性炎症性疾病,主要累及皮肤和关节,与潜在的遗传易感性和免疫失调有关[52]。轻中度银屑病的治疗通常是局部治疗,包括糖皮质激素、维生素D类似物和光疗,而中重度银屑病的治疗通常需要系统药物治疗,包括甲氨蝶呤、维甲酸或环孢素等小分子药物,以及单克隆抗体和受体融合蛋白等生物制剂等[53]。然而,长期使用这些药物往往会引发严重的不良反应,如肝毒性、肾毒性、高血压、低镁血症、高钾血症和恶性肿瘤等[54]。
以往已有研究成功将AD-MSCs 应用于咪喹莫特诱导的银屑病小鼠模型中,并证明该治疗可显著阻止银屑病的发展[55]。临床上也报道过AD-MSCs治疗银屑病患者具有一定的安全性和有效性的病例报告[56-57]。最近一项单中心、开放性的试点研究评估了AD-MSCs 治疗中重度银屑病的可行性、安全性和有效性。试验中共涉及7 例中重度银屑病患者。患者每月接受静脉注射AD-MSCs(5×105个/kg),持续3个月。在治疗期间未观察到与AD-MSCs 相关的严重不良事件发生。其中2 例患者在未接受其他任何治疗的1 年后银屑病严重程度指数改善了50%。该研究[58]表明,静脉注射AD-MSCs 治疗银屑病是安全的,且具有较大的潜在临床价值。
3 总结与展望
目前,很多临床试验结果均表明AD-MSCs 在治疗AIDs 方面具有良好的有效性和安全性(表1)。在应用AD-MSCs治疗AIDs时,临床医师应注意移植方式的选择:如在SLE、RA、T1DM、银屑病中,ADMSCs 更适合静脉注射;在治疗CD 相关肛周瘘、SS的皮肤纤维化时,AD-MSCs可选择局部注射。此外,将AD-MSCs与其他药物联合治疗AIDs,在一定程度上可以获得更好的临床效果,如AD-MSCs 联合纤维蛋白胶治疗CD相关瘘[39];这也提示在单独使用ADMSCs 的基础上可以探索更多联合治疗AIDs 的方式,以期获得更好的临床疗效。AD-MSCs在治疗AIDs方面仍有很多问题尚待解决,如AD-MSCs 移植治疗的最佳时间、数量以及移植后在体内能否发挥长期稳定的免疫调节功能;与其他来源的MSCs 相比,ADMSCs 的免疫调节功能的机制以及临床疗效是否有较多差异等。希望这些问题能够在目前正在开展的临床试验中得到更多的解决(表2)。此外,现阶段临床上对于AD-MSCs在AIDs中的应用研究尚处于不成熟的阶段,想要使其更加安全有效地运用于不同AIDs的治疗中还需要多方向、多层次、多学科的基础研究成果作为依据。在未来,无论是基础研究人员还是临床工作者均需进一步深入探究AD-MSCs 的免疫调节机制及功能,为治疗免疫性疾病提供新的策略。
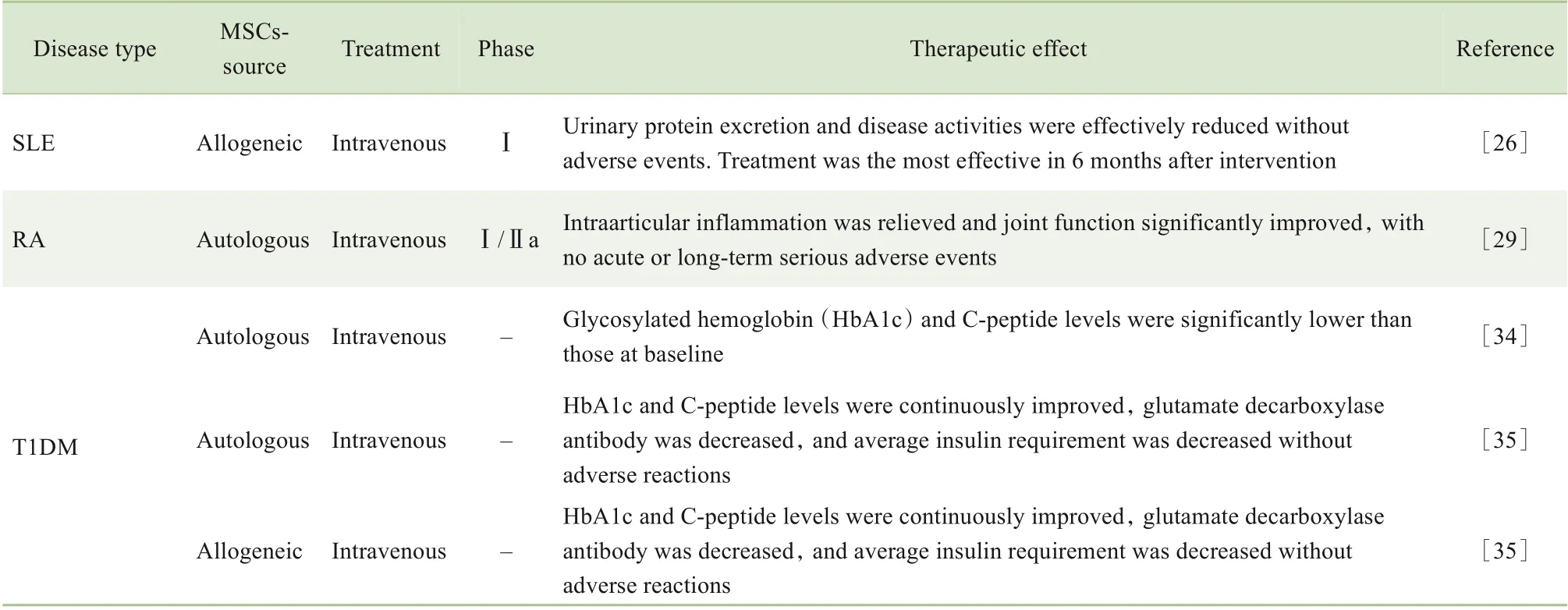
表1 AD-MSCs应用于AIDs治疗的临床试验Tab 1 Clinical trials of AD-MSCs in the treatment of AIDs
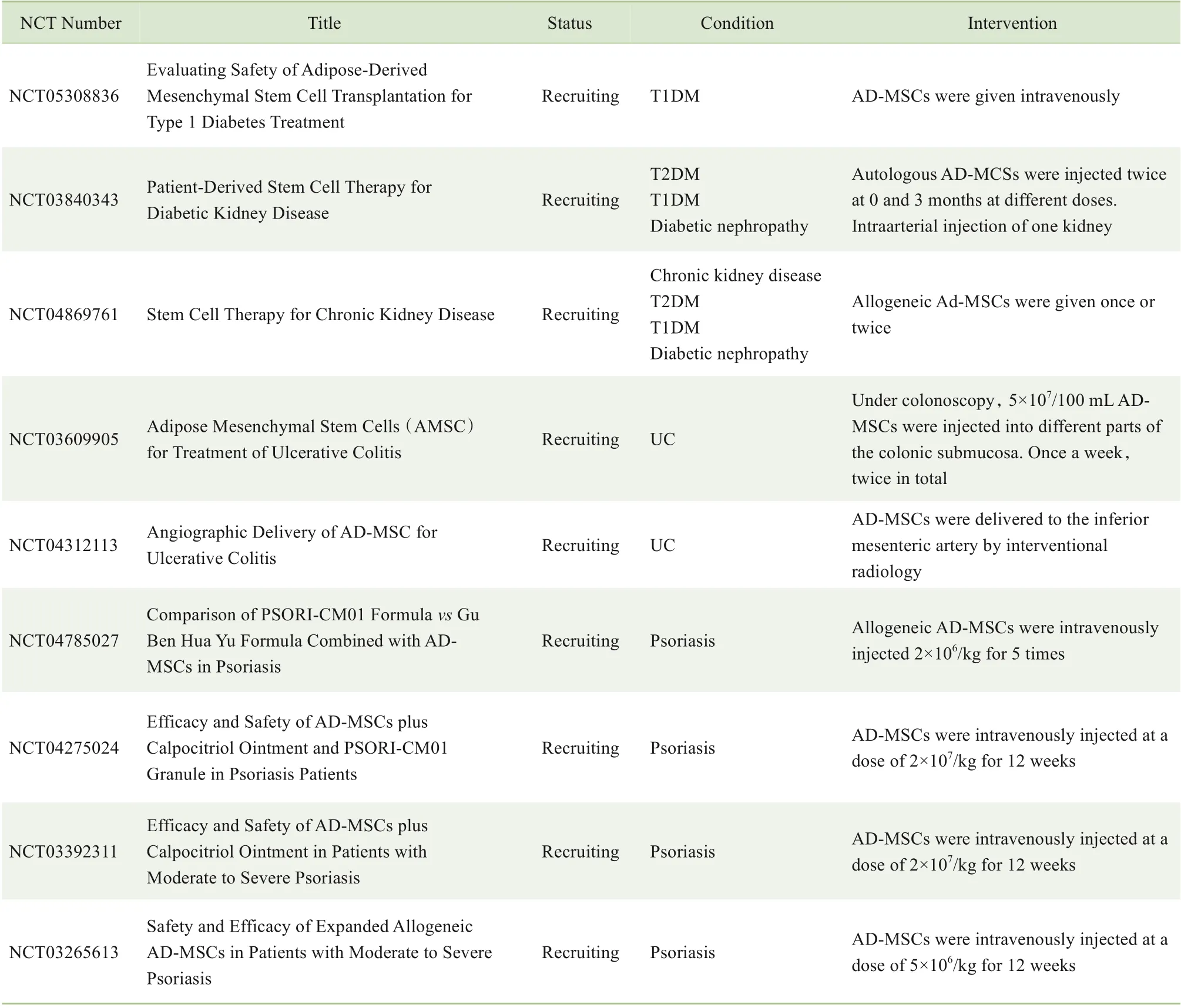
表2 AD-MSCs应用于AIDs正在进行中的临床试验Tab 2 Application of AD-MSCs to AIDs in ongoing clinical trials
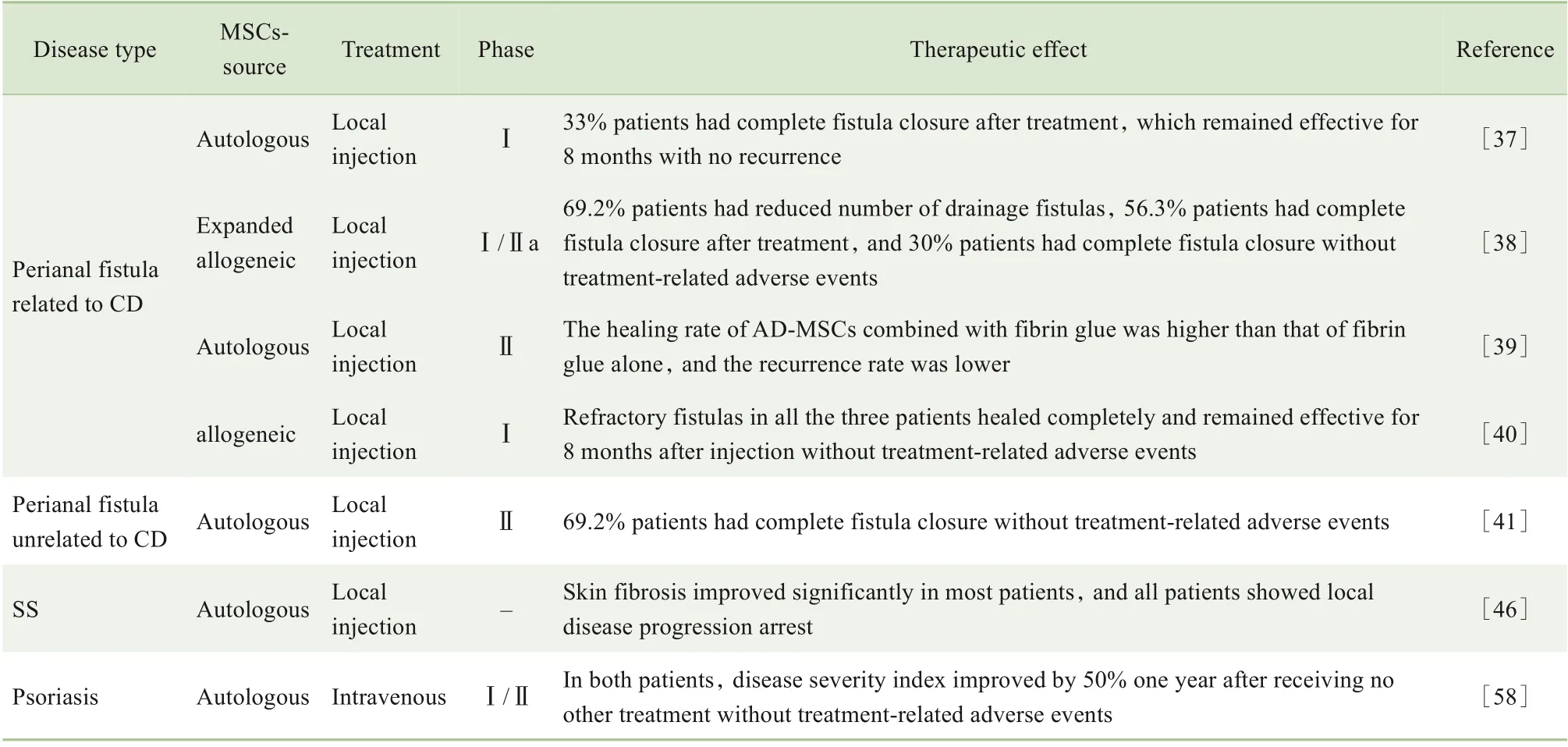
续表
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
作者贡献/Authors'Contributions
谢芸、李青峰、李悦华参与了综述构思;谢芸、李悦华参与了论文的写作和修改。所有作者均阅读并同意了最终稿件的提交。The review was conceived by XIE Yun,LI Qingfeng and LI Yuehua.The manuscript was drafted and revised by XIE Yun and LI Yuehua.All the authors have read the last version of paper and consented for submission.
·Received:2022-03-23
·Accepted:2022-06-23
·Published online:2022-08-08
参·考·文·献
[1] HELLESEN A, BRATLAND E, HUSEBYE E S. Autoimmune Addison's disease:an update on pathogenesis[J]. Ann D'endocrinologie,2018,79(3):157-163.
[2] ROSE N R. Prediction and prevention of autoimmune disease in the 21st century: a review and preview[J]. Am J Epidemiol, 2016, 183(5):403-406.
[3] WANG L F, WANG F S, GERSHWIN M E. Human autoimmune diseases: a comprehensive update[J]. J Intern Med, 2015, 278(4):369-395.
[4] CROW M K, OLFERIEV M, KIROU K A. Type Ⅰinterferons in autoimmune disease[J]. Annu Rev Pathol,2019,14:369-393.
[5] SURACE A E A, HEDRICH C M. The role of epigenetics in autoimmune/inflammatory disease[J]. Front Immunol, 2019, 10:1525.
[6] LERNER A, SHOENFELD Y, MATTHIAS T. Adverse effects of gluten ingestion and advantages of gluten withdrawal in nonceliac autoimmune disease[J]. Nutr Rev,2017,75(12):1046-1058.
[7] RA J C,KANG S K,SHIN I S,et al. Stem cell treatment for patients with autoimmune disease by systemic infusion of culture-expanded autologous adipose tissue derived mesenchymal stem cells[J]. J Transl Med,2011,9:181.
[8] MUNIR H, MCGETTRICK H M. Mesenchymal stem cell therapy for autoimmune disease:risks and rewards[J]. Stem Cells Dev,2015,24(18):2091-2100.
[9] RHEE K J,LEE J I,EOM Y W. Mesenchymal stem cell-mediated effects of tumor support or suppression[J]. Int J Mol Sci,2015,16(12):30015-30033.
[10] TSUJI W, RUBIN J P, MARRA K G. Adipose-derived stem cells:implications in tissue regeneration[J]. World J Stem Cells,2014,6(3):312-321.
[11] AGRAWAL I, JHA S. Comprehensive review of ASC structure and function in immune homeostasis and disease[J]. Mol Biol Rep,2020,47(4):3077-3096.
[12] ZUK P A, ZHU M, MIZUNO H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[13] KOCAN B, MAZIARZ A, TABARKIEWICZ J, et al. Trophic activity and phenotype of adipose tissue-derived mesenchymal stem cells as a background of their regenerative potential[J]. Stem Cells Int,2017,2017:1653254.
[14] MARIA A T, MAUMUS M, LE QUELLEC A, et al. Adiposederived mesenchymal stem cells in autoimmune disorders: state of the art and perspectives for systemic sclerosis[J]. Clin Rev Allergy Immunol,2017,52(2):234-259.
[15] CHO K S, ROH H J. Immunomodulatory effects of adipose-derived stem cells in airway allergic diseases[J]. Curr Stem Cell Res Ther,2010,5(2):111-115.
[16] CHEN Y D, YU Q, HU Y F, et al. Current research and use of mesenchymal stem cells in the therapy of autoimmune diseases[J].Curr Stem Cell Res Ther,2019,14(7):579-582.
[17] NARAYAN S, KOLLY L, SO A, et al. Increased interleukin-10 production by ASC-deficient CD4+T cells impairs bystander T-cell proliferation[J]. Immunology,2011,134(1):33-40.
[18] HEO J S, CHOI Y, KIM H O. Adipose-derived mesenchymal stem cells promote M2 macrophage phenotype through exosomes[J].Stem Cells Int,2019,2019:7921760.
[19] MA S, XIE N, LI W, et al. Immunobiology of mesenchymal stem cells[J]. Cell Death Differ,2014,21(2):216-225.
[20] HARRELL C R,JOVICIC N,DJONOV V,et al. Mesenchymal stem cell-derived exosomes and other extracellular vesicles as new remedies in the therapy of inflammatory diseases[J]. Cells, 2019,8(12):E1605.
[21] TOH W S,LAI R C,ZHANG B,et al. MSC exosome works through a protein-based mechanism of action[J]. Biochem Soc Trans, 2018,46(4):843-853.
[22] FATHOLLAHI A,GABALOU N B,ASLANI S. Mesenchymal stem cell transplantation in systemic lupus erythematous, a mesenchymal stem cell disorder[J]. Lupus,2018,27(7):1053-1064.
[23] CHOI E W, SHIN I S, PARK S Y, et al. Reversal of serologic,immunologic,and histologic dysfunction in mice with systemic lupus erythematosus by long-term serial adipose tissue-derived mesenchymal stem cell transplantation[J]. Arthritis Rheum,2012,64(1):243-253.
[24] WEI S, XIE S, YANG Z, et al. Allogeneic adipose-derived stem cells suppress mTORC1 pathway in a murine model of systemic lupus erythematosus[J]. Lupus,2019,28(2):199-209.
[25] MATSUDA S, KOTANI T, SAITO T, et al. Low-molecular-weight heparin enhanced therapeutic effects of human adipose-derived stem cell administration in a mouse model of lupus nephritis[J]. Front Immunol,2021,12:792739.
[26] RANJBAR A, HASSANZADEH H, JAHANDOUST F, et al.Allogeneic adipose-derived mesenchymal stromal cell transplantation for refractory lupus nephritis: results of a phase I clinical trial[J]. Curr Res Transl Med,2022,70(2):103324.
[27] ZHOU B, YUAN J D, ZHOU Y X, et al. Administering human adipose-derived mesenchymal stem cells to prevent and treat experimental arthritis[J]. Clin Immunol,2011,141(3):328-337.
[28] GARIMELLA M G, KOUR S, PIPRODE V, et al. Adipose-derived mesenchymal stem cells prevent systemic bone loss in collageninduced arthritis[J]. J Immunol,2015,195(11):5136-5148.
[29] VIJ R, STEBBINGS K A, KIM H, et al. Safety and efficacy of autologous, adipose-derived mesenchymal stem cells in patients with rheumatoid arthritis: a phase Ⅰ/Ⅱa, open-label, non-randomized pilot trial[J]. Stem Cell Res Ther,2022,13(1):88.
[30] LIN H P, CHAN T M, FU R H, et al. Applicability of adiposederived stem cells in type 1 diabetes mellitus[J]. Cell Transplant,2015,24(3):521-532.
[31] IKEMOTO T, TOKUDA K, WADA Y M, et al. Adipose tissue from type 1 diabetes mellitus patients can be used to generate insulinproducing cells[J]. Pancreas,2020,49(9):1225-1231.
[32] DANG L T, BUI A N, LE-THANH NGUYEN C, et al. Intravenous infusion of human adipose tissue-derived mesenchymal stem cells to treat type 1 diabetic mellitus in mice: an evaluation of grafted cell doses[J]. Adv Exp Med Biol,2018,1083:145-156.
[33] HASHEMI S M, HASSAN Z M, HOSSEIN-KHANNAZER N, et al. Investigating the route of administration and efficacy of adipose tissue-derived mesenchymal stem cells and conditioned medium in type 1 diabetic mice[J]. Inflammopharmacology, 2020, 28(2): 585-601.
[34] DANTAS J R,ARAÚJO D B,SILVA K R,et al. Adipose tissue-derived stromal/stem cells+cholecalciferol:a pilot study in recent-onset type 1 diabetes patients[J]. Arch Endocrinol Metab,2021,65(3):342-351.
[35] THAKKAR U G, TRIVEDI H L, VANIKAR A V, et al. Insulinsecreting adipose-derived mesenchymal stromal cells with bone marrow-derived hematopoietic stem cells from autologous and allogenic sources for type 1 diabetes mellitus[J]. Cytotherapy, 2015,17(7):940-947.
[36] GARCÍA-OLMO D, GARCÍA-ARRANZ M, HERREROS D, et al.A phase Ⅰclinical trial of the treatment of Crohn's fistula by adipose mesenchymal stem cell transplantation[J]. Dis Colon Rectum, 2005,48(7):1416-1423.
[37] CHO Y B, LEE W Y, PARK K J, et al. Autologous adipose tissuederived stem cells for the treatment of Crohn's fistula: a phase I clinical study[J]. Cell Transplant,2013,22(2):279-285.
[38] DE LA PORTILLA F, ALBA F, GARCÍA-OLMO D, et al.Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn's disease: results from a multicenter phase Ⅰ/Ⅱa clinical trial[J]. Int J Colorectal Dis,2013,28(3):313-323.
[39] GARCIA-OLMO D, HERREROS D, PASCUAL I, et al. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase Ⅱclinical trial[J]. Dis Colon Rectum, 2009, 52(1):79-86.
[40] PARK K J, RYOO S B, KIM J S, et al. Allogeneic adipose-derived stem cells for the treatment of perianal fistula in Crohn's disease: a pilot clinical trial[J]. Colorectal Dis,2016,18(5):468-476.
[41] CHOI S, RYOO S B, PARK K J, et al. Autologous adipose tissuederived stem cells for the treatment of complex perianal fistulas not associated with Crohn's disease: a phase Ⅱclinical trial for safety and efficacy[J]. Tech Coloproctol,2017,21(5):345-353.
[42] WU Y,HUANG S,ENHE J,et al. Bone marrow-derived mesenchymal stem cell attenuates skin fibrosis development in mice[J]. Int Wound J,2014,11(6):701-710.
[43] MOODLEY Y, ATIENZA D, MANUELPILLAI U, et al. Human umbilical cord mesenchymal stem cells reduce fibrosis of bleomycininduced lung injury[J]. Am J Pathol,2009,175(1):303-313.
[44] ZHAO F, ZHANG Y F, LIU Y G, et al. Therapeutic effects of bone marrow-derived mesenchymal stem cells engraftment on bleomycininduced lung injury in rats[J]. Transplant Proc, 2008, 40(5): 1700-1705.
[45] MARIA A T, TOUPET K, MAUMUS M, et al. Human adipose mesenchymal stem cells as potent anti-fibrosis therapy for systemic sclerosis[J]. J Autoimmun,2016,70:31-39.
[46] SCUDERI N, CECCARELLI S, ONESTI M G, et al. Human adipose-derived stromal cells for cell-based therapies in the treatment of systemic sclerosis[J]. Cell Transplant,2013,22(5):779-795.
[47] COLEMAN S R. Structural fat grafting:more than a permanent filler[J].Plast Reconstr Surg,2006,118(3 Suppl):108S-120S.
[48] STRONG A L,ADIDHARMA W, BROWN O H, et al. Fat grafting subjectively improves facial skin elasticity and hand function of scleroderma patients[J]. Plast Reconstr Surg Glob Open, 2021, 9(1):e3373.
[49] GHEISARI M, AHMADZADEH A, NOBARI N, et al. Autologous fat grafting in the treatment of facial scleroderma[J]. Dermatol Res Pract,2018,2018:6568016.
[50] MAGALON G, DAUMAS A, SAUTEREAU N, et al. Regenerative approach to scleroderma with fat grafting[J]. Clin Plast Surg, 2015,42(3):353-364,viii-ix.
[51] GUILLAUME-JUGNOT P,DAUMAS A,MAGALON J,et al. State of the art. Autologous fat graft and adipose tissue-derived stromal vascular fraction injection for hand therapy in systemic sclerosis patients[J]. Curr Res Transl Med,2016,64(1):35-42.
[52] MENTER A, GOTTLIEB A, FELDMAN S R, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics[J]. J Am Acad Dermatol, 2008, 58(5):826-850.
[53] ARMSTRONG A W, READ C. Pathophysiology, clinical presentation, and treatment of psoriasis: a review[J]. JAMA, 2020,323(19):1945-1960.
[54] KIM W B, JEROME D, YEUNG J. Diagnosis and management of psoriasis[J]. Can Fam Physician,2017,63(4):278-285.
[55] ROKUNOHE A, MATSUZAKI Y, ROKUNOHE D, et al.Immunosuppressive effect of adipose-derived stromal cells on imiquimod-induced psoriasis in mice[J]. J Dermatol Sci,2016,82(1):50-53.
[56] DE JESUS M M, SANTIAGO J S, TRINIDAD C V, et al.Autologous adipose-derived mesenchymal stromal cells for the treatment of psoriasis vulgaris and psoriatic arthritis: a case report[J]. Cell Transplant,2016,25(11):2063-2069.
[57] COMELLA K, PARLO M, DALY R, et al. First-in-man intravenous implantation of stromal vascular fraction in psoriasis:a case study[J].Int Med Case Rep J,2018,11:59-64.
[58] YAO D N, YE S Y, HE Z Y, et al. Adipose-derived mesenchymal stem cells (AD-MSCs) in the treatment for psoriasis: results of a single-arm pilot trial[J]. Ann Transl Med,2021,9(22):1653.

