微量O2对SF6过热分解影响机理的同位素示踪分析
何 清,王 伟,邓万婷,胡丹晖,张施令,曾福平
(1.国网湖北省电力有限公司电力科学研究院,湖北 武汉 430077;2.国网湖北省电力有限公司,湖北 武汉 430077;3.国网重庆市电力公司电力科学研究院,重庆 401123;4.武汉大学 电气与自动化学院,湖北 武汉 430072)
0 引言
以SF6气体作为绝缘介质的气体绝缘开关(GIS)、气体绝缘线路(GIL)、气体绝缘变压器(GIT)等设备广泛应用于电力系统中[1-3]。但是,运行经验表明:SF6气体绝缘设备在长期运行中可能会出现弹簧松动或导杆接触不良等现象,导致设备内部发生局部过热性故障[4]。在局部过热性故障的持续作用下,SF6会逐步分解生成低氟硫化物SFx(x=1,2,…,5),生成的这些SFx又会进一步与设备内的杂质气体(尤其是氧气和水气)发生反应生成SO2F2、SOF2、SO2、SOF4、HF、H2S等分解产物[5-7]。一方面,生成的这些分解产物大多具有毒性或腐蚀性,会腐蚀气体绝缘设备部件、威胁运维人员的安全健康,并导致设备整体绝缘性能下降,诱发停电事故;另一方面,这些分解产物的生成又与设备内部绝缘状态密切相关,通过对这些分解产物的监测,可以实现对气体绝缘设备内部绝缘状态的实时监测[8-10]。
但是,为了准确掌握气体组分情况与设备故障状态之间的关系,需要全面掌握SF6在故障状态下的分解特性和分解机理,进而根据SF6故障分解机理提取出表征故障属性的组分特征量。目前对于SF6在不同故障类型下的局部放电分解特性已有较多研究[11-13],但是对于SF6在局部过热故障下分解并与微水、微氧反应的作用机理尚不明确。
为探究O2对SF6过热分解的作用机制,本文采用同位素示踪法[14-16],研究SF6主要含氧分解产物在微量O2条件下的生成过程,尝试揭示微量O2对SF6过热分解的作用机制。通过检测18O标记产物的含量,验证O2是否参与产物的生成过程,再结合标记产物随注入氧气含量的变化规律,分析主要反应路径。
1 实验
1.1 实验平台
模拟GIS局部过热故障的实验平台如图1所示。主要由PID温度控制仪、密闭罐体(容积为2.07 L)、过热故障缺陷模型、气压表、温度计和气相色谱-质谱联用仪(GC-MS)组成。使用色谱-质谱联用技术,可以有效分离SF6过热分解的气体产物并对其进行准确(体积分数低至10-9)的含量测定。本研究使用的GC-MS型号为岛津GCMS-QP2010 Ultra,使用六通阀进样,每次进样量为1 mL。GC-MS所使用的色谱柱型号为CP-SIL 5 CB 60 m×0.32 mm,载气为纯度高于99.999%的氦气。

图1 实验平台Fig.1 Experimental platform
过热故障缺陷模型为棒状热源,其加热温度(外表面温度)最高可达1000℃,内置k型温度传感器,与温度控制仪连接,通过PID实时控制加热温度,在实验中可以保持加热温度不变。实验罐体选用不锈钢材质,具有良好的气密性,可以在0~0.5 MPa气压下安全使用,无明显漏气。
1.2 实验方法
为了掌握O2对于SF6分解反应的作用机制,需要减少气室内残留空气、水分对实验的影响,并使用含示踪原子的18O2气体作为反应物,与纯净的SF6新气充分混合,开展实验。
相关研究和案例表明,当GIS内部局部热点温度达到300℃以上时,SF6开始出现明显的分解并生成少量的气体产物(SOF2、SO2、SO2F2、SOF4、CO2等)[17]。以这些气体为特征组分,可以间接掌握设备内部故障程度[18]。研究表明,随着温度的升高,分解产物的生成速度明显加快[19]。一般情况下,局部过热性故障发生时,局部高温的范围是300~660℃。当达到660℃时,局部高温已足以使金属铝发生熔化,并且导致SF6快速分解,产生大量危害性气体,可视之为严重、难以挽回的故障。目前的研究主要通过在前期故障阶段对故障进行及时的诊断,从而避免故障不断恶化。综合考虑以上因素,本文选择400℃作为实验温度,一方面是因为在此温度下SF6发生明显的分解,产生多种含氧特征产物,从而可分析各组分的生成过程;另一方面是为了避免损坏设备、产生过多有害气体,威胁实验人员的安全。
主要的实验条件设置如下:实验室温度保持20℃,加热时间设置为6 h,SF6可以完成较为充分的分解。气压为0.2 MPa(绝对值),18O2气体的注入量分别为100、200、300、400 mL。由于连续的高温加热会使SF6分解并生成分解产物,气室内部压力会明显增加。另外,若提高气压可能导致操作过程中有害气体泄露、实验后反应废气过多等问题。本研究适当降低气压,虽然可能会影响反应速率,但不会干扰SF6分解反应的路径和O2的作用机制。实验室环境湿度维持在45%。
进行6 h的局部过热实验,实验完成后关闭温度控制系统,并立即打开采样口的气阀,采集样品气体并通入GC-MS进行样品的定量分析。完整的实验操作步骤如下:①每次实验前,使用无水乙醇浸湿的脱脂棉擦拭罐体内壁及局部过热缺陷模型的表面,避免杂质和前一次实验后的产物残留干扰;②将气室抽至真空,然后将纯净的SF6气体充入气室,至气压达到0.2 MPa(绝对值)后,静置10 min,再次抽至真空,重复3~4次,以充分排出气室内可能存在的杂质残留,最后将气室抽至真空状态;③向真空的气室内充入实验所需微量18O2气体,随后匀速充入SF6纯净气体,至实验所需气压0.2 MPa(绝对值),然后再静置12 h,使SF6气体与18O2在气室内充分混合均匀;④静置后,检查气室气压是否符合实验要求,检查无误后使用温度控制仪将局部热源的温度调至400℃,开始实验。实验持续6 h,实验结束后从采样口采集气室内样品气体,并通入GC-MS对分解产物进行定性定量检测;⑤所有检测完成后,将气室抽至真空状态,回收处理反应废气。实验罐体真空静置24 h,以便被气室内壁吸附的残留分解产物充分释放,为下次实验做准备。
由于每次实验步骤相同,进行步骤①、②之后,气室内所残留的16O2和H216O的含量近似相等。认为每次实验时气室内16O的含量保持不变。
使用GC-MS定量分析之前,首先需使用标准气体对目标产物(CO2、SO2、SOF2、SO2F2、SOF4)进行标定,确定目标产物的保留时间,如表1所示。

表1 特征分解组分的保留时间及质荷比参数Tab.1 Retention time and mass-to-charge ratio of characteristic decomposition components
设置GC-MS的柱箱温度为32℃,进样口温度为200℃,分流进样,分流比设置为10∶1。利用GCMS对不同质荷比的离子碎片的分离作用,可以识别出同种物质的不同同位素物质。例如,C16O2的特征离子碎片的质荷比为44,而C18O2的特征离子碎片的质荷比为48,这是由于其分子中包含了两个18O原子。通过GC-MS的分离作用,可以检测不同同位素化合物的相对含量。
2 结果与分析
CO2含有两个氧原子,理想情况下反应生成的CO2都应该以C18O2的形式存在。但在实验室条件下难以实现绝对的真空。因此,实验罐体的气室内部依然不可避免地存在着一定含量的H2O和O2,自然条件下,18O的丰度仅为0.3%,因此H2O和O2所含的氧原子可近似地视为都是16O。实验充入的18O2和气室残留的H216O、16O2作为部分反应物,与气室内部的含碳元素的部件发生反应,生成CO2气体,并被18O原子标记,CO2含量的变化规律如图2所示。在气体绝缘设备中,这些碳原子可能来自于固体绝缘材料和含碳金属导体部件的表面。具体的反应过程如式(1)~(2)所示。
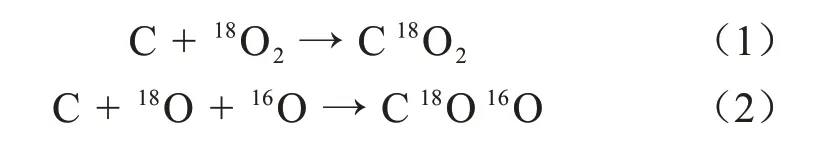
从图2可以看出,随着实验中加入的18O2含量增加,生成的被标记的CO2的体积分数也明显增大,并在18O2含量为300~400 mL的区间内有最大的增幅,CO2的体积分数由360.2×10-6增大到1408.8×10-6,增长率高达291.1%,说明高含量下的18O2与罐体内部的含碳部件接触更加充分,反应更为剧烈,在同样的温度和反应时间下,CO2生成量增加了2倍以上。另外,当18O2含量较低时,生成量较小,仅有62.3×10-6。这可能是由于O2优先与其他物质发生反应,而CO2是在反应后期生成的。

图2 标记的CO2随18O2含量的变化规律Fig.2 Content of labelled CO2 with content of 18O2
对气体绝缘设备进行故障监测时,CO2可以作为辅助参考的特征气体,虽然CO2并不直接来自于氟硫化物的反应,但是其含量也与设备内部的温度、杂质(尤其是空气)有密切的关系。当设备内部出现局部热点时,CO2含量会不断增加,如图2所示,当其含量较高时,可能同时伴随设备内部空气含量超标等问题。
图3是标记的SO2F2随18O2含量的变化规律。从图3可以看出,SO2F2的生成量与CO2接近。充入100 mL的18O2时,生成的SO2F2仅有10.4×10-6。200 mL与300 mL的18O2下SO2F2的生成量较为接近,在400×10-6左右。当18O2含量达到400 mL时,SO2F2含量达到1385×10-6。

图3 标记的SO2F2随18O2含量的变化规律Fig.3 Content of labelled SO2F2 with content of 18O2
SO2F2是SF6发生分解的重要产物。由于其性质稳定,被视为表征设备故障的重要特征气体。研究认为,SO2F2来自氟硫化物SFx与H2O的反应[20]。反应过程如式(3)~(5)所示。

图3直观地证明了SO2F2可以由氟硫化物SFx与O2反应生成[21]。根据图3的含量变化规律,在18O2低含量时SO2F2生成量增加不明显(200~300 mL),而300 mL之后出现大幅增加。可能的原因为18O2在400℃条件下发生裂解产生大量18O原子的难度较大,需要吸收较多的能量[22]。因此,只有当18O2含量增加到一定程度时,设备内部温度最高点附近具有足够的18O2与低氟硫化物分子充分碰撞、反应,从而生成被标记的SO2F2,含量出现大幅增加。在高温区域,一部分18O2和H216O、16O2都可能发生裂解,并产生单个的18O或16O原子,这些处于活跃状态的原子迅速与低氟硫化物结合并生成稳定的反应产物SO2F2。反应过程如式(6)~(7)所示。

图4为被标记的SOF2含量的变化情况。从图4可以 看出,相比于CO2和SO2F2两 种产物,SOF2在低18O2含量的条件下,具有最高的含量为357.4×10-6。并且随着18O2含量增加,其含量也有显著的增长。在18O2充入量达到400 mL时,S18OF2的体积分数达 到最 大值(5531.5×10-6),显著 高于CO2与SO2F2。结果表明O2是生成SOF2的反应的重要反应物,且O2与氟硫化物生成SOF2的反应优先级较高。即在含量不充足时,O2首先与氟硫化物反应生成SOF2,优先于SO2F2。

图4 标记的SOF2随18O2含量的变化规律Fig.4 Content of labelled SOF2 with content of 18O2
分析SOF2的生成过程,主要来自SF2与O2的反应。但是如前所述,SF2也可以与O2直接发生合成反应,生成SO2F2。实验结果显示SO2F2的含量低于SOF2,可能的原因是SF、SF2、SF3可以各自与O2发生反应,分别如式(8)~(10)所示。

其中,SOF和SOF3两种物质化学性质较为不稳定,SOF容易与气室内部由于SF6裂解等反应产生的活性F原子结合,生成相对稳定的SOF2;而SOF3也容易脱去一个F原子而生成SOF2。另外,反应生成的活性O原子易于再次与氟硫化物发生以上反应,从而促进式(8)~(10)反应向正方向发展;总体反应过程可以理解为低氟硫化物(SF、SF2、SF3)与O2分子的反应,如式(11)所示。实验结果验证了O2在SOF2生成过程中的重要作用,在已有研究的基础上,证明SOF2不止来自SF4与H2O的反应,也来自于低氟硫化物SF、SF2、SF3与O2的反应。当18O2用量为400 mL时,根据图1~4可以看到,SO2的含量最高,而SOF2的含量在主要含氧产物中位于第二位,说明O2对其生成的贡献程度较大。当环境内O2为主要杂质时,可以与低氟硫化物反应生成大量的SOF2。

此外,SOF2化学性质较为稳定,但遇水容易发生液化,生成SO2和HF,如式(12)所示。该反应也被视为SO2的主导生成路径[17,21]。

图5是被标记的SO2含量的变化情况。从图5可以看出,SO2生成量较大,随18O2充入量的增加不断大幅增长。当18O2用量为400 mL时,被标记的SO2最多达到了17605.7×10-6,是CO2、SO2F2、SOF2、SO2这4种气体中产量最多的。

图5 标记的SO2随18O2含量的变化规律Fig.5 Content of labelled SO2 with content of 18O2
比较图4和图5可以看出,SO2生成量远高于SOF2。实验通过步骤①、②重复的充气、抽真空以及静置的操作,已在很大程度上控制了气室内残留水分的含量。通过精密露点仪的实际测量,只充入SF6气体至0.2 MPa时,气室内部的微量水分含量低于45×10-6,符合SF6新气标准的要求[23]。因此,气室内的残留水分极其有限,仅为痕量级水平,实验后产生的大量SO2并非来自于SOF2的水解,即反应(12)。
根据反应机理分析,S18O2和S18O16O的生成来自SF或S单质与O原子的反应,如式(13)~(15)。

首先,结果证明了较多的SF6分子在高温和氧气的作用下,已完成连续的分解反应SFx→SFx-1+F,并最终生成S单质。另外,结果说明SO2不止来自SOF2的水解反应,O2与S的反应也具有重要贡献。
3 结论
(1)检测到了被标记的4种含氧产物CO2、SO2F2、SOF2、SO2,并 且 含 两 个O原 子 的 产 物 既有-18O2-的存在形式,也有-18O16O-的存在形式。说明氧气可以直接参与4种产物的生成过程,并且在局部过热故障的作用下已裂解生成两个O原子,可以单独参与反应。
(2)CO2主要来自于核心高温区域O2或O原子与C的反应;实验结果证明SO2F2可以从O2获得两个O原子,反应路径是SF2+O2→SO2F2,但是该反应并非主要路径,即SO2F2获得氧元素的主要来源不是O2。
(3)S18OF2生成量大,说明大量18O2参与其生成过程。根据实验结果总结其生成路径为2SF2+O2→2SOF2,反应机制为在O2含量不充足时,两个SF2分子各获得一个O原子,加速氧气分子化学键断裂。从产物含量占比和O2的促进作用方面分析,该反应是SOF2的重要生成路径。
(4)S18O2和S18O16O的大量生成说明在实验的过热故障条件下,部分SF6分子发生彻底的分解,并生成S单质。在O2的作用下,SO2主要来自于S单质或SF分子与O2的直接反应,可以视为SF6局部过热故障下最重要的分解产物。

