液相色谱—柱后衍生法测定苹果中5种氨基甲酸酯类农药残留量的不确定性评定
余 星 常 薇 王咏麟 姚 曾
(四川省轻工业研究设计院有限公司,四川 成都 610084)
氨基甲酸酯类农药作为一类新兴的合成农药,相比于传统的有机磷类农药,因出色的高效性和低残留性已被广泛应用于农业生产中[1-2]。虽然氨基甲酸酯类农药具有刺激农作物生长作用,但同时也具有很强的毒性。因此,GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》对氨基甲酸酯类农药在不同蔬菜中的限量进行了相应的规定。研究拟依据NY/T 761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》测定苹果中氨基甲酸酯类残留量的测量不确定度进行分析和评定,并结合JJF 1059.1—2012《测量不确定度评定与表示》的要求,对苹果中5种氨基甲酸酯类农药检测结果的准确度进行分析,确定检测过程中引入不确定度的主要影响因素,为液相色谱法测定苹果中氨基甲酸酯类农药残留量的不确定度评定提供依据。
1 材料与方法
1.1 试验材料与试剂
苹果:2021年攀枝花市东区食品安全抽检样品;
克百威、灭多威、3-羟基克百威、涕灭威、异丙威标准物质:100.0 μg/mL,曼哈格科技有限公司;
甲醇(纯度为99.9%)、乙腈(纯度为99.9%)、二氯甲烷(纯度为99.9%):色谱级,成都市时联贸易有限公司;
NaOH:优级纯,广州得翔科技有限公司;
邻苯二甲醛:99%,德国CNW 科技公司;
OPA稀释溶液:分析纯,广州得翔科技有限公司;
巯基乙醇:分析纯,上海安谱实验科技股份有限公司;
氨基固相萃取小柱:北京振翔科技有限公司;
实验室用水均为一级水。
1.2 仪器与设备
液相色谱仪:LC-20AT型,日本岛津(Shimadzu)公司;
高速分散均质机:FJ200型,上海标本模型厂;
高速离心机:TGL-16C型,上海安亭科学仪器厂;
氮吹仪:UGC-45CE型,北京优晟联合科技有限公司;
百分之一电子分析天平:JJ1000型,常熟市双杰测试仪器厂;
超声波清洗仪:PS-20型,深圳市洁康洗净电器有限公司。
1.3 色谱条件
色谱柱为Shimadzu C18(4.6 mm×250 mm,5 μm);RF-20A荧光检测器;进样体积10 μL; 检测波长λex330 nm,λem465 nm;流速1.0 mL/min;运行时间27 min;柱温42 ℃;流动相为甲醇—水;反应器温度80 ℃;柱后衍生试剂流速0.3 mL/min。
1.4 试验方法
称取25.00 g样品于匀浆机中,加入50 mL乙腈,高速匀浆2 min,过滤,滤液移至装有7.0 g氯化钠的100 mL 量筒中,收集50 mL滤液,手动剧烈振荡2 min,静置30 min,移取上层乙腈溶液10.00 mL,80 ℃水浴氮吹至近干,用2.0 mL甲醇—二氯甲烷(V甲醇∶V二氯甲烷为1∶99)溶解残渣。净化时先用4.0 mL甲醇—二氯甲烷(V甲醇∶V二氯甲烷为1∶99)活化氨基柱,收集洗脱液,用2.0 mL 甲醇—二氯甲烷(V甲醇∶V二氯甲烷为1∶99)溶解残渣并过柱,重复一次,50 ℃水浴氮气吹干,甲醇定容。过0.2 μm滤膜,上机待测。
2 结果分析
2.1 公式计算
按式(1)计算5种氨基甲酸酯类农药在水果中的残留量。
(1)
式中:
X——样品中被测组分含量,mg/kg;
C——标准溶液中被测组分质量浓度,mg/L;
V1——提取溶剂总体积,mL;
V2——提取液分取体积,mL;
V3——待测溶液定容体积,mL;
f——待测溶液的稀释系数;
m——实样质量,g。
2.2 不确定度的来源
测定苹果中氨基甲酸酯类农药结果的不确定度来源于4个方面:标准物质、检测仪器、样品前处理过程和试验结果分析。
3 不确定度评价
3.1 标准品引入的不确定度



3.1.3 环境温度对容量瓶和移液管量取溶液时引入的不确定度 实验室温度为(20±5) ℃,经查表,乙腈膨胀系数为1.37×10-3℃-1,玻璃器皿膨胀系数为2.50×10-5℃-1[3],乙腈膨胀系数远大于玻璃器皿膨胀系数,因此只对温度影响乙腈的膨胀系数结果进行计算处理,则温度对玻璃器皿移取溶剂时引入的不确定度为:

3.1.4 标准曲线拟合引入的不确定度 克百威、灭多威、3-羟基克百威、涕灭威、异丙威均采取最小二乘法拟合标准溶液质量浓度—色谱峰面积曲线[4-5],其中标准曲线方程以浓度为横坐标,峰面积为纵坐标,在0.050 0~1.000 0 μg/mL 质量浓度范围内呈良好的线性关系,克百威、灭多威、3-羟基克百威、涕灭威及异丙威的标准曲线线性回归方程分别为:
Y1=1 023 884.32X1+2 664.21(R2=0.999 9);Y2=2 085 714.22X2+8 298.33(R2=0.999 9);Y3=1 147 173.09X3-3 270.91(R2=0.999 9);Y4=1 034 606.75X4+8 817.64(R2=0.999 9);Y5=1 432 506.14X5+7 206.70(R2=0.999 9)。
标准曲线拟合时的不确定度分别按式(2)~式(4)计算。
(2)
(3)

(4)
式中:
S——残差标准偏差;
B——斜率;
n——标准溶液浓度测定的总次数;
Cx——样品的平均质量浓度,μg/mL;
Ci——标准的质量浓度,μg/mL;

p——测定样品总次数;
yi——第i次测得的峰面积;
a——曲线截距;
b——曲线斜率。
根据式(2)~式(4)计算出克百威、灭多威、3-羟基克百威、涕灭威以及异丙威的相对标准不确定度Urel(曲)分别为0.002 5,0.017,0.015,0.026,0.022。克百威标准物品引入的总相对不确定度

同理,灭多威、3-羟基克百威、涕灭威和异丙威标准物品引入的相对不确定度分别为0.024,0.022,0.031,0.027。
3.2 检测仪器的不确定度
3.2.1 仪器校准引入的不确定度 根据仪器中的检定信息,其定量重复误差RSD为0.13%(n=6),则:

3.2.2 仪器的重复性引入的不确定度 在重复检测样品过程中,所测的样品峰面积存在不同差异,采用标准不确定度的A类评定,将5种氨基甲酸酯类农药标准物质均配制为质量浓度1.00 μg/mL,分别重复检测6 次,测定结果见表1。

表1 5种氨基甲酸酯类农药重复进样结果
依据JJF 1059.1—2012《测量不确定度评定与表示》,进样6次,查“极差系数C及自由度V”表,极差系数C=2.53,S为6次检测峰面积的平均值,克百威的标准不确定度为:
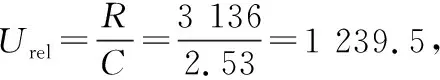
同理,灭多威、3-羟基克百威、涕灭威、异丙威的相对标准不确定度Urel分别为0.000 77,0.001 1,0.001 1,0.000 95。因此克百威、灭多威、3-羟基克百威、涕灭威、异丙威引入的相对不确定度分别为0.001 2,0.000 77,0.001 1,0.001 1,0.000 95。
3.3 样品前处理引入的不确定度

3.3.2 样品前处理使用相关玻璃器皿引入的不确定度
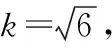

3.3.3 环境温度对容量瓶与移液管量取溶液时引入的不确定度 参考3.1.3结果,温度对玻璃器皿移取溶剂时引入的不确定度为:


3.4 试验结果分析引入的不确定度
样品加标回收是试验结果分析中不确定度的主要因素,根据GB/T 27404—2008《实验室质量控制规范 食品理化检测》,当被测组分含量<0.1 mg/kg时,回收率允许范围为60%~120%,当被测组分含量为0.1~1.0 mg/kg时,回收率允许范围为80%~110%,试验采取0.025 0,0.050 0,0.100 0 mg/kg 3个质量浓度作为质控样,回收率均在80%~110%,符合国标要求。其中每个质量浓度设6次重复试验,结果见表2和表3。

表2 样品加标试验结果
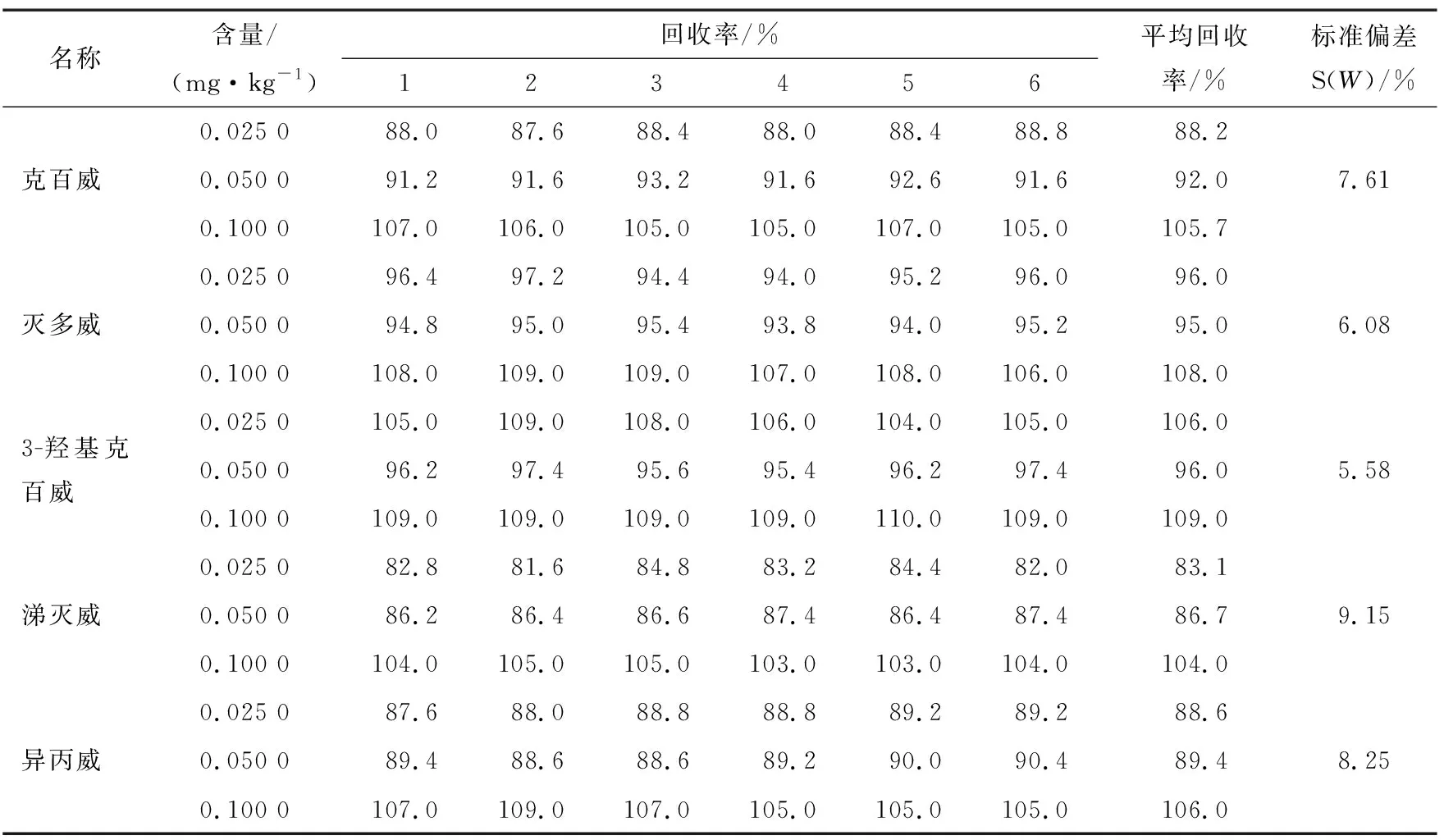
表3 加标回收率试验结果
根据JJF 1059.1—2012《测量不确定度评定与表示》,采用标准不确定度的A类评定贝塞尔公式计算回收率[6-7],则5种氨基甲酸酯类农药回收率引入的相对不确定度分别为:
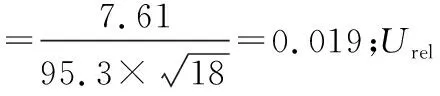
3.5 相对合成标准不确定度
克百威、灭多威、3-羟基克百威、涕灭威、异丙威的相对合成标准不确定度为:
(5)
即5种氨基甲酸酯类农药合成的相对合成不确定度分别为0.037,0.029,0.027,0.040,0.036。
3.6 合成标准不确定度
在相同的试验条件下, 采用苹果阴性样品,加入加标量为0.100 mg/kg的5种氨基甲酸酯类农药混标,重复进行6次试验,其色谱图见图1,结果见表4。
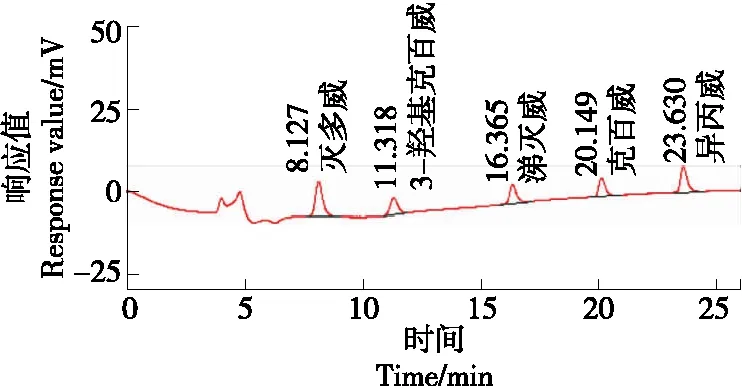
图1 5 种氨基甲酸酯类农药在苹果中的色谱图
由表4可知,苹果中重复测定的克百威、灭多威、3-羟基克百威、涕灭威、异丙威含量分别为0.105 7,0.107 7,0.109 2,0.103 9,0.106 1 mg/kg,其合成标准不确定度Urel(合)分别为0.003 9,0.003 1,0.002 9,0.004 2,0.003 8 mg/kg。

表4 苹果中添加5种氨基甲酸酯类农药的测定值
3.7 扩展不确定度
在95%置信水平下,取包含因子k为2,计算得到的扩展不确定度U扩展=Urel(合)×k,结果分别为0.007 8,0.006 2,0.005 8,0.008 4,0.007 6 mg/kg。
4 结论
通过高效液相色谱—柱后衍生法分析测定了苹果中5种氨基甲酸酯类农药的不确定度。结果表明,影响不确定度的主要因素为标准物质,其次为样品回收率和样品前处理以及检测仪器,具体表现为Urel(标准)>Urel(回收率)>Urel(前处理)>Urel(仪器)。因此,在测定过程中需要用高精密校准的量具和标准物质,优化检测分析方法,如控制前处理过程和仪器方法等,减小由标准物质、回收率、前处理以及仪器引入的不确定度,提高数据的准确性[8]。后续可以采用QuEChERS方法进行前处理[9],优化前处理过程,减少溶剂的消耗,保证结果的准确性。

