阿帕他胺治疗中国前列腺癌患者真实世界的临床观察
姜婧琦,贺大林,李 磊,秦卫军,种 铁,杨增悦,文 彬,陈 鹏,李恒平,周逢海,尹永生,张 波,王玉杰0,程永毅,李 军,王志平
(1.兰州大学第二医院泌尿外科,甘肃省泌尿系疾病研究重点实验室,甘肃兰州 730000;2.西安交通大学医学院第一附属医院泌尿外科,陕西西安 710000;3.空军军医大学西京医院泌尿外科,陕西西安 710000;4.西安交通大学医学院第二附属医院泌尿外科,陕西西安 710000;5.西安国际医学中心泌尿外科,陕西西安 710000;6.新疆维吾尔自治区人民医院泌尿外科,新疆乌鲁木齐 830000;7.新疆医科大学附属肿瘤医院泌尿外科,新疆乌鲁木齐 830000;8.甘肃省人民医院泌尿外科,甘肃兰州 730000;9.空军军医大学唐都医院泌尿外科,陕西西安 710000;10.新疆医科大学第一附属医院泌尿外科,新疆乌鲁木齐 830000;11.陕西省人民医院泌尿外科,陕西西安 710000;12.甘肃省肿瘤医院泌尿外科,甘肃兰州 730000)
前列腺癌(prostate cancer, PCa)作为男性第二大常见癌症和第五大癌症死因,影响着全球数百万男性的生命健康[1]。目前PCa位于中国男性泌尿生殖系统恶性肿瘤发病第一位,其死亡率也呈明显上升趋势[2-4]。PCa通常为雄激素依赖性,以手术与药物去势为主要治疗方式[5]。但几乎所有PCa都会发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),使得去势治疗失去原有的效果[6],通过雄激素受体(androgen receptor, AR)抑制剂阻断激动剂与AR结合是一种行之有效的新策略。从传统的氟他胺(flutamide)、比卡鲁胺(bicalutamide)到现在的恩扎卢胺(enzalutamide)、阿帕他胺(apalutamide)等,AR拮抗剂的功效一直在不断提高[7]。阿帕他胺作为一种选择性、竞争性新型非甾体AR抑制剂,其可以竞争性结合AR,阻止AR复合物进入细胞核,抑制AR与DNA结合,阻断AR介导的基因转录,具有完全AR拮抗剂活性[8]。国外TITAN和SPARTAN三期临床试验均证明了阿帕他胺联合雄激素剥夺治疗(androgen deprivation therapy, ADT)能给PCa患者带来更大的生存获益[9-11]。然而目前尚没有关于阿帕他胺在中国真实世界治疗效果的数据发表。因此, 我们设计了一项回顾性真实世界研究,首次对中国西北地区PCa患者使用阿帕他胺治疗前后体内前列腺特异性抗原(prostate specific antigen,PSA)水平的动态变化及影像学变化进行评估,旨在为阿帕他胺的临床疗效和PCa患者内分泌治疗药物的选择上提供数据参考。
1 资料与方法
1.1 临床资料纳入病例为中国西北多中心20家三甲医院泌尿外科2020年4月-2021年10月期间使用阿帕他胺联合ADT治疗的经组织病理学确诊的前列腺腺癌患者,需满足:①年龄≥18周岁;②ECOG评分0或1;③重要器官功能符合下列要求:肌酐清除率>40 mL/min,Child-Pugh肝功能分级A级或B级。排除标准:①严重心绞痛、心肌梗死、心力衰竭等心脏疾病;②动脉或静脉血栓栓塞;③癫痫发作病史。本研究符合《赫尔辛基宣言》原则,并通过了医院伦理委员会批准,项目编号为2022A-101。
1.2 治疗方案患者均接受最大限度阻断雄激素治疗:手术/药物去势+抗雄激素治疗(阿帕他胺240 mg,每日1次口服)。
1.3 随访与观察指标收集的临床数据主要包括临床分期、Gleason评分、诊断时的疾病负担、内脏转移情况、骨转移情况、既往治疗方案、基线PSA水平、使用阿帕他胺后PSA水平、影像学、不良反应等。所有受试者在内分泌治疗前需完成包括血清PSA、血常规、肝肾功能、前列腺B超、前列腺核磁共振成像(magnetic resonance imaging,MRI)、骨扫描等基线检查。阿帕他胺治疗开始后每3个月检测1次血清PSA水平和睾酮浓度等, 每半年至少一次影像学(包括全身骨显像、盆腔电子计算机断层扫描(computed tomography,CT)或MRI,合并其他内脏转移时增加相应部位的CT或B超复查。其中PSA缓解[12]为治疗12周后,PSA值较基线值下降≥50%。并统计每次随访的PSA 50(PSA下降幅度≥50%)、PSA 90(PSA下降幅度≥90%)[13]及PSA下降至0.2 ng/mL及以下[14]的患者比例。
1.4 统计学方法采用SPSS25.0统计学软件分析处理数据,基线数据使用中位数(范围)比较,PSA水平为>100 ng/mL时按照100 ng/mL计算,PSA应答率用百分数表述患者比例。
2 结 果
2.1 各组患者基线资料截止至文章撰写时(2022-03-04)中国西北地区多中心使用阿帕他胺治疗符合纳入标准的PCa患者共37例(只有1次随访数据的患者也可纳入研究),包括局限PCa患者5例(中位年龄67岁,中位基线PSA 91.23 ng/mL),转移性激素敏感性前列腺癌(metastatic hormone-sensitive prostate cancer,mHSPC)患者17例(中位年龄73岁,中位基线PSA>100 ng/mL),非转移性去势抵抗性前列腺癌(nonmetastatic castration-resistant prostate cancer,nmCRPC)患者1例(年龄81岁,基线PSA>100 ng/mL),转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)14例(中位年龄75岁,中位基线PSA30.5 ng/mL)。88.9%的患者Gleason 评分为 8 分及以上(32/36,缺失1例数据),近一半患者伴随其他疾病(表1)。
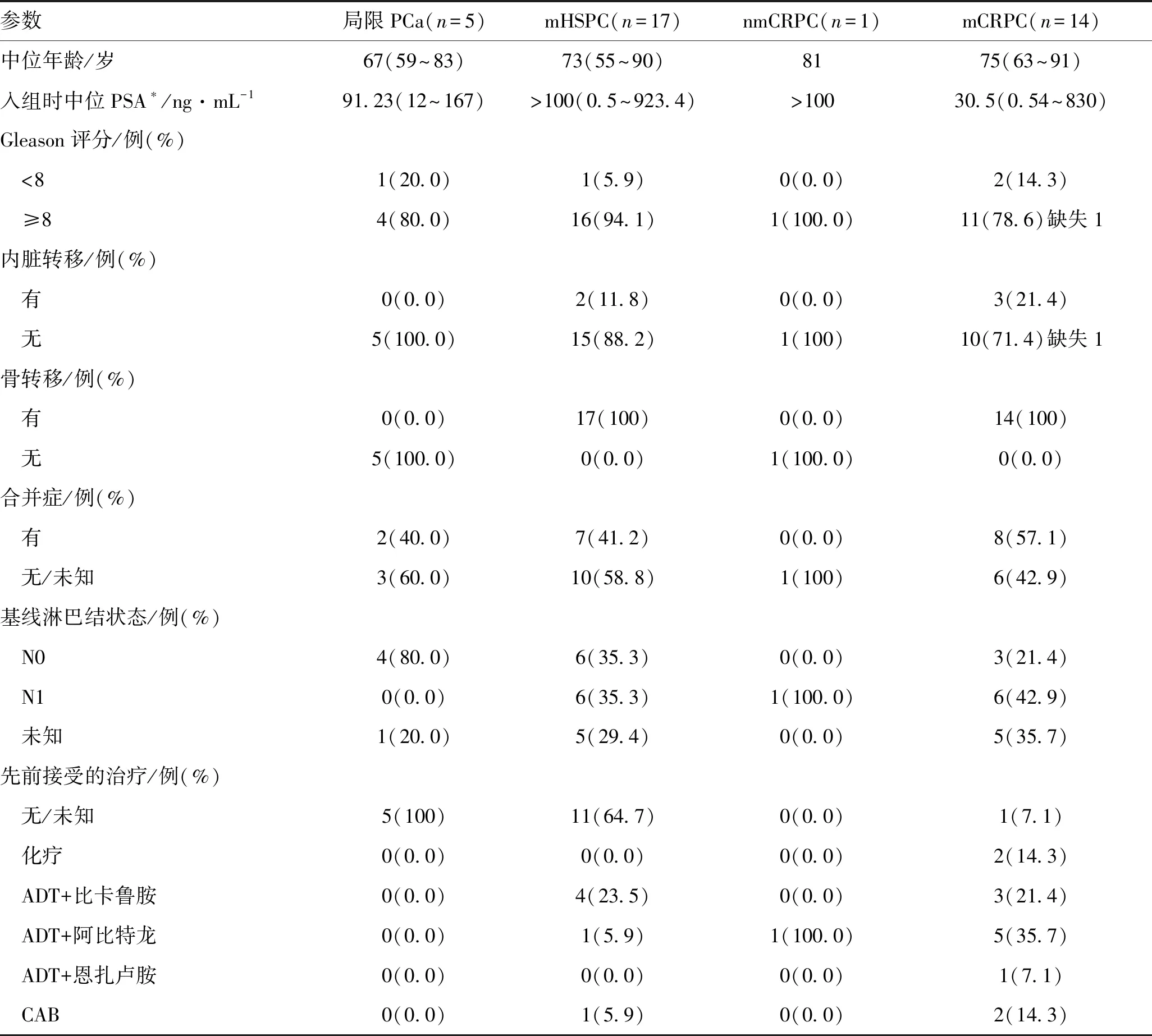
表1 中国西北多中心三甲医院使用阿帕他胺治疗的37例PCa患者基线资料
2.2 阿帕他胺治疗后患者PSA反应率本研究37例患者使用阿帕他胺1月后,有26例(70.3%)患者PSA相比基线下降≥50%, 15例(40.5%)PSA相比基线下降≥90%,4例(10.8%)PSA≤0.2 ng/mL。其中局限PCa、mHSPC和mCRPC患者PSA 50的占比分别为100%、94.1%和35.7%, PSA 90的占比分别为40%、70.6%和7.1%(图1A)。
共有30例患者有3个月的完整随访资料。24例(80%)PCa患者在使用阿帕他胺后PSA相比基线下降≥50%,可以被认为达到PSA缓解。20例(66.7%)PSA相比基线下降≥90%,10例(33.3%)PSA≤0.2 ng/mL。其中局限PCa、mHSPC和mCRPC患者PSA 50的占比分别为100%、100%和45.5%,PSA 90的占比分别为100%、92.3%和27.3%(图1B)。
共有15例患者有6个月的随访资料。11例(73.3%)PCa患者在使用阿帕他胺后PSA相比基线下降≥50%,9例(60%)PSA相比基线下降≥90.0%,10例(66.7%)PSA≤0.2 ng/mL。其中局限PCa和mHSPC患者PSA水平全部下降至0.2 ng/mL以下(图1C)。1例mHSPC患者PSA已经降至0.2 ng/mL,然而因其基线PSA较低(0.67 ng/mL),所以PSA下降幅度未达到90%。
2.3 阿帕他胺治疗后患者影像学反应mHSPC中共9例患者有影像学随访结果,8例(88.9%)在治疗3个月后的骨转移灶显著减少。mCRPC中共4例患者有影像学随访结果,1例(25%)在治疗6个月后的骨转移减少。
3 讨 论
以ADT为基础联合以AR为靶点的药物治疗是目前PCa治疗的新思路。传统的AR靶向抑制剂不能抑制肾上腺及瘤内来源的雄激素的作用,且当肿瘤微环境适应了更低的雄激素水平,反而会促进肿瘤进展。因此新型AR靶向药物的研发使用逐渐成为临床治疗PCa的热点[15-16]。与传统抗雄药物相比,阿帕他胺在药代动力学和作用功效方面针对抑制AR转录和PCa细胞增殖进行了优化,不仅与AR结合的亲和力较比卡鲁胺高7~10倍,具有更强的抗肿瘤活性,而且避免了长期治疗后由抑制剂转为激动剂的缺点[17]。
在新型内分泌治疗药物中阿帕他胺同样存在优势。MORI等[18]通过网状Meta法对mHSPC患者的药物治疗进行分析,发现患者对阿帕他胺的耐受性最好,且新型内分泌药物都比多西他赛更有效。与治疗剂量的恩扎卢胺相比,阿帕他胺的稳态血浆浓度和大脑药物水平均较低,癫痫发作的不良事件较少,安全性更强[19]。而达罗他胺的体内药动学参数较阿帕他胺差,其适宜口服剂量为每日1 200 mg,是阿帕他胺的5倍[20]。与阿比特龙对比,阿帕他胺使用时无需与类固醇类激素共同给药,减少了激素引起的潜在副作用。ACIS三期临床研究还证明阿比特龙联用阿帕他胺可以延长晚期PCa患者的放射学无进展生存期(radiographic progression-free survival,rPFS)[21]。
目前尚缺乏阿帕他胺治疗中国PCa患者的效果和相关影响因素的数据,潜在生存获益的证据大多基于循证医学研究。因此我们建立了基于中国西北临床随访数据库的PCa诊治和研究体系,首次对中国西北地区PCa患者使用阿帕他胺治疗前后体内PSA水平的动态变化及影像学变化进行评估,为个体化治疗提供依据。根据目前的随访数据,我们的真实世界研究与TITAN三期研究对比,患者中位年龄(73岁vs.69岁)和中位基线PSA水平(>100 ng/mLvs.5.97ng/mL)均较高,大多数Gleason评分≥8,符合我国目前mHSPC患者的 “三高”普遍现象(Gleason评分高、PSA高、分期晚)[22]。有学者研究结果显示,阿帕他胺组治疗mHSPC患者的PSA缓解率显著优于安慰剂组[9],我们的研究结果显示mHSPC使用阿帕他胺后第3个月随访达到PSA 50、PSA 90及PSA≤0.2 ng/mL的患者分别有13例(100%)、12例(92.3%)和7例(53.8%),符合该学者研究中阿帕他胺组第3个月随访89%、58%和51%的数据。第6个月随访达到PSA 50、PSA 90及PSA≤0.2 ng/mL的mHSPC患者分别有8例(100%)、7例(87.5%)和8例(100%),同样符合TITAN研究中阿帕他胺组第6个月随访90%、67%和61%的数据。在降幅方面,我们的研究从基线开始的最大降幅的中位数为99.67%(n=17),符合TITAN研究97.74%(n=525)的结果。
mCRPC由于其去势抵抗性一直是晚期PCa患者需要克服的致命难题。根据日本研究人员对阿帕他胺治疗mCRPC的临床研究结果发现,mCRPC患者(n=6)在使用阿帕他胺联合ADT治疗3个月后PSA水平有明显下降,4例(66.7%)患者达到PSA 50,2例(33.3%)患者达到PSA 90[23]。在我们的研究中发现mCRPC患者在阿帕他胺治疗3个月后达到PSA 50和PSA 90的患者分别有5例(45.5%)和3例(27.3%)。可见阿帕他胺对mCRPC患者的治疗也有积极的前景。
SPARTAN及TITAN研究中最常见(≥10%)且阿帕他胺组发生率更高的不良反应为疲乏、关节痛、皮疹、食欲下降、跌倒、体重降低等[9-11]。在我们的研究中服用阿帕他胺的患者总体耐受性较好,部分患者出现皮疹、乏力、易跌倒等不良反应,均为1~2级,给予对症治疗或不治疗后症状消失,对患者的生活无重大影响。目前尚无3级及以上重大不良反应反馈。
本研究结果初步显示,中国西北PCa患者绝大多数能够从阿帕他胺联合ADT的治疗中获益。本研究的局限性之一是虽然它是一项多中心回顾性临床研究,但是目前病例数少,随访时间短,可能存在病例偏倚。疾病因素(如 Gleason 评分、疾病负担等的存在)可能是影响结果的关键区分机制,需要我们接下来的进一步分层分析。
综上所述,阿帕他胺联合ADT治疗PCa患者效果确切,PSA反应率与国外三期临床研究一致,有较高的PSA缓解率。我们会继续随访观察阿帕他胺联合ADT治疗PCa患者的生存获益,期待进一步的真实世界随访结果支持和改进PCa内分泌治疗领域的临床实践。

