不同浓度N 营养条件对水稻生长发育和C、N 代谢的影响
蒋欣瑜,胡晓渝,吕 蔺,胡秋涛,魏涵天,林新春,许永汉*
(1. 安徽农业大学农学院,合肥 230036;2. 浙江农林大学林业与生物技术学院,杭州 311300)
氮是作物生长发育必需的大量营养元素,增施化学氮肥,是作物生产采取的主要增产措施之一。然而,近20 年来,我国作物氮施用量逐年升高,氮素利用效率趋于下降,而带来的环境污染则趋于加重[1]。因此,提高氮素利用率,降低其对环境的负面影响,在提高作物产量的同时兼顾生态效益,是当前我国土壤氮素研究的指导思想[1-2]。研究土壤中氮素营养吸收和转化过程,明确其对植株生长影响效果的规律及分子机制,对于合理施用氮肥及保护生态环境具有重要意义。
植株内C、N 代谢贯穿整个生育期。前人研究表明,不同浓度的N 肥对水稻植株生长发育和C、N 有显著差异,但对于不同浓度的N 营养在全生育期内施于水稻时,其植株生长发育和C、N 代谢如何响应还没有系统报道。鉴于此,作者用含有不同浓度N 营养的培养液对水稻进行全生育期水培,分析水稻植株农艺性状、糖代谢(C 代谢)和氨基酸代谢(N 代谢)状态、色素合成代谢和N 转运和代谢关键基因的表达响应,以期为水稻生理代谢分子机制和指导作物施肥提供理论基础。
1 材料与方法
1.1 水稻全生育期培养条件
所有水稻均在生长箱培养(Thermoline Scientific Equipment Pty. Ltd, Smithfield, Australia)。昼/夜光暗时间(光/暗条件)比例为13 h/11 h,光照时间为6:00 到19:00,光照强度为400 μmol·m-2·s-1。昼/夜温度条件为25 ℃/20 ℃;培养箱维持70%的相对湿度。
水稻基本培养液采用国际水稻所标准配方(IRRI nutrient solution):1.25 mmol·L-1NH4NO3,0.3 mmol·L-1KH2PO4, 0.35 mmol·L-1K2SO4, 1 mmol·L-1CaCl2.2H2O, 1 mmol·L-1MgSO4·7H2O, 0.5 mmol·L-1Na2SiO3, 20 μmol·L-1NaFeEDTA, 20 μmol·L-1H3BO3, 9 μmol·L-1MnCl2·4H2O, 0.32 μmol·L-1CuSO4·5H2O, 0.77 μmol·L-1ZnSO4·7H2O和0.39 μmol·L-1Na2MoO4·2H2O, pH 5.5。苗期水培营养液每4~5 d 更换1 次,孕穗期开始每3 d 更换1 次。为了抑制硝化作用,营养液添加7 μmol·L-1dicyandiamide (DCDC2H4N4)。
1.2 N 营养配方
N 营养4 种浓度分别为0.05、0.5、2 和5 mmol·L-1, 用NH4NO3作为N 营养源,确保硝态氮(NO3+):氨态氮(NH4+)= 1:1。
1.3 3 种主要的可溶性糖含量测定
水稻材料在拔节期开始时取样。所有水稻植株材料取样后迅速经105 ℃高温杀青0.5 h,再经80 ℃烘12 h 。将干燥后的植株样品分成根、叶鞘、叶和茎4部分,磨碎。测定主要参照文献用高压液相色谱方法(high pressure liquid chromatography,HPLC)测定3种可溶性糖[3-4]。糖分提取操作规程稍作如下改动:取磨碎后的样品0.1 g放入5 mL离心管,加2 mL蒸馏水,80 ℃水浴提取10 min,3 000 r·min-1离心5 min,上清液转入10 mL 具刻度试管或容量瓶中,剩余残渣继续以蒸馏水溶解离心2 次,确保可溶性糖提取充分。上清液均转入10 mL 试管中,定容,待测。
1.4 游离氨基酸含量测定
有常用的水合茚三酮法测定游离氨基酸的氨基可与水合茚三酮反应,产生蓝紫色化合物,其颜色的深浅与游离氨基酸的含量成正比。
1.5 色素含量测定
叶绿素的测定参照文献[5],步骤如下:取新鲜植物叶片或干材料,擦净表面污物,将叶片剪碎(去掉中脉,宽度1~2 mm),混匀,准确称取剪好的叶片0.100 g(重复3~5 次)分别放到试管中,准确加入95%乙醇(475 mL 无水乙醇定容到500 mL)20 mL, 塞紧试管塞,置暗处24 h(中间摇一次),然后在470 nm、649 nm 和665 nm 下比色。
由于叶绿体色素在不同溶剂中的吸收光谱有差异,因此,在使用其他溶剂提取色素时,计算公式也有所不同。叶绿素a、b 在95%乙醇中最大吸收峰的波长分别为665 nm 和649 nm,类胡萝卜素为470 nm,可据此列出以下关系式:
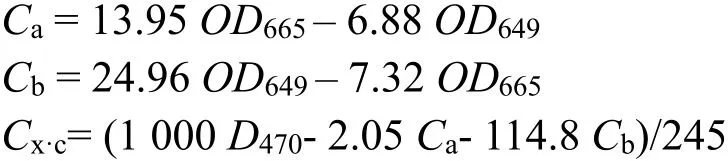
式中:Ca、Cb分别为叶绿素a 和b 的浓度;Cx·c为类胡萝卜素的总浓度;OD663、OD646和OD470分别为叶绿体色素提取液在波长663 nm、646 nm 和470 nm 下的光密度。
1.6 基因表达定量分析
用荧光实时定量PCR(quantitative real-time PCR,qRT-PCR)分析基因表达水平。首先用Rneasy kit(Qiagen)提取水稻各组织的总RNA,将至少2 mg总RNA 用RNase-free Dnase I(Invitrogen)消化DNA后,再用逆转录酶试剂盒(Promega)反转录得到cDNA。以OsACTIN2(Os05g36280)基因作内参,内参正向引物5´-GTCAATAACTGGGATGACATGGAG-3´和反向引物5´-AGCTTCATGTATGCCAGGAGATTC-3´[3]。其他所用仪器和试剂包括Real-time PCR Detection System (MyiQ Optical Module;Bio-Rad)和SYBR Green master mix(SYBR PremixEx TaqTMII;TaKaRa Biotechnology)。目标基因和OsACTIN2样品均一化稀释比例分别为1:10、1:100 和1:1 000[6]。
所有基因的表达实时定量PCR 所用引物见表1。

表1 实时定量PCR 引物Table 1 Primers for qRT-PCR
2 结果与分析
为了系统而准确地探究不同浓度外施N营养条件对水稻植株生长发育和C、N 代谢的影响效果,本研究选用常规粳稻品种日本晴作为水稻研究材料。在整个生育期均用营养液培养水稻植株材料。
从整个生长过程来看,在0.5 和2 mmol·L-1N营养条件下,水稻植株生长正常,生育期、株高、根系发育和分蘖数等性状均为正常状态,其中在2 mmol·L-1N 下,单株平均籽粒数(260 粒·株-1)相对最接近正常大田的产量(图 1(a)和(b))。高N 营养条件(5 mmol·L-1)下,株高、根系发育和结实率等性状均受到抑制,分蘖数显著增多,后期实粒数几乎为零,尽管整个植株的生物量较高;而低N营养条件(0.05 mmol·L-1)下,水稻植株株高和分蘖数等农艺性状均受到显著抑制,整个植株的生物量很低,后期虽然结实率不低,但总粒数和实粒数很少,平均每株实粒数只有5 粒左右(图 1(a)和(b))。随着N 浓度升高,叶片明显更绿,植株生育期明显延长,贪青状态也更突出(图 1(a)和(b))。
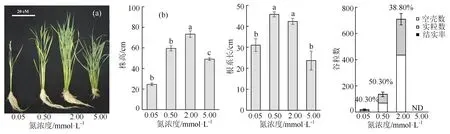
图1 4 种浓度N 营养处理后植株的性状表现Figure 1 Phenotype of rice plants under 4 kinds of N nutrition conditions
2.2 水稻植株内主要的可溶性糖含量和代谢分析
光合作用主要合成碳水化合物,这些碳同化产物是植株生长发育的物质和能量基础[3,7-8]。为了明确外施N肥对水稻植株光合碳同化合成代谢的影响效果,我们在水稻拔节后测定4 种浓度N 营养处理的水稻各组织3 种主要的可溶性糖含量。结果表明,葡萄糖和果糖在各组织中的含量与N 营养浓度没有显著相关性;而叶片和茎秆中蔗糖含量变化与N 营养浓度呈现明显的规律。正常浓度即0.5 和2 mmol·L-1N 营养条件下,水稻叶片内蔗糖含量比高浓度(即5 mmol·L-1)条件下均高出7 倍,茎秆内均高出2 倍左右;而在低浓度即0.05 mmol·L-1条件下,叶片和茎秆内蔗糖含量更低(图 2)。
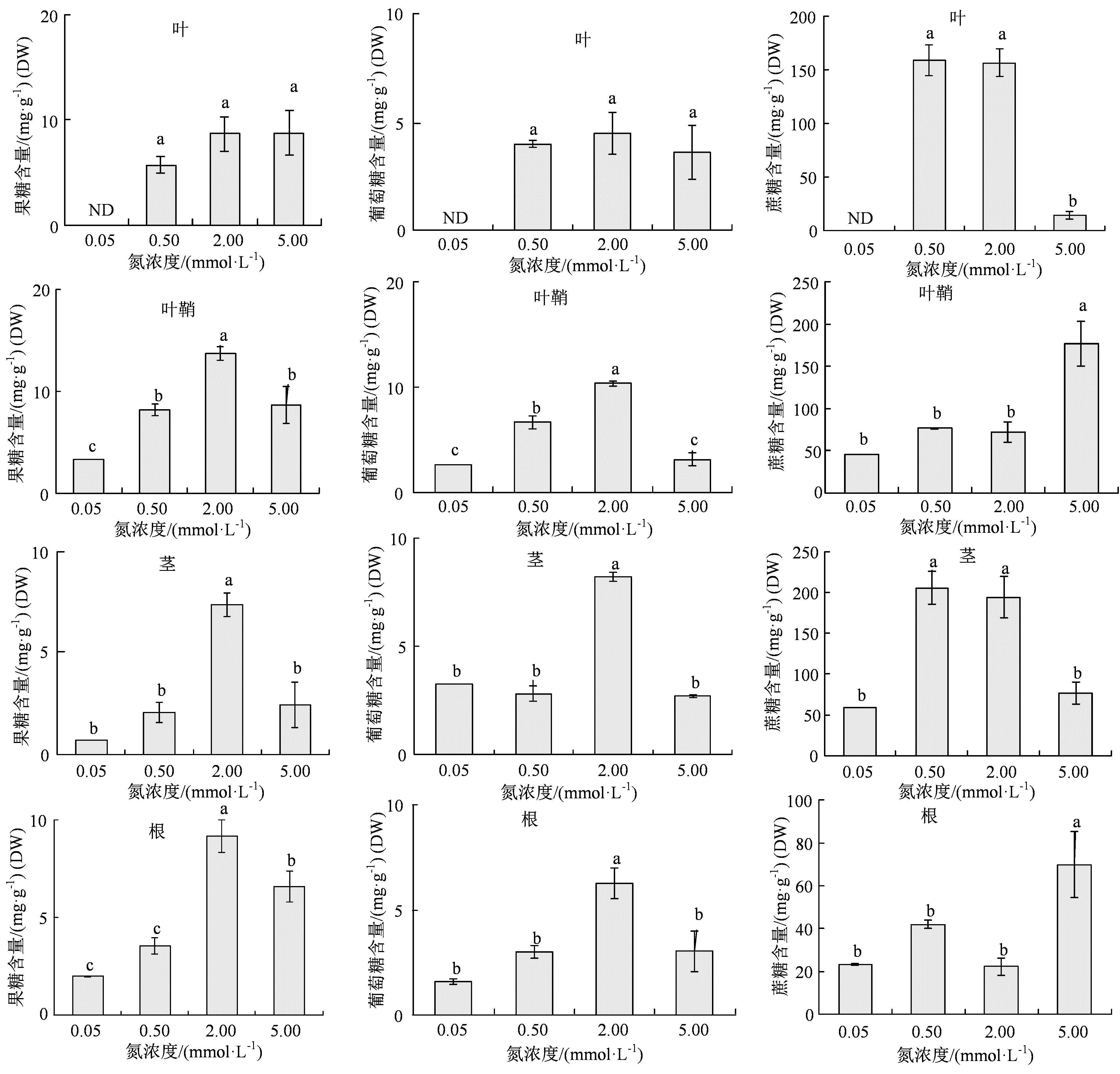
图2 4 种N 营养条件处理后水稻各组织内主要的可溶性糖含量Figure 2 Contents of major soluble sugars in the rice plants under 4 kinds of N nutrition conditions
蔗糖是光合作用最主要的产物,也是光合碳同化产物转运的最主要形式[3,7-8]。而叶片为光合作用主要场所,同时,茎秆是蔗糖长距离运输(long-distance transport of sucrose)主要通道,因此,叶片和茎秆中蔗糖含量变化基本上反映了光合作用合成代谢水平[7-8]。由此可以看出,低N 条件很可能导致植株N 营养缺乏,光合碳同化作用降低,而高N 条件(5 mmol·L-1)则可能高度抑制水稻叶片中的光合作用。
因此,以上结果表明根吸收的N 营养直接影响到整体的光合作用,N 浓度0.5 和2 mmol·L-1营养条件最有利于水稻植株的光合作用。
2.3 水稻植株内氨基酸代谢分析
为了系统地分析以上4 种浓度N 营养条件对水稻植株内氨基酸代谢的影响效果,我们测定根、茎、叶鞘和叶等4 种组织中游离氨基酸含量。
表2—表5 数据分析清晰地表明,4 种N 浓度处理的根、茎、叶鞘和叶等4 种组织中游离氨基酸含量在0.05 和0.5 mmol·L-1N 条件下相对很低,而在2 和5 mmol·L-1N 条件下含量显著提高,相较前两者,至少升高1 倍以上。总体上看,大部分游离氨基酸水平随着外施N 浓度增加而提高,说明N 代谢水平随着N 营养浓度增加而提高,N营养促进N 代谢。
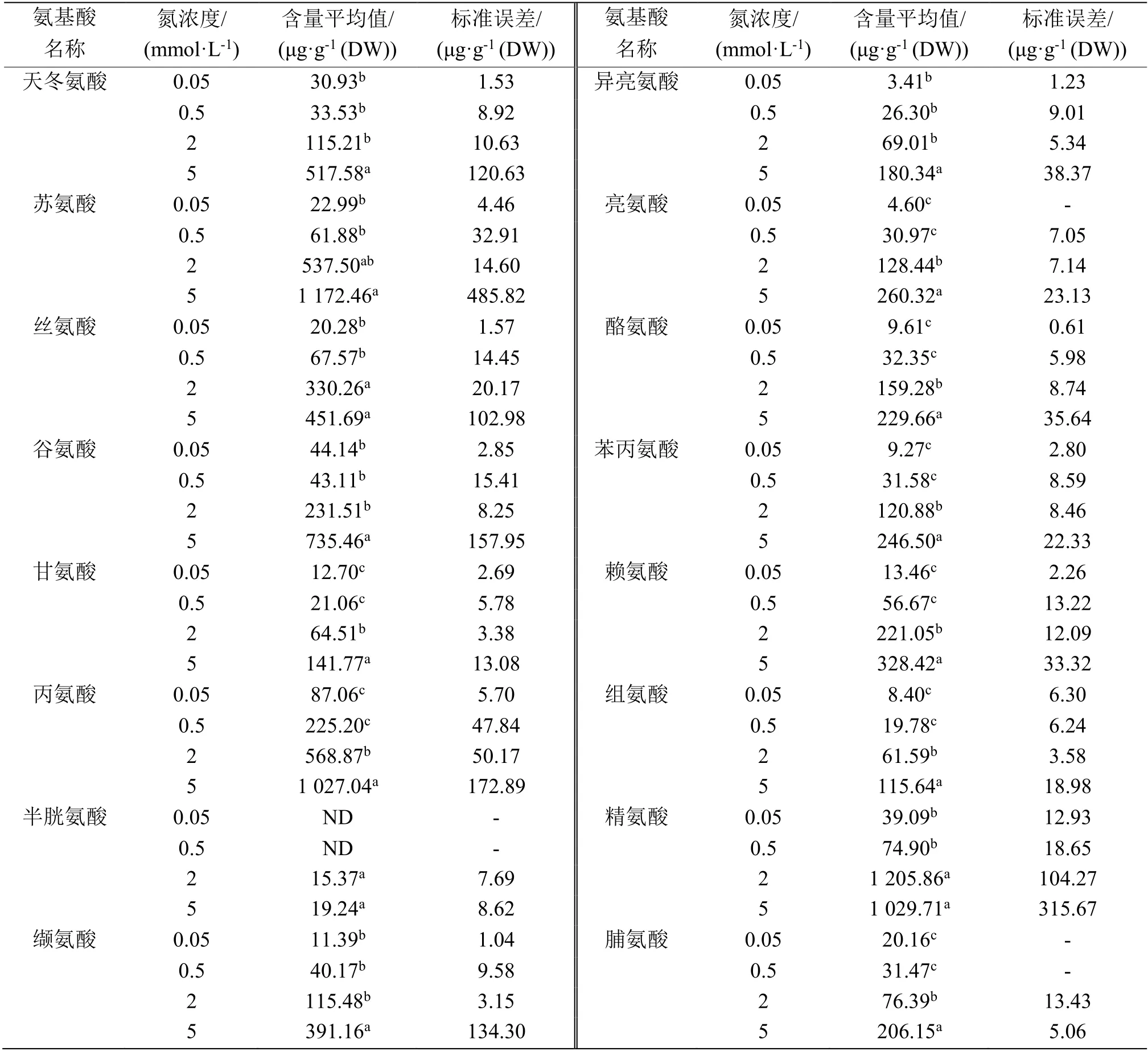
表2 4 种N 营养浓度处理后水稻根内游离氨基酸的含量Table 2 Contents of free amino acids in the rice roots under 4 kinds of N nutrition conditions
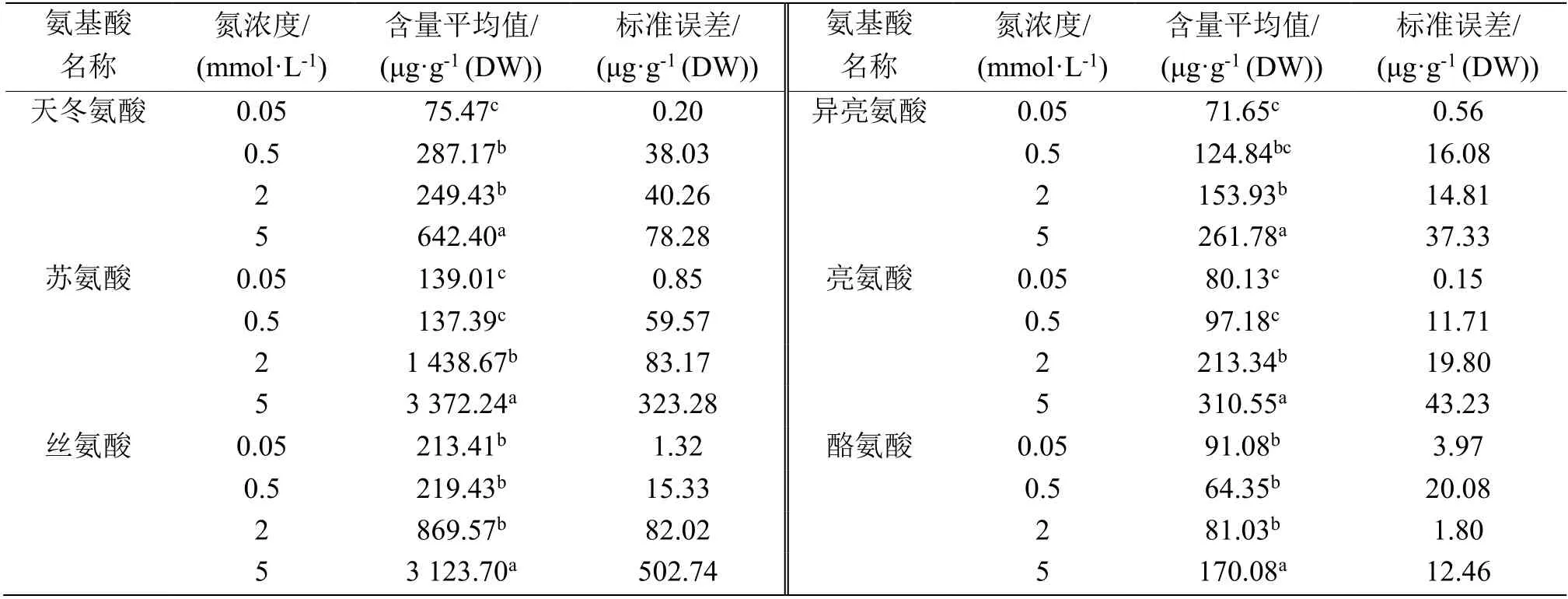
表3 4 种N 营养浓度处理后水稻茎内游离氨基酸的含量Table 3 Contents of free amino acids in the rice stems under 4 kinds of N nutrition conditions

续表3
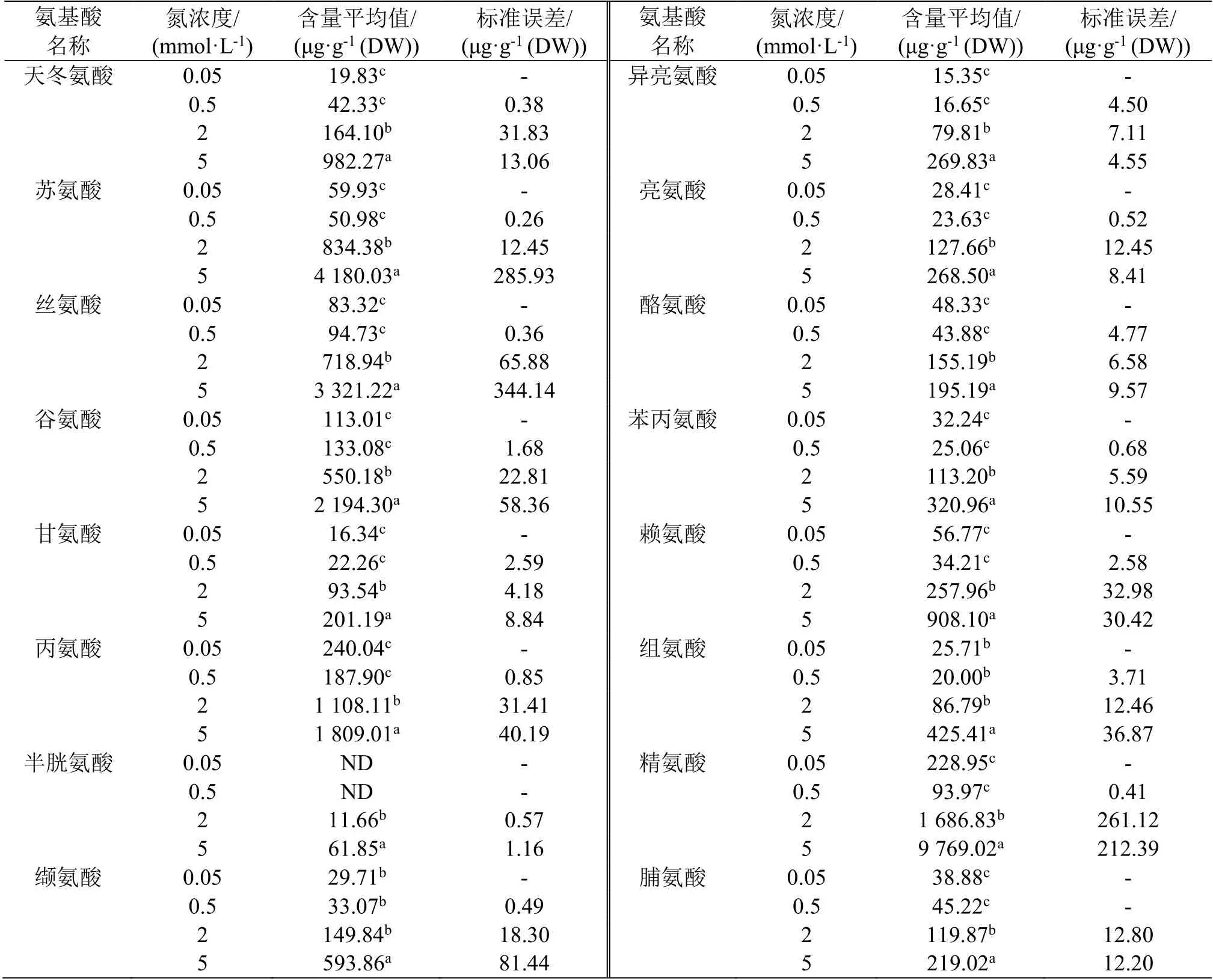
表4 4 种N 营养浓度处理后水稻叶鞘内游离氨基酸的含量Table 4 Contents of free amino acids in the rice sheaths under 4 kinds of N nutrition conditions

表5 4 种N 营养浓度处理后水稻叶片内游离氨基酸的含量Table 5 Contents of free amino acids in the rice leaves under 4 kinds of N nutrition conditions
2.4 水稻植株内色素含量和代谢分析
从以上水稻植株表型可以看出,外施N 肥浓度越高,叶色更深绿(图 1(a))。因此,我们在抽穗期取新鲜叶片,测定3 种色素,叶绿素a、叶绿素b 和类胡萝卜素的含量。结果表明,在0.05 mmol·L-1到2 mmol·L-1N 营养范围内,植株内3 种色素合成代谢随着N 营养浓度升高而显著提高,高N 即5 mmol·L-1N 营养条件并没有显著提高色素合成代谢,也就是说,2 mmol·L-1N 条件下色素合成已经达到最高水平(图 3);在0.05 mmol·L-1N营养条件下,3 种色素的含量均只有2 mmol·L-1营养条件下的1/3 不到(图 3)。这与上述植株表型的趋势完全一致(图 1),而与以上氨基酸在叶片中含量及蔗糖含量变化趋势不完全一致(表 2)。
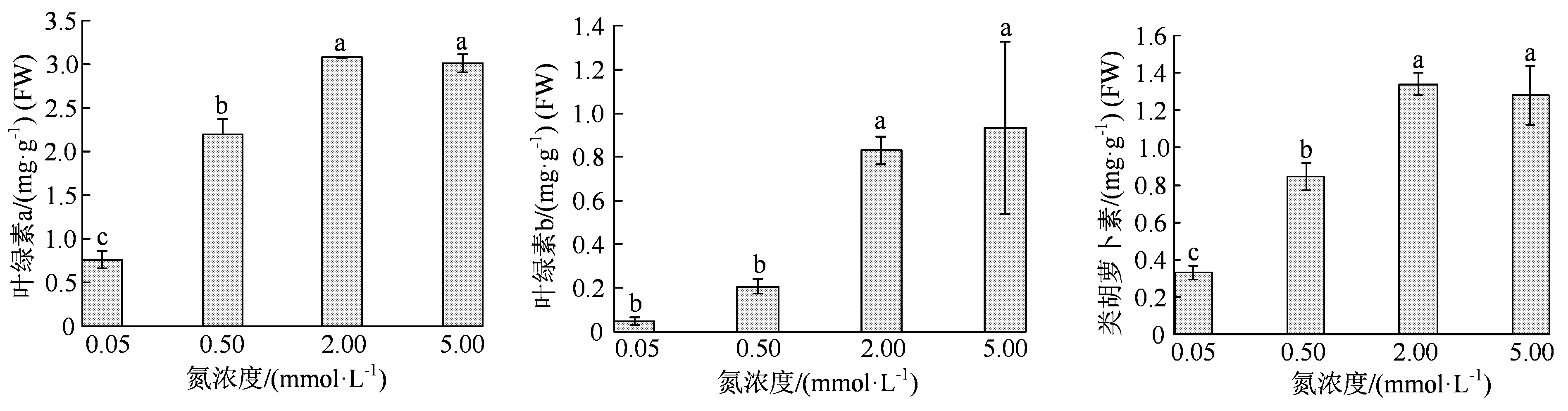
图3 4 种N 浓度处理后水稻植株叶片中的色素含量Figure 3 Contents of pigments in the leaves of rice plants under 4 kinds of N nutrition conditions
2.5 4 种浓度N 营养对水稻植株内一些C、N 代谢关键基因表达的影响
为了探究水稻植株对N 营养浓度变化响应的分子机制,我们进一步分析苗期水稻植株内一些C、N代谢关键基因对4 种N 浓度的表达响应。首先是4个硝态 N 转运关键基因,包括OsNRT2.1(Os02g02170)、OsNRT2.2(Os02g02190)、OsNAR2.1a(Os02g38230)和OsNAR2.1b(Os04g40410)。其中,OsNRT2.1和OsNRT2.2硝态氮转运关键基因,是硝态氮高亲和基因,而OsNAR2.1a 和OsNAR2.1b与OsNRT2.1 和OsNRT2.2 蛋白互作,促进硝态氮吸收和转运,因此也参与硝态氮吸收和转运。有意思的是,OsNRT2.1和OsNRT2.2是串联重复同源基因(图 4(a));这些基因的表达均受硝态氮诱导[9-10]。OsNIA1和OsNIA2是水稻中重要的硝酸还原酶编码基因,OsASN1编码参与天冬酰胺 (asparagine)合成代谢的关键酶[11]。磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)催化磷酸烯醇式丙酮酸(phosphoeno lpyruvate)和HCO3-生成草酰乙酸和无机磷酸的不可逆反应,参与植物光合碳同化等重要代谢。在植物,尤其是叶片组织细胞中,PEPC 编码基因受到多种因素调控,从而直接影响碳同化效率。在C3 植物中,PEPC 为Lrebs 物质循环补充四碳二羧酸从而调节回补反应。水稻中共有5个PEPC编码基因(Osppc1、Osppc2a、Osppc2b、Osppc3和Osppc4), 这些PEPC 酶均位于叶绿体,其中Osppc4 是叶肉细胞中主要的PEPC 酶[12]。
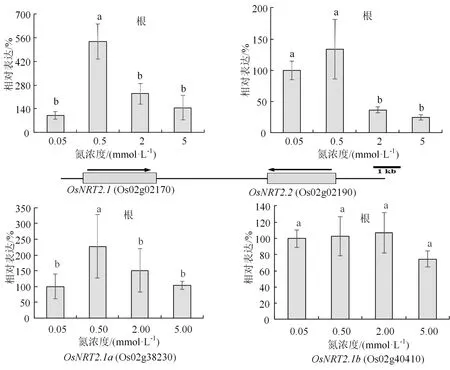
图4 4 种N 浓度处理后水稻植株4 个硝态氮转运关键基因在根部的表达响应Figure 4 Expression response of 4 key nitrate N transport genes in root to 4 different N nutrition conditions
我们对30 d 左右的日本晴植株用上述4 种N 浓度营养液处理1 h 后,进行荧光实时定量PCR(qRT-PCR)分析基因表达。可以看出,只有OsNRT2.1在0.5 mmol·L-1N 营养条件下表达显著上调,上调幅度为1~3 倍。而其他N 浓度处理则没有显著的表达变化(图 4(a)和(b));有意思的是,OsNIA1、OsNIA2、OsASN1和OcPPC4个氮代谢关键基因在根部或叶片的表达响应并不显著(图 5)。
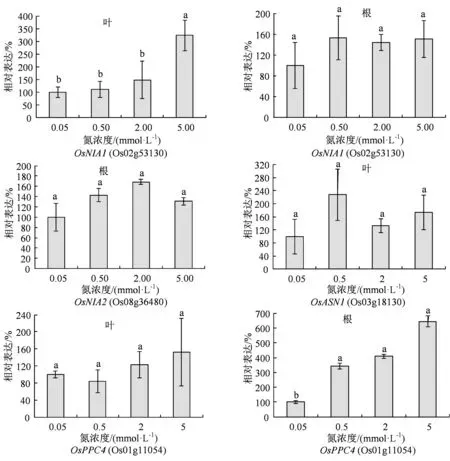
图5 4 种N 浓度处理后水稻植株4 个氮代谢关键基因在根部或叶片的表达响应Figure 5 Expression response of 4 key N metabolism genes in root or leaf to 4 different N nutrition conditions
3 讨论与结论
本研究系统分析全生育期内不同N营养条件对水稻植株生物和发育的影响效果。可以看出,外施N 肥对蔗糖代谢和转运(光合碳同化)、氨基酸代谢及叶绿素合成代谢均有重要的影响。首先,蔗糖代谢和转运(光合碳同化)、叶绿素合成代谢,植株籽粒产量和结实率等性状之间表现非常一致的变化趋势,即在相对正常的N 营养浓度(0.5 和2 mmol·L-1)条件下,这些性状均表现最大值。然而,水稻植株氨基酸代谢与外施N 营养浓度始终是成正比,这表明氨基酸代谢与蔗糖代谢和转运(光合同化作用)及色素合成代谢有不同的调控机制和调控途径。
孟亚利等[12]在水稻地上部干物质分配动态模拟的研究中发现环境因素中N 供应水平对色素分配指数的影响最大, 水稻株体内N 水平高, 分配给形成叶的同化物比例也大。王月福等[13]在施氮量对小麦耔粒蛋白质组分含量及加工品质影响的研究表明,增施氮肥能够显著提高籽粒蛋白质各组分的含量,但各组分含量提高的幅度存在差异。本研究表明,水稻植株生长发育有一个比较狭窄的适宜N 营养浓度范围。综合来看,2 mmol·L-1N 是最适宜水稻生长发育的N 营养浓度条件。这个结论对指导水稻农业生产具有重要的应用价值,也清楚地表明,过度施N 肥不仅不能提高作物产量,反而导致水稻生长发育抑制,生育期延长,结实率降低等不利农艺性状特点。
本研究结果将为后续深入探究N 营养对水稻生长发育和C、N代谢的相关分子机制提供了前期基础。

