重建参数对于基于CZT半导体探测器SPECT/CT系统锝绝对定量准确性的影响
王深,张如意,王澎,谭建,李宁,林晓云,孟召伟,贾强
天津医科大学总医院 核医学科,天津 300052
引言
单光子发射计算机断层扫描(Single Photon Emission Computed Tomography,SPECT)/CT系统自20世纪90年代发明以来,已被广泛应用于诊断人类各种疾病,如心肌疾病、内分泌疾病、中枢神经系统疾病等[1-3]。SPECT/CT系统原理为Anger摄像机使用NaI(Tl)作为闪烁材料,通过闪烁光的位置计算出发生γ射线在人体中的位置[4]。目前1种新型的基于数字化碲-锌-镉化物(Cadmium-Zinc-Telluride,CZT)的SPECT/CT系统配备固态探测器,可在高压电场下将入射的γ光子转化为电子-空穴对,直接产生电信号[5],这一过程避免了光子损耗,同时由于其具有比传统NaI SPECT/CT系统更高的空间和能量分辨率,因此在得到更好的图像质量的同时[6],采集时间较短,辐射剂量较低[7-8]。
绝对定量最初应用于正电子发射计算机断层扫描(Positron Emission Computed Tomography,PECT),由于其定量精度高,被认为是冠心病、微血管疾病、肿瘤等的无创定量分析方法的“金标准”[9-11]。传统的NaI SPECT/CT系统无论是空间分辨率还是能量分辨率均相对较低,同时与PET相比,在SPECT/CT系统中应用的放射性核素,有更多的散射光子[12-13]。这些缺点可能会放大部分体积效应,影响散射校正(Scatter Correction,SC)、衰减校正(Attenuation Correction,AC)和分辨率恢复校正(Resolution Recovery Correction,RR)的效果,因此,SPECT/CT图像可能更难量化。
然而近年来,随着SPECT/CT系统的发展,绝对量化也得到了广泛的验证和应用,研究表明,在重建协议标准化的情况下,绝对SPECT/CT定量在不同的SPECT/CT设备中前景广阔[14]。虽然已有临床实践表明,各种重建参数也可能影响SPECT/CT定量的准确性,但大多数研究仅基于传统的NaI SPECT/CT系统[15-17],因此需要进一步研究不同的重建参数对CZT SPECT/CT绝对定量的影响。本研究旨在评估不同重建参数(包括迭代重建算法中的迭代次数和子集数、后滤波、AC、SC以及RR)对CZT SPECT/CT系统中锝定量准确性的影响。
1 材料与方法
1.1 模型准备
本实验使用的体模(NEMA/IEC 2001)由一个“D”形圆柱体和6个直径不同的球体(分别为37、28、22、17、13和10 mm)组成,同时将99mTcO4-(中国原子高科技术公司)以32∶1靶 -本(Target-to-Background,T/B)比对体模进行填充。采集时小球放射性浓度为0.20 MBq/mL。
1.2 图像采集参数
在Discovery NM/CT 670 CZT(GE Healthcare,美国)上进行PET NEMA/IEC图像质量模型的SPECT/CT采集,该模型配备宽能高分辨率准直器。所有SPECT图像采用list模式(表模式)采集。采用步进模式360°双探头采集(120 s/6°/帧),矩阵大小为128×128,Zoom值为1。主能量窗为140%±7.5% keV,散射能量窗为120%±5% keV。CT采集管电压为120 kVp,管电流为200 mA,矩阵尺寸为512×512,层厚为1.25 mm。
1.3 图像重建参数
所有图像均采用OSEM算法进行重建,迭代次数为1~90次,子集为2~30个。高斯滤波器的半高宽值(Full-Width Half-Maximum,FWHM)范围为0.20~6.99 mm。本研究采用的校正方法包括基于CT的AC、基于双能量窗技术的SC、基于点扩散函数的RR校正。采用AC+SC+RR、AC+SC、AC+RR 3种图像校正组合评价图像校正方法的影响。分析过程中在确定所有其他参数的同时,评估某个参数的影响,以确定最优值。
1.4 定量分析
1.4.1 恢复系数
以CT图像中球体的内边缘为参考,绘制6个球体的感兴趣区(Volume of Interest,VOI)。使用GE-xeleris 4.0工作站(GE Healthcare,美国)的Q.Metrix自动计算3次平均摄取值(MBq/mL)。恢复系数(Recovery Coefficients,RCs)计算方式如公式(1)所示。

1.4.2 图像质量评估
为评估图像质量,按照NEMA NU 2-2012标准计算了对比度百分比和变异系数(Cofficient of Variation,COV)[18-21]。每个热球的对比度QH,,j通过公式(2)计算。

式中,CH,,j为球体j的ROI平均值;CB,,j为球体j的背景ROI平均值;aH为热球体中的活性浓度;aB为背景中的活性浓度。其中,背景ROI定义为:在每个层面上距离体模边缘15 mm(但与任何热球的距离不得小于15 mm)的位置绘制12个与对应热球ROI大小形状相同的背景区域。通过公式(3)计算每个热球的背景变异度Nj。
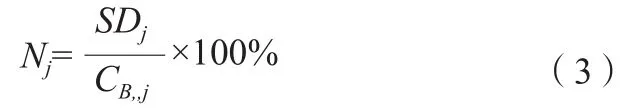
式中,SDj为球体j的背景ROI计数的标准差;CB,,j为球体j的背景ROI平均值。
1.5 统计学分析
采用SPSS 23.0软件进行统计学分析,所有图形均由GraphPad Prism 8.3.0和Origin Pro 2021制作。通过Pearson秩相关和线性回归分析,分析了RCs与不同迭代次数和子集数、FWHM之间的关系。采用配对t检验比较3种不同校正组合的RCs和对比度,以P<0.05为差异有统计学意义。
2 结果
2.1 迭代和子集数的影响
由图1可知,较大球体的RCs比较小球体的RCs更早收敛,其中17~37 mm球体在35次迭代时收敛,10~13 mm球体在85次迭代时收敛。由表1可知,RCs与迭代次数之间存在显著正相关关系(1~35次迭代,r=0.58~0.92;35~90次迭代,r=0.97~0.99,P<0.05)。线性回归分析表明,1~35次迭代β值高于 35~90次迭代的β值(0.63~1.60vs.0.02~0.15)。在前35次迭代中,RCs迅速增加。
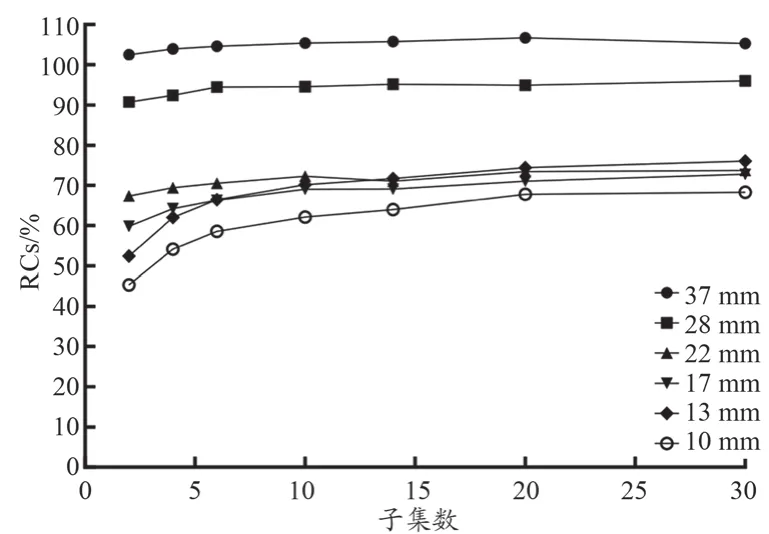
图1 迭代次数对RCs的影响
由图2可知,RCs并未随着子集数量的增加而迅速增加。较大球体(17~37 mm)的RCs在20次子集后趋于稳定。由表1可知,6个球体的r值介于0.68~0.89之间。经线性回归分析,6个球的β值介于0.09~0.70之间。
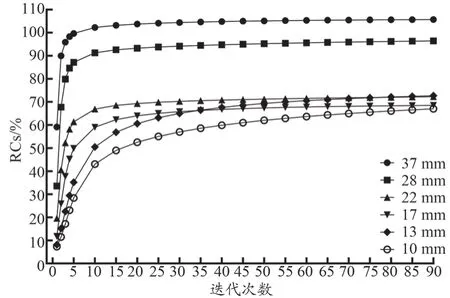
图2 子集数对RCs的影响
2.2 高斯滤波的影响
由图3可知,随着高斯滤波FWHM值的增大(0.70~6.99 mm),所有球体的RCs都显著下降。由表1可知,不同直径球体的高斯滤波器FWHM值与RCs呈显著负相关(r=-1.00~-0.87,P<0.05)。6个球体的β值均较高(-11.83~-9.49),此外,与迭代次数或子集不同,FWHM在RCs变化过程中无平台期。
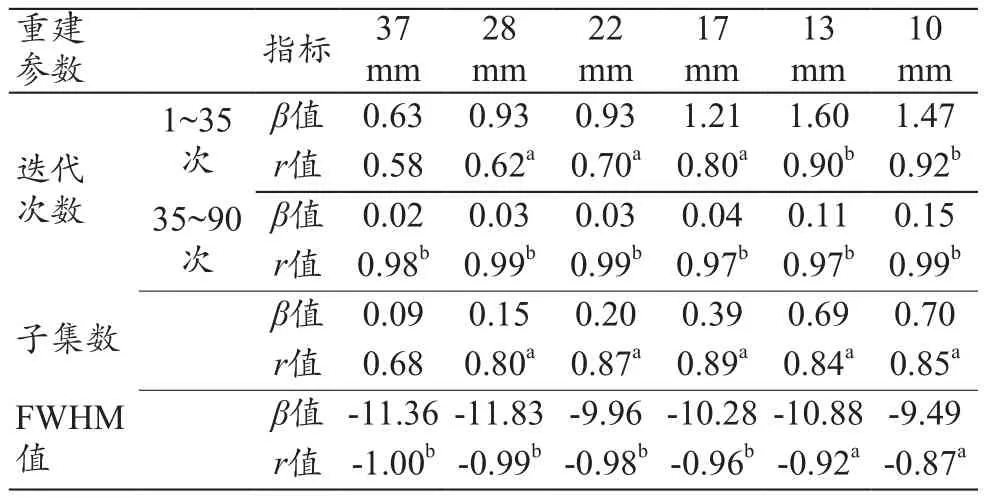
表1 不同重建参数下RCs的相关性和线性回归分析
2.3 图像校正方法的影响
图4显示了不同校正组合后重建图像的视觉差异,由图4可知,在所有T/B比值中,AC+SC+RR组合的视觉图像质量较好。由图5的剖面图表明,AC+SC+RR组合的RCs更接近实际球活度浓度,AC+RR组合预测的平均摄取值最高,由表2可知,AC+SC+RR组合的RCs低于AC+RR组合,但高于AC+SC组合(32∶1 T/B比为67.80%~106.70%vs.75.68%~120.23%vs.29.91%~67.96%,P<0.001)。由表3可知,AC+SC+RR组合重建的6个小球的对比度百分比高于其他校正组合(AC+SC+RRvs.AC+RR;AC+SC+RRvs.AC+SC,P<0.05)。但由表 4可知,AC+RR组合的COV低于AC+SC+RR组合或AC+RR组合(P<0.001)。AC+SC组合高于AC+SC+RR组合(100.70%~103.52%vs.85.95%~93.77%,P<0.001)。
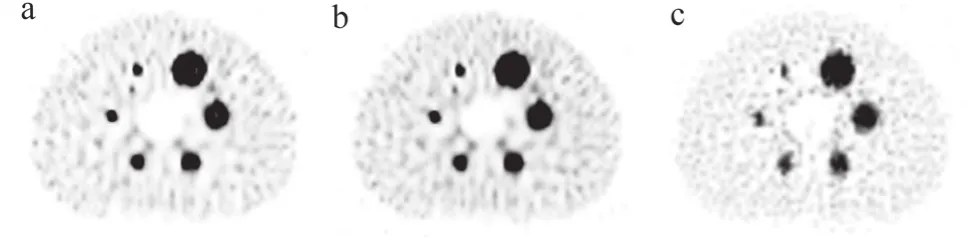
图4 不同的图像校正组合下的重建图像
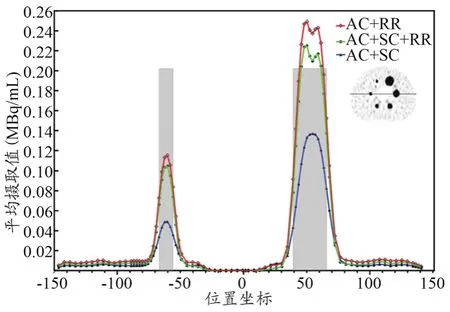
图5 模体剖面图
3 讨论
研究表明,以CT图像为参考,可避免SPECT/CT系统的部分体积效应,计算RCs的误差更小[22]。Koole等[23]的研究表明,MR或CT图像的高分辨率结构信息有助于确定SPECT/CT图像中的潜在病变。
本研究结果表明,迭代次数对量化有较大影响。37~17 mm较大球的RCs比13 mm和10 mm小球体的RCs更早收敛(图1),说明在绝对定量中,小的迭代次数即可能满足较大的病变。虽然RCs与1~35次迭代的相关性低于35~90次迭代,但1~35次迭代的回归系数比35~90次迭代的回归系数高(表1)。所有球体的RCs在前35次迭代中也会迅速增加(图1)。因此,确定最优迭代次数为35次。此外,子集和RCs之间的相关性并不明显,各T/B比的回归系数均较低(0.09~0.70),说明RCs不能随着子集数量的增加而快速增加,因此子集对量化的影响相对较小。Vriens等[24]的模型研究也提示,子集对标准化摄取值的影响较小。本研究中,对于较大的球体(17~37 mm),RCs在20个子集后趋于稳定,而对于较小的球体(10~13 mm),RCs在20个子集后无显著增加(图2),因此本研究采用了20个子集。在Kupitz等[25]的研究中,最佳的迭代次数为24次,最佳的子集数为10个,所得出的最大球的定量误差在10%左右,本研究结果相对更接近于真实值。这说明CZT SPECT/CT的定量准确性优于传统NaI SPECT/CT。
在所有重建参数,高斯滤波FWHM值与RCs之间显示最显著的相关性(r=-1.00~-0.87)以及最高的回归系数(-11.83~-9.49),这说明高斯滤波可能对定量准确性有较大影响。本研究显示,RCs均随FWHM的降低而显著下降。由于高斯滤波在RCs中无平台期(图3),所以今后的研究中还需再进一步分析该参数。
AC+SC+RR组合在球体中具有较高的浓度一致性,同时AC+SC组合的RCs最低(图5和表2)。AC+RR组合在各球体中计算的RCs均高于AC+SC+RR和AC+SC组合,这可能是对能量和位置信息不准确的散射光子进行补偿的结果。AC+RR组合计算的最大37 mm球的RCs,正偏差甚至大于20%。相比之下,AC+SC+RR组合的正偏差仅为6.70%(表2)。由于散射光子占SPECT/CT探测器采集到的全部光子的20%~40%,应用SC可以在很大程度上降低计算浓度的误差[26]。Kim等[17]的研究也证实AC、SC、RR的使用能够很大程度上提高定量的准确性,与本研究结果一致。
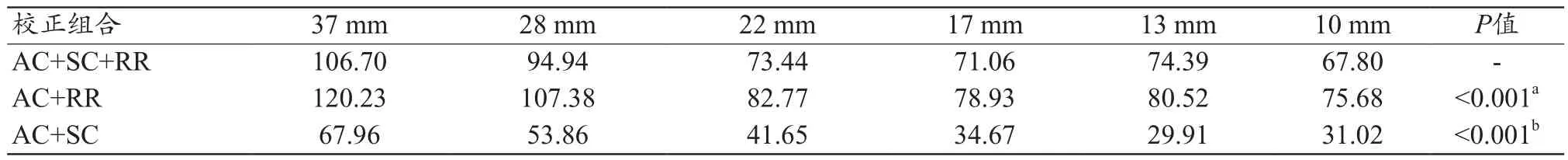
表2 3种校正组合下所有球体的RCs比较(%)
在图像质量方面,AC+SC+RR组合在所有T/B比率中具有最好的对比度(表3)。而AC+SC+RR在各T/B比值中COV均高于AC+RR组合(表4)。Knoll等[27]的研究也显示了类似的结果,即SC的应用可能会增加背景变异性。这表明,虽然AC+SC+RR的定量性能最好,但其图像质量可能存在一定的争议。本研究主要目的为进行量化分析,因此选择AC+SC+RR作为最优校正组合。本研究还表明,在所有T/B比率中,COV都相对较高,分析原因为在以量化为主要目标时不可避免,因为更大的迭代次数不仅会提高量化精度,同时会带来更多的背景噪声[28]。本研究结果从总体上解释了以上重建参数在定量过程中的变化趋势和影响程度,因此在临床实践中对于这些参数的组合估计可能仍有指导意义,可尽可能接近最优化的重建条件。
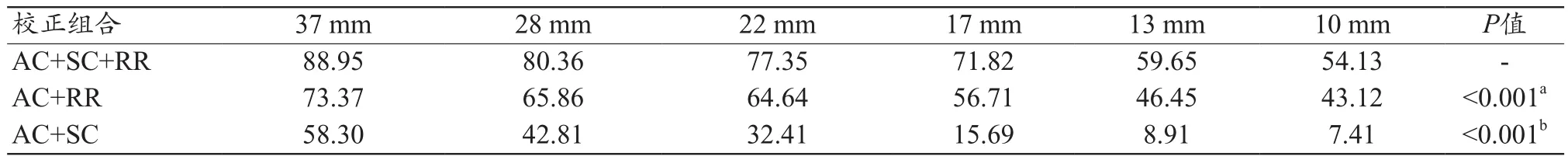
表3 3种不同校正组合下所有球体的对比度百分比比较(%)
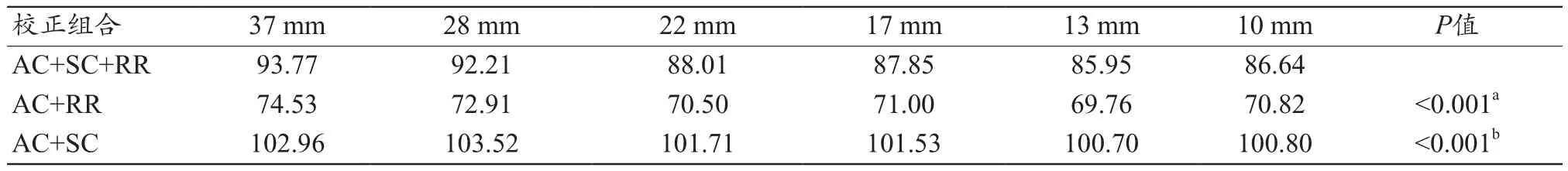
表4 3种不同校正组合下所有球体的COV(%)
本研究有以下4个局限性:① 建立的重建参数可能只适用于定量目的和本研究中调查的CZTSPECT/CT设备。同时,由于各种设备性能的不确定性、各种算法的复杂性、以及临床上受检患者、采集协议和采集环境的多样性,本文提出的效率最优的参数会不可避免的产生相应变动。② 为计算误差最小的平均摄取值,并找出不同重建参数的影响,本研究以CT图像为参考,绘制VOI,这在临床应用上可能存在局限性。③ 本研究中相应COV均较高,这是以量化为主要目标时不可避免的结果。一般情况下,随着迭代次数的增加,图像高频信息逐渐丰富,像素值与噪声水平会相应增加,之后会逐渐趋于稳定。④ 定量测量仅使用基于CZT的SPECT/CT系统,而未使用基于NaI(Tl)的SPECT/CT系统,因此未进行两者间的比较。
4 结论
迭代次数对于绝对定量有较大的影响,较小的病灶需要更大的迭代次数来提高定量准确性,其影响主要集中在35次迭代范围内;子集数对于绝对定量的影响较小,RCs在20个子集后已无明显变化;高斯滤波器的FWHM值对于绝对定量的影响最大,RCs随着FWHM值的增加而显著降低且无平台期可供选择。图像校正方法对于绝对定量也有较大的影响。其中,AC+SC+RR组合下的绝对定量更接近于真实值且图像质量相对较好。CZTSPECT/CT显示了良好的定量准确度,且35次迭代,20个子集,AC+SC+RR校正组合和不进行滤波是较好的重建参数。

