酰肼介导的抗体定向偶联策略提高免疫层析试纸条检测性能
周梦君,周 舒,黄小林,李响敏, ,熊勇华
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330031)
胶体金免疫层析试纸条(gold nanoparticles-based immunochromatographic assay,AuNPs-ICA)是最常用的快速检测方法之一。胶体金探针的生物活性与AuNPs-ICA的检测性能密切相关。目前,制备胶体金探针的方法有物理吸附法、共价偶联法和蛋白A/G介导的定向偶联法。物理吸附法偶联效率高、操作简单,但是该方法在检测一些含复杂基质的样本时,因探针的稳定性差而不能达到检测要求。采用配基交换方式可使AuNPs表面富含羧基功能团,进一步可通过碳二亚胺法介导抗体的共价偶联。与物理吸附法相比,该方法可以有效提高胶体金探针的稳定性,从而扩展免疫层析试纸条的应用场景。然而,碳二亚胺法介导的抗体偶联因抗体分子上不同部位的氨基都可能与活化的羧基发生偶联反应,导致抗体在AuNPs表面可能出现端对、正对、侧对或平对的取向,从而导致抗体中Fab片段与抗原结合的生物活性下降。通过控制抗体的取向(特异性偶联Fc区域)使抗体Fab片段充分暴露,是提高抗体生物活性的有效手段。之前一些研究表明,蛋白A/G也可以特异性结合抗体的Fc片段,使得抗体竖立在AuNPs表面,可以最大限度地提高抗体的生物活性。然而,蛋白A/G必须首先通过共价偶联的方法固定在AuNPs表面,这增加了胶体金探针合成的操作复杂度和生产成本。
本研究提出了一种基于酰肼基团共价定向偶联抗体的新策略。该策略利用了部分抗体的Fc片段天然含有醛基的特性(或通过高碘酸钠氧化抗体Fc片段糖基侧链生成醛基),在弱酸条件下,醛基与酰肼基团通过亲核加成反应形成共价键,从而实现抗体在AuNPs表面的定向偶联。首先,采用种子生长法制备100 nm的AuNPs,自主合成羧基配体和酰肼配体,通过配基交换制备了羧基化胶体金(carboxylated gold nanoparticles,cAuNPs)以及酰肼化胶体金(hydrazided gold nanoparticles,hAuNPs);进一步将抗玉米赤霉烯酮(zearalenone,ZEN)单克隆抗体与cAuNPs及hAuNPs共价偶联,得到两种胶体金探针;在此基础上,比较两种偶联方法所需抗体标记量以及偶联反应时间的差异;同时以两种胶体金抗体偶联物为探针制备试纸条,比较两种试纸条检测ZEN灵敏度的差异;此外,进一步评价酰肼介导的定向偶联策略对试纸条检测实际玉米样本中ZEN的性能影响。
1 材料与方法
1.1 材料与试剂
柠檬酸三钠 天津市大茂化学试剂厂;1-乙基-(3-二甲基氨基丙基)碳二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC)、对苯二酚、氯金酸、三氟乙酸(trifluoroacetic acid,TFA)、三异丙基硅烷(triisopropyl silane,TIPS)、二异丙基碳二亚胺(diisopropylcarbodiimide,DIC) 美国Sigma公司;,-二甲基乙酰胺(dimethylacetamide,DMA) 西陇科学股份有限公司;ZEN标准品、赭曲霉毒素标准品、伏马毒素标准品、橘青霉素标准品、黄曲霉毒素G标准品、黄曲霉毒素B标准品、脱氧雪腐镰刀菌烯醇标准品、黄曲霉毒素B标准品 青岛普瑞邦生物工程有限公司;猪血清 江西宝灵科技发展有限公司;山羊抗鼠IgG抗体 北京中杉生物技术有限公司;硝酸纤维素膜(NC膜) 德国Sartorius公司;吸水纸、PVC黏性底板上海捷宁生物技术有限公司;5-氧代-6,9,12,15,18-五氧杂-30-硫杂-31,31,31-三苯基-三十一碳酸由实验室自主合成;实验中所用试剂均为分析纯;实验用水为超纯水。
1.2 仪器与设备
JEOL Model JEM-2100透射电子显微镜 日本日立高新技术有限公司;U-3900型紫外-可见分光光度计日本株式会社日立高新技术科学事务所;HGS201可编程切条机、HGS510划膜喷金标机 杭州峰航科学仪器有限公司;胶体金试纸条读取仪 无锡中德伯尔生物有限公司;DHP-9082电热恒温鼓风干燥箱 上海福玛实验设备有限公司;TGL-16K台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;Nano ZSE粒度分析仪英国马尔文公司;液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)仪、超高效液相色谱(ultra-high performance liquid chromatography,UPLC)仪 安捷伦科技有限公司。
1.3 方法
1.3.1 100 nm AuNPs的合成
采用柠檬酸还原法制备20 nm的种子金,具体方案如下:取1 mL 质量分数1%的氯金酸溶液加入装有99 mL超纯水的锥形瓶中,缓慢匀速搅拌条件下加热至沸腾,迅速加入2.7 mL质量分数1%的柠檬酸三钠溶液,快速搅拌10 min,待溶液颜色变为酒红色并且不再发生变化时,停止加热,在搅拌条件下冷却至室温,置于4 ℃保存备用。采用种子生长法合成100 nm的AuNPs,具体方案如下:将1.0 mL上述方法合成的20 nm种子金溶液加入至装有99 mL超纯水的锥形瓶中,然后快速加入2.4 mL质量分数1%的氯金酸溶液,待搅拌均匀后,每隔10 min加入400 μL质量分数1%的柠檬酸三钠溶液和200 μL对苯二酚溶液(30 mol/L),重复8 次。继续反应1 h后,将所合成的胶体金溶液离心、弃上清液、沉淀复溶于10 mL质量分数0.02%的柠檬酸三钠溶液中,置于4 ℃保存备用。
1.3.2 配体的制备
1.3.2.1 羧基配体制备
参照Zhou Yaofeng等的方案并略作修改,羧基配体的制备方案如图1所示:将300 mg 5-氧代-6,9,12,15,18-五氧杂-30-硫杂-31,31,31-三苯基-三十一碳酸溶于3 mL二氯甲烷中,加入2 mL TFA,瓶内溶液立即变成棕红色,加入1 mL TIPS,溶液颜色变浅,于氮气保护下室温搅拌反应3 h。反应结束后,真空浓缩,黄色残留油状液体用正己烷搅洗4 次,每次5 mL,残余物再通过真空干燥得到羧基配体。

图1 羧基配体的合成方案Fig.1 Synthesis of the carboxyl ligand
1.3.2.2 酰肼配体制备
参照Zhou Yaofeng等的方案并进行衍生,酰肼配体的制备方案如图2所示。将700 mg 5-氧代-6,9,12,15,18-五氧杂-30-硫杂-31,31,31-三苯基-三十一碳酸和330 mg己二酸二酰肼溶于25 mL DMA中,加入240 mg DIC,50 ℃搅拌反应18 h,反应结束后,真空浓缩,柱层析提纯后,得到770 mg中间体,将其用5 mL二氯甲烷溶解,加入3 mL TFA和1.5 mL TIPS,于氮气保护下室温搅拌反应3 h。真空浓缩,黄色残留油状液体用正己烷搅洗6 次,每次6 mL,残余物再通过真空干燥得到酰肼配体。

图2 酰肼配体的合成方案Fig.2 Synthesis of the hydrazide ligand
1.3.3 羧基化胶体金探针(cAuNPs@mAbs)和酰肼化胶体金探针(hAuNPs@mAbs)的制备
1.3.3.1 cAuNPs@mAbs制备
利用羧基配体修饰AuNPs,制备cAuNPs。具体步骤如下:将10 mL胶体金(100 nm)溶液以4 000 r/min离心10 min,弃上清液,沉淀复溶于10 mL碱性超纯水(pH 9)中,加入0.2 mg羧基配体,室温缓慢振荡反应4 h,反应混合物离心去除游离的配体,沉淀复溶于10 mL超纯水中,置于4 ℃保存备用,此时cAuNPs浓度为0.11 pmol/L。然后,在EDC存在的情况下,将所合成的cAuNPs与抗ZEN单克隆抗体的氨基偶联,制备cAuNPs@mAbs。具体步骤如下:在0.9 mL 0.01 mol/L磷酸缓冲液(phosphate buffer,PB,pH 7.0)中加入100 μL cAuNPs(0.011 pmol),再将2.53 µg抗ZEN单克隆抗体和4 μL EDC(10ng/mL)加入到上述混合溶液中,室温搅拌反应90 min。加入100 µL的质量分数10% BSA溶液,封闭反应30 min。制备的胶体金探针以4 000 r/min离心10 min,沉淀重悬分散于100 µL PB溶液中,4 ℃保存备用。
1.3.3.2 hAuNPs@mAbs制备
将等比例的酰肼配体和羧基配体共修饰AuNPs,制备hAuNPs。具体步骤如下:将10 mL胶体金(100 nm)溶液以4 000 r/min离心10 min,弃上清液,沉淀复溶于10 mL碱性超纯水(pH 9)中,再加入0.2 mg酰肼配体与0.2 mg羧基配体,室温缓慢振荡反应4 h,反应混合物离心去除游离的配体,沉淀复溶于10 mL超纯水中,置于4 ℃保存备用,此时hAuNPs浓度为0.11 pmol/L。然后,将所合成的hAuNPs与抗ZEN单克隆抗体的醛基偶联,制备hAuNPs@mAbs。具体步骤如下:在0.9 mL 0.01 mol/L PB溶液(pH 6.5)中加入100 μL hAuNPs(0.011 pmol),再将1.32 µg抗ZEN单克隆抗体加入到上述混合溶液中反应10 min。加入20 µL猪血清溶液封闭30 min后,离心去除上清液,沉淀重悬分散于100 µL PB溶液中,4 ℃保存备用。
1.3.4 羧基化胶体金试纸条(cAuNPs-ICA)和酰肼化胶体金试纸条(hAuNPs-ICA)的制备及免疫层析检测流程
试纸条由四部分组成:样本垫、NC膜、吸水纸、PVC底板。使用划膜仪将一定浓度的ZEN-BSA和羊抗鼠抗体(10ng/mL)喷涂到NC膜上,分别作为试纸条的T线和C线,37 ℃干燥6 h。将制备好的NC膜贴在底板上,再将吸水纸和样本垫依次贴在底板的其余两个部分,并与NC膜重叠1.0 mm左右,最后将组装好的cAuNPs-ICA和hAuNPs-ICA切割成每条3.9 mm,密封干燥条件下保存。样品中ZEN的检测流程如图3所示:取4 µL cAuNPs@mAbs或5 µL hAuNPs@mAbs与70 µL待测样品提取液充分混合孵育5 min后,再加入到试纸条的加样孔中,15 min后用胶体金读取仪测定T线光密度(OD)和C线光密度(OD)。每个实验做3 个平行。如果C线显色T线不显色,则为阳性结果;若T、C线都显色,则为阴性结果;若C线不显色,则结果无效。
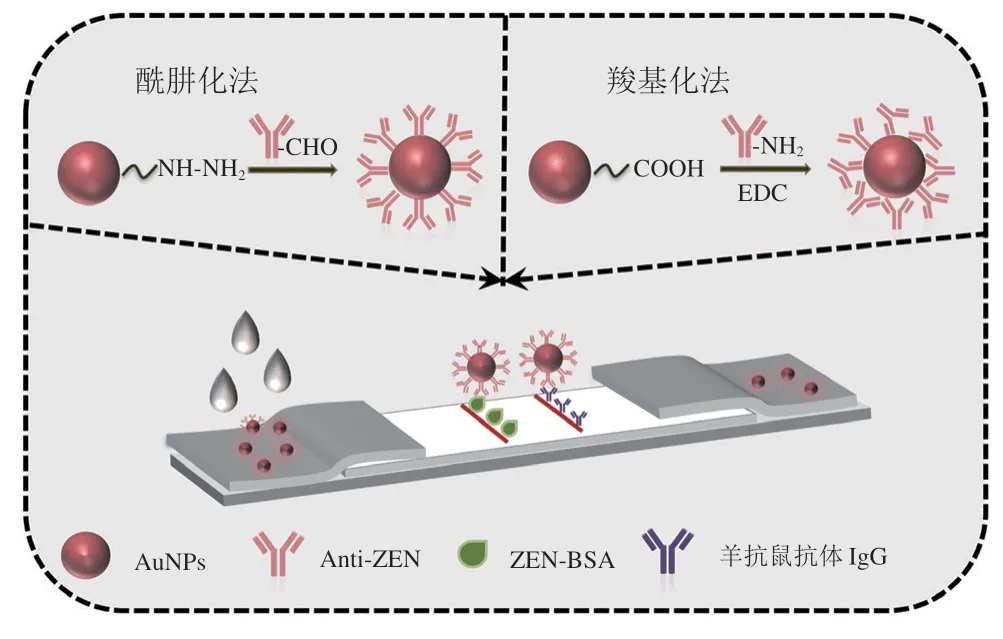
图3 cAuNPs-ICA和hAuNPs-ICA检测ZEN的原理图Fig.3 Schematic diagrams of the cAuNPs-ICA and hAuNPs-ICA for the detection of zearalenone
1.3.5 两种胶体金试纸条检测ZEN的标准曲线
将ZEN标准品用磷酸盐缓冲液(phosphate buffered saline,PBS,pH 7.4)(0.01 mol/L)稀释成终质量浓度为0~1 500 ng/mL的标准溶液,每个质量浓度取70 μL与5 μL cAuNPs@mAbs或4 μL hAuNPs@mAbs充分混匀后,移取70 μL混合物至样品孔中(每个质量浓度重复3 次测定),15 min后使用读取仪记录试纸条T线与C线的读值。以/为纵坐标(代表试纸条检测系列标准品的OD/OD值,代表试纸条检测阴性对照样品的OD/OD值),ZEN溶液质量浓度的对数值为横坐标,绘制定量检测ZEN的试纸条标准曲线,确定线性定量范围,并计算试纸条的IC以及检出限(limit of detection,LOD),IC定义为抑制率为50%时所对应的ZEN质量浓度,LOD定义为抑制率为10%时所对应的ZEN质量浓度。
1.3.6 hAuNPs-ICA检测性能的评价
1.3.6.1 玉米中ZEN的提取
采用GB 5009.209—2016《食品中玉米赤霉烯酮的测定》的方法提取玉米中ZEN。具体步骤如下:称取40.0 g玉米粉碎试样(精确到0.1 g)于均质杯中,加入4 g氯化钠和100 mL乙腈-水(9∶1,/),以均质器高速搅拌2 min,定量滤纸过滤,滤液置于4 ℃保存备用。
1.3.6.2 检测条件优化
移取5.0 mL经LC-MS/MS测定为阴性的玉米提取液,加入85 mL水稀释混匀,定量滤纸过滤,滤液同时添加ZEN储备液至终质量浓度为1 ng/mL。使用浓度为1 mol/L的HCl或NaOH溶液将阴性及阳性添加玉米稀释液的pH值调成5.0、6.0、7.0、8.0。分别取70 μL不同pH值的玉米稀释液与4 μL hAuNPs@mAbs反应5 min后,将上述溶液加到试纸条样品孔中,每个梯度pH值重复3 次,15 min后使用读取仪记录试纸条T线与C线的读值。竞争抑制率/%=(1-/)×100,通过竞争抑制率确定试纸条最佳反应pH值。进一步将玉米提取液乙腈含量稀释至体积分数0%、2.5%、5%、10%、15%、20%,按照上述方法评价溶液中乙腈含量对试纸条检测性能的影响。
1.3.6.3 玉米样本中ZEN的灵敏度检测
在最佳检测条件下,用阴性玉米稀释液将ZEN标准品配制成若干个梯度标准溶液,各取70 μL上述溶液与4 μL hAuNPs@mAbs孵育5 min后加入到试纸条加样孔中,每个质量浓度分别重复3 次,15 min后用胶体金读取仪获得试纸条T线与C线的读值。以/为纵坐标,ZEN质量浓度对数值为横坐标绘制标准曲线,得到试纸条的检测灵敏度以及线性定量范围。
1.3.6.4 试纸条精密度、准确度及特异性评价
分别配制加标量为1、10、100 μg/kg的ZEN阳性样本,用hAuNPs-ICA进行检测。每个不同质量浓度的ZEN样品,在同1 d内使用同一批次试纸条分别测定3 次,每隔3 d测定1 次,且每个质量浓度重复3 次,最后通过计算得到每个质量浓度的平均加标回收率和批内、批间回收率,评价试纸条的精密度与准确度。选取粮食污染中常见的7 种真菌毒素进行试纸条的特异性评价,包括赭曲霉毒素A、伏马菌素B、黄曲霉毒素B、黄曲霉毒素B、黄曲霉毒素G、橘青霉毒素、呕吐毒素,并将质量浓度配制为1 000 ng/mL。然后将上述溶液与hAuNPs@mAbs混合反应5 min后加入试纸条加样孔中,每种溶液测定3 次,记录试纸条T线和C线的读值,并与ZEN阳性样品的竞争抑制率进行比较。
1.3.6.5 与UPLC法的相关性评价
取17 份经商业化ELISA试剂盒检测为阳性的玉米样本,使用本法和UPLC法同时检测。以hAuNPs-ICA测定结果为横坐标,UPLC法测定结果为纵坐标,绘制二者的相关性曲线并计算相关系数。
1.4 数据处理及分析
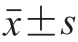
2 结果与分析
2.1 AuNPs、cAuNPs及hAuNPs的表征
根据实验室前期研究发现,大粒径胶体金有利于提高竞争模式免疫层析方法的检测灵敏度,因此本研究采用种子法合成了大粒径的AuNPs。图4 A表明,制备的AuNPs具有规则的球形形状,尺寸为(100±4.3)nm(=50)。如图4B所示,羧基配体在傅里叶红外光谱中1 710 cm处出现羧基C=O的伸缩振动峰,酰肼配体在1 654 cm处出现了明显的酰胺键C=O的伸缩振动峰,表明两种配体已经成功合成。利用配基置换的方法制备cAuNPs和hAuNPs。相对于原始AuNPs,cAuNPs的Zeta电位从-36.8 mV略微增加到-32 mV,而hAuNPs的Zeta电位从-36.8 mV显著增加到-16 mV(图4C)。此外,与原始AuNPs相比,合成的cAuNPs和hAuNPs的紫外-可见吸收光谱出现明显的红移,cAuNPs和hAuNPs的红移分别从566 nm到570 nm和573 nm(图4D),而水化粒径分别从99 nm增加到108 nm和111 nm(图4E)。这些结果表明羧基和酰肼配体已经成功修饰到AuNPs表面。
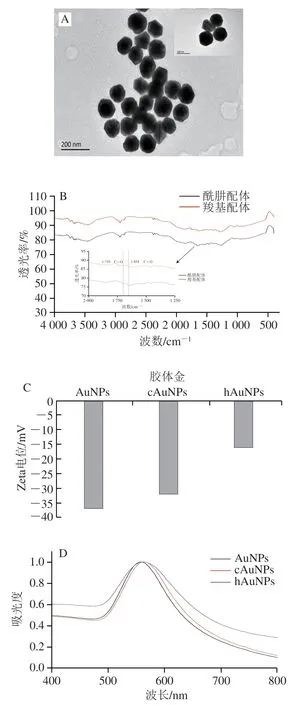
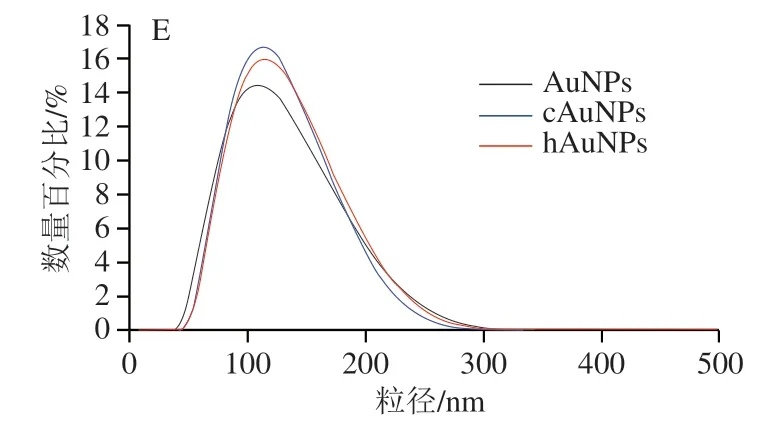
图4 AuNPs、cAuNPs和hAuNPs的表征Fig.4 Characterization of AuNPs,cAuNPs and hAuNPs
2.2 cAuNPs@mAbs和hAuNPs@mAbs的合成及表征
2.2.1 cAuNPs@mAbs合成及表征
通过EDC活化cAuNPs表面羧基与抗ZEN单克隆抗体上的氨基形成酰胺键制备cAuNPs@mAbs。为了获得探针的最佳活性,对影响抗体活性的几个关键偶联参数进行优化,具体包括缓冲液pH值、EDC用量、偶联反应时间以及抗体饱和标记量。将制备的胶体金探针进行试纸条检测,以试纸条T线显色信号强弱确认最佳标记参数。如图5A所示,当溶液pH 7.0时,试纸条T线显色值(OD)最大,因此选取pH 7.0的缓冲液用于后续偶联实验。图5B显示,当EDC用量为0.364 mg/pmol时,试纸条OD值最高。图5C显示,T线读值随着偶联时间的延长而增大,在偶联反应90 min时,T线读值达到最大,之后OD值保持稳定,说明最佳偶联反应时间为90 min。抗体饱和标记量结果如图5D所示,OD值随着抗体用量的增加而增加,当抗体标记量达到0.23 mg/pmol时OD值最大,表明抗体最佳标记量为0.23 mg/pmol。在上述最优条件下制备cAuNPs@mAbs并表征其水化粒径,结果如图5E所示,探针合成前后水化粒径发生明显改变,cAuNPs的粒径从108 nm增加到145 nm,表明成功制备了cAuNPs@mAbs。
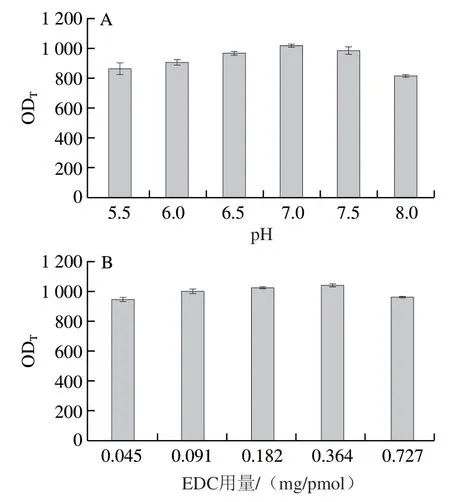

图5 cAuNPs@mAbs的合成条件优化Fig.5 Parameter optimization for synthesis of cAuNPs@mAbs
2.2.2 hAuNPs@mAbs合成及表征
溶液pH值和偶联反应时间是影响酰肼定向偶联效率的两个关键参数。理论上,弱酸性条件有利于促进抗体Fc片段上醛基与hAuNPs酰肼基团发生亲核加成反应。但是当溶液pH值接近抗体的等电点时,由于抗体溶解度下降反而会降低偶联效率,甚至导致探针出现沉淀反应。如图6A所示,当缓冲溶液pH 6.5时,OD值达到最大,表明此时探针具有最高的生物活性。在最佳的反应pH值条件下,将抗ZEN单克隆抗体与hAuNPs分别孵育1、3、5、7、10、30、50、70、90、120 min。图6B显示,抗体与hAuNPs孵育10 min后,试纸条OD值已经达到最大值,表明酰肼介导的亲核加成反应在10 min内即可快速完成偶联反应。相比于碳二亚胺介导的共价偶联反应(90 min),酰肼介导的定向偶联策略大大减少了探针的制备时间。在最佳的反应pH值下,使用不同量的抗ZEN单克隆抗体偶联hAuNPs制备免疫探针。如图6C所示,随着ZEN抗体用量的增加,试纸条OD值也逐渐增加,当抗体标记量超过0.12 mg/pmol hAuNPs时,由于位阻效应试纸条OD值反而呈现降低趋势。所以酰肼法介导的定向偶联最佳抗体标记量为0.12 mg/pmol hAuNPs,较碳二亚胺介导的共价偶联抗体用量降低接近一倍左右,表明定向偶联策略能有效降低抗体的用量,从而减少试纸条的制作成本。在上述最优条件下制备hAuNPs@mAbs并表征其水化粒径,结果如图6D所示,探针合成前后水化粒径发生明显改变,hAuNPs的粒径从111 nm增加到136 nm,表明成功合成了hAuNPs@mAbs。
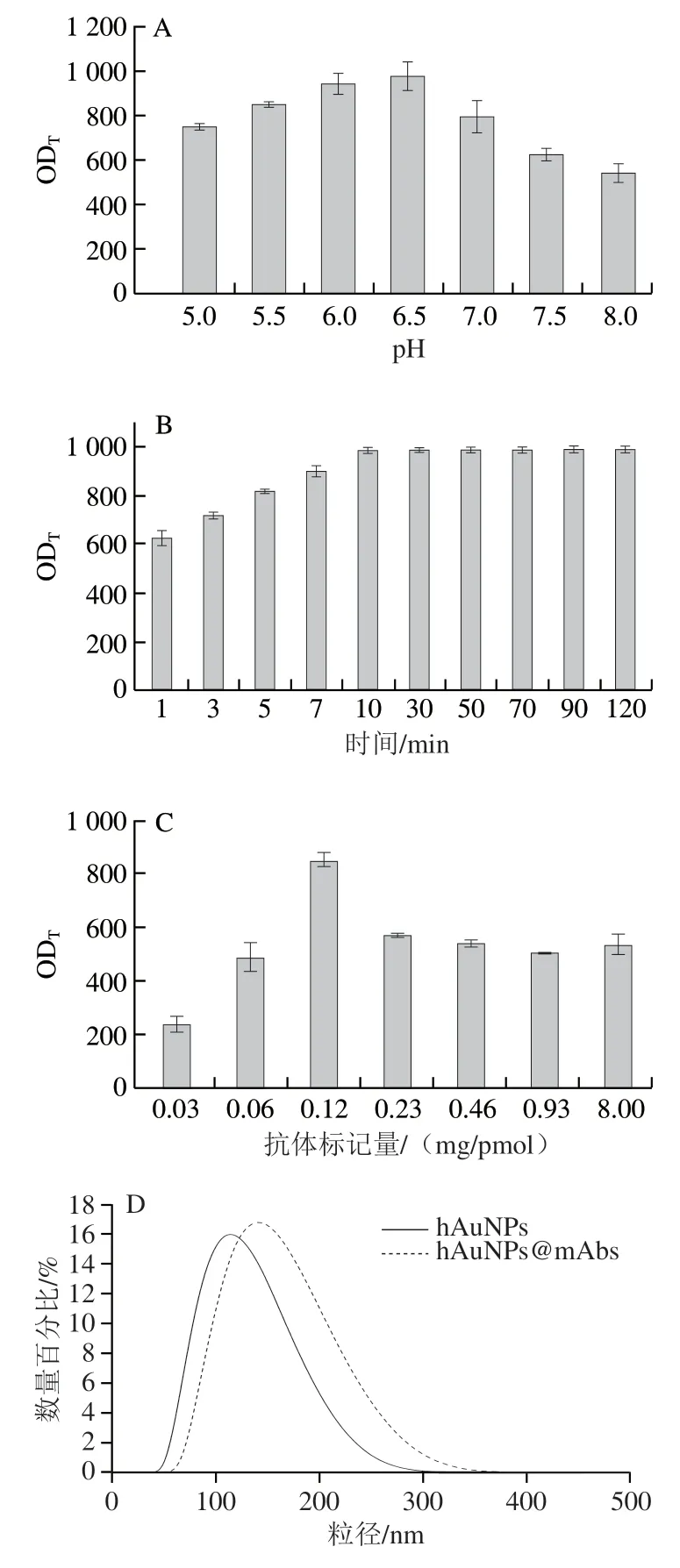
图6 hAuNPs@mAbs制备条件优化Fig.6 Parameter optimization for preparation of hAuNPs@mAbs
2.3 cAuNPs-ICA和hAuNPs-ICA制备
胶体金探针用量与T线ZEN-BSA喷涂质量浓度是影响试纸条灵敏度的两个重要因素。为了获得试纸条最佳检测性能,本研究通过2因素3水平正交试验优化以上参数。如表1、2所示,当T线ZEN-BSA质量浓度为2.5×10ng/mL,cAuNPs@mAbs用量为5 μL/条,试纸条检测1 ng/mL的ZEN样品时,抑制率达到27.89%;当T线ZEN-BSA质量浓度为10ng/mL,hAuNPs@mAbs用量为4 μL/条,检测1 ng/mL的ZEN样品时,抑制率达到43.8%。此时,两种胶体金试纸条T线与C线均具有合适的显色信号(cAuNPs-ICA:OD=977±10,OD=183±16;hAuNPs-ICA:OD=801±17,OD=850±30)。因此,cAuNPs-ICA的最佳制备工艺为T线抗原喷涂质量浓度2.5×10ng/mL,探针用量5 μL/条。hAuNPs-ICA的最佳制备工艺为T线抗原喷涂质量浓度10ng/mL、探针用量4 μL/条。
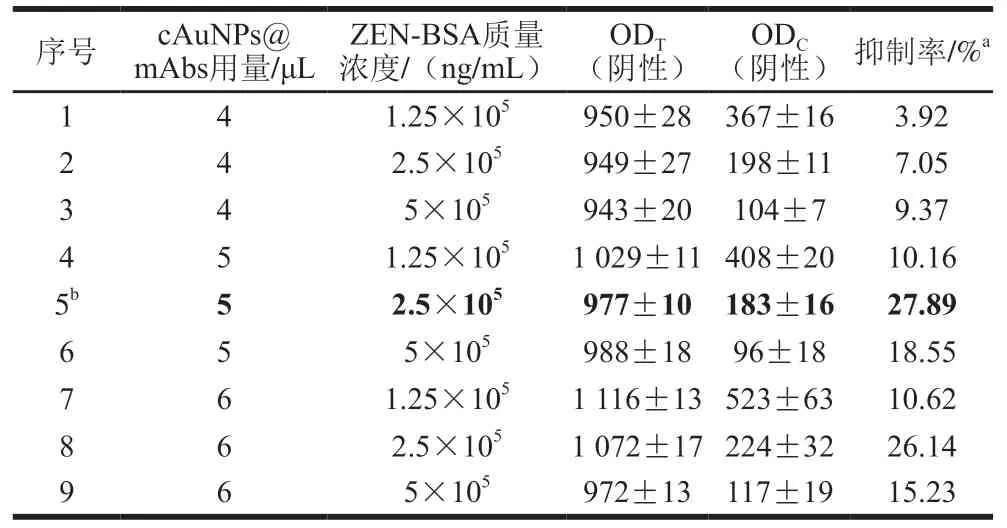
表1 cAuNPs-ICA制备参数2因素3水平正交试验优化Table 1 Orthogonal array design and experimental results for parameter optimization for preparation of cAuNPs-ICA
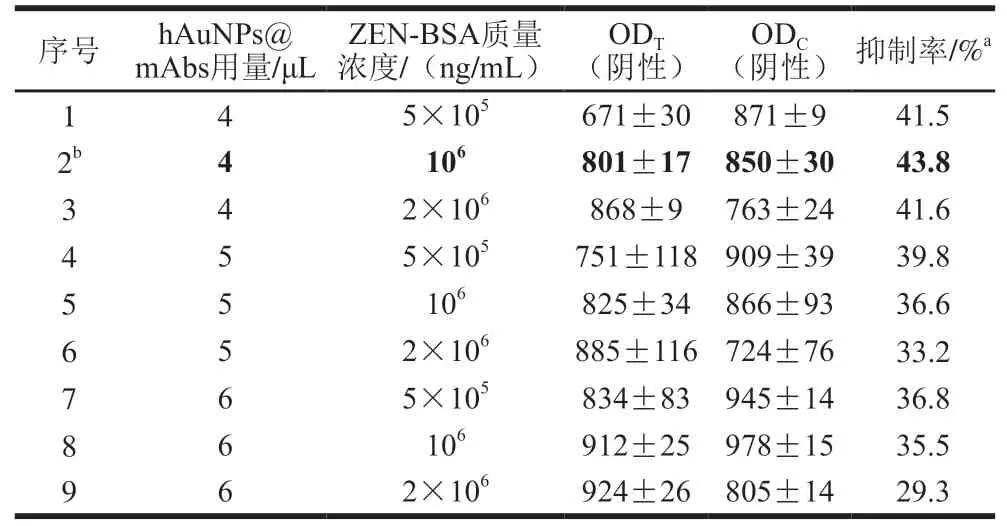
表2 hAuNPs-ICA制备参数2因素3水平正交试验优化Table 2 Orthogonal array design and experimental results for parameter optimization for preparation of hAuNPs-ICA
2.4 两种胶体金试纸条检测ZEN的标准曲线
在最优条件下,用两种胶体金试纸条检测PBS 7.4(0.01 mol/L)配制质量浓度为0~1 500 ng/mL的ZEN样品。如图7A所示,cAuNP-ICA与hAuNP-ICA定量检测ZEN均呈良好的线性相关。如图7B所示,当ZEN质量浓度介于0.488~31.253 ng/mL时,满足线性回归方程=-0.153ln+0.864(=0.978 8),经计算得cAuNPICA的IC为10.795 1 ng/mL,LOD为0.843 7 ng/mL;酰肼方法的线性回归方程为=-0.124ln+0.701 5(=0.990 1),检测范围为0.2~100 ng/mL,IC为5.078 ng/mL,LOD为0.201 7 ng/mL。以上结果表明酰肼介导的定向偶联抗体策略有助于提高试纸条的检测灵敏度。因此,本研究选用该法用于后续实际玉米样本中ZEN的检测。
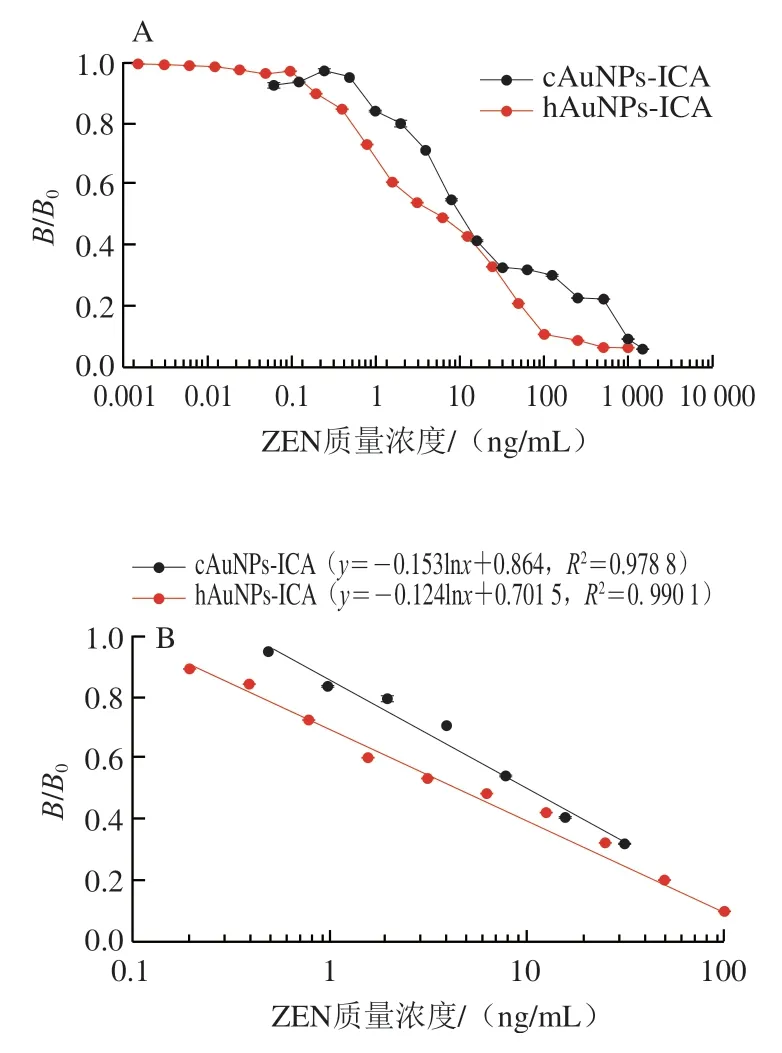
图7 cAuNPs-ICA和hAuNPs-ICA在PBS中检测ZEN的标准曲线Fig.7 Calibration curves for ZEN detection based on cAuNPs-ICA and hAuNPs-ICA
2.5 hAuNPs-ICA的性能评价
2.5.1 检测参数的优化
将hAuNPs-ICA应用于玉米样本中ZEN的检测,以评价其在实际样本中的检测性能。由于ZEN是一种脂溶性真菌毒素,在提取过程中通常需要添加较高浓度的乙腈或甲醇以提高ZEN的提取得率,而高浓度的有机溶剂会极大地破坏抗原-抗体的亲和力,因此,本研究首先优化溶液中乙腈体积分数对试纸条检测性能的影响。如图8A所示,当溶液中乙腈体积分数逐渐增加,竞争抑制率由39%下降至15%。说明随着乙腈体积分数的增加,抗体-抗原的反应效果越来越差,从而影响试纸条的检测性能。综合考虑试纸条灵敏度以及样本稀释倍数两个因素,最终选取溶液中乙腈体积分数为5%作为后续实验条件。其次,溶液的pH值也会影响抗原-抗体的反应效率,因此进一步优化了检测体系的pH值。如图8B所示,试纸条检测阴性样本的ODT/ODC值随着pH值的升高而降低(由1.2±0.06下降至0.84±0.04),说明抗原-抗体的结合效率在下降。当溶液pH 5.0时,试纸条的竞争抑制率达到最高(43%),因此确定最佳反应pH 5.0。
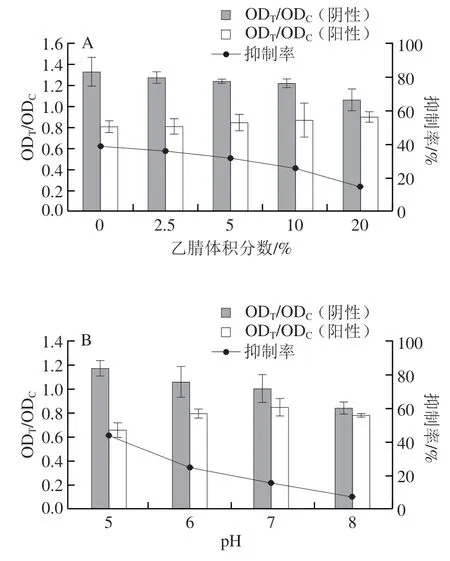
图8 hAuNPs-ICA检测参数的优化Fig.8 Optimization of detection parameters of hAuNPs-ICA
2.5.2 玉米样本中ZEN的标准曲线
为减少玉米样本基质对检测结果准确性的影响,采用阴性玉米提取液配制质量浓度为0~10 000 ng/mL的ZEN标准溶液。图9显示,ZEN质量浓度在0.25~250 ng/mL范围内,hAuNPs-ICA定量检测ZEN呈良好线性相关,其线性回归方程为=-0.122ln+0.778 1(=0.984 5),根据方程计算出IC为9.4 ng/mL,LOD为0.32 ng/mL。
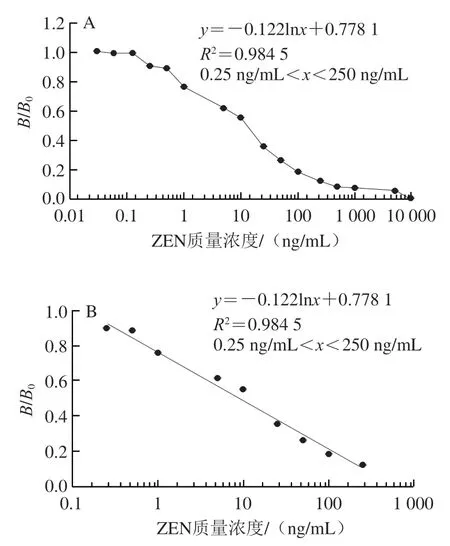
图9 hAuNPs-ICA检测玉米样本中ZEN的标准曲线Fig.9 Calibration curves for ZEN detection in corn based on hAuNPs-ICA
2.5.3 试纸条精密度、准确度及特异性评价
在玉米阴性样本中添加量分别为1、10、100 μg/kg的ZEN 标准品,进行批间及批内加标实验,评价hAuNPs-ICA的准确度和精密度。如表3所示,试纸条批内和批间的回收率在83.1%~118.0%之间,变异系数在3.9%~13.1%之间,表明hAuNPs-ICA具有良好的准确度和精密度。进一步选取粮食污染中常见的7 种真菌毒素进行试纸条的特异性评价,包括赭曲霉毒素A、伏马菌素B、黄曲霉毒素B、黄曲霉毒素B、黄曲霉毒素G、橘青霉毒素、呕吐毒素,并将质量浓度配制为1 000 ng/mL。结果表明本研究建立的hAuNPs-ICA与以上7 种真菌毒素无交叉反应,表明本研究方法检测ZEN具有良好的特异性。
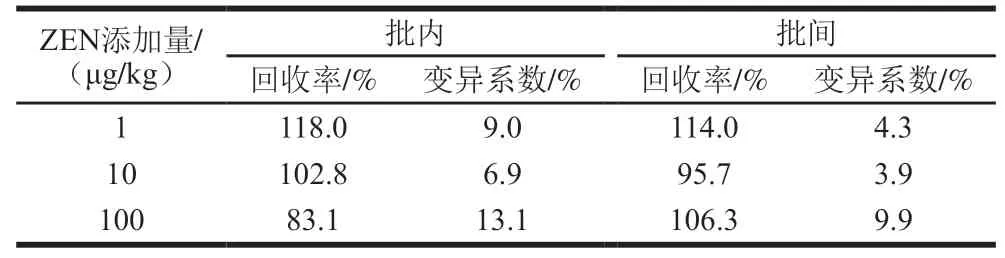
表3 hAuNPs-ICA精密度与准确度评价Table 3 Precision and accuracy of hAuNPs-ICA
2.5.4 与UPLC方法的相关性评价
取17 份经商业化ELISA试剂盒检测为阳性的玉米样本,使用酰肼法和UPLC方法同时检测。以hAuNPs-ICA测定结果为横坐标,UPLC方法的测定结果为纵坐标,绘制二者的相关性曲线。如图10所示,hAuNPs-ICA与UPLC的检测结果有较好的相关性(=0.962 7),表明该方法可应用于真实玉米样品中ZEN的定量检测。

图10 hAuNPs-ICA方法与UPLC方法对比(n=17)Fig.10 Correlation between the results of hAuNPs-ICA and UPLC (n=17)
3 结论
建立了一种利用胶体金纳米粒子表面的酰肼基团与抗体Fc片段醛基发生亲核反应,从而实现抗体在金纳米粒子表面定向共价偶联的新方法。该方法与常规碳二亚胺共价法相比具有以下优势:1)偶联过程无需额外添加其他偶联反应试剂;2)抗体饱和标记量更低(0.12 mg/pmol);3)偶联时间更短(10 min);4)基于hAuNPs-mAbs探针制备的试纸条检测ZEN具有更高的灵敏度(0.2 ng/mL),以及更宽的定量检测范围(0.2~100 ng/mL)。以上结果表明hAuNPs金作为一种新型标记材料在提高免疫层析方法检测性能方面具有广泛的开发应用价值。

