四种救护陆龟粪便菌群组成分析
张笑颖 邹洁建 肖嘉杰 陆宇燕 李丕鹏 古河祥 杨光大 侯方晖
(1.沈阳师范大学两栖爬行动物研究所,沈阳,110034;2.广东省野生动物监测救护中心,广州,510660)
存在了几十亿年的微生物已融合到各生物群落中,经过长期的自然选择与宿主形成亲密的共生关系。动物肠道是一个动态的生态系统,动物机体生理条件(饮食类型、疾病等)和外界环境都会对肠道内微生物产生影响[1],以肠道微生物菌群的组成和相对丰度等指标差异呈现出在不同物种和同种个体之间的差异[2]。Zhang等[3]通过对我国南方4种养殖蛇(舟山眼镜蛇Najaatra、滑鼠蛇Ptyasmucosa、王锦蛇Elaphecarinata、尖吻蝮Deinagkistrodonacutus)的粪便微生物区系对比分析发现,肠道微生物菌群的组成和多样性在种内更为相似、种间差异极为明显,表明同类但不同物种之间肠道微生物区系具有自身的独特性,并在同类个体之间具有一定的相似性。相似的研究结果也在不同种鹿科(Cervidae)动物的瘤胃菌群组成分析[4]中得到了很好的印证。
陆龟(Testudinidae)主要是草食性(生活在雨林中的陆龟是以植物为主的杂食性),对纤维素的消化利用更依赖于相对稳定的、具有特定功能的肠道群落[5]。目前爬行动物肠道微生物的研究主要集中在蛇类(Serpentiformes)和蜥蜴类(Lacertifomes),龟鳖类(Testudoformes)的研究相对较少[6]。本研究选取来自温暖潮湿原始生境的缅甸陆龟(Indotestudoelongata)和豹龟(Stigmochelyspardalis),以及来自干旱炎热原始生境的苏卡达陆龟(Centrochelyssulcata)和辐射陆龟(Astrochelysradiata),通过分析4种陆龟的粪便微生物菌群构成,揭示肠道微生物结构特征,旨在积累相关的生物学资料。
1 材料与方法
1.1 试验动物及样品采集
试验在广东省野生动物监测救护中心完成,选取在救护中心饲养半年以上的苏卡达陆龟、豹龟、辐射陆龟和缅甸陆龟,观察取样期间常规投食。依据背甲长推算大致年龄(公式为样本背甲长/成体背甲长,选取结果在0.5~0.8的个体),选择相近年龄段的个体(表1),每种陆龟一组7只,依次标记为S1~S7(苏卡达陆龟)、B1~B7(豹龟)、F1~F7(辐射陆龟)、M1~M7(缅甸陆龟)。由于陆龟排便时间不确定,试验前一天下班前清理龟场粪便,试验当天一早选择较为新鲜的粪便取样,以保证样本的新鲜。取材时避免样本被污染,仅取粪便中心部分,并将取出的样本置于灭菌的离心管内-20 ℃保存,待所有样品采集完毕后送往上海派森诺生物科技股份有限公司进行微生物多样性测序分析。由于苏卡达陆龟样本中2个样本出现异常,剔除后最终得到26个样本。
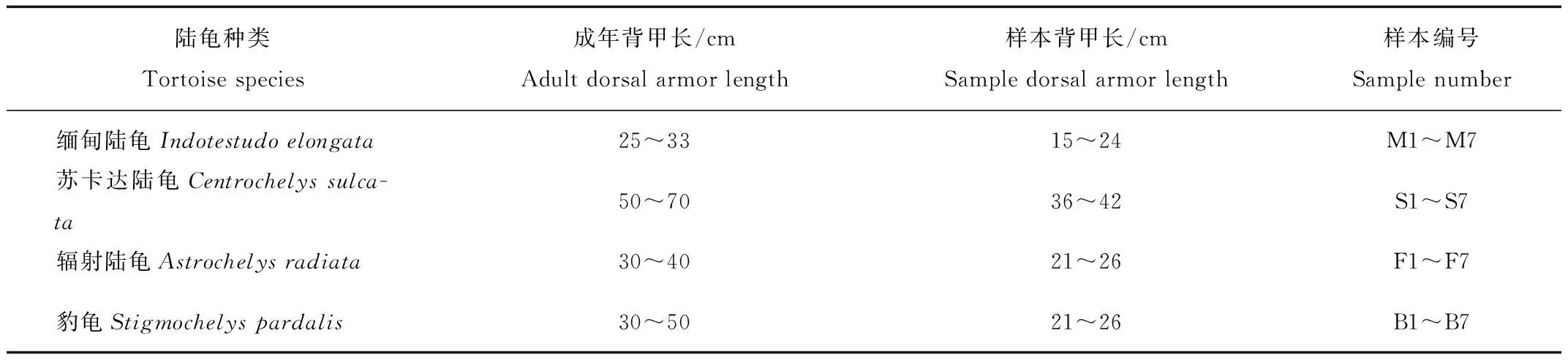
表1 4种救护陆龟样本分组信息
1.2 微生物多样性分析
使用Illumina公司NovaSeq PE250测序平台进行16S rRNA测序。通过1.2%琼脂糖凝胶电泳对样品DNA进行检测与质量提取,采用NanoDrop紫外定量设备进行紫外分光光度检测。采用NEB公司的Q5高保真DNA聚合酶,用引物(正向引物5′-ACTCCTACG GGAGGCAGCA-3′;反向引物3′-GGACTACHVGGGTWTCTAAT-5′)对样本中细菌16S rRNA的可变区V3—V4基因片段进行PCR扩增。扩增体系为25.00 μL:5.00 μL 5×反应缓冲液,5.00 μL 5×GC缓冲液,2.00 μL 2.5 mmol·L-1dNTP,1.00 μL 10 μmol·L-1正向引物,1.00 μL 10 μmol·L-1反向引物,2.00 μL DNA模板,8.75 μL ddH2O以及0.25 μL Q5 DNA聚合酶。扩增参数:98 ℃预变性5 min;98 ℃变性30 s,52 ℃退火30 s,72 ℃延伸45 s,25次循环;最终72 ℃延伸5 min。
采用QIIME 2(2019.4)完成序列质控、去噪、聚类等步骤以及物种组成和多样性分析。应用Alpha多样性方法,通过Chao Ⅰ、Observed species、Shannon和Simpson 4个指标分析样本物种多样性和丰富度;使用Beta多样性分析,通过基于unweighted UniFrac距离生成的非量度多维尺度分析(NMDS)评价样本组间差异。利用Python LEfSe包等进行LEfSe分析,寻找分组之间稳健的差异物种即标志物种。采用Excel进行数据初步整理,由SPSS软件通过单因素ANOVA分析,在经过方差齐性检验后分析组间是否存在显著差异。菌群名称和分类引用生物医药大辞典(https://lpsn.dsmz.de/)。
1.3 16S rRNA功能预测分析
采用PICRUSt 2功能预测分析,根据最新的Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库信息,通过将现有的16S rRNA基因测序数据与代谢功能已知的微生物参考基因组数据库比对,了解检测样本中菌群功能的潜能。
2 结果与分析
2.1 微生物组成和结构特征
通过QIIME 2软件对4种陆龟共计26个粪便样本进行测序分析,采用DADA2方法对序列进行去噪等步骤,获得去重序列(amplicon sequence variants,ASVs)。
稀疏曲线显示在测序深度为20 000时序列数量基本稳定,表明测序深度可以真实反映样本的基本情况(图1)。所有样品中,获得平均长度为414.95 bp的1 615 523个有效序列。缅甸陆龟、苏卡达陆龟、辐射陆龟和豹龟的平均有效序列数量分别为98 413、95 843、95 024和110 192;ASV数量从低到高分别是:苏卡达陆龟(12 458个)、豹龟(12 631个)、辐射陆龟(12 973个)、缅甸陆龟(13 770个)。4种陆龟共享的ASV仅617个,苏卡达陆龟和豹龟共享1 480个ASV、缅甸陆龟和苏卡达陆龟共享1 556个ASV、辐射陆龟和苏卡达陆龟共享1 574个ASV、缅甸陆龟和辐射陆龟共享2 222个ASV、缅甸陆龟和豹龟共享2 598个ASV、辐射陆龟和豹龟共享2 611个ASV(图2)。

图1 4种陆龟粪便微生物的稀疏曲线Fig.1 Analysis of sparsity curves of the four tortoise species 注:M.缅甸陆龟;S.苏卡达陆龟;F.辐射陆龟;B.豹龟。下同 Note:M,Indotestudo elongate.S,Centrochelys sulcata.F,Astrochelys radiata.B,Stigmochelys pardalis.The same as below
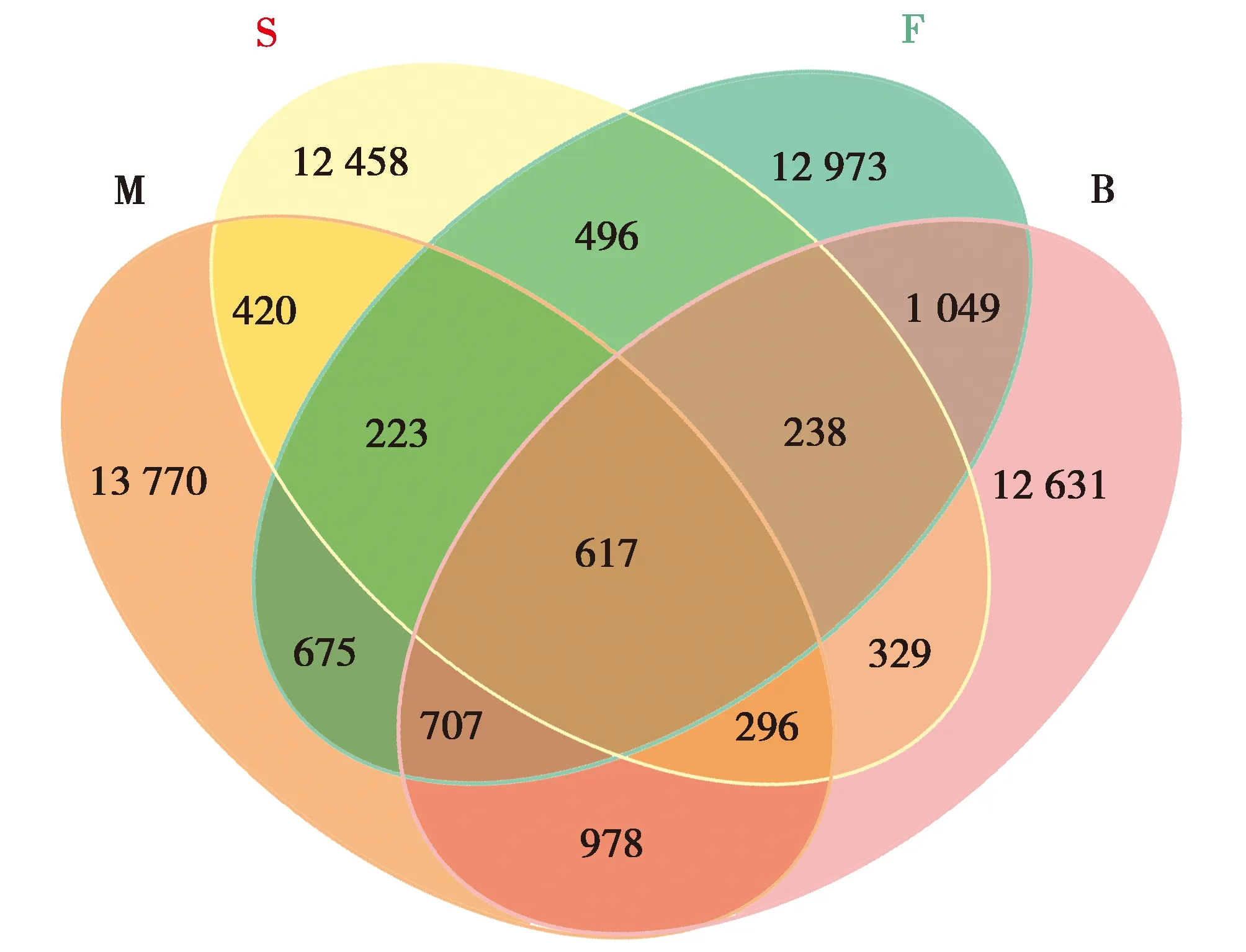
图2 4种陆龟粪便微生物的venn图Fig.2 Venn diagram showing shared and specific ASVs among the fecal microorganisms of four tortoise species
全部样本检测到并注释的微生物共包含18个门,相对丰度大于0.1%的菌门共有10个(图3),依相对丰度数值大小位列前4的是厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、互养菌门(Synergistetes)和变形菌门(Proteobacteria)。4种陆龟样本中,厚壁菌门的相对丰度最高,均在50%以上,其中辐射陆龟样本相对丰度最高[缅甸陆龟(56.47%±7.64%)、苏卡达陆龟(59.77%±8.24%)、辐射陆龟(70.04%±8.12%)、豹龟(59.01%±16.70%)],缅甸陆龟与辐射陆龟组间存在显著性差异(P=0.046)。拟杆菌门相对丰度(20.93%~35.64%)均位列第二,其中豹龟样本最高[缅甸陆龟(32.02%±9.66%)、苏卡达陆龟(27.33%±10.88%)、辐射陆龟(20.93%±7.34%)、豹龟(35.64%±16.51%)],辐射陆龟与豹龟组间存在显著性差异(P=0.041)。互养菌门相对丰度(0.72%~6.10%)位列第三,其中苏卡达陆龟样本最高,豹龟样本最低且小于1%[(缅甸陆龟(2.59%±1.60%)、苏卡达陆龟(6.10%±4.53%)、辐射陆龟(3.10%±1.26%)、豹龟(0.72%±0.38%)],辐射陆龟与豹龟组间存在显著性差异(P=0.015)。变形菌门相对丰度(1.95%~4.58%)位列第四,缅甸陆龟相对丰度最高[缅甸陆龟(4.58%±3.22%)、苏卡达陆龟(2.18%±0.75%)、辐射陆龟(3.65%±1.66%)、豹龟(1.95%±0.46%)],4种龟组间均无显著性差异。另外,厚壁菌门与拟杆菌门的比值(F/B)豹龟最低[缅甸陆龟(1.76±0.91)、苏卡达陆龟(2.19±1.88)、辐射陆龟(3.35±2.11)、豹龟(1.66±4.43)]。

图3 4种陆龟门水平大于0.1%菌门的相对丰度Fig.3 Relative abundance of four tortoise species greater than 0.1% phylum at phylum levels
属水平分析(表2)显示,检测标本中完成匹配的菌属共有559个。从4种龟粪便样本相对丰度之和看,排列在前50的菌属(分析软件仅提供前50的数据)在整体中的占比没有超过40%(辐射陆龟38.85%,缅甸陆龟32.68%、豹龟30.71%和苏卡达陆龟19.29%)。相对丰度大于1%的菌属,豹龟样本共有8个菌属,相对丰度最高的菌属是普雷沃氏菌属(Prevotella);缅甸陆龟和辐射陆龟样本均含有5个菌,相对丰度最高的菌属均为氨基酸球菌属(Acidaminococcus),后者虽大于前者3倍以上,但两者间无显著差异;苏卡达陆龟样本仅有4个菌属,相对丰度值最高的是梭菌科-梭菌属(Clostridiaceae-Clostridium)。此属也是4种龟粪便样本中唯一一个相对丰度均大于1%的菌属。

表2 4种陆龟粪便菌群前10菌属相对丰度
在相对丰度前10的菌属中,仅有2个菌属在相应的龟种间呈显著差异,其中八叠球菌属(Sarcina)在苏卡达陆龟和辐射陆龟之间呈显著性差异,粪球菌属(Coprococcus)在豹龟与缅甸陆龟、苏卡达陆龟、辐射陆龟间均呈显著性差异。
2.2 微生物多样性与物种差异
4种陆龟微生物群落的Alpha多样性统计(图4)显示,Shannon,Simpson,ChaoⅠ及Observed species指数均无显著差异(P>0.05),其中苏卡达陆龟在代表多样性的Shannon和Simpson指数最高(Shannon=8.85±0.70,Simpson=0.98±0.01),但代表物种丰富度、对稀有物种更敏感的ChaoⅠ指数最低(3 687.25±661.22)。

图4 4种陆龟粪便微生物Alpha多样性Fig.4 Alpha diversity of microorganisms in fecal samples of four tortoise
非量度多维尺度分析(NMDS,图5)表明,4种陆龟共26个样本中有21个样本是聚集在中央位置的,仅有缅甸陆龟的2个样本和苏卡达陆龟的3个样本散在较远处,显示了4种陆龟粪便样本具有一定的共性。4种龟中豹龟和辐射陆龟样本的聚集性较好,即个体间的差异较小。而苏卡达陆龟和缅甸陆龟样本聚集性明显较前两者差,苏卡达陆龟尤其明显。从图形看,缅甸陆龟和豹龟,辐射陆龟和苏卡达陆龟呈现了明显的“重合”现象,尤其是缅甸陆龟和豹龟。
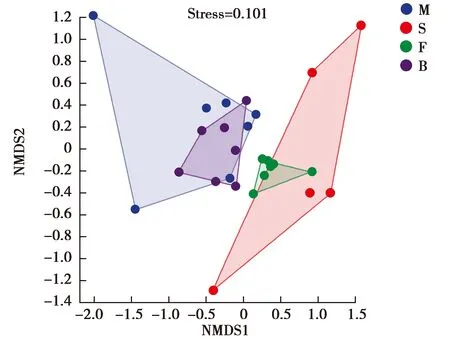
图5 4种陆龟粪便微生物NMDS分析结果Fig.5 NMDS analysis of fecal flora of four tortoise species
LEfSe分析中,LDA阈值取3,结果显示4种陆龟粪便样本具有提供相互区分的标志物种,它们是缅甸陆龟样本中厚壁菌门中韦荣球菌科(Erysipelotrichaceae)、苏卡达陆龟样本中互养菌门中Synergistaceae菌科、辐射陆龟样本中拟杆菌门的理研菌科(Rikenellaceae)和变形菌门的伯克氏菌目(Burkholderiales),豹龟样本中拟杆菌门的[Paraprevotellaceae]和S24_7菌科(图6A)。
图6 4种陆龟粪便微生物LEfSe分析结果Fig.6 Results of fecal microbial LEfSe analysis of four tortoise species 注:节点大小表示该分类单元的平均相对丰度;空心节点代表组间差异不显著的分类单元;不同颜色节点分别代表组间显著差异的分类单元,且在对应组样本中丰度较高 Note:The node size indicates the average relative abundance of the taxonomic unit.Hollow nodes represent taxonomic units that do not differ significantly between groups.Different color nodes represent the classification units that are significantly different between groups and have higher abundance in the corresponding group samples,respectively
若将NMDS分析中两两相聚,即缅甸陆龟与豹龟和辐射陆龟与苏卡达陆龟的样本进行LEfSe分析,结果显示:缅甸陆龟样本标志物种有3个菌门的4个属,它们是放线菌门(Actinobacteria)中Paraeggerthella菌属、互养菌门的vadinCA02菌属和厚壁菌门中Sedimentibacter和Bulleidia菌属。豹龟标志物种有2个门中1科和1属,它们是拟杆菌门的S24_7菌科和厚壁菌门中的芽孢杆菌属(Bacillaceae_Bacillus)(图6B)。苏卡达陆龟和辐射陆龟间,苏卡达陆龟标志物种有3个门中的1个目3个科,它们是疣微菌门(Verrucomicrobia)中的RFP12菌科、拟杆菌门的p_2534_18B5菌科、变形菌门中的Campylobacterales菌目和Comamonadaceae菌科。辐射陆龟的标志物种有4个门中的3个目、3个科以及9个属,它们是OP11菌门的d153目;拟杆菌门的[Paraprevotellaceae]菌科、理研菌科、Paludibacter菌属;变形菌门立克次氏体目(Rickettsiales)和Coxiellaceae科以及Heraspirillum、草酸杆菌属(Oxalobacter)、嗜胆菌属(Bilophila) 3属;厚壁菌门中的SHA_98目和八叠球菌属、优杆菌属(Pseudoramibacter_Eubacterium)、Dorea、rc4_4、费氏刺骨鱼菌属(Epulopiscium)5个属(图6C)。
2.3 功能预测分析
比对4种陆龟粪便微生物菌群的ASVs与KEGG数据库核心生物代谢通路分析数据,注释后得到KEGG代谢通路预测结果。所有样品共涉及6类一级生物代谢通路和31个第二级代谢通路子功能。代谢通路中的二级代谢通路子功能菌群丰度值最为突出,丰度由高到低排序前4位依次为碳水化合物代谢、氨基酸代谢、辅助因子和维生素的代谢以及萜类化合物和聚酮类化合物的代谢等。
4种陆龟粪便样本的KEGG三级代谢通路中,缅甸陆龟与豹龟间有7个存在显著性差异(表3),苏卡达陆龟与辐射陆龟之间有9个显示存在着显著性差异(表4)。另外,值得注意的是在4种陆龟样本中均有一定菌群丰度的丁酸和丙酸代谢通路,在丁酸代谢通路中菌群丰度依次为苏卡达陆龟(291.03)、辐射陆龟(284.75)、缅甸陆龟(276.03)、豹龟(257.68),其中苏卡达陆龟和豹龟间具显著性差异(P=0.024),缅甸陆龟和豹龟间具显著性差异(P=0.042)。在丙酸代谢通路中菌群丰度依次为:苏卡达陆龟(303.59)、缅甸陆龟(285.49)、豹龟(275.28)、辐射陆龟(262.92),其中缅甸陆龟(P=0.032)和苏卡达陆龟(P=0.019)分别与辐射陆龟存在组间差异性。提示了4种陆龟粪便菌群结构与宿主代谢功能间存在共性,各自也有不同的特点,且菌群在为其宿主利用饲料及完成营养物质转换过程中起到非常重要的作用。
3 讨论
3.1 爬行类肠道菌群的共性
肠道微生物在经历了与宿主长期的生存磨合和协同进化后,在菌群结构和功能上均表现出了辅助宿主适应新环境的趋势[7]。虽然有学者指出样本取自肠道黏液和内容物与样本取自粪便的研究结果存在一定的差异,但更多的研究证实两类不同取材方式获得的样本,其含有的菌群组成具有很大的相似性,即粪便样本可以间接反映出肠道微生物菌群的特点[8]。通过对野生食鱼蝮(Agkistrodonpiscivorus)肠道和泄殖腔[9],野生虎斑颈槽蛇(Rhabdophistigrinus)肠道和泄殖腔[10],人工养殖的滑鼠蛇、眼镜蛇、王锦蛇、尖吻蝮、赤峰锦蛇(Elapheanomala)和棕黑锦蛇(E.schrenckii)粪便[3,11]等的研究发现蛇类肠道和粪便微生物菌门均以厚壁菌门、拟杆菌门和变形菌门作为优势菌群;对短吻鳄(Osteolaemustetraspis)胃肠道及粪便[12]和扬子鳄(Alligatorsinensis)胃肠道及粪便[13]的研究指出2种鳄鱼粪便微生物菌门均以变形菌门、梭杆菌门、拟杆菌门和厚壁菌门作为优势菌群;对淡水龟红耳龟(Trachemysscriptaelegans)和四眼斑水龟(Sacaliaquadriocellata)粪便[14]、绿海龟(Cheloniamydas)泄殖腔粪便[15]和佛州穴陆龟(Gopheruspolyphemus)粪便[5]的研究显示龟类泄殖腔和粪便微生物菌门均以拟杆菌门、厚壁菌门和变形菌门为优势菌群。本研究中4种陆龟粪便微生物相对丰度前3的菌门为厚壁菌门、拟杆菌门和变形菌门,与已报道的爬行动物肠道和粪便微生物的优势菌门相似,显示了爬行动物胃肠道和粪便微生物菌群的共性。

3.2 食草动物肠道菌群的共性
反刍动物特化的瘤胃中生存着大量复杂的厌氧细菌等共生微生物菌群,当食物进入后就成了一个天然发酵场[16],这些菌群可以将进食的纤维素逐步分解,形成在肠道中较容易消化利用的较小分子团。瘤胃菌群中门水平以厚壁菌门和拟杆菌门为主,2个菌群的比例一般为0.8~3.0[4,17-18]。反刍动物主要依靠厚壁菌门成员利用碳水化合物,而拟杆菌门成员则是分解纤维素的主要菌群[19],两者比值(F/B)也在一定程度上代表宿主对能量的利用能力,即比值越高更易促进宿主储存能量,并且较高丰度的拟杆菌门更利于宿主分解植物多糖并从中获能[4]。Yuan等[5]探究了后肠发酵的佛州穴陆龟粪便微生物菌群特征,结果表明此陆龟粪便中微生物菌群组成与多种后肠发酵哺乳动物更为相似,推测可能基于饮食和消化形态(后肠发酵)的相似。本研究中的4种陆龟均属于草食性后肠发酵动物,样本均显示出厚壁菌门和拟杆菌门具有绝对优势的相对丰度数值,并且4种陆龟的F/B比值(1.66~3.35)与反刍动物瘤胃内情况基本吻合,此结果提示了4种陆龟样本菌群中在门水平上具有与其他草食性动物相一致的特点。
反刍动物瘤胃菌群在属水平上,丰度占比较高的有普雷沃氏菌属、琥珀酸菌属(Succiniclasticum)、瘤胃球菌属、粪球菌属、梭菌属和理研菌科等[4,17,20]。研究表明以上菌群是瘤胃中降解植物纤维素的主要微生物,可生产出大量的纤维素酶,有助于纤维素的转化[21]。本研究中4种陆龟样本中拟杆菌门的普雷沃氏菌属,厚壁菌门的梭菌属、瘤胃球菌属、粪球菌属的相对丰度有着明显差别,但相对丰度均位列前10,提示了陆龟与反刍动物之间均借助于相似的可分解纤维素的微生物,以达到利用植物性食物中含有的营养与能量。其中反刍动物瘤胃中高丰度的琥珀酸菌属等是爬行类后肠发酵动物(草食性爬行动物)所没有发现的,陆龟和反刍动物由于胃肠道的生理状态不同,其粪便所含菌群也存在一定的区别,但体现了相似的食性与相似的菌群之间的对应关系。
3.3 不同陆龟肠道菌群的特点
有学者认为,个体遗传特质决定了其代谢特点,胃肠道生理状态的差异势必会导致胃肠道微生物菌群的差异[22-23]。食物与其他因素相比,可以更直接地影响着胃肠道理化特征,因此在肠道菌群结构的动态平衡中起着决定性作用[24-25]。另有研究显示,在饥饿或者改变食物后,肠道菌群可以在短时间内(6 h~11 d)迅速重建新的动态平衡[26-27]。赵佩华[28]分析来自5个大洲人群的粪便微生物,在uniFrac距离的箱线图发现:肠道菌群成员组成在同一家庭中有血缘关系人之间的距离要小于没有血缘关系(如父母)之间的距离,但肠道菌群的结构却没有显著差异。因为家庭成员之间共享类似的生活方式、饮食习惯和生活环境,因此遗传信息是唯一的差别。4种陆龟在救护中心相同环境下,投喂相同饲料的时间达半年以上,不同个体肠道微生物菌群已处于相对稳定且相似的状态(Alpha多样性组间无显著差异)。Beta多样性反映组间微生物群落的差异,NMDS分析结果中显示了“两两聚集”的现象,4种陆龟在门水平和属水平上相对丰度排序中均有明显的差异,LEfSe分析结果显示4种陆龟都有各自的标志菌,均提示4种陆龟存在着明显的种间差异性,那么导致它们肠道菌群差异的根本因素在很大程度上取决于其自身的遗传特质,而详细结论还有待于深入研究。
本研究中发现了2个较为特殊的菌属,且相对丰度值不低,它们是氨基酸球菌属和费氏刺骨鱼菌属。氨基酸球菌属是严格厌氧菌,有研究在人类粪便中检测出此菌属[29],以氨基酸特别是谷氨酸作为其主要能源(http://www.hopebiol.com/);费氏刺骨鱼菌属是1985年在栖息于红海、澳大利亚等地浅水区刺尾鱼肠道中被发现的一种长达0.7 mm的杆状细菌[30]。这2个菌属在已有的关于爬行动物肠道微生物研究中并未见报道,它们出现在4种陆龟粪便样本中的意义,有待深入研究。
4种陆龟均有很大一部分未知和未分类菌属(超过60%),其中苏卡达陆龟相对丰度前50菌属的相对丰度之和最低,Alpha多样性显示代表多样性的Shannon和Simpson指数在4种陆龟中最高,但代表物种丰富度、对稀有物种更敏感的ChaoⅠ指数最低,说明4种陆龟粪便微生物菌群还有很多的未知菌种,存在很大的探索空间。
致谢:感谢广东省野生动物监测救护中心徐锦兴、毛学群、成鉴荣和梁颖琳在动物饲养和取材中的帮助。

