仿生抗体的制备及应用*
尹会敏,刘 培,于 苗,周沫茏,栗 慧,魏玉文,魏 东
(1 河北北方学院河北省农产品食品质量安全分析检测重点实验室,河北 张家口 075000;2 河北北方学院农林科技学院,河北 张家口 075000;3 张家口市动物卫生监督所,河北 张家口 075000)
仿生抗体,也称分子印迹聚合物(molecularly imprinted polymer,MIPs),是一种利用MIT制备的含抗体或酶专一性的识别材料。由于其实用性强,稳定性好,结构预定,制备简单,能特异性识别靶物质,对极端环境具有很强的耐受能力,常常代替传统的生物抗体用于复杂基质中目标化合物的定性和定量分析[1]。随着对MIT的不断研究,仿生抗体已广泛应用于色谱(chromatograph)、固相萃取、模拟酶和仿生传感器等各个领域。同时,也在食品、环境和生物样品的分离、纯化和富集分析中展示出广阔的应用前景。本文就仿生抗体的制备及应用进行了介绍,并对仿生抗体目前存在的问题和发展前景进行了分析。
1 仿生抗体的制备
1.1 分子印迹技术(MIT)
MIT是由20世纪中期发展起来的一种具有特定选择性和亲和性的新型聚合技术。它的思想起源于免疫学抗体形成学说中“一把钥匙一把锁”的概念[2-3],是指以某一特定的目标分子为模板,通过交联聚合反应制备具有特异识别位点的聚合物的过程。“分子印迹”的概念是1949年由Dickey[4]提出的,被称为“分子印迹的萌芽”,但在以后的发展过程中并没有引起太多的关注。1972年,Wulff等[5]成功制备出共价型MIPs,为MIT的发展创造了新思路。1993年,瑞典科学家Mosbach等[6]在《Nature》上发表了运用自组装法制备茶碱MIPs的报道,使得MIPs的制备工艺简单、制备效果显著,MIT随即便成为学术界的研究热点。如今,MIT在生物传感器、食品分析、临床医学等各个领域得到了快速发展。全球至少数十个国家、上百个团队和学术科研机构在从事MIT的研究和开发工作。分子印迹示意图如图1所示。

图1 分子印迹示意图[7]Fig.1 Schematic diagram of mdecular imprinting
1.2 仿生抗体的基本原理
MIPs的基本原理是将目标物质(模板分子)与功能单体按一定比例将加入到合适的溶剂中相互作用,形成多个操作点,再加入适当的交联剂和引发剂,使其发生交联聚合反应,形成初始配合物。运用物理或化学手段去除模板分子,配合物形成一个特定的空间结构,再次加入目标分子,该配合物仅对目标分子表现出特异识别性[8]。
MIPs的合成步骤一般分为三步:(1)形成模板-单体复合物。将模板分子与功能单体按一定比例加入到合适的溶剂中自组装反应形成模板-单体复合物;(2)引发聚合反应。缓慢加入适当比例的交联剂和引发剂,与(1)中的复合物交联聚合,形成聚合物;(3)去除模板分子。运用物理或化学手段去除聚合物中的模板分子,使得聚合物形成一个和模板分子形态大小相同的空间结构,再次加入模板分子,该聚合物表现出识别专一性。
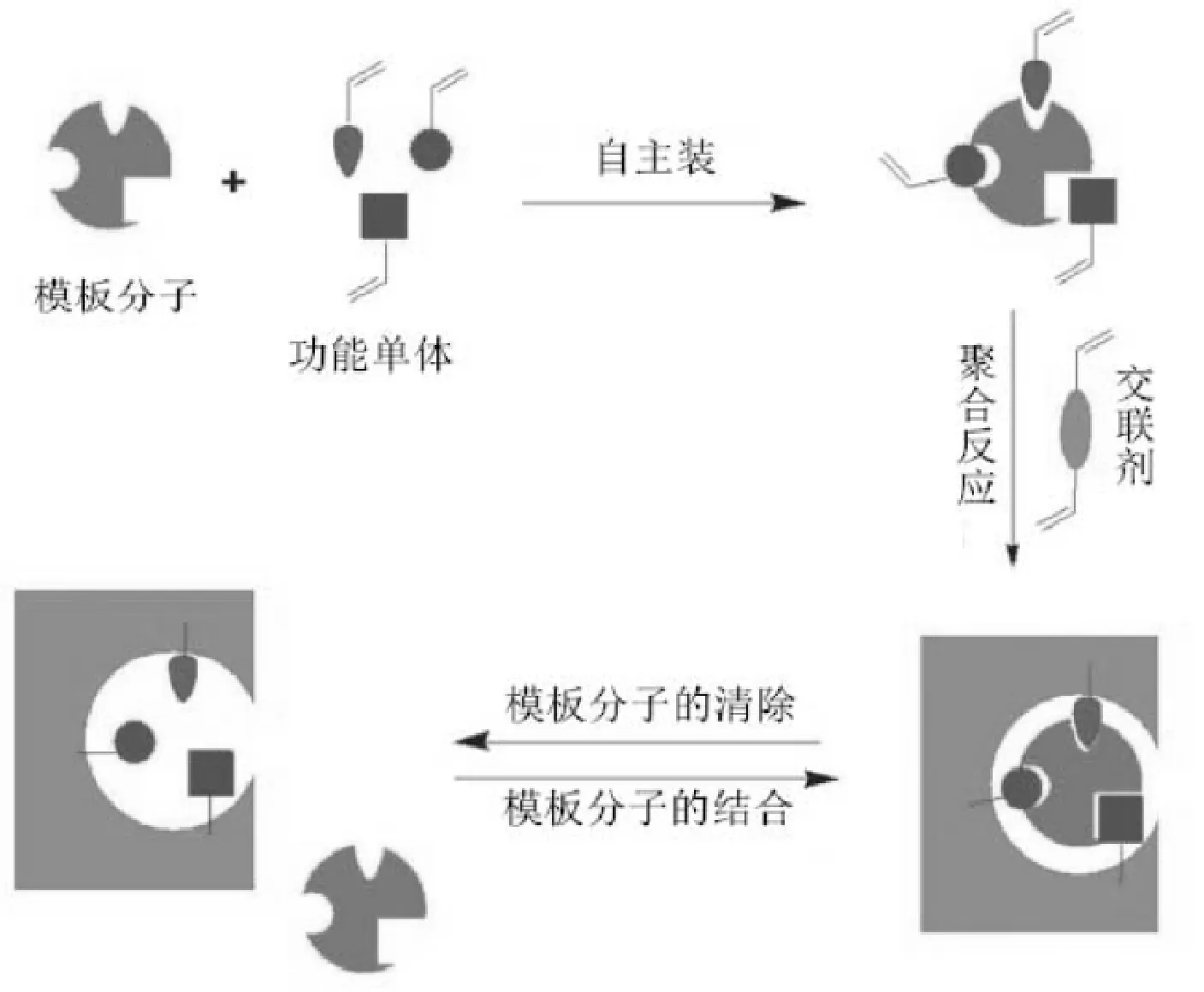
图2 仿生抗体的制备原理及过程[9]Fig.2 Scheme and processes for preparing molecular imprinting polymer
1.3 仿生抗体的制备方法
合成聚合物的分子印迹是在分子水平上创建模板的过程。与生物抗体相比,MIPs的生产通常具有良好的可重复性、快速、经济、不涉及动物。同样,MIPs的物理和化学稳定性使其能够使用各种溶剂而不会破坏识别部位。近年来,随着对MIT的深入研究,MIPs的制备方法也不断涌现。目前为止,MIPs的制备方法主要有以下几种。
1.3.1 本体聚合法
本体聚合法(Bulk Polymerization)是一种将模板分子、功能单体和交联剂等按一定比例加入到合适的溶剂中交联聚合制备块状MIPs的方法。得到的聚合物需经干燥、研磨、粉碎、筛分,得到所需粒径大小的粒子。这是目前制备MIPs研究中最常见的方法。该方法实验条件易于满足,操作简便,制备的MIPs具有良好的筛选和鉴定能力,受到研究者们的广泛欢迎[10]。Engy等[11]运用该方法和悬浮聚合法制备MIPs,对菊苣中的菊苣酸进行分离纯化。相比之下,采用本体聚合法制备的MIPs拥有更好的吸附效果。该方法沿用至今,制备简单,但研究人员发现该方法在研磨过程中容易破坏MIPs上的结合位点,导致MIPs的最终产率降低,限制了其在分析检测中的应用。
1.3.2 原位聚合法
原位聚合法(In situ Polymerization)是直接将预聚合溶液加到色谱柱或两个基板之间交联聚合,制备MIPs的方法。1993年,Matsul等[12]以D-苯丙氨酸和L-苯丙氨酸为目标分析物,采用原位聚合法制备了分子印迹整体柱。这是关于运用原位聚合法制备MIPs的首次报道。Du等[13]在SPME的细管处制备了可以特异性识别苯醚甲环唑的分子印迹整体柱,对自来水和葡萄汁中的苯醚甲环唑进行提取,检出限为0.5μg/L,回收率为87.6%~95.4%。
与本体聚合法相比,该方法无需研磨、筛分等复杂的过程,具有操作简便,实用性强,分离效果好等优点。此外,该方法制备的MIPs可以替代生物分子作为传感器的识别元件,对目标物质进行特异性检测。
1.3.3 表面印迹法
表面印迹法(Surface Molecular Imprinting)是一种以固体(SiO2、Al2O3、Fe3O4等)为载体,在其表面直接聚合反应,使其表面产生特定的可识别印迹位点的方法。运用该方法制备的MIPs,印迹位点将暴露在聚合物表面,加快了模板分子与印迹位点的结合速率。Wang等[14]以环丙沙星为模板分子,Fe3O4为磁性材料,在羧化纤维素纳米晶体表面直接聚合制备MIPs。经鉴定,该MIPs的选择性吸附容量为50 mg/g,具有适宜的饱和磁化强度,可同时应用于多种FQs的选择性鉴定。该方法克服了传统的MIPs制备方法存在的印迹位点嵌入过深、印迹分子难以洗脱等缺点,提高了聚合物的吸附容量和吸附效率[15]。但是,该方法可能会导致印迹过程中MIPs对载体的包裹不完全,导致漏磁。因此,选择合适的载体是十分必要的。
1.3.4 悬浮聚合法
悬浮聚合法(Suspension Polymerization)是添加溶有引发剂的功能单体到水或其他溶剂中,在高速搅拌下进行自由基聚合,制备得到微球型MIPs的方法。该方法操作简单、制备时间短、所获得的MIPs微球形态规则、微球粒径均匀(约10~100 μm),是用于高效液相色谱法和SPE包装的理想材料[16]。
Walsh等[17]将组胺类药物作为目标分析物,采用悬浮聚合法制备了粒径均一的MIPs,将扑尔敏和d-扑尔敏,溴非尼腊明和d-溴非尼腊明成功分离。Lian等[18]将茶氨酸作为目标分析物,采用悬浮聚合法通过控制搅拌速度制备了粒径均匀的微球型MIPs。并将MIPs与HPLC-MS联用,成功地消除了基质干扰,对岩藻毒素表现出良好的选择性。然而,该方法中水的极性过强会降低目标分析物与功能单体之间的非共价键作用,影响聚合物结构的形成,从而降低印迹效应和MIPs的最大吸附容量。
1.3.5 沉淀聚合法
沉淀聚合法(Precipitation Polymerization)的制备过程与传统的制备方法类似,是将模板分子和功能单体按一定比例加入到合适的有机溶剂中混匀,在物理条件下,制备得到一个更小粒度的微球形聚合物,微球粒径在0.2~2 μm之间。1994年,Uezu等[19]报道了水-油-水乳液体系中微球的制备,这也是关于沉淀聚合法的首次报道。近年来,为了使其得到更广泛的应用,许多研究将沉淀聚合与其他方法相结合来控制反应速率,以增加聚合物的粒径。然而,为了获得颗粒均匀的聚合物,实验条件往往比较严格,所以在选择该方法时,需要考察不同因素的影响[20]。
2 仿生抗体的应用
近年来,仿生抗体凭借自身较强的识别能力、良好的稳定性以及高选择性等优点,在SPE、传感器、膜分离、免疫分析等多个领域展现出了良好的应用前景。
2.1 分子印迹固相萃取
分子印迹固相萃取(Molecularly imprinted polymer SPE,MSPE)是以MIPs为固相萃取剂进行固相萃取的一门新技术。MSPE融合了MIT和SPE的优点,具有选择性高、稳定性好、可重复利用等特点,为样品的采集和分析提供了极大的方便。1994年,Sellergern领导的研究小组[21]以喷他脒(一种AIDS病毒的抑制药物)为模板分子,甲基丙烯酸为功能单体制备了喷他脒MIPs,将其作为MSPE吸附材料,成功分离和富集了尿中痕量的喷他脒。结果表明,该方法优于传统的固相萃取法。这也是关于MIPs应用于固相萃取的首次报道。何慧清等[22]采用沉淀聚合法制备了白藜芦醇MIPs。将聚合物与固相萃取技术结合,研究了聚合物的最佳吸附条件。结果表明,制备的微球的印迹因子为1.62。同时从花生根和茎中分离纯化白藜芦醇,结果表明,白藜芦醇的纯度为92.5%,回收率为76.2%,吸附效果显著。目前,MIPs作为固相萃取材料已成为MIPs最重要的应用方向,充分显示了MIPs和MIT在实际应用中的优越性。
2.2 分子印迹传感器
在生物传感技术中,一种生物受体(抗体、抗原、酶、细胞等)表面的固定化转换器与分析物的相互作用导致系统的物理和化学参数的变化,从而产生进一步放大和记录的信号,利用设备进行记录和处理数据[23]。分子印迹传感器的工作原理与生物传感器是相似的,但不是使用生物分子,而是将传感器技术与含有分子识别位点的聚合物结合,极大地提高了传感器的选择性和灵敏度,缩短了响应时间。此外,由于其设计简单、经济适用等优点引起科学家们的广泛关注。1991年,Mosbach等首次将MIT与传感器技术相结合,将MIPs作为识别元件制备了分子印迹传感器并申请了专利。Li等[24]以磺胺胍为模板分子合成磺胺胍MIPs,又结合分散的SiO2微球制备了光子晶体传感器用于并鱼肉中磺胺胍的检测。检测限为2.8×10-7mmol/L,反应时间仅为5 min,与磺胺类化合物相比,该传感器对磺胺胍具有更高的特异性。这一发现表明,分子印迹传感器也可以用于检测具有复杂基质的食物样品。
MIPs的出现成功地填补了传统生物传感器生物识别元件稳定性差、成本高、对环境使用要求高的缺陷,这也使分子印迹传感器取代传统生物传感器成为必然的趋势。相信随着MIT技术的更新发明与创造,分子印迹传感器的检测领域会拓展到更多的领域。
2.3 分子印迹膜
分子印迹膜(molecularly imprinted membrane,MIM)是MIT结合膜分离技术制备出的一种新型分离膜,具有特异识别性和分离效率高等特点,被广泛应用于各分离领域。Ke等[25]以醋酸纤维素为基膜,功能化环糊精为功能单体制备了复合MIM。由于环糊精与药物分子包合作用的差异,可用于手性药物分离。Wu等[26]以PVDF膜为基膜,多巴胺为功能单体制备复合MIM,提高了膜的亲水性和布洛芬分离的选择性。同时,银纳米粒子在MIM上的结合使膜具有抗菌性能,实现了MIM的多功能。Asliyuce等[27]以甲基丙烯酸羟乙酯为功能单体,低温聚合制备了乙型肝炎表面抗体(antiHBs)的复合水凝胶MIM,并在膜色谱模式下进行了分离纯化研究,取得了良好的分离效果。
2.4 分子印迹免疫吸附分析技术
分子印迹免疫吸附分析技术(molecularly imprinted sorbent immunoassays,MIAs)是利用分子印迹仿生抗体的特异性识别能力建立的亲和分析方法,已成为近年来的研究热点之一。其基本原理是基于抗原抗体的竞争反应。反应体系中的目标物和探针竞相与MIPs中特定的结合位点结合。探针与MIPs的结合率随目标物的增加而降低,通过检测探针与MIPs结合物质的含量,来计算目标物的含量[28]。分子印迹免疫吸附分析技术因标记物种类的不同可分为放射标记MIAs,荧光标记MIAs和酶标记MIAs。
2.4.1 放射标记MIAs
放射标记MIAs是基于放射化学标记分子(如3H,14C或125I)的使用。放射性同位素标记在分析发展的早期阶段是最常见的。它们的主要优点是,标记分析物的化学结构与印迹模板相同,可以保持与空腔竞争结合的高选择性。Vlatakis等[29]在1993年报道了第一个异质射电分子印迹试验。在本研究中,以MAA为功能单体,EGDMA为交联剂合成的MIPs成功地用于竞争分析法测定人血浆样品中的茶碱或地西泮药物。本文报道了基于抗吗啡和抗脑素的MIPs的制备及其在放射免疫分析中的应用。该结果与基于抗体的检测系统的结果相当,并证实了MIPs作为抗体模拟物用于MIPs免疫检测的可行性。放射标记MIAs也被用于开发检测其他化合物的分析系统,如药物、除草剂、糖皮质激素等[30]。需要注意的是,该方法的应用总是与辐射安全和废物处理问题有关。因此,我们可以得出结论,尽管使用与目标物质分子结构相同的放射标记分析物具有无可辩驳的优势,但2000年后基于放射化学示踪剂的分子印迹吸附剂分析研究大大减少。这种下降的原因可能是许多分析物同位素标记示踪剂的市场供应不足,以及使用放射性核素的滞留。
2.4.2 荧光标记MIAs
荧光标记MIAs是以荧光物质作为标记物标记目标物质或其他相关物质的一种免疫分析法。近年来,许多用于抗生素检测的荧光MIPs免疫分析法被报道。Zhang等[31]描述了一种基于荧光MIPs的检测大环内酯类抗生素红霉素(ERY)的方法。以3-amino-propyl triethoxysilane为功能单体,tetraethoxysilane为交联剂,通过简单的溶胶-凝胶表面印迹法合成分子印迹荧光探针。印迹因子为4.0。在ERY浓度0.1~11.9 μM范围内,396/585nm激发/发射波长处测得的荧光呈线性下降,检出限为12nM。该方法已成功地用于人尿和唾液中痕量砷的测定。Geng等[32]以MAA和硫醇改性适配体为功能单体,CdSe量子点(QDs)为载体,制备了一种荧光MIPs,用于氨基糖苷类抗生素卡那霉素(KAN)的特异性测定。这种结构使得印迹空腔和适配体能够对抗生素进行双重识别,适配体与MAA之间存在协同作用,提高了MIPs对KAN的识别能力。结果表明,该方法选择性高,印迹系数可达3.51。KAN的检出限为13 ng/mL。
与放射标记MIAs相比,该技术无辐射伤害,对环境无污染,但在阳光照射下极易发生分解,使检测结果受到影响。到目前为止,一直局限于实验室研究。
2.4.3 酶标记MIAs
酶标记MIAs是以酶作为标记物,通过观察底物被酶分解后的显色反应或发光强度来检测目标物质含量的一种技术。该技术由于没有放射性标记的典型缺陷,许多酶以低成本和高纯度的商业可用性,以及易于与低分子量和高分子量抗原结合而受到欢迎。
报道的第一个酶标记分子印迹吸附测定法是Surugiu等[33]对2,4-D除草剂的异相测定法。用烟草过氧化物酶直接标记2,4-D,通过沉淀聚合得到微球形式的印迹聚合物。经分析表明,该聚合物对于模板分子的一些类似物有很好的选择性。比色模式下动态检测范围为40~600 μg/mL,化学发光模式下动态检测范围为1~200 μg/mL。Piletsky等[34]建议发展酶标记肾上腺素的印迹微孔板检测方法。酶示踪剂是HRP和去甲肾上腺素(目标分析物的类似物)的结合。校准曲线的动态范围从1~100 μM。同样的方法也被用于制备与辣根过氧化物酶、乳过氧化物酶、微过氧化物酶和血红蛋白结合的蛋白印迹微滴定板。
酶标记MIAs仍处于初始阶段。相对于生物抗体,MIPs作为仿生抗体应用于酶联免疫吸附分析(Enzyme-linked immunoassay,ELISA)中仍然具有较低的选择性和吸附能力,但稳定性和经济性较好。随着MIT和ELISA的发展,该方法将成为分子印迹应用领域的热点。
3 结 语
近年来,在仿生抗体的合成和应用方面取得了重要进展。仿生抗体的低成本、优异的稳定性和不断提高的性能使其成为不同科学领域最有前途的分子识别合成材料。但这并不意味着仿生抗体的研究已达到非常深入的程度,因为我国开始从事分子印迹研究历史尚短,仿生抗体在实际应用中仍有一些不足,尚难以完全代替生物抗体应用于各种检测中。首先,在印迹过程中,目标分析物与聚合物之间主要靠非共价键作用,作用力较弱,降低了聚合物的印迹能力和印迹效果;其次,我们对仿生抗体在印迹和识别过程中的作用机理研究还不够深入;此外,将仿生抗体的合成和应用在水相中完成,使之完全能与天然分子识别系统相比拟,仍然是目前一个重要的研究方向。

