2021年美国批准上市新药数据分析
张华吉,孙晓灿
1《中国药学杂志》社有限公司,北京 100022;
2北京华灿康国际医药研究有限公司,北京 100027
药物创新是指通过研发新药、新疗法或其他方式有效提高临床疗效、使疾病可控的过程,其核心是为了满足临床需求。获批的新药往往具有以下1个或多个属性:①首次发现可用于治疗某种疾病的药物。②与现有药物或疗法相比,具有更高疗效的药物。③与现有药物或疗法相比,具有更小不良反应发生风险的药物。④可改善患者用药依从性的药物[1]。更多的新药上市意味着增加了患者获得治疗药物的机会,有利于改善患者生活质量,缓解疾病症状或降低病情严重程度,降低治疗成本、减轻患者经济负担。
2021年新型冠状病毒肺炎严重影响着人们的工作和生活,但全球新药研发仍收获了丰硕的成果。2021年1月~2021年12月,美国批准了50个新药上市(其中38个为全球首批)[2]。大量的创新药获批上市,为广大患者带来了战胜疾病的希望和福音。获批新药中还有一些具有里程碑意义的药物,比如Kristen鼠肉瘤病毒致癌基因(Kristen rat sarcoma viral oncogene,KRAS)抑制剂Lumakras(sotorasib)。KRAS作为肿瘤最频繁的突变基因之一,一直以来患病者被认为无药可治。Lumakras是一种高选择性、不可逆转的KRAS G12C突变抑制剂,也是针对KRAS基因的首个靶向药物,其成功获批颠覆了一直以来认为该靶点难以成药的想法[3]。
通过整理美国食品药品监督管理局(Food and Drug Administration,FDA)官网(https://www.fda.gov)公布的2021年新药批准资料与数据[4],结合FDA往年新药批准情况[5],对2021年FDA批准新药情况进行简要分析,以期了解美国新药审批情况和研发的动向,供相关药学同仁参考。
1 2021年批准新药数量稳定增长
2021年FDA药品审评与研究中心(Center for Drug Evaluation and Research,CDER) 共批准了50个新分子实体药物(new molecular entities,NMEs),包括36个(72.00%)新药上市申请(new drug applications,NDAs)和14个(28.00%)生物制剂上市许可申请(biologics license applications, BLAs)。2021年新药总批准数量位居近20年的年度批准新药数量排名第3位,仅低于2018年(59个)和2020年(53个),且远高于近20年批准数量平均值(33个)和近10年批准数量平均值(43个)。2002~2021年度批准新药数量趋势见图1。这些药物的治疗领域涵盖了肿瘤、心血管、传染病、内分泌、免疫、呼吸、神经和精神疾病等。
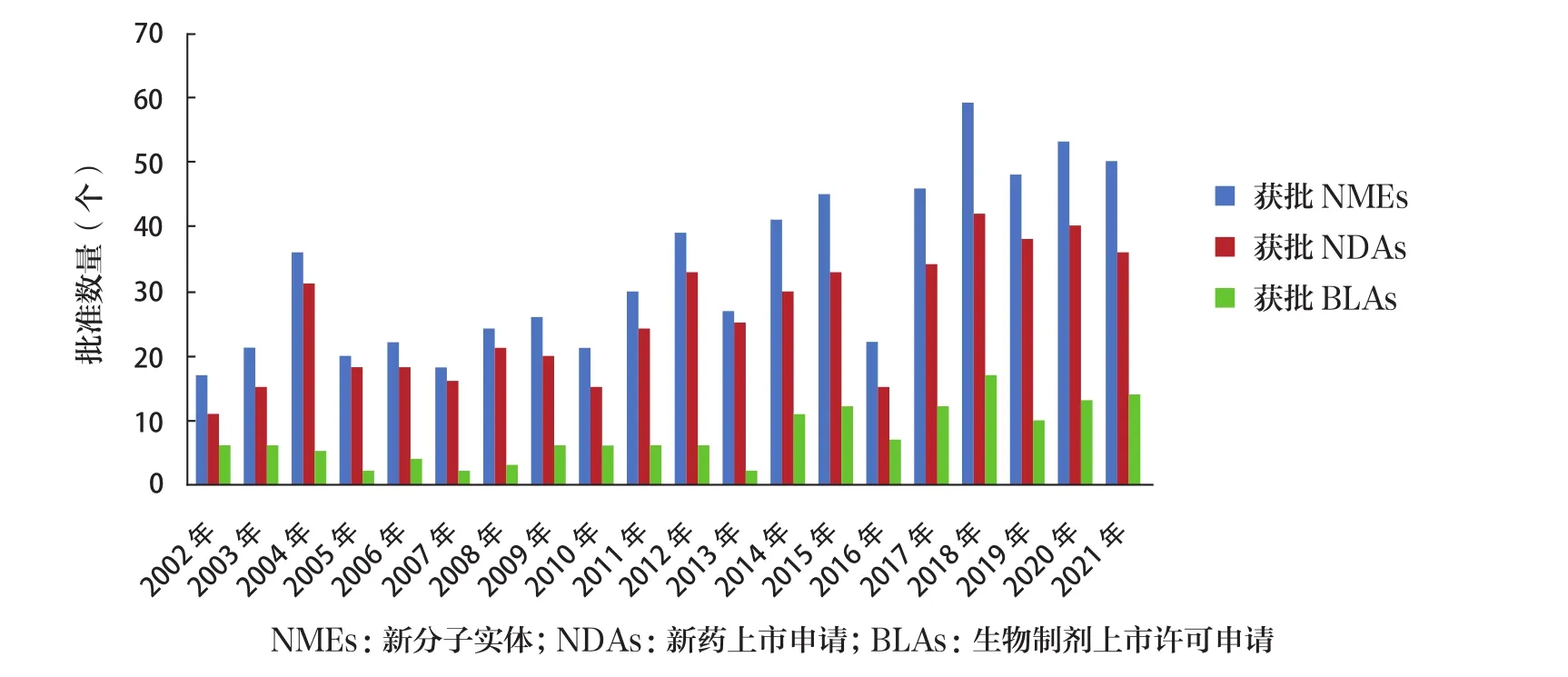
图1 2002~2021年FDA批准新药情况
2021年FDA批准新药月平均数量超过4个。其中,2月批准7个新药,位居首位;排名第2、第3的分别是5月(6个)、7月(5个);3月、4月、8月、9月、11月、12月批准数量均为4个。NDAs获批数量最多的月份为2月(6个),其次是5月(5个),3月、7月各批准4个。BLAs获批数量最多的月份为12月(3个),4月、6月、8月各批准2个。见图2。
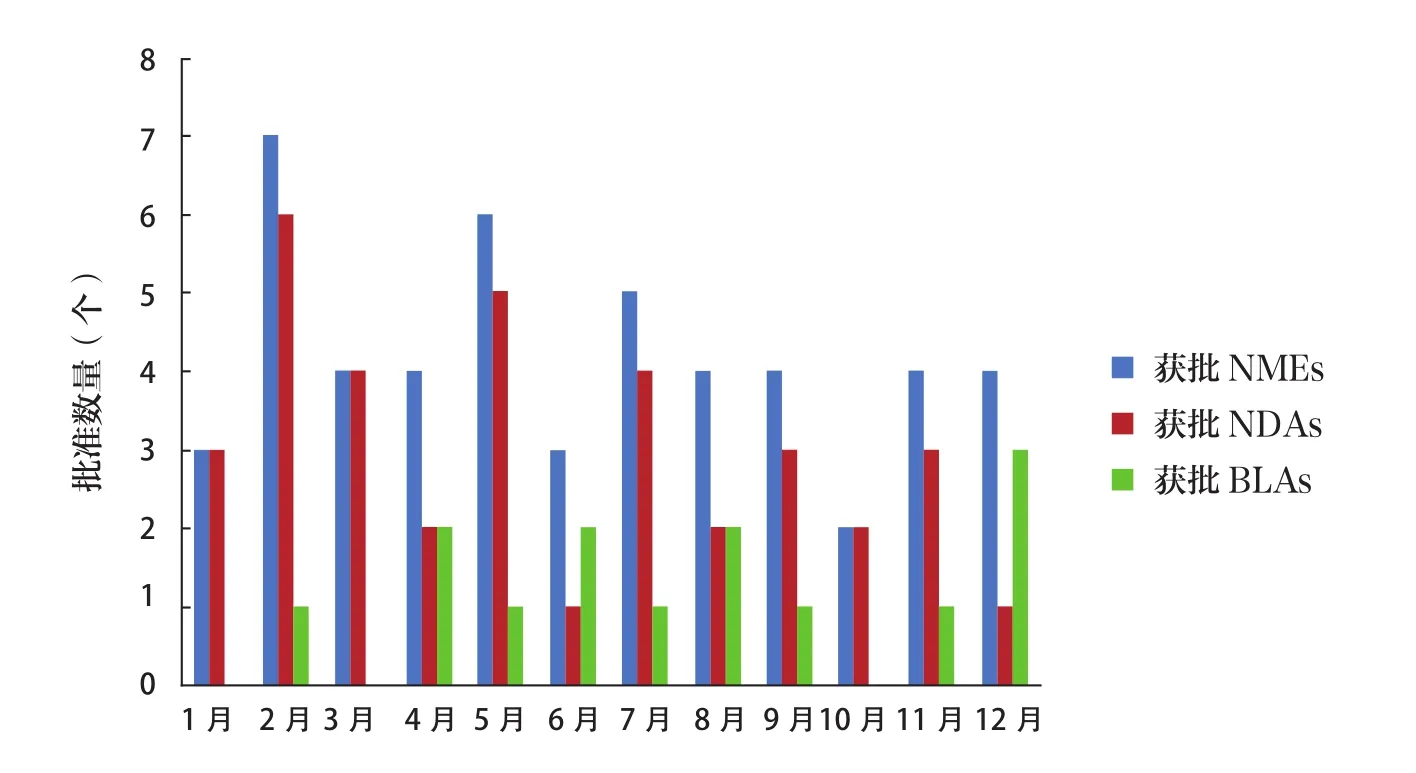
图2 2021年FDA批准新药情况
2 药物创新劲头持续
2021年FDA批准的50个新药中,27个(54.00%)为first-in-class新药,这些药物通常具有与现有药物或疗法不同的作用机制,整体上新药创新性较强,疾病治疗领域、药物治疗靶点不断取得突破性进展。例如,Lumakras(sotorasib)作为特异性靶向KRAS G12C突变体抑制剂的上市,击破了针对KRAS靶点不可成药的理念[6];Cabenuva [cabotegravir and rilpivirine (copackaged)]是首个长效HIV注射疗法,每月只需进行一次治疗,极大缓解了患者每日服药的压力[7];Tezspire(tezepelumab-ekko)是靶向抗胸腺基质淋巴细胞生成素的单克隆抗体疗法,为无法控制症状的严重哮喘患者提供了新的治疗选择[8];Rybrevant(amivantamab-vmjw)为首个获批靶向不同肿瘤抗原的双特异性抗体,具有多重抗癌的作用机制[8];Zynlonta(loncastuximabtesirinelpyl)是首款靶向CD19的获批抗体偶联药物[9];Pepaxto(melphalan flufenamide)是首个获批的肽偶联抗癌药物[10];Leqvio(inclisiran)是首个降低“坏胆固醇”的siRNA疗法[11];Adbry(tralokinumab-ldrm)被批准用于不能通过皮肤给药达到治疗目的的成年人中度至重度特应性皮炎(湿疹)的治疗[8];Verquvo(vericiguat)是首个治疗慢性心力衰竭恶化患者的可溶性鸟苷酸环化酶激 动 剂[12];Aduhelm(aducanumab-avwa) 是第1个针对阿尔茨海默病基本疾病病理生理学的疗法[13];Brexafemme(ibrexafungerp)是 20 多年来第1个获批治疗由酵母菌感染的外阴阴道念珠菌病的新抗真菌药[14]。
2012~2021年FDA共批准新药430个,其中first-in-class新药共170个(39.53%)。2021年无论是first-in-class新药数量的绝对数值(27个),还是占当年新药批准总量的比例(54.00%),均明显高于近10年的均值(17个,39.53%)。2012~2021年各年度first-in-class新药批准情况见图3。

图3 2012~2021年FDA批准first-in-class情况
此外,突破性疗法认定的新药数量同样是衡量创新性的一个标准。2021年获批的50个新药中,有14个(28.00%)获得突破性疗法认定,与近5年年均获得突破性疗法认定的数量15.8个(30.86%)接近。
3 罕见病用药研发热度不减
近年来,罕见病用药市场已成为新药研发的主战场。随着全世界对罕见病的日益重视,各国纷纷出台罕见病用药相关的法律法规,激发了药物研发企业对罕见病用药的研发热情,加速推动罕见病用药上市进程[15]。据统计,2020年全球罕见病用药市场规模为1351亿美元,预计2025年将达到 2430亿 美 元[16]。2012~2021年 FDA 共 批 准203个(47.21%)罕见病用药,年平均批准数量达20.3个。2021年FDA批准了26个(52.00%)罕见病用药,数量高于近10年的平均批准数量,该结果提示罕见病用药的研发持续保持较高的热度。2012~2021年各年度罕见病用药批准情况见图4。
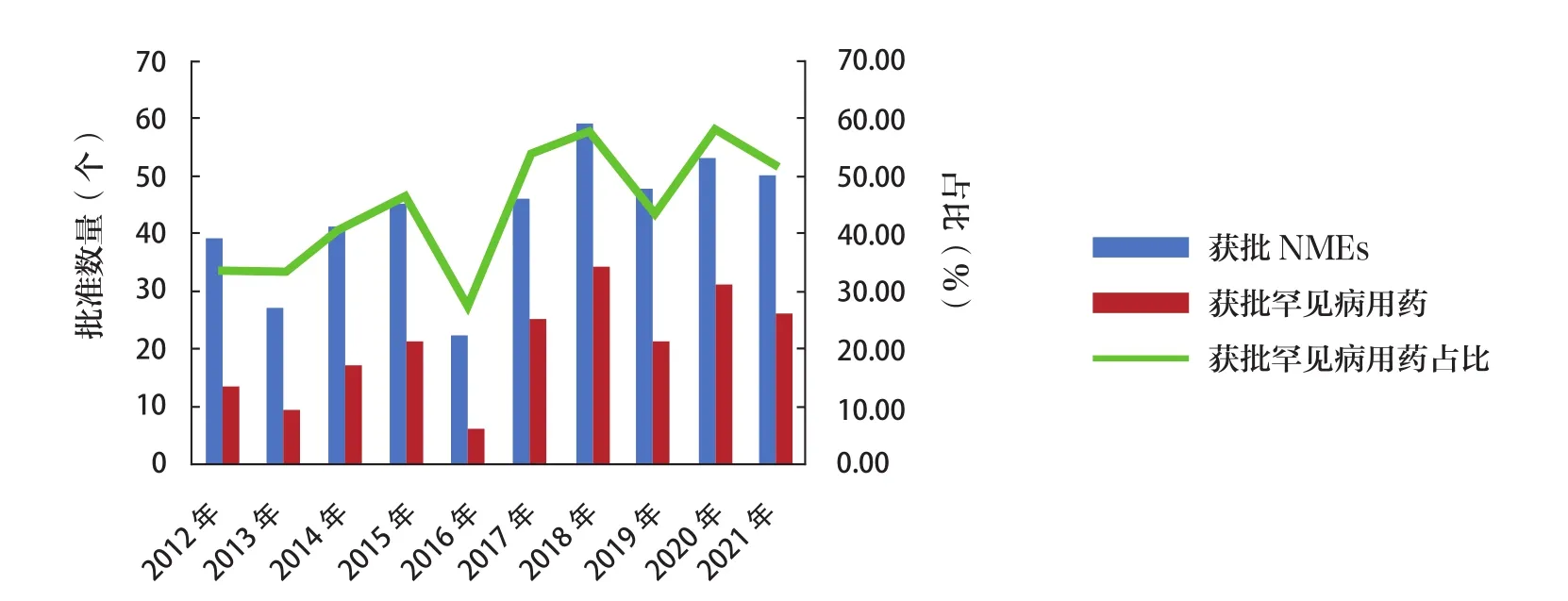
图4 2012~2021年FDA批准罕见病用药情况
4 抗肿瘤药继续稳居治疗领域榜首
2021年是美国《国家癌症法案》(National Cancer Act)发布50周年[17],该项立法对抗肿瘤治疗具有里程碑意义。FDA于2021年批准了15个(30.00%)针对不同肿瘤的治疗药物,该数量远高于其他疾病治疗领域的获批新药,稳居榜首,提示肿瘤仍旧为最热门的治疗领域。神经系统用药的获批新药数量位居第2(5个,10.00%);抗感染药和心血管系统用药的获批新药数量并列第3(4个,8.00%)。药批新药在治疗领域的分布见图5。
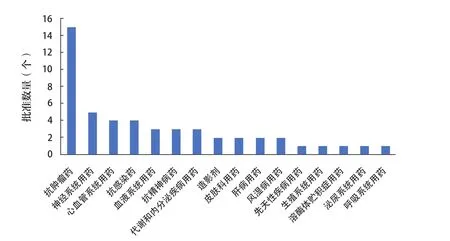
图5 2021年FDA批准新药的治疗领域分布
27个获批的first-in-class新药中,抗肿瘤新药有6个(22.22%);26个获批的罕见病用药中,抗肿瘤新药有10个(38.46%);14个获得突破性疗法认定药物中,抗肿瘤新药有7个(50.00%);24个获得快速通道认定药物中,抗肿瘤新药有6个(25.00%);34个获得优先审评认定药物中,抗肿瘤新药有13个(38.24%);14个获得加速审批认定药物中,抗肿瘤新药有11个(78.57%)。此外,15个获批抗肿瘤新药中,有4个(26.67%)可用于治疗非小细胞肺癌(non-small cell lung cancer,NSCLC),分别为:①Tepmetko(tepotinib)是一种小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI),能高选择性地结合间质-上皮细胞转化基因(mesenchymal-epithelial transition factor, MET)表达产物C-MET蛋白、抑制相关信号通路的激活,发挥抗癌作用[18],可用于治疗MET外显子14跳跃突变的转移性NSCLC成年患者。②Rybrevant(amivantamab-vmjw)是一种双特异性表皮生长因子受体(epidermal growth factor receptor,EGFR)导向和MET受体导向的抗体,可用于治疗EGFR外显子20插入突变、铂类化学疗法或之后其疾病进展的局部晚期或转移性NSCLC患者,是EGFR外显子20插入突变肺癌患者的首款靶向疗法[19]。③Exkivity(mobocertinib)是一种强效TKI,可高靶向性作用于EGFR和人表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER2)基因20号外显子插入突变,用于治疗先前接受含铂化疗期间或之后病情进展、携带EGFR外显子20插入突变的局部晚期或转移性NSCLC成人患者,Exkivity是第1个也是唯一被专门批准用于选择性靶向EGFR外显子20插入突变的口服疗法[20]。④ Lumakras(sotorasib)是一种KRAS G12C抑制剂,用于治疗既往至少接受过1次系统治疗、携带KRAS G12C突变的局部晚期或转移性患者,Lumakras作为全球首款KRAS靶向药物获批上市[21],为KRAS突变的NSCLC患者提供了新的治疗选择。
5 利用加快审批机制、充分沟通,推进药品上市进度
新药获批上市前,要经过早期测试、动物实验、临床试验申请、临床试验、新药申请等多个阶段,整个流程时间较长,通常需要8~10年的时间[22]。FDA采用增加与药物研发人员的互动、灵活设计工作计划、缩短申请审评时间线等多项监管通道,并使用快速通道、突破性疗法、优先审评、加速审批等审批方式,在一定程度上提高了新药的审评效率[23]。同时促进了新疗法更快地进入市场,推动了新药开发与市场上产品的竞争。
2021年FDA批准上市的50种新药中,共有37个(74.00%)新药使用了1种或多种加快审批机制。使用4种加快审批机制的新药有3个(6.00%),使用3种的有7个(14.00%),使用2种的有20个(40.00%), 使 用 1种 的 有 7个(14.00%)。有18个(36.00%)新药获得快速通道认定,14个(28.00%)新药获得突破性疗法认定,34个(68.00%)新药被认定为优先评审,14个(28.00%)新药被认定为加速审批。
此外,有43个(86.00%)新药在审评首轮获批,意味着这些新药的上市申请人与FDA沟通顺畅,确保上市申请材料包含FDA要求的全部材料且未收到FDA的“完全回应”函,“完全回应”函会要求上市申请人重新提交更多资料,无疑会增加更多的审评时间。
6 多数获批新药在美国率先上市
FDA加快审批制度鼓励申请者首先在美国寻求产品上市,50个新药中有38个(76.00%)率先在美国上市,而此前5年共批准的228个新药中,在美国率先上市的数量为170个(74.56%)。2016~2021年在美国率先上市的获批新药情况见图6。
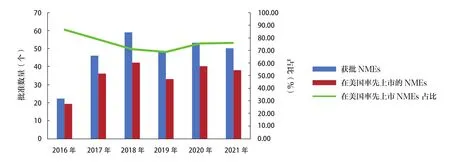
图6 2016~2021年FDA批准新药率先在美国上市情况
7 小结
2021年FDA批准新药数量稳定增长、药物创新劲头持续,是新药上市大获丰收的一年。这些获批的新药将使患有各种罕见病、恶性肿瘤、神经系统疾病、传染病和许多其他疾病的患者受益,增加患者获得治疗的机会并降低其经济负担。FDA正在努力探索更有效的评价方法以评估药物疗法的安全性和有效性,并运用多种方法完善审批机制、加速药物审批进度,推动更多的创新药物开发与上市。
——第一部分:新药和生物制品(Ⅲ)

