桦褐孔菌乙酸乙酯萃取物对朊病毒复制的抑制作用
王 琳,姚 强,杨 微,陈 嘉,胡 超,夏 影,陈志宝 ,陈 操,6,7,
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163000;2.广东海洋大学深圳研究院,广东深圳 518108;3.中国疾病预防控制中心病毒病预防控制所,北京 102206;4.中国动物疫病预防控制中心,北京 100125;5.传染病预防控制国家重点实验室,北京 102206;6.中国科学院生物安全大科学研究中心,湖北武汉 430071;7.卫生部医学病毒和病毒病重点实验室,北京 102206)
朊病毒病(Prion Disease)又称为传染性海绵状脑病(TSEs)是由朊病毒引起的一类影响人类及多种动物的致死性神经退行性疾病[1-2]。这些神经退行性疾病还包括致死性家族性失眠症(FFI)、吉斯特曼-斯特劳斯综合征(GSS)、库鲁病(Kuru)、克雅氏病(CJD)以及羊瘙痒病(Scrapie)、疯牛病(BSE)等[3]。感染朊病毒后宿主通常以死亡转归,目前临床上还未见有效治疗朊病毒病的特效药[4]。
桦褐孔菌(Inonotus obliquus)是一种白色寄生真菌,主要分布在 45°N~50°N 纬度的国家和地区[5],有“桦木天鹅绒”[6]和“西伯利亚灵芝”[5]之称。桦褐孔菌通常寄生在桦树上,具有烧焦木炭的外观[7]。这种真菌长期暴露在季节性极低的环境温度下生长十分缓慢,并在生长多年后形成直径25~40 cm的瘤状菌核,呈黄褐色至黑色,含有丰富的维生素、矿物质、蛋白质、高纤维以及碳水化合物[8]。研究表明桦褐孔菌的药理学活性是药物作用的基础,它具有抗氧化[9]、抗菌[10]、抗炎[11]、抗过敏[12]、抗疲劳[13]、抗肿瘤[14]等作用以及免疫调节功能[15]。因其具有较强的医疗保健价值,故在俄罗斯、中国和日本桦褐孔菌也被用作食品、营养食品和传统草药使用,从而预防和治疗各种疾病,如胃肠道疾病、糖尿病、结核病和心血管疾病[7,16]。
本课题组前期研究结果显示,桦褐孔菌乙醇粗提物通过其抗氧化活性对朊病毒的复制产生抑制作用[17]。在前期研究基础上,本文进一步比较了桦褐孔菌醇提物的不同极性部位萃取物对朊病毒复制的抑制作用,并对其抗氧化活性及作用机制进行研究,为筛选有效抑制朊病毒复制的药物和深层次挖掘桦褐孔菌的药用价值提供科学依据。
1 材料与方法
1.1 材料与仪器
细胞株朊病毒Chandler株持续感染的SMB-S15细胞系 英国罗斯林研究所;CCK-8活细胞检测试剂盒(CK04-500) 日本DOJINDO公司;DCFDA细胞活性氧检测试剂盒(ab113851) 英国Abcam公司;过氧化氢检测试剂盒(S0038)、超氧化物歧化酶(SOD)活性检测试剂盒(S0103)、总谷胱甘肽检测试剂盒(S0052)、SDS-PAGE 试剂盒(P0012A) 中国Beyotime 公司;蛋白酶K(Proteinase K)(1245680100)德国Merck公司;ECL显影液(EL105001EA)美国 Perkin-Elmer公司;PrP 抗体(6D11)(sc-58581)美国 Santa Cruz公司;β-actin 抗体(TA-09) 中国 ZSGB-Bio公司;HO-1抗体(66743-1-Ig)、GCLC抗体(12601-1-AP) 美国 Proteintech公司;Goat Anti-Mouse IgG(H+L)二抗(115-035-003) 美国Jackson Immuno Research公司。
371高温灭菌CO2细胞培养箱(配有HEPA过滤器和高温干热灭菌技术)、D11971超纯水器(配有超滤柱和双波长紫外灯氧化技术) 美国Thermo Scientific公司;DYY-6C稳压稳流电泳仪、DYCP-40C半干式电转仪 北京六一生物科技有限公司;EnSpire多功能酶标仪(配有高精度四光栅模块和超敏感化学发光检测技术)、Operetta CLS高通量高内涵活细胞共聚焦(配有高内涵成像分析系统) 美国PerkinElmer公司;6000化学发光成像仪 中国上海勤翔科学仪器有限公司。
1.2 实验方法
1.2.1 桦褐孔菌二氯甲烷萃取物、乙酸乙酯萃取物、正丁醇萃取物提取 参考师苑等[18]的方法,将块状的桦褐孔菌子实体粉碎,60 ℃热风干燥至恒重,用75%浓度乙醇浸泡提取3次,经减压浓缩得乙醇浸提物。用水将乙醇提取物分散成悬浊液,依次用有机溶剂二氯甲烷(98.5%)、乙酸乙酯(98%)和正丁醇(99.8%)分别萃取,浓缩得二氯甲烷萃取物、乙酸乙酯萃取物和正丁醇萃取物。
1.2.2 供试样品的制备与处理 称量干燥的二氯甲烷萃取物、乙酸乙酯萃取物及正丁醇萃取物粉末,在无菌条件下,以二甲基亚砜(DMSO)为溶剂,制备成10 mg/mL母液,并过0.22 μm微孔滤膜过滤,分装后放置于暗处留存。
1.2.3 SMB-S15细胞培养及药物处理 细胞培养:使用含10%胎牛血清的DMEM培养基培养细胞,将细胞瓶按十字形摇晃,水平置于33℃,含5%CO2的恒温培养箱中培养。当细胞培养密度至80%左右时,依照1:2~1:5的比例传代。
细胞加药处理:细胞传代后过夜培养,待贴壁后,更换含有溶剂或药物的培养基,空白对照组不作处理,溶剂组添加0.1%浓度的DMSO作为对照,药物组添加不同浓度的二氯甲烷萃取物、乙酸乙酯萃取物和正丁醇萃取物,处理后继续培养细胞不同时间点并进行Western blot及相关试剂盒检测。
1.2.4 CCK-8法检测细胞活性 按照1.2.3项下条件培养细胞,接种细胞悬液于96孔细胞培养板中,过夜贴壁后,加入不同浓度药物并设置实验孔及空白孔,继续培养细胞1、3 d[19],参照试剂盒说明书中方法进行后续检测。
1.2.5 DCFDA法检测细胞内活性氧 按照1.2.3项下条件培养细胞,接种细胞悬液于96孔板中,药物处理后继续培养细胞3 d,弃掉96孔板中培养基,加入终浓度为20 μmol/L的DCFDA溶液,37 ℃避光孵育30 min,PBS洗两次,用Operetta高内涵细胞成像系统观察细胞内活性氧荧光强度。
1.2.6 SMB-S15细胞裂解液制备 弃去细胞培养液,加入0.025%胰蛋白酶消化细胞,消化完毕后弃胰酶,使用PBS吹下细胞,将获得的细胞悬液收集至1.5 mL离心管,1000 r/min离心5 min,弃上清,收集细胞沉淀,加入细胞裂解液RIPA以及蛋白酶抑制剂,冰上裂解30 min,5000 r/min离心3 min,小心收集上清,于-20 ℃保存备用。
1.2.7 Western blot检测 取5×蛋白上样缓冲液加入已制备好的细胞裂解液中,使终浓度为1×,置于沸水浴中煮样5~10 min,变性后进行SDS-PAGE电泳,利用半干式电转至NC膜,室温封闭2 h,再分别与 PrP(1:1000稀释)、β-actin(1:2000稀释)、HO-1(1:1000 稀释)、GCLC(1:10000 稀释),4 ℃ 孵育过夜。漂洗3次×10 min,然后与相应的HRP标记羊抗鼠(1: 5000稀释)IgG抗体室温孵育2 h,漂洗3次,使用化学发光液显色,数据采集仪自动曝光[20]。
细胞PK消化:使用终浓度20 μg/mL的PK酶处理细胞裂解液,37 ℃水浴消化1 h后参照上述方法进行PrP特异性Western blot测定。
1.2.8 过氧化氢水平测定 参照1.2.6项下方法收集细胞沉淀至1.5 mL离心管,加入过氧化氢检测裂解液,随后充分匀浆以破碎并裂解细胞,4 ℃约12000×g 离心 3~5 min,取上清[21],遵循试剂盒说明书进行检测,最终计算出样品中过氧化氢浓度。
1.2.9 超氧化物歧化酶活性检测 按照Luo等[22]的方法,使用WST-8法进行测定。收集细胞样品,用4 ℃的PBS或生理盐水洗涤1~2遍。沉淀用预冷的PBS在4 ℃进行匀浆,匀浆液4 ℃离心,取上清作为待测样品。取96孔板每孔加入20 μL样品,并设定空白对照孔1、2、3,依次加入SOD检测缓冲液、WST-8/酶工作液以及反应启动工作液,37 ℃孵育30 min,使用酶标仪450 nm处测定吸光度值。WST-8可以和黄嘌呤氧化酶催化产生的超氧化物阴离子反应产生水溶性的甲臜染料,该反应步骤可以被SOD所抑制,故通过对抑制百分率的分析即可进一步计算SOD酶活力。抑制百分率计算公式如下:

式中:A空白对照1表示不加入样品空白对照组吸光度;A空白对照2表示不加入样品和反应启动工作液空白对照组吸光度;A空白对照3表示加入样品但不加入反应启动工作液空白对照组吸光度。
SOD酶活力单位的定义:按照此检测方法,当反应体系抑制百分率为50%时,SOD酶活力定义为一个酶活力单位(unit)。SOD酶活力按如下公式计算:

1.2.10 总谷胱甘肽水平检测 参照1.2.6项下方法收集新鲜的细胞,加入细胞沉淀体积3倍量的蛋白去除试剂S溶液,利用-20 ℃冰箱和37 ℃水浴对样品进行两次快速的冻融,4 ℃,10000×g离心10 min,取上清作为待测样品[23]。按照试剂盒说明书对总谷胱甘肽的含量(μmol/L)进行测定。
1.3 数据处理
利用Image J软件对免疫印迹图像进行灰度分析,利用Columbus软件对活性氧荧光强度结果进行定量分析,利用T检验比较两组间差异。P<0.05认为有统计学意义,*代表P<0.05,**代表P<0.01,***代表P<0.001。
2 结果与分析
2.1 SMB-S15细胞系的鉴定
朊病毒病的致病因子为PrPSc,它具有抗蛋白酶消化的能力[24-25]。为评估SMB-S15细胞中是否存在PrPSc,对细胞进行PrP特异性Western blot测定。实验结果(图1)显示,SMB-S15细胞中存在PrP特异性条带,说明该细胞中存在大量具有蛋白酶抗性的PrPSc。本实验结果表明SMB-S15细胞模型有效,可用于后续研究。

图1 SMB-S15细胞PK酶处理前后PrP特异性条带Fig.1 PrP-specific bands before and after PK treatment with SMB-S15 cells
2.2 桦褐孔菌二氯甲烷萃取物、乙酸乙酯萃取物以及正丁醇萃取物的细胞毒性评价
研究显示,桦褐孔菌水提物和醇提物均具有不同程度的毒性[26],为确定二氯甲烷萃取物、乙酸乙酯萃取物以及正丁醇萃取物处理SMB-S15细胞的最大安全浓度和最佳作用时间,本研究采用CCK-8法对几种萃取物的细胞毒性进行评价。结果显示,不同浓度的萃取物作用于SMB-S15细胞1 d和3 d后,与对照组相比,给药组的细胞生存率均随着浓度的增加而降低。且二氯甲烷萃取物、乙酸乙酯萃取物以及正丁醇萃取物浓度为0.1×2-8mg/mL时,其在1 d和3 d相应的细胞存活率分别为94.67%、93.67%,90.33%、92.00%和96.33%、90.67%,且与对照组相比,细胞存活率无统计学差异(图2 A,B,C)。综上所述,几种萃取物的最大安全浓度范围为0.1×2-14~0.1×2-8mg/mL。
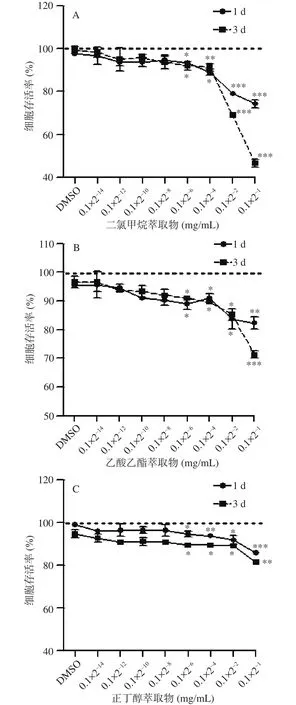
图2 桦褐孔菌二氯甲烷萃取物、乙酸乙酯萃取物、正丁醇萃取物细胞毒性评价Fig.2 Evaluation of the cytotoxicity of dichloromethane extracts, ethyl acetate extracts, n-butanol extracts from Inonotus obliquus
2.3 桦褐孔菌二氯甲烷萃取物、乙酸乙酯萃取物以及正丁醇萃取物对朊病毒复制的影响
前期研究表明,桦褐孔菌醇提物具有抑制朊病毒复制的作用效果[17]。为继续探究几种萃取物对SMB-S15细胞内朊病毒复制的影响,选取安全范围内的药物处理浓度作用细胞1 d和3 d,并对处理后的SMB-S15细胞进行PK后的PrP特异性Western blot检测。由图3实验结果显示,在二氯甲烷萃取物和正丁醇萃取物分别处理1 d和3 d时,不同药物处理浓度下的PrPSc水平没有显著差异;乙酸乙酯萃取物处理1 d后细胞内的PrPSc水平没有显著差异,而使用乙酸乙酯萃取物连续处理3 d时,SMB-S15细胞内的PrPSc水平略有变化,与空白对照组相比,有一定的下降趋势。定量分析结果显示,0.1×2-8mg/mL的乙酸乙酯萃取物连续处理3 d后PrPSc信号的平均灰度值与未处理组相比具有统计学显著差异(P<0.01,图3 B)。上述实验结果表明,乙酸乙酯萃取物具有抑制SMB-S15细胞中朊病毒复制的能力。

图3 桦褐孔菌二氯甲烷萃取物、乙酸乙酯萃取物、正丁醇萃取物对细胞模型中朊病毒复制的影响Fig.3 Inhibition of prion replication in cell model by dichloromethane extracts, ethyl acetate extracts,n-butanol extracts from Inonotus obliquus
2.4 桦褐孔菌乙酸乙酯萃取物的活性氧和过氧化氢水平分析
以往的研究结果证实在朊病毒感染SMBS15细胞中活性氧水平显著上调[27]。为评价桦褐孔菌乙酸乙酯萃取物的抗氧化活性,使用药物处理SMB-S15细胞3 d,利用DCFDA荧光探针检测细胞内活性氧水平。实验结果表明,SMB-S15细胞中活性氧荧光信号强度呈下调趋势,且呈显著的剂量依赖性(图4A)。在 0.1×2-10mg/mL(P<0.05,图4B)和0.1×2-8mg/mL(P<0.01,图4B)药物浓度下与未处理组相比,活性氧水平有统计学差异;进一步探究了乙酸乙酯萃取物处理3 d后细胞内的过氧化氢水平。结果显示0.1×2-8mg/mL乙酸乙酯萃取物的过氧化氢水平显著降低,且与对照组相比具有统计学显著差异(P<0.01,图4C)。以上结果表明桦褐孔菌乙酸乙酯萃取物可能通过降低活性氧水平来缓解氧化应激,具有较强的抗氧化活性。

图4 桦褐孔菌乙酸乙酯萃取物处理SMB-S15细胞后活性氧和过氧化氢水平Fig.4 Levels of ROS and H2O2 in SMB-S15 cells treated with ethyl acetate extracts from Inonotus obliquus
2.5 桦褐孔菌乙酸乙酯萃取物相关抗氧化信号通路探究
研究显示,桦褐孔菌多糖提取物可通过介导Nrf2信号通路调节氧化应激,对抗L-Glu损伤的HT22细胞和APP/PS1小鼠中阿尔兹海默病(Alzheimer's Disease,AD)的疾病进程[28]。另有研究显示,桦褐孔菌提取物能够清除活性氧活性,抑制过氧化氢诱导的细胞凋亡以及过氧化氢或紫外线诱导的早衰[29]。为探究乙酸乙酯萃取物是否通过激活Nrf2信号通路抵抗氧化应激,使用乙酸乙酯萃取物处理SMB-S15细胞3 d,分析血红素加氧酶(HO-1)和谷胱甘肽合成酶催化亚基(GCLC)相关抗氧化蛋白水平变化。结果显示与对照组相比,HO-1和GCLC水平在乙酸乙酯萃取物浓度为0.1×2-8mg/mL时增加,具有统计学差异(P<0.05,图5B);超氧化物歧化酶(SOD)对调节细胞内环境和维持稳定正常的细胞功能非常重要,是强大的抗氧化酶。使用乙酸乙酯萃取物处理SMBS15细胞3 d后,细胞内SOD活性呈剂量依赖性增加,与对照组相比药物浓度在0.1×2-10mg/mL和0.1×2-8mg/mL 时具有统计学差异(P<0.05,图5C);谷胱甘肽作为细胞中主要的可溶性抗氧化剂,也是一些解毒酶的辅助因子。同时,在乙酸乙酯萃取物处理3 d后,总谷胱甘肽水平也增加,具有统计学差异(P<0.05,图5D)。以上结果表明,桦褐孔菌乙酸乙酯萃取物通过激活Nrf2信号通路增加相关抗氧化蛋白表达并上调SOD和总谷胱甘肽水平抵抗氧化应激。
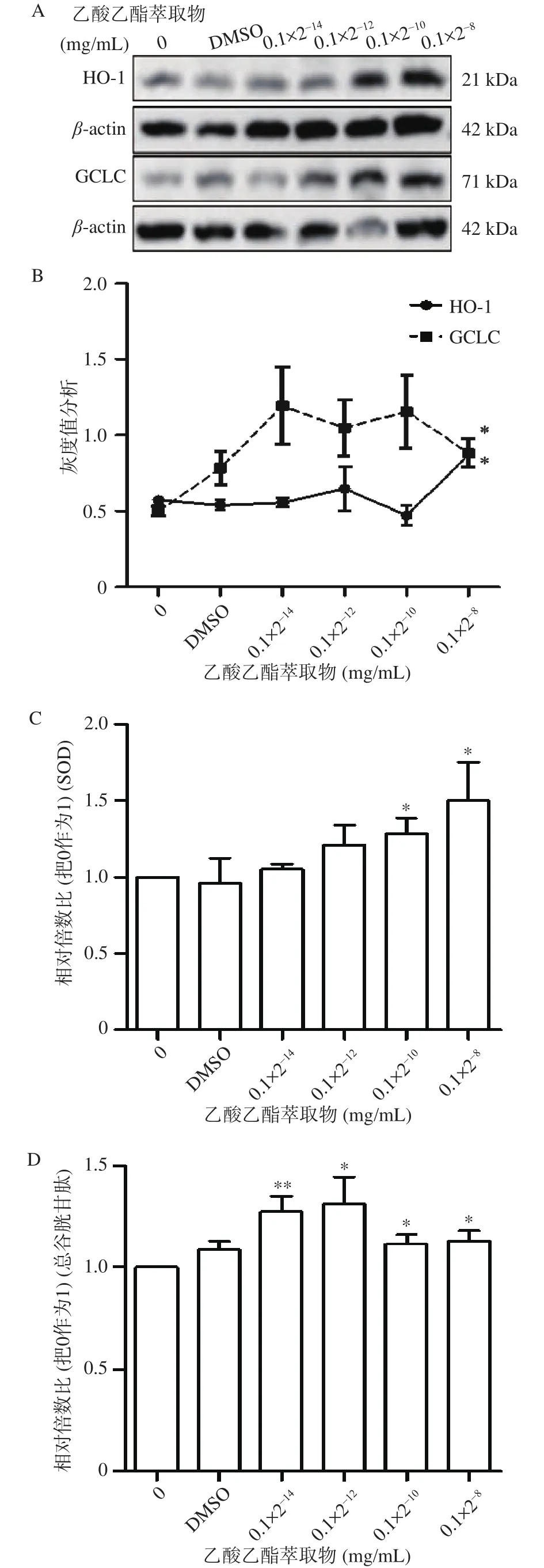
图5 桦褐孔菌乙酸乙酯萃取物处理SMB-S15细胞后抗氧化因子水平检测Fig.5 Levels of antioxidant factors in SMB-S15 cells treated with ethyl acetate extracts from Inonotus obliquus
3 讨论与结论
朊病毒病在全世界的发病率约为百万分之一,尽管罕见,每年仍有成千上万人死于此类疾病,因此寻求一种安全、有效的抗朊病毒的化合物或疫苗是十分必要的。朊病毒病的发病机制与主要在脑中表达的正常朊蛋白PrPC转化为异常朊蛋白PrPSc有关,由于这种转化是朊病毒病发生发展的主要触发事件,因此抑制转化是一种主要的治疗策略[30-31]。本文的数据显示,一定浓度的乙酸乙酯萃取物处理降低了朊病毒感染细胞内PrPSc水平,同时氧化应激也得以缓解。
氧化应激(Oxidative stress)是细胞在受到内源或外源性刺激后短时间内产生大量活性氧(Reactive oxygen species, ROS),破坏细胞内环境平衡,并最终导致机体发生氧化损伤的过程[32]。过氧化氢是一种在生物体内发挥广泛生物介质作用的活性氧代表化合物。乙酸乙酯萃取物处理后显著降低的活性氧和过氧化氢水平表明了该化合物具有抗氧化活性。HO-1是受Nrf2信号通路转录调节的抗氧化蛋白,可与血红素降解产物共同发挥抗氧化的防御作用[33]。GCLC能够促进体内谷胱甘肽的合成,增强机体内的抗氧化能力。SOD作为生物体中天然存在的超氧自由基清除者,可将超氧自由基转化为H2O2。本实验使用乙酸乙酯萃取物处理SMB-S15细胞后,通过检测到HO-1和GCLC等Nrf2下游抗氧化因子水平的显著升高,以及细胞内总谷胱甘肽和超氧化物歧化酶活性的上调,揭示了乙酸乙酯萃取物在激活细胞防御系统,抵抗朊病毒感染细胞中氧化应激的作用。
综上所述,桦褐孔菌乙酸乙酯萃取物具有抑制朊病毒复制作用,其作用机制可能与激活Nrf2信号通路有关,这可能为朊病毒病提供新的研究靶点和治疗方法。但朊病毒病致病机理较为复杂,桦褐孔菌作为一种功能性食品或药物,在抑制朊病毒复制的作用机制方面还值得进一步的研究。

