掺磷PdNi催化剂的合成及其电催化脱氧机理研究
黄彬彬 秦仕忆 曹兴凯






摘要:采用一步法合成含磷摻杂的Pd/NiP三元合金材料,其透射电子显微镜图、场发射扫描电子显微镜图以及X射线光电子能谱图等结果显示,合成的Pd/NiP材料为直径(4.4±1.0)nm的超细纳米颗粒,循环伏安结果显示该材料具有优异的电化学性能,Pd/NiP纳米颗粒中Pd的电化学活性比表面积(ECSA)为42.11 m/g,是商业Pd/C纳米颗粒的1.5倍;Pd/NiP材料对4- 氯苯酚(4-CP)显示出优异的电催化脱氯活性,直接电化学还原脱氯和间接电催化脱氯加氢两种途径均参与到4-CP的电催化脱氯过程中.同时,伏安特性分析显示,直接电化学还原脱氯过程中的电子转移系数(4)远小于0.5,表明C-Cl键的裂解遵循同步离解电子转移机理.研究表明,掺杂Ni和P原子引起的协同效应和压缩应变显著增强了Pd生成与储存氢原子的能力,同时有效抑制了氢气析出反应(HER),进而提升了电催化还原脱氯效率.电解实验结果显示,1.02 mg该材料对2 mmol/L 4-CP的脱氯效率在360 min内可达到87.5%,表观速率常数为0.005 7 min,展现了极强的催化脱氯活性.三次循环实验结果显示,其脱氯效率仍达到70% 以上,表明该材料具有较好稳定性.本工作为掺磷双金属纳米颗粒的合成提供了一种简便策略,同时为电催化脱氯过程提供了一种良好的催化材料,为脱氯机理研究提供了重要参考.
关键词:电催化脱氯;4-氯苯酚;直接电化学还原;间接电催化脱氯加氢
中图分类号:X592文献标志码:A
Study on Preparation and Electrocatalytic Dechlorination Mechanism of phosphorus-doped Pd/NiP Nanoparticles
HUANG Binbin1,2,QIN ShiYi1,2,CAO Xingkai1,2
(1. College of Environmental Science and Engineering,Hunan University,Changsha 410082,China;2. Key Laboratory of Environmental Biology and Pollution Control (Hunan University),Ministry of Education,Changsha 410082,China)
Abstract:Phosphorus doped PdNi nanoparticles were prepared by one-pot synthesis method,which was carefully characterized by transmission electron microscope,scanning electron microscopy and X-ray photoelectron spectroscopy methods,showing an ultrafine particle size with a diameter of (4.4±1.0)nm. A cyclic voltammetry study demonstrated this material exhibited an excellent electrochemical property with an electrochemically active surface area(ECSA)of Pd at 42.11 m/g,which was 1.5 times higher than its commercial Pd/C counterparts. Pd/NiPnanoparticles showed a remarkable electrocatalytic dechlorination activity,in which direct electron transfer and indirect atomic hydrogen mediated electron transfer two pathways simultaneously occurred during the dehalogenation process. Meanwhile,voltammetric analyses showed that the electron transfer coefficient (k)was much smaller than 0.5,suggesting the dissociative electron transfer(DET)to the C-Cl bond of 4-CP following the concerted DET mechanism. Results indicated that the synergistic effect of trimetallic alloy and the compressive strain caused by the doping of Ni and P atoms markedly promoted the generation and retainment capacities of the adsorbed atomic hydrogen (H*)and the absorbed atomic hydrogen (H*),and effectively inhibited the hydrogen evolution reaction,thereby enhancing the electrocatalytic dechlorination efficiency. That was advantageous to improving the electrocatalytic reduction dechlorination efficiency. Electrolyses of 2 mM 4-CP showed that for the material catalyzed by the Pd/ NiP nanoparticles (1.02 mg),87.5% of 4-CP could be completely dechlorinated within 360 min with an apparent rate constant of 0.0057 min,demonstrating an excellent dechlorination performance and high stability of the developed material. This work provides a facile strategy for the synthesis of phosphorus-doped bimetallic nanoparticles,which provides an excellent catalyst and an important reference for the future electrocatalytic dechlorination works.
Key words:electrocatalytic dechlorination;4-chlorophenol;direct electrochemical reduction;indirect electrocatalytic hydrochlorination
有机氯化物,特别是氯苯酚类化合物(Chlorinated Phenols,CPs)被广泛应用在农业和工业中,其已成为水和土壤环境中的主要污染物之一[1].由于氯原子(Cl)的存在,CPs通常具有较高的致癌性、致突变性和毒性.同时,稳定的碳氯(C-Cl)键能抑制苯环裂解酶的活性,因此CPs在生态系统中具有很强的降解抗性[2].鉴于CPs的诸多危害,人们已经开发出许多高效的技术用于去除环境中的CPs污染物.目前常见的技术有物理吸附[3],催化还原[4,5],生物降解[6]以及包括光催化[3,7]、臭氧氧化[8]和芬顿反应[9]在内的高级氧化技术.与上述常见的处理技术相比,电化学还原脱氯技术的电极材料损耗较少,无需投加化学试剂,仅使用电子作为绿色还原剂,并且不会产生二次污染,因此具有显著优势[10].根据电子转移方式的不同,电化学还原脱氯可分为直接电化学还原脱氯[11-13]、电催化脱氯加氢[10,14,15]和电化学介导还原脱氯[16].在间接电催化脱氯加氢过程中,电子首先被用于还原水中的质子,生成吸附在电极表面的原子氢(Adsorbed Atomic Hydrogen,H*)物种,H*具有强还原性,对于C-Cl键裂解起到重要作用[17].而直接电化学还原通常所需的还原电位更高(负),通过污染物和阴极材料之间的电子隧穿或者生成化学吸附配合物进行脱氯[18].间接电催化脱氯加氢过程通常伴随着析氢反应(Hydrogen Evolution Reaction,HER)的发生.而HER中的Heyrovsky和Tafel步骤会使得原子氢(Atomics Hydrogen,H*)大量转化为氢气分子(H),随后产生的H附着在电极表面,阻碍电极表面的异相传质过程.因此在水相中实现直接电化学还原过程所需的较高的还原电位,将促使HER剧烈发生,导致间接电催化脱氯加氢效率的下降[10,14],以往在水相中进行电催化脱氯的研究,由于对HER的关注和对间接电催化脱氯加氢还原的高估,直接电化学还原脱氯过程往往被忽视.尽管很多研究人员认为在水相脱氯过程中存在直接还原途径,但仍缺乏证据来证实这一论断,目前还未出现关于CPs在水相中的直接电化学还原脱氯的报道[10,14].因此,在电化学还原脱氯过程中识别直接还原途径和间接还原途径,并揭示它们与脱氯过程的关系显得尤为重要.
以往的研究显示,Pd基催化剂具有优异的电催化脱氯加氢活性,其在低过电位下可以高效地还原质子生成H*[10,14,19].此外Pd基催化剂还具有出色的储氢能力,其d轨道能够与H*之间形成较强的σ键,从而有效地将H*吸收到Pd晶格中形成Pd-H键(Absorbed Atomic Hydrogen,H*)[10,14,20].为进一步优化和提高Pd基催化剂活性,同时降低催化剂成本,将Pd与Cu、Ag等成本低、电催化脱氯活性较高的金属合金化[11-13,15,21,22]是一种有效的策略.通过调节Pd的电子构型,引起Pd的晶格应变,从而获得更多的活性中心,提高Pd基催化剂的活性和稳定性[23].由于Pd与这些金属之间的协同作用,通常合金催化剂的活性要高于纯Pd[24].此外,Pd与含有丰富价电子的磷(P)结合,也可以改变Pd的电子态,从而对Pd的催化活性产生显著影响[25].有研究显示镍原子(Ni)对有机氯化物在水中的直接电化学还原脱氯过程具有优于Pd的催化活性,而掺磷的Ni纳米颗粒具有很高的HER反应活性[26,27],因此,将Pd与P、Ni合金化将有利于提高Pd的产H*与储H*能力,同时促进CPs的直接还原与间接还原过程.目前,关于掺杂P的PdNi三元合金材料用于水相中CPs的电催化脱氯研究仍鲜有报道.
本文通过富含Ni空位的氢氧化镍[V-Ni(OH)]作为支撑前驱体稳定分散Pd物种,然后使用次亚磷酸钠(NaHPO)在水中共还原PdNi金属前驱体,在常温条件下一步合成了高分散的磷掺杂的三元合金催化剂.研究结果显示,该方法可充分暴露催化剂的活性位点,从而进一步提高Pd基催化剂的质量活性.最后,以四氯苯酚(4-chlorophenol,4-CP)为目标污染物,考察Pd/NiP对4-CP的电催化脱氯活性,并揭示直接电化学还原途径和间接电催化脱氯加氢还原途径在4-CP电化学还原脱氯过程中的作用机制.
1材料与方法
1.1实验试剂及仪器
本实验使用的主要实验试剂包括:六水合氯化镍(NiCl·6HO)、1,2-环氧丙烷(CHO)、NaHPO、N,N-二甲基甲酰胺(DMF)、无水硫酸钠(NaSO)、4-CP(>99.9%)、叔丁醇(TBA,98.0%)、丙酮(>99.5%)、磷酸二氢钾(KHPO)和磷酸氢二钾(KHPO·3HO)均购于国药集团化学试剂有限公司(分析纯);氧化铝粉末(AIO,0.25 μm)购于武汉高仕睿联科技有限公司;四氯钯酸钠(NaPdCl)由上海麦克林生化有限公司提供.全氟磺酸(Nafion,5wt%)由苏州翼隆晟能源科技有限公司提供.無水乙醇(>99.7%)购于天津市富宇精细化工有限公司.本研究中使用的水均为比电导率等于18.25 MΩ·cm的去离子水.
主要仪器有:Autolab电化学工作站(瑞士万通AUT85812)、电化学工作站(上海辰华仪器有限公司CHI760E)高效液相色谱(High-Performance Liquid Chromatography,HPLC,Agilent 1100,色谱柱为Agilent ZORBAX Eclipse SB-C18,4.6 mm×150 mm,5μm)、数显控磁力搅拌器(金坛市大地自动仪器厂85-2)、电子分析天平(TE124S)与恒温循环水箱(北京长流科学仪器有限公司HX-305).
1.2实验方法
1.2.1Pd/NiP纳米颗粒的制备
V-Ni(OH)前驱体采用CH。介导的碱化沉淀法制备[28]:将713.6 mg NiCl·6HO溶解于9 mL CHCHOH中,待固体完全溶解后边搅拌边逐滴加入2.6 mL CHO,充分反应24 h.所得沉淀经离心分离后用水和CHCHOH洗涤3次,然后置于60 ℃真空干燥箱中干燥2 h,所得绿色固体经充分研磨后密封保存备用.
Pd/NiP纳米颗粒通过化学共还原制备[25,29]:将25 mg V-Ni(OH)材料加入到25 mL水中超声分散,然后在室温下边搅拌边逐滴加入344 μL 0.06 M NaPdCl.反应24 h后,向其中加入0.32 g NaHPO并充分反应5h.所得产物经离心后,分别用水和乙醇洗涤3次,然后置于60 ℃真空干燥箱中干燥2h后密封保存备用.
1.2.2电化学实验
所有实验均在25 ℃水浴条件下自制的六孔电解池中进行[11,12].循环伏安由Autolab电化学工作站(AUT85812)控制进行,扫描速率为50 mV/s.计时电流实验由电化学工作站(CHI760E)控制进行,电位固定为-0.96 V.以上实验均以0.5 M NaSO为电解质,玻碳电极(Glassy Carbon Electrode,GCE,φ2 mm,Tokai,GC-20)或者负载Pd/NiP颗粒的玻碳电极为工作电极,Pt丝为对电极,饱和甘汞电极(SCE)为参比电极(298K时为0.241 5 V vs SHE).将3 mg Pd/NiP纳米颗粒分散在1.44 mL DMF和0.03 mL Nafion的混合溶液中,形成油墨状混合物.然后取0.5 μL滴加到GCE表面并在室温下干燥,从而制备出负载Pd/NiP催化剂的工作电极.每次实验均在充满氩气保护的条件下进行,且在实验过程中均需对GCE进行抛光预处理.根据Woods的方法[30],在20 mLi M HSO中开展扫描速率为20 mV/s的循环伏安实验,从而计算出Pd在Pd/NiP纳米颗粒中的电化学活性比表面积(Electrochemically Active Surface Area,ECSA).
电解实验在分隔开(两室)的电解池中由电化学工作站(CHI760E)控制进行,将500 μL含Pd/NiP纳米颗粒的混合溶液滴加到酸处理过的碳纸(2.2 cm×2 cm)上[14]作为工作电极,对电极和参比电极分别为Pt丝和饱和甘汞电极.每次实验,向电解池中加入含有2 mmol/L 4-CP 以及0.5 M NaSO的20 mL去离子水,并定时从电解池中取出0.1 mL电解液用于产物分析.
1.2.3表征与数据分析
运用HPLC对电解过程中4-CP的浓度及其产物苯酚的浓度进行定量分析.通过透射电子显微镜
(Transmission Electron Microscopy,TEM,Titan G260-300)及其能量色散X射线映射图像(Energy Dispersive X-ray Mapping Images,EDX)、场发射扫描电子显微镜(Scan Electron Microscopy,SEM,SU8010)和X射线光电子能谱(X-Ray Photoelectron Spectroscopy,XPS,Escalab Xi+)表征Pd/NiP 纳米颗粒的形貌、价态和晶体结构.
在直接电化学还原途径中,一般通过Butler- Volmer动力学测量的电子转移系数(a)值判断目标污染物C-Cl键断裂的离解电子转移机理.考虑到α不适用于C-Cl键断裂和电子转移两个步骤均对电化学还原过程动力学有显著影响的情况,拟用以下公式中的k值作为区分电子转移机理的指标[31]:
式中:R为摩尔气体常数,8.413 J/(mol·K);F为法拉第常数,96 485 C/mol;T为反应温度,K;E是不同扫速下与4-CP直接电化学还原有关的还原峰电位值,V;v为扫速,V/s.
拟用一级动力学模型拟合Pd/NiP纳米颗粒修饰的碳纸工作电极的电催化脱氯过程的反应动力学,表达式为:
式中:C和C分别表示4-CP在t min和0 min的浓度(mmol/L);K是对电解数据进行线性回归拟合得到的表观速率常数(/min).
2结果与讨论
2.1Pd/NiP纳米颗粒的表征
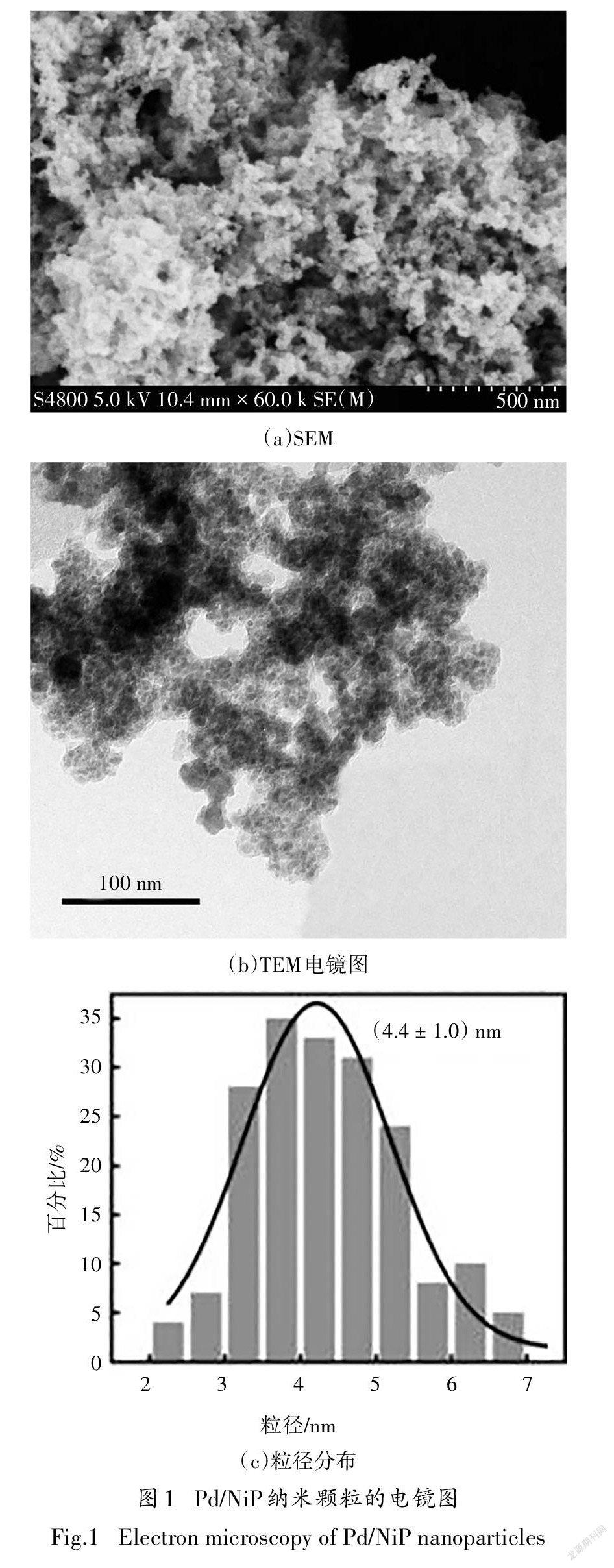
通过富含Ni空位V-Ni(OH)作为支撑前驱体充分稳定分散水中的Pd物种后,使用NaHPO还原PdNi的同时进行P掺杂,最终合成三元合金材料.SEM结果显示(图1(a))其呈现疏松多孔的三维形貌.TEM结果观察到均匀分散的Pd/NiP纳米颗粒,平均直径为(4.4±1.0)nm[图1(b)].V-Ni(OH)结构中含有丰富的金属结合位点,可以有效地防止还原过程中颗粒的聚集,从而得到超小粒径和良好分散的Pd/NiP纳米颗粒.均匀分散的Pd/NiP超細纳米颗粒具有较高的比表面积,有利于电极表面的电子与物质传递.同时,活性中心的充分暴露,对于提高4-CP 降解率和Pd/NiP纳米颗粒的利用率具有重要作用.
图2为Pd/NiP纳米颗粒的高分辨透射电镜(High-Resolution Transmission Electron Microscopy,HRTEM)图,结果显示Pd/NiP纳米颗粒的晶格间距分别为0.230 nm和0.197 nm,与Pd的(111)晶面和(200)晶面的晶格常数相比有略微的增大,可能是NaHPO在还原Pd的过程中,原子半径较Pd(0.138 nm)大的P(1.23 nm)部分取代Pd晶格中原子的某些位置,从而导致晶体的晶格常数增大.HRTEM结果中没有观察到明显的Ni单质晶面(晶格常数为0.35 nm),表明成功合成了Pd/NiP三元纳米颗粒材料.
TEM-EDX的结果显示[图3(a)],Pd/Ni/P三种元素之间的原子比为2.4:1.9:1,Pd原子占比为44.8%.通过TEM能量色散X射线映射仪(TEM- EDS)进一步表征了Pd/NiP纳米颗粒的元素分布.如图3(b)所示,Ni、P、Pd三种元素在Pd/NiP纳米颗粒结构中呈均匀分布。
为进一步测定材料表面的组成和价态,进行了XPS分析.图4为Pd/NiP纳米颗粒的XPS能谱图,采用Shirley背底对XPS谱峰进行拟合,再次证实了材料中Pd、Ni和P的存在.在图4(a)中,Ni 2P的芯能级谱峰包含3个峰,分别位于852.9 eV,856.4 eV,和874.3 eV,两个卫星峰分别位于861.4 eV和879.7 eV. Pd/NiP材料表面Ni主要以Ni存在,含少量的Ni单质.P 2P的芯能级谱峰包含1个峰[图4(b)],位于134.0 eV,为P,表明P在还原纳米颗粒过程中起到关键作用.将Pd的XPS光谱分解为2个峰[图4 (c)],与纯金属Pd 3d(334.9 eV)和Pd 3d(340.2 eV)的结合能(ICDD-04-002-9728)相比,Pd 3d(335.4 eV)和Pd 3d(340.6 eV)的结合能略有正移,这可归因于材料合成过程中其他元素的掺杂导致了Pd品格的膨胀和压缩.XPS结果显示成功合成了Pd/NiP三元纳米材料.
2.2Pd/NiP纳米颗粒的电催化产H*能力
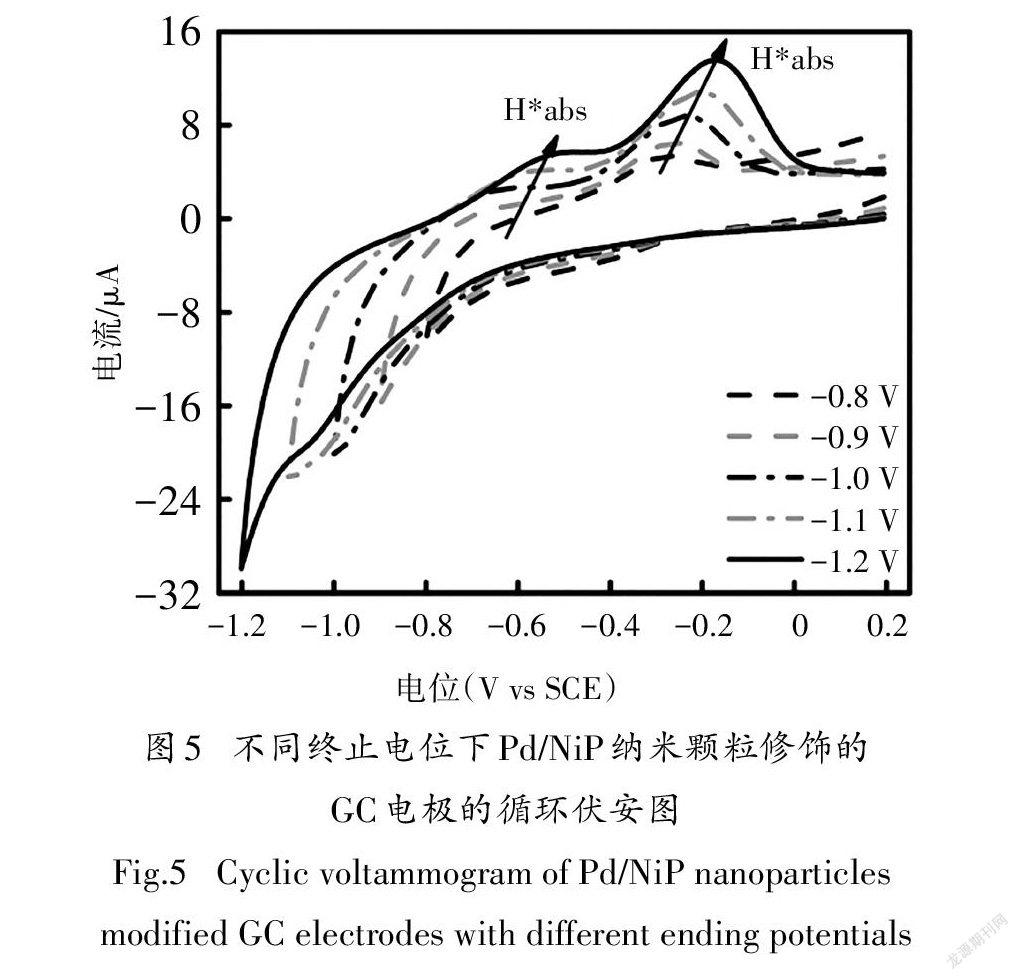
为了研究Pd/NiP纳米颗粒的电催化产H*能力,以负载1.02 μg Pd/NiP材料的GC电极作为工作电极进行循环伏安实验,起始电位固定为0.2 V,终止电位从-0.8 V逐渐负移至-1.2 V.结果如图5所示,随着终止电位的逐渐负移,负向扫描过程出现了一个还原峰,正向扫描过程中出现两个明显的氧化峰.基于以前的研究可知[14,32],-1.0~-1.1 V间的还原峰为质子还原峰,位于-0.4~-0.8 V间的氧化峰为吸收到Pd品格中形成Pd-H键的H*的氧化峰,位于0.0~-0.4 V间的氧化峰为吸附在Pd纳米颗粒表面的H*的氧化峰.结果表明,主要的H*物种是H*.
在终止电位负移过程中,两个氧化峰位置逐渐向正向移动,这可能是因为H*与Pd/NiP之间的结合逐渐达到了稳态.值得注意的是,此次实验的循环伏安结果没有显示出H的氧化峰,这与以往关于水相中间接电催化脱氯加氢的报道明显不同[10,14].结果表明,Pd/NiP催化剂可显著抑制H的产生,这可归因于高分散的Pd/NiP纳米颗粒能够充分暴露活性位点,具有优异的储H*能力.假设还原Pd单层氧化物所需的电荷为424 μC/cm[33],通过在酸性介质(1.0 M HSO)中的循环伏安实验测定了Pd/NiP纳米颗粒中Pd的ECSA为42.11 m/g,该值是商用Pd/C催化剂(28.42 m/g)的1.5倍[33].实验结果显示高分散的Pd/NiP纳米颗粒具有优越的产H*和储H*能力,同时能够为4-CP的电化学还原脱氯提供丰富的反应位点.
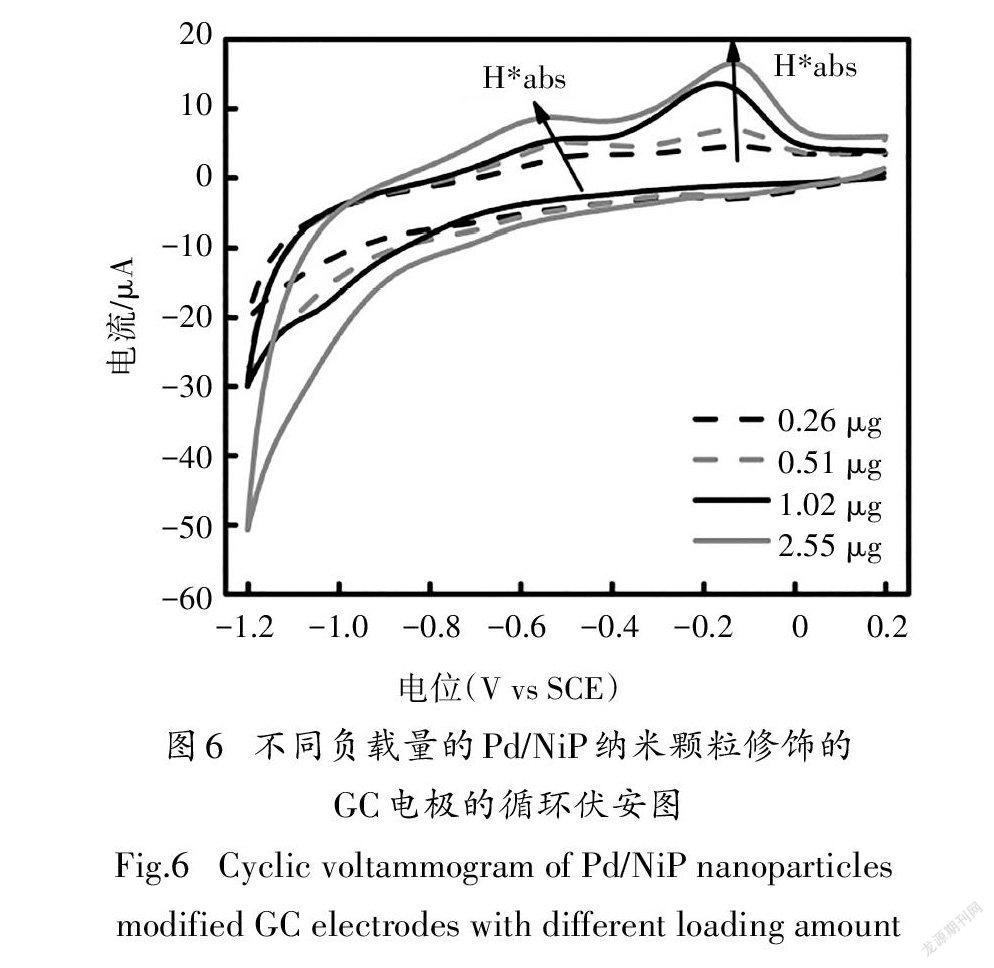
在相同的实验条件下,又进行了GC电极上负载0.26~2.55 μg质量梯度的Pd/NiP纳米颗粒的循环伏安实验,终止电位均为-1.2 V.实验结果如图6所示,四组循环伏安曲线均未出现H的氧化峰,而与H*和H*有关的两个氧化峰均出现在相同的电位范围内,且随着Pd/NiP含量的增加,氧化峰面积显著增加,H*物种的增加量远高于H*.随着负载量逐渐增加到2.55 μg,活性氢物种的增加趋势放缓.综合考虑到催化剂成本及电催化产氢效果,本研究选取1.02 μg为最佳负载量,并进一步开展电催化脱氯的研究.
2.3Pd/NiP纳米颗粒对4-CP的电催化脱氯活性
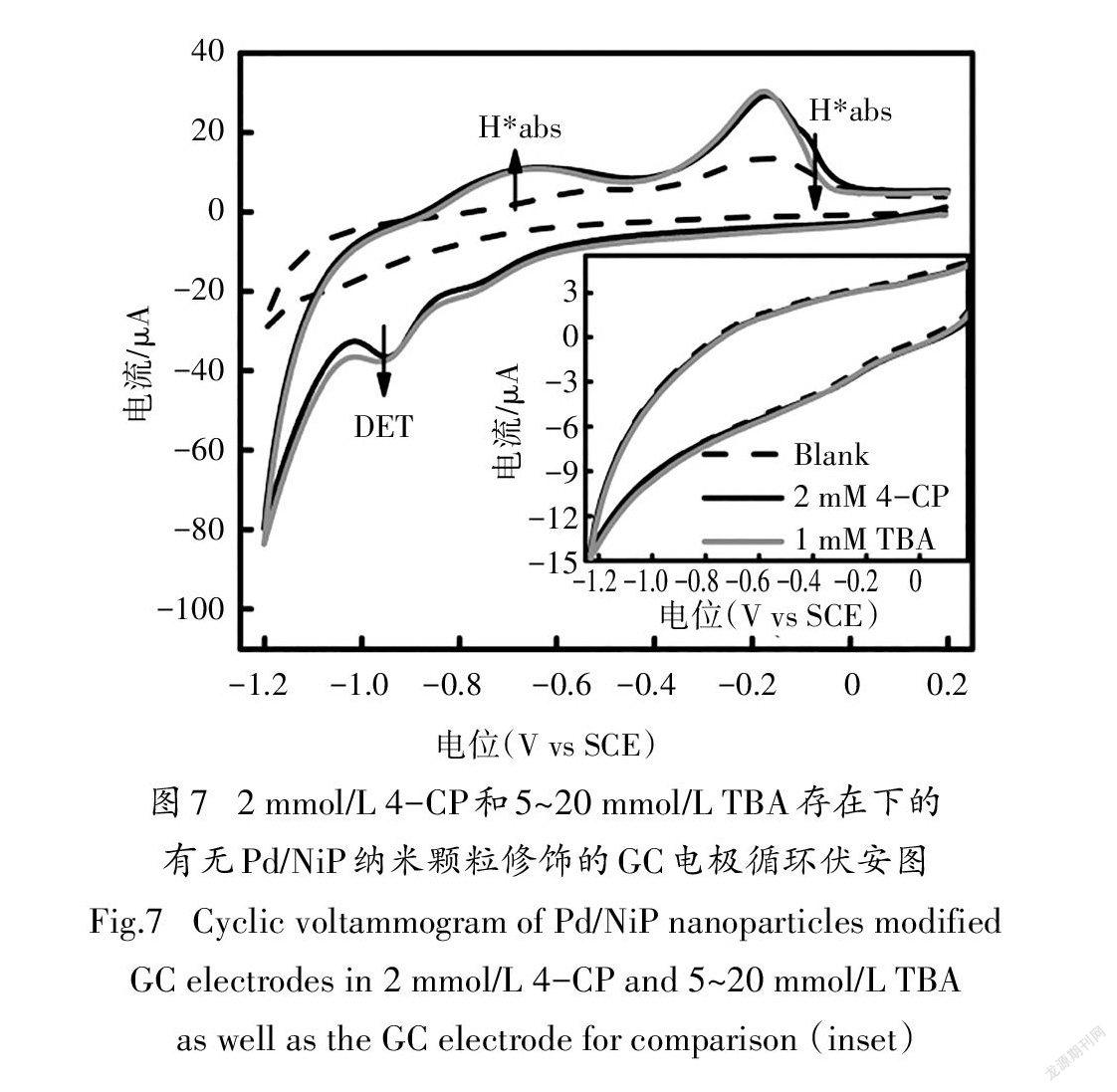
以负载1.02 μg Pd/NiP纳米颗粒的GC电极作为工作电极,进行循環伏安实验,研究Pd/NiP纳米颗粒对4-CP的电催化脱氯活性及脱氯机理.图7为Pd/NiP纳米颗粒修饰GC电极的淬灭实验结果图.与空白对照相比,在加入2 mmol/L 4-CP后的循环伏安实验负向扫描过程中,在-0.9~-1.0 V间出现了一个新的还原峰,峰电位与空白对照中-1.0~-1.1 V间的质子还原峰明显不同,推测其为质子还原和4-CP直接电化学还原的重叠峰.且在正向扫描过程中两个H*氧化峰均明显减小,表明H*与H*均参与了4- CP的间接电催化脱氯加氢过程.随着TBA的加入,H*出现少量减少,这表明TBA对H*成功进行了淬灭[18].而得益于稳定的Pd-H键,H*的量几乎没有变化.质子还原和4-CP直接电化学还原的重叠峰因H*的减少而增加,显示出直接电化学还原脱氯作用的增强.从插图中可知,加入2 mmol/L 4- CP后的纯GC电极的循环伏安曲线无明显变化,且电流值远远小于Pd/NiP材料修饰后的GC电极,表明Pd/NiP纳米颗粒对4-CP具有优异的电催化脱氯活性,且直接还原和间接还原均参与到4-CP的电化学脱氯过程中.
为了进一步验证所观察到的还原峰与4-CP直接电化学还原脱氯有关,紧接着开展了不同浓度(2~20 mmol/L)4-CP的循环伏安实验,图8为Pd/NiP纳米颗粒修饰的GC电极在不同浓度4-CP下的循环伏安行为.如图所示,随着4-CP浓度的增加,还原峰电流随之增大.假设观察到的还原峰仅归因于质子还原峰,还原峰电流应基本保持不变,而还原峰电流的增大再次证实直接电化学还原脱氯途径存在于4- CP的电化学脱氯过程中.此外,随着4-CP浓度的增大,两个氧化峰(H*和H*)逐渐减小,进一步表明H*也参与了4-CP的电催化脱氯过程,即通过间接电催化脱氯加氢路径进行了4-CP的电催化脱氯.同时,由于H*的产量较低,其对降解4-CP的贡献低于H*.值得注意的是,逆向扫描过程中在-1.0 V附近出现一新的氧化峰,这应该属于H氧化峰[14].从图中可知,在4-CP浓度达到10 mmol/L前,H對间接电催化脱氯加氢还原几乎没有贡献,直到4-CP浓度达到10 mmol/L后,两个H*氧化峰强度显著减小,H在-1.0 V的氧化峰开始出现,并呈降低的趋势,表明H在H*缺乏的情况下也可作为降解4-CP的补充还原剂[34].
以上结果表明Pd/NiP纳米颗粒催化的4-CP电化学还原过程存在两种脱氯途径,即直接还原途径和间接还原途径.Ni、P与Pd之间的协同效应显著提高了催化剂活性,从而实现直接电化学还原过程[26,27].而间接还原途径则主要依赖于Pd位点上储存的H*物种[10,14,15,32].
2.44-CP直接电化学还原脱氯过程的电子转移机理
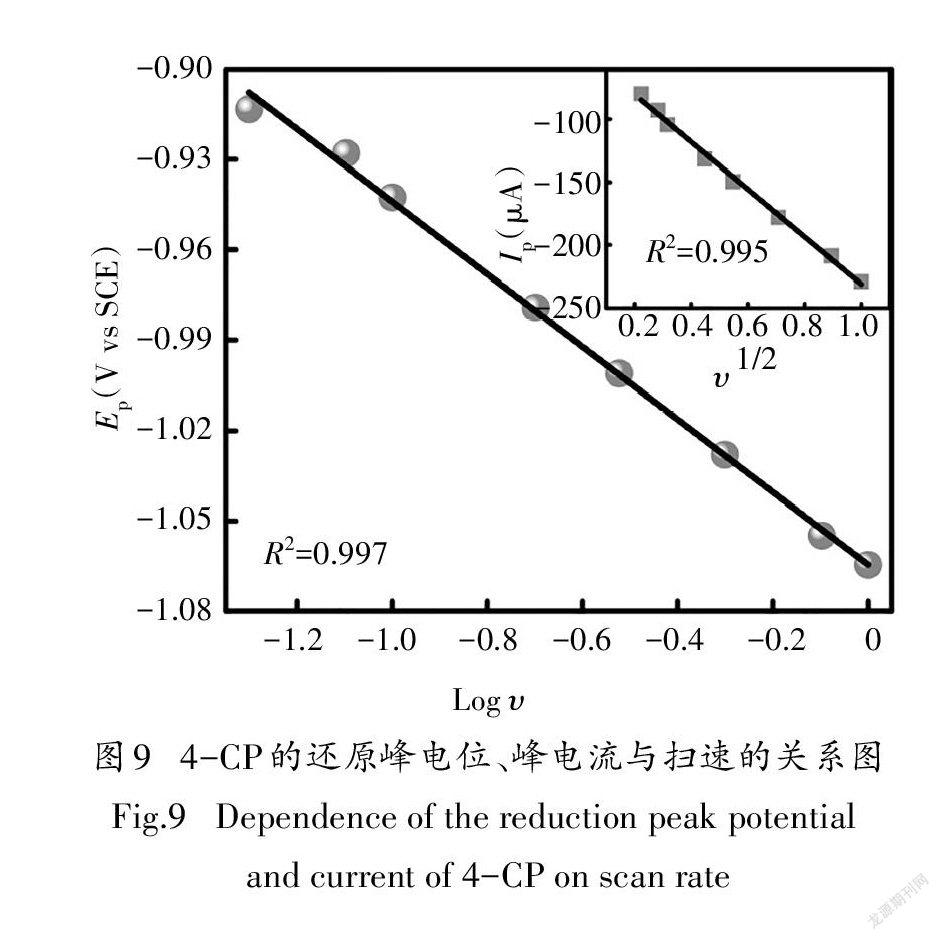
4-CP在Pd/NiP修饰的电极表面发生的直接电化学还原脱氯需要电子从电极表面转移至4-CP,诱导其C-Cl键断裂来完成.根据电子转移和C-Cl键的断裂顺序,离解电子转移机理可分为同步离解电子转移机理和分步离解电子转移机理.分步离解电子转移过程中电子转移至目标污染物后形成了不稳定的中间产物阴离子自由基,随后再发生C-Cl键断裂反应;同步离解电子转移过程中电子转移和C-Cl键断裂同时发生,速控步骤为电子转移过程[16].为探究Pd/NiP直接电化学还原4-CP过程中的电子转移机理及速控步骤,开展了不同扫速下(0.05~2 V/s)的循环伏安实验研究.通过公式(1)计算得到的k值为0.25,远小于0.5,表明4-CP在Pd/NiP修饰的电极表面的直接电化学还原遵循同步离解电子转移机理,4-CP在电极表面得到一个电子的同时发生了C-Cl键的断裂[31].
图9为4-CP的还原峰电位E、峰电流I与扫速的关系图,如图所示,还原峰电流I随着扫描速率的增加而增大,还原峰电位E随着扫速的增加逐渐负移,表明4-CP的直接电化学还原过程同时受到电子转移与物质转移的联合控制.同时,还原峰电流I与v之间呈现良好线性关系,表明在阴极还原过程中,4-CP从溶液到电极表面的扩散控制起主导作用[13].
2.5Pd/NiP修饰碳纸电极对4-CP的电解实验
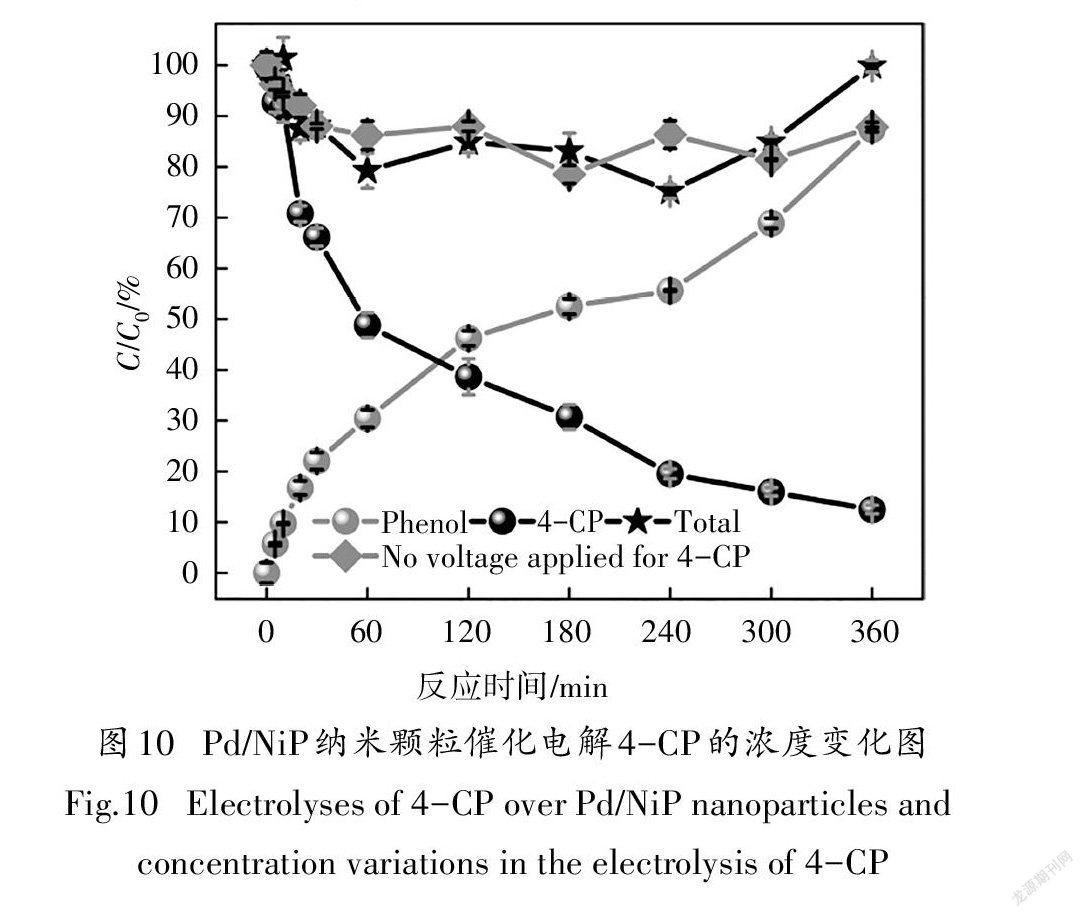
为了进一步评价和验证Pd/NiP纳米颗粒对4- CP的电催化脱氯性能,以负载1.02 mg Pd/NiP材料的导电碳纸作为工作电极,通过CHI760E电化学工作站进行恒电位电解实验.电位设置在-0.78 V,4- CP浓度为2 mmol/L.图10为Pd/NiP纳米颗粒催化电解4-CP的实验结果,如图所示,苯酚是4-CP降解过程的唯一产物,且随着4-CP的降解,苯酚产量逐渐增多,总质量(Mass balance)保持在79%~101%,质量较为守恒.而在没有施加电位的情况下,电极表现出对4- CP轻微的吸附,且没有苯酚生成,表明4-CP的脱氯是通过电化学还原途径实现的.值得注意的是,在电解60 min时达到了51.0%的去除率,随后电解效率趋缓,电解360 min,脱氯率达到87.5%.这可能是由于越来越多的苯酚吸附在阴极表面,占据了产生H*和降解4-CP的活性位点,导致脱氯效率下降[15,32,36].
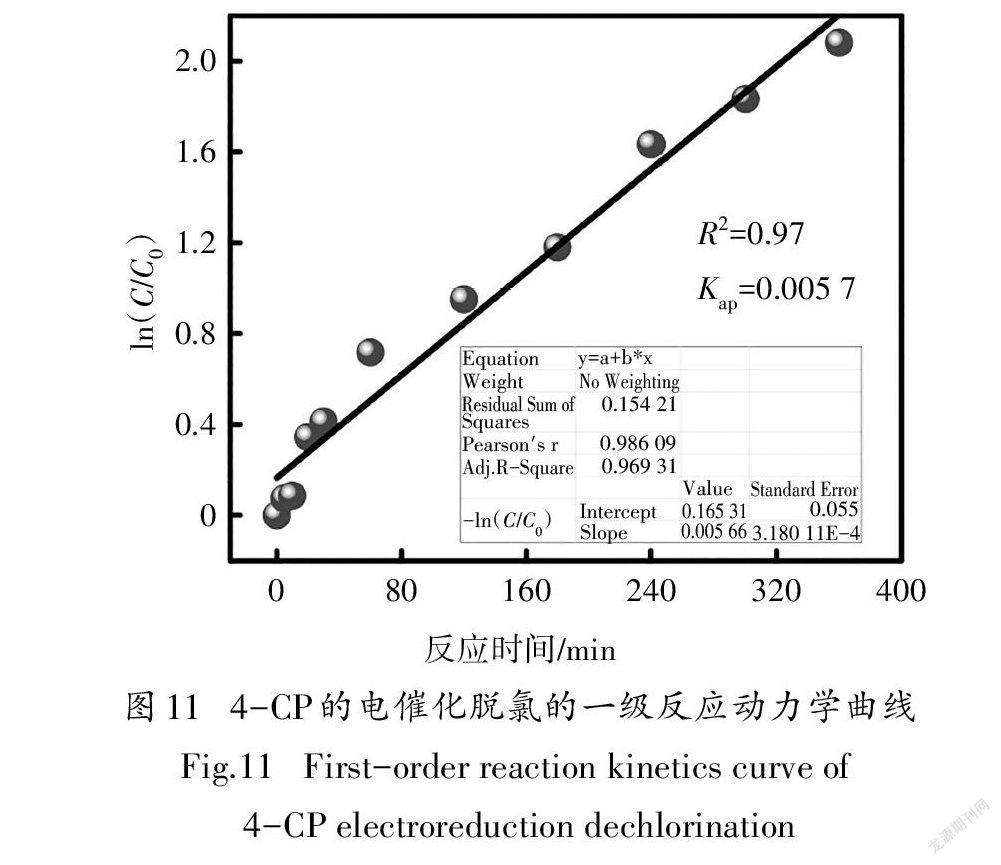
对动力学结果的分析表明,4-CP在Pd/NiP修饰电极上的电催化脱氯遵循准一级反应,K为0.0057/min(图11).在没有优化实验条件的情况下,Pd/NiP材料依然表现出较高的电催化脱氯性能:在4-CP浓度较高,电解电位较正,材料负载量较小(Pd的负载量为0.1 mg/cm)的情况下,电解60 min后污染物的去除率依然比负载Pd-MnO材料(Pd的负载量为0.44 mg/cm)的泡沫Ni电极高5%[32];质量活性比单分散纯Pd/C材料(Kap为0.007 1/min,Pd的负载量为2.28 mg/cm)高7.2/min·g[14].三次循环实验结果显示,Pd/NiP修饰电极在未经任何处理情况下(每次循环后仅用水大量冲洗),其脱氯效率仍达到70%以上,表明该材料具有较好稳定性.
3结论
本研究采用一步法成功合成了磷掺杂的三元合金纳米颗粒.TEM与XPS等表征结果显示合成的Pd/NiP纳米颗粒直径为4.4 nm ±1.0 nm,具有超细的粒径和良好的分散性.掺杂Ni和P引起的压缩应变以及协同效应,使得Pd/NiP纳米颗粒对4-CP显示出优异的电催化脱氯活性与良好的稳定性.本研究证实了直接电化学还原途径和间接电催化脱氯加氢还原途径同时存在于4-CP的电化学还原脱氯过程中,并且详细阐述了H*、H*以及H均有助于间接电催化脱氯加氢过程.此外,在直接电化学还原途径中,电子转移系数k值小于0.5,表明4-CP在Pd/NiP修饰电极表面的直接电化学还原裂解遵循同步离解电子转移机理.最后,电解360 min,4-CP的脱氯效率达到87.5%,K为0.0057/min,体现了Pd/NiP纳米颗粒优异的电催化脱氯活性.本研究为掺磷双金属材料的制备提供了一种简易的方法,论证了电化学还原脱氯反应中同时存在直接还原途径和间接还原途径,为电化学脱氯机理的深入研究提供了重要手段和参考.
參考文献
[1] OLLER I,MALATO S,SANCHEZ-PEREZ J A. Combination of Advanced Oxidation Processes and biological treatments for wastewater decontamination—A review [J]. Science of The Total Environment,2011,409:4141-4166.
[2] DE MORAIS P,STOICHEV T,BASTO M C P,et al. Extraction and preconcentration techniques for chromatographic determination of chlorophenols in environmental and food samples [J]. Talanta,2012,89:1-11.
[3] ABOU TALEB M F. Adsorption and photocatalytic degradation of 2-CP in wastewater onto CS/CoFeO nanocomposite synthesized using gamma radiation [J]. Carbohydrate Polymers,2014,114:65-72.
[4] ZHANG Y,CUI Z,LI L,et al. Two-dimensional structure Au nanosheets are super active for the catalytic reduction of 4-nitro- phenol [J]. Physical Chemistry Chemical Physics,2015,17:14656-14661.
[5] PIZARRO A H,MOLINA C B,CASAS J A,et al. Catalytic HDC/HDN of 4-chloronitrobenzene in water under ambient-like conditions with Pd supported on pillared clay[J]. Applied Catalysis B:Environmental,2014,158-159:175-181.
[6] UYSAL A. Turkman. Biodegradation of 4-CP in an activated sludge reactor:Effects of biosurfactant and the sludge age[J]. Journal of Hazardous Materials,2007,148:151-157.
[7] VAIZOGULLAR A i. Highly efficient light responsive BiOCl/AgI composites for photocatalytic degradation of 3-CP under visible and UV light irradiations[J]. Journal of Materials Science:Materials in Electronics,2018,29:13292-13301.
[8]QI L,YAO J,YOU H,et al. Oxidation products and degradation pathways of 4-chlorophenol by catalytic ozonation with MnO/γ- AlO/TiO as catalyst in aqueous solution[J]. Journal of Environmental Science and Health,Part A,2013,49:327-337.
[9] WANG M,FANG G,LIU P,et al. FeO @β-CD nanocomposite as heterogeneous Fenton-like catalyst for enhanced degradation of 4-chlorophenol (4-CP)[J]. Applied Catalysis B:Environmental,2016,188:113-122.
[10] LIU R,ZHAO H,ZHAO X,et al. Defect Sites in Ultrathin Pd Nanowires Facilitate the Highly Efficient Electrochemical Hydro - dechlorination of Pollutants by H*[J]. Environmental Science & Technology,2018,52:9992-10002.
[11] ISSE A A,HUANG B,DURANTE C,et al. Electrocatalytic dechlorination of volatile organic compounds at a copper cathode. Part I:Polychloromethanes[J]. Applied Catalysis B:Environmental,2012,126:347-354.
[12] DURANTE C,HUANG B,ISSE A A,et al. Electrocatalytic dechlorination of volatile organic compounds at copper cathode. Part II:Polychloroethanes [J]. Applied Catalysis B:Environmental,2012,126:355-362.
[13] HUANG B,LI J,CAO X,et al. Electrochemical reduction of p- chloronitrobenzene (p-CNB)at silver cathode in dimethylformamide [J]. Electrochimica Acta,2019,296:980-988.
[14] JIANG G,LAN M,ZHANG Z,et al. Identification of active hydrogen species on palladium nanoparticles for an enhanced electrocatalytic hydrodechlorination of 2,4-dichlorophenol in water [J]. Environmental Science & Technology,2017,51:7599-7605.
[15] PENG Y,CUI M,ZHANG Z,et al. Bimetallic composition- promoted electrocatalytic hydrodechlorination reaction on silver - palladium alloy nanoparticles [J]. ACS Catalysis,2019,9:10803-10811.
[16] SAVEANT J M. Elements of molecular and biomolecular electro- chemistry[M]. 2nd ed. New Jersey:America Willey-VCH,2006:184-193.
[17] ZHENG Y,JIAO Y,JARONIECM,et al. Advancing the electrochemistry of the hydrogen-evolution reaction through combining experiment and theory [J]. Angewandte Chemie International Edition,2015,54:52-65.
[18] MAO R,LI N,LAN H,et al. Dechlorination of trichloroacetic acid using a noble metal-free graphene - Cu Foam electrode via direct cathodic reduction and atomic H* [J]. Environmental Science & Technology,2016,50:3829-3837.
[19] LOU Z,ZHOU J,SUN M,et al. MnO:enhances electrocatalytic hydrodechlorination by Pd/Ni foam electrodes and reduces Pd needs[J]. Chemical Engineering Journal,2018,352:549-557.
[20] CHAPLIN B P,REINHARDM,SCHNEIDER WF,et al. Critical review of Pd-based catalytic treatment of priority contaminants in water [J]. Environmental Science & Technology,2012,46:3655-3670.
[21] RONG H,CAI S,NIU Z,et al. Composition-dependent catalytic activity of bimetallic nanocrystals:AgPd-catalyzed hydrodechlorination of 4-chlorophenol[J]. ACS Catalysis,2013,3:1560- 1563.
[22] HUANG B,ZHU Y,LI J,et al. Uncovering the intrinsic relationship of electrocatalysis and molecular electrochemistry for dissociative electron transfer to polychloroethanes at silver cathode[J]. Electrochimica Acta,2017,231:590-600.
[23] WANG H,YIN S,LI Y,et al. One-step fabrication of trimetallic PdCuAu nanothorn assemblies as an efficient catalyst for oxygen reduction reaction[J]. Journal of Materials Chemistry A,2018,6:3642-3648.
[24] GAO F,ZHANG Y,SONG P,et al. Self-template construction of Sub-24 nm Pd Ag hollow nanodendrites as highly efficientelectrocatalysts for ethylene glycol oxidation[J]. Journal of Power Sources,2019,418:186-192.
[25] ZHAO Z,MA X,WANG X,et al. Synthesis of amorphous PdP nanoparticles supported on carbon nanospheres for 4-nitrophenol reduction in environmental applications[J]. Applied Surface Science,2018,457:1009-1017.
[26] XU Y,YAO Z,MAO Z,et al. Single-Ni-atom catalyzes aqueous phase electrochemical reductive dechlorination reaction[J]. Applied Catalysis B:Environmental,2020,277:11905711190578.
[27] POPCZUN E J,MCKONE JR,READ C G,et al. Nanostructured nickel phosphide as an electrocatalyst for the hydrogen evolution reaction[J]. Journal of the American Chemical Society,2013,135:9267-9270.
[28] HE Q,WAN Y,JIANG H,et al. Nickel vacancies boost reconstruction in nickel hydroxide electrocatalyst[J]. ACS Energy Letters,2018,3:1373-1380.
[29] HE Q,TIAN D,JIANG H,et al. Achieving efficient alkaline hydrogen evolution reaction over a NiP catalyst Incorporating single-atomic Ru sites [J]. Advanced Materials,2020,32:19069721-19069728.
[30] RAND D A J,WOODS R. The nature of adsorbed oxygen on rhodium,palladium and gold electrodes[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1971,31:29-38.
[31] ISSE A A,MUSSINI P R,GENNARO A. New insights into electrocatalysis and dissociative electron transfer mechanisms:the case of aromatic bromides[J]. The Journal of Physical Chemistry C,2009,113:14983-14992.
[32] LOU Z,XU J,ZHOU J,et al. Insight into atomic H* generation,H evolution,and cathode potential of MnO2 induced Pd/Ni foam cathode for electrocatalytic hydrodechlorination[J]. Chemical Engineering Journal,2019,374:211-220.
[33] BI C,SONG Y,HE H,et al. Simple synthesis and surface facettuning of ultrathin alloy-shells of Au@AuPd nanoparticles via silver-assisted co-reduction onto facet-controlled Au nanopar- ticles[J]. Journal of Materials Chemistry A,2018,6:7675-7685.
[34] LEE J,SHIM W,NOH J S,et al. Design rules for nanogap-based hydrogen gas sensors[J]. ChemPhysChem,2012,13:1395- 1403.
[35] AN C,KUANG Y,FU C,et al. Study on Ag - Pd bimetallic nanoparticles for electrocatalytic reduction of benzyl chloride[J]. Electrochemistry Communications,2011,13:1413-1416.
[36] JIANG G,WANG K,LI J,et al. Electrocatalytic hydrodechlorination of 2,4-dichlorophenol over palladium nanoparticles and its pH-mediated tug-of-war with hydrogen evolution[J]. Chemical Engineering Journal,2018,348:26-34.

