人肺腺癌细胞A549对蜱媒脑炎病毒的易感性分析
唐万达,赵 平,任瑞文,戚中田,赵兰娟*
1. 海军军医大学(第二军医大学)海军医学系生物医学防护教研室,上海 200433
2. 南部战区疾病预防控制中心,广州 510507
蜱媒脑炎病毒(tick-borne encephalitis virus,TBEV)是一种由传播媒介蜱叮咬传播的虫媒病毒,也称森林脑炎病毒(forest encephalitis virus),为自然疫源性疾病蜱媒脑炎的病原体。TBEV感染会侵犯中枢神经系统,引起急性脑膜炎或脑炎,可伴有永久性后遗症,致死率为12%~40%[1]。蜱媒脑炎主要流行于欧洲、东亚和东南亚[2]。在中国,蜱媒脑炎主要分布于东北和新疆地区,西藏和云南也有病例;传播媒介蜱的生活习性造成疾病呈季节性流行[3]。目前蜱媒脑炎的临床治疗缺乏高效、特异的抗TBEV药物。
TBEV属于黄病毒科黄病毒属,和该属其他成员如寨卡病毒、登革病毒、黄热病毒、西尼罗病毒、乙型脑炎病毒等均是重要的人类高致病性病原体。TBEV是有包膜的正链单链RNA病毒,病毒基因组编码衣壳蛋白、前膜蛋白、包膜蛋白3个结构蛋白和7个非结构蛋白[4]。TBEV分为欧洲亚型、西伯利亚亚型、远东亚型、贝加尔亚型和喜马拉雅亚型[5]。文献报道,中国TBEV分离株均为远东亚型[6]。TBEV感染所致疾病的严重程度与病毒的型别有关,而远东亚型TBEV是致病性最严重的型别[5]。全球蜱媒脑炎存在较高的发病率和致死率,一些非自然疫源地也曾有病例发生。本研究旨在考察TBEV在易感细胞中的培养特性及鉴定病毒的RNA复制、蛋白质表达和感染性,为抗TBEV药物的筛选研究提供合适的细胞模型和病毒检测方法。
1 材料和方法
1.1 主要材料 DMEM、FBS、EDTA、胰蛋白酶、TRIzol试剂(美国Invitrogen公司),M-MLV反转录酶、三磷酸脱氧核苷酸混合溶液、Eastep®qPCR预混液试剂盒(美国Promega公司),随机引物、TBEV非结构蛋白1引物(北京六合华大基因科技股份有限公司),黄病毒包膜蛋白鼠单克隆抗体4G2(美国Sigma-Aldrich公司),β-肌动蛋白兔多克隆抗体(美国Cell Signaling Technology公司),HRP标记的山羊抗兔或鼠IgG、ECL化学发光液(美国Bio-Rad公司),Alexa Fluor®488山羊抗鼠IgG、DAPI封固剂(英国Abcam公司),牛血清白蛋白(美国Affymetrix公司),4%多聚甲醛溶液(北京鼎国昌盛生物技术有限责任公司)。人肺腺癌细胞A549和猪肾细胞PK-15由复旦大学基础医学院病原生物学系叶荣研究员馈赠,TBEV及非洲绿猴肾细胞Vero由海军军医大学(第二军医大学)海军医学系生物医学防护教研室保存。
1.2 细胞培养 A549、PK-15、Vero细胞均采用含10% FBS、1%谷氨酰胺、1%青霉素、1%链霉素的DMEM(完全培养基)在37 ℃、5% CO2培养箱中培养。用含EDTA的胰蛋白酶消化细胞,对融合度达到95%以上的细胞进行传代培养。
1.3 病毒制备 将生长状态佳的Vero细胞接种于T75细胞培养瓶,细胞融合度约为90%时吸弃培养基,将1 mL TBEV和5 mL完全培养基涡旋混匀后加入细胞培养瓶内,置37 ℃培养箱中吸附2 h,其间轻缓摇动2次;2 h后于培养瓶内补加12 mL完全培养基,继续培养并开始计时。每天于显微镜下观察细胞病变效应;培养72 h后将培养瓶内培养基转移至15 mL离心管,1 010×g离心10 min,收集、分装病毒,-80 ℃冰箱贮存备用。
1.4 空斑实验 对于Vero细胞培养的TBEV,使用前在PK-15细胞上用空斑法测定病毒滴度。空斑实验操作参照文献[7]并适当改进:PK-15细胞接种于12孔培养板,细胞融合度接近100%时进行实验;用完全培养基10倍系列稀释病毒,于吸弃培养基的培养板内每孔加入稀释病毒液1 mL,吸附3 h后吸弃病毒液,每孔加入2%羧甲基纤维素钠覆盖液3 mL,培养6 d后吸弃覆盖液;每孔加入4%多聚甲醛溶液600 μL,室温固定15 min后吸弃 ;每孔加入1%结晶紫染液600 μL,染色15 min后吸弃;轻缓流水洗板至流水无色,晾干后观察并计数病毒空斑。采用Reed-Muench法计算空斑形成单位(plaque-forming unit,PFU),以PFU/mL表示病毒滴度。
1.5 TBEV感染细胞 将A549细胞接种于12孔培养板,培养过夜。TBEV感染细胞方式一:细胞融合度接近100%时,吸弃孔内培养基;每孔加入完全培养基稀释的病毒液1 mL,病毒感染复数(multiplicity of infection,MOI)为0.1。方式二:吸弃孔内培养基后,每孔加入稀释病毒液200 μL,MOI为0.1,于37 ℃吸附2 h后吸弃病毒液,培养基洗涤1次后加入完全培养基(每孔1 mL)。每种方式均设未感染病毒的细胞对照。培养48 h后,使用倒置显微镜(日本Olympus公司)观察细胞病变效应。
1.6 免疫荧光实验 A549、Vero细胞接种于48孔培养板,培养过夜,细胞融合度约90%时吸弃培养基,每孔加入完全培养基稀释的TBEV 300 μL(分别按1∶1 000、1∶100 000比例稀释),未感染病毒的对照孔加入完全培养基。细胞培养48 h后,吸弃稀释病毒液,PBS洗涤后每孔加入4%多聚甲醛溶液300 μL,室温固定15 min。PBS洗涤后每孔加入甲醇300 μL,于-20 ℃透化20 min。PBS洗涤后每孔加入3%牛血清白蛋白溶液300 μL,封闭2 h。吸弃封闭液后加入1%牛血清白蛋白溶液稀释的黄病毒包膜蛋白鼠单克隆抗体(稀释比例为1∶500),4 ℃孵育过夜。PBS洗涤3次,加入1%牛血清白蛋白溶液稀释的Alexa Fluor®488标记山羊抗鼠IgG(稀释比例为1∶1 000)避光孵育1 h,PBS洗涤3次后加入DAPI封固剂,细胞核染色5 min。使用全自动细胞成像及分析系统(BioTek Cytation 5 Imaging Reader,美国BioTek公司)观察,分析病毒包膜蛋白的表达情况。
1.7 实时qPCR实验 Vero细胞中RNA样品收集、RNA浓度检测、反转录实验操作参照文献[8]。以cDNA为模板,使用Eastep®qPCR预混液试剂盒,采用Rotor-Gene 3000型PCR仪(澳大利亚Corbett公司)扩增目的基因。TBEV的非结构蛋白1引物序列见文献[9]。
1.8 蛋白质印迹法实验 Vero细胞中蛋白质样品的制备、电泳及电转膜实验操作参照文献[8],电泳及电转膜实验使用Bio-Rad Mini仪。一抗用稀释的黄病毒包膜蛋白鼠单克隆抗体(稀释比例为1∶1 000)和β-肌动蛋白兔多克隆抗体(稀释比例为1∶1 000),二抗用HRP标记羊抗鼠或兔IgG(稀释比例均为1∶2 000)。最后膜上加ECL化学发光液,用化学发光成像仪(英国GeneGnome公司)显色,分析黄病毒包膜蛋白的表达情况。
1.9 统计学处理 应用GraphPad Prism 5.0软件进行数据分析。符合正态分布的计量资料以±s表示,病毒滴度的组间比较采用Studentt检验。检验水准(α)为0.05。
2结 果
2.1 Vero细胞能够用于培养TBEV qPCR检测结果显示,在无TBEV孵育的对照Vero细胞中,TBEV的非结构蛋白1基因未出现扩增曲线;TBEV孵育的Vero细胞出现扩增曲线,并且孵育72 h样品的扩增曲线起峰时间较孵育48 h样品早,荧光强度值也较高(图1A)。蛋白质印迹法检测结果显示,在对照Vero细胞中未见黄病毒包膜蛋白表达,而在TBEV孵育72 h的细胞中检出黄病毒包膜蛋白表达(图1B)。空斑实验结果显示,在TBEV孵育Vero细胞72 h的培养基中病毒滴度为(2.0±1.4)×106PFU/mL。上述结果表明,Vero细胞能够用于TBEV培养。
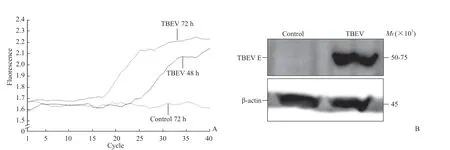
图1 Vero细胞培养TBEV的RNA复制和黄病毒包膜蛋白表达Fig 1 RNA replication and flavivirus envelope protein expression of TBEV in Vero cells incubated with TBEV
2.2 TBEV感染导致A549细胞病变 如图2A所示,TBEV未感染的A549细胞形态正常,铺满培养板孔底;TBEV感染48 h的A549细胞出现明显细胞病变效应,表现为胞体皱缩、变圆,细胞间隙增大,并出现细胞脱落。TBEV孵育2 h后吸弃病毒液,继续以新鲜培养基培养48 h的A549细胞也有明显细胞病变效应,而无TBEV孵育的对照组细胞则形态正常(图2B)。这一结果提示,Vero细胞培养的TBEV具有高度感染性,A549细胞对其易感,2种感染方式均可引发细胞病变效应。

图2 TBEV感染后A549细胞的细胞病变效应(100×)Fig 2 Cytopathic effect of A549 cells after TBEV infection (100×)
2.3 TBEV感染的A549和Vero细胞中黄病毒包膜蛋白表达及病毒增殖水平 如图3所示,在未感染TBEV的A549细胞中无阳性信号,而在1∶1 000稀释TBEV感染的A549和Vero细胞中均可见阳性信号——绿色荧光(包膜蛋白)。经计数分析,在1∶1 000稀释TBEV感染的A549细胞中黄病毒包膜蛋白表达的阳性率为61.0%,而在Vero细胞中阳性率仅为9.3%;在1∶100 000稀释TBEV感染的A549细胞中黄病毒包膜蛋白表达的阳性率为43.0%,在Vero细胞中未检测到黄病毒包膜蛋白表达。空斑实验结果显示,TBEV感染A549细胞48 h的培养基中的病毒滴度为(2.0±0.4)×107PFU/mL,高于Vero细胞培养基中的病毒滴度[(8.5±2.1)×103PFU/mL],差异有统计学意义(P<0.05)。上述结果表明,TBEV在A549细胞中的增殖水平较Vero细胞高,A549细胞可作为抗病毒药物筛选研究的细胞模型。
图 3 TBEV感染的A549和Vero细胞中黄病毒包膜蛋白的表达(100×)Fig 3 Expression of flavivirus envelope protein in TBEV-infected A549 and Vero cells (100×)
3 讨 论
虫媒病毒在吸血昆虫和宿主动物体内循环,可在自然界中长期存在,并随着传播媒介在全球分布范围的扩大而传播扩散,被称为重要的被忽略的热带传染病病原体[10]。深入研究TBEV的生物学性状与致病机制对于防控TBEV感染具有重要意义。
病毒的生物学性状、病毒-细胞相互作用、病毒的致病机制和抗病毒药物的研发等研究工作需要合适的细胞模型。一些人畜共患病病毒如天花病毒、裂谷热病毒和脑心肌炎病毒1可在许多细胞系中增殖,而西尼罗病毒、辛德比斯病毒和TBEV仅在部分细胞系中增殖,表明特异的细胞分子可能参与病毒的增殖过程[11]。文献报道,猪肾PK细胞对TBEV易感,可用于培养病毒,TBEV感染的PK细胞可观察到细胞病变效应和空斑形成[12]。
有研究通过检测TBEV滴度和RNA复制水平发现,病毒可在人单核细胞THP-1内有效复制和增殖,提示在TBEV感染并播散至其他组织器官过程中单核细胞可能起重要作用[13]。仓鼠肾细胞BHK-21可用于从野生啮齿动物体内分离TBEV[14]。对TBEV包膜蛋白变异与感染性的研究选用病毒感染的BHK-21细胞作为模型[15]。检测TBEV在BHK-21细胞内的空斑形成、RNA复制和蛋白质合成可用于比较不同型别TBEV生物学特性的差异[16]。Vero细胞被用于从蜱体内分离培养TBEV[17],还可用于蜱媒脑炎疫苗的研发[18]。本研究通过对TBEV的RNA复制、蛋白质表达与滴度等指标进行检测,发现在TBEV孵育的Vero细胞内不仅检测到TBEV RNA与黄病毒包膜蛋白,还在细胞培养基中检测到释放的病毒。这些结果表明Vero细胞能够用于培养TBEV,并可从病毒的RNA复制、蛋白质合成与滴度方面对其进行鉴定。
TBEV的增殖水平在不同类型细胞中有所差异。A549细胞曾被用于研究蜱体内TBEV分离株与标准株Hypr之间的区别[17]。近年有研究报道,在A549细胞中,腺苷类似物NITD008可抑制TBEV RNA复制,2-脱氧糖尿苷衍生物也可降低病毒滴度,均具有较高的抗TBEV活性[19-20]。本研究用Vero细胞培养的TBEV感染A549细胞,发现TBEV在2种感染方式下均可引发明显细胞病变效应;间接免疫荧光法检测结果显示A549细胞中病毒包膜蛋白的表达水平远高于Vero细胞;空斑实验结果证明A549细胞培养基中病毒滴度高于Vero细胞。本研究结果表明Vero细胞培养的TBEV具有感染性,A549细胞对TBEV更易感。

