急性脑梗死患者单核细胞/高密度脂蛋白比值与颅内动脉斑块稳定性的相关性分析
林煌斌,王 诺,吴 涛
海军军医大学(第二军医大学)第一附属医院脑血管病中心,上海 200433
大动脉粥样硬化是脑梗死的主要原因,相较于白种人,亚洲人群的动脉粥样硬化多发于颅内动脉[1-2],在我国脑梗死患者中颅内动脉粥样硬化约占46.6%[3]。颅内动脉斑块的稳定性与急性脑梗死密切相关,研究表明高分辨率磁共振(high resolution magnetic resonance,HRMR)颅内动脉管壁成像能够有效评估颅内动脉粥样硬化斑块的大小、形态和稳定性,斑块强化程度和斑块内出血与斑块稳定性密切相关[4-6],但目前仍缺乏能够有效反映颅内动脉粥样硬化斑块稳定性的血清标志物。单核细胞与高密度脂蛋白在动脉血管斑块的形成中发挥着重要作用[7-8],研究表明单核细胞/高密度脂蛋白比值(monocyte to high density lipoprotein ratio,MHR)与心脑血管疾病的发生有关[9-10]。目前有关MHR与动脉粥样硬化斑块稳定性尤其是颅内动脉斑块稳定性的研究很少。本研究通过HRMR颅内动脉管壁成像判断急性脑梗死患者的颅内动脉斑块稳定性,分析颅内动脉斑块稳定性与MHR的相关性,探讨MHR在评估颅内动脉斑块稳定性中的作用。
1 资料和方法
1.1 研究对象 回顾性连续选择2019年1月至2020年7月于我院脑血管病中心住院治疗且行颅内血管管壁成像的患者635例。纳入标准:(1)18岁以上急性脑梗死(发病2周内)患者;(2)责任病变为颅内动脉狭窄;(3)行HRMR颅内动脉管壁成像检查。排除标准:(1)心源性栓塞或其他原因脑梗死(动脉夹层、动脉炎等);(2)颈内动脉颅外段狭窄>50%;(3)有既往自身免疫病、血管炎,院前明确感染,肿瘤,近3个月内心肌梗死、手术或创伤,外周血管严重狭窄或闭塞,或慢性支气管炎、慢性胃炎等病史;(4)入院前服用糖皮质激素、免疫抑制剂药物;(5)肝肾功能异常。本研究通过我院伦理委员会审批,所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 临床资料 收集患者年龄、性别、BMI、脑血管病危险因素(吸烟史、脑卒中病史、冠心病史、糖尿病史、高血压病史)。吸烟史定义为连续或累积吸烟6个月以上且每天吸烟至少1支。入院前采用美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NHISS)评 价 脑梗死严重程度。采用改良Rankin量表(modified Rankin scale,mRS)评价脑梗死患者的预后情况,术后90 d mRS评分≤2分为预后良好。
1.2.2 实验室检查 收集脑血管病中心急诊48 h内患者的血常规、血脂、CRP、尿酸、同型半胱氨酸等数据。
1.2.3 影像学检查 (1)采用颈动脉CT血管造影检查评价颅外血管狭窄程度,以排除颈内动脉颅外段狭窄>50%的患者。所有入组患者均应用日本东芝公司Aquillion ONE 320排CT仪进行颈动脉CT血管造影检查,扫描范围为主动脉弓下缘2~3 cm至颅顶。扫描方式为单心跳前瞻性心电门控轴向扫描模式,管电压为80 kV,管电流为120 mA。采用双筒高压注射器以5.0 mL/s的流速在右侧肘关节处静脉注射非离子型碘造影剂碘普罗胺(碘质量浓度为370 mg/mL)60 mL,注射完毕后加注40 mL生理盐水。扫描准直器宽度为320×0.5 mm,旋转时间为0.35 s,层厚为0.5 mm,层间距为0.5 mm,扫描时间为4~5 s。依据北美症状性颈动脉内膜切除术试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET),采用颈内动脉膨大部以远正常血管管腔内径为基础内径(A),以颈内动脉颅外段最窄处管腔内径(B)为测量基准,计算颈内动脉颅外段狭窄程度:NASCET血管狭窄程度(%)=(1-B/A)×100%(如颈动脉分叉后全程狭窄,则取对侧颈内动脉内径为基础内径A)。根据NASCET血管狭窄程度将颈内动脉颅外段狭窄分为4级:轻度狭窄(<50%)、中度狭窄(50%~69%)、重度狭窄(70%~99%)和完全闭塞(100%)。
(2)采用HRMR颅内动脉管壁成像评估颅内动脉狭窄程度和斑块稳定性。所有入组患者均应用美国GE Healthcare公司HDX platform 3.0 T磁共振扫描平台成像系统,采用8通道标准线圈进行多序列MRI检查。HRMR扫描矩阵为320×256。首先采用“亮血技术”行三维时间飞跃法磁共振血管成像,进行血管重建后明确病变血管部位,然后采用“黑血技术”进行颅内病变血管多序列扫描。扫描参数如下:快速自旋回波T1加权成像、快速自旋回波T2加权增强成像、T1加权增强成像重复时间分别为567、2 883、567 ms,回波时间分别为15.8、49、15.8 ms,成像视野为100 mm×100 mm,层厚为2 mm ,间距为2.5 mm;T1加权可变翻转角三维快速自旋回波序列重复时间为900 ms,回波时间为5.6 ms,层厚为0.5 mm。增强检查采用钆喷酸葡胺作为造影剂,静脉注射造影剂5 min后进行扫描,扫描参数同T1加权可变翻转角三维快速自旋回波序列。以上序列扫描完成时间为30~40 min。
颅内责任血管的评估内容包括责任动脉狭窄程度及责任斑块特征。责任血管定义为供应责任病灶的血管。仅有一处病变的血管,该病变处的斑块为责任斑块;若有多处病变的血管,则血管狭窄最严重处的斑块为责任斑块。按照华法林-阿司匹林治疗症状性颅内动脉狭窄(Warfarin-Aspirin Symptomatic Intracranial Disease,WASID)计算方法,在磁共振血管成像最大强度投影图像上测量责任血管的狭窄程度。狭窄程度分为5个等级:未见明显狭窄(狭窄程度为0%)、轻度狭窄(1%~49%)、中度狭窄(50%~69%)、重度狭窄(70%~99%)和闭塞(100%)。
斑块特征的描述包括斑块分布位置、斑块形状、斑块强化程度、斑块负荷、血管重构方向。(1)斑块分布位置:评估基底动脉、大脑中动脉M1和M2段的斑块,根据斑块在血管横断面图像上的位置,将基底动脉划分为前壁、左侧壁、后壁、右侧壁,大脑中动脉划分为上壁、后壁、下壁、前壁。(2)斑块形状:若血管壁增厚的偏心指数≥0.5,斑块为弧形斑块,否则为环形斑块。偏心指数=(最大管壁厚度-最小管壁厚度)/最大管壁厚度。(3)斑块强化程度:注射造影剂后,T1加权成像显示斑块的信号增高,即为有强化。根据T1加权成像增强前后信号的变化,以增强后垂体漏斗的信号为参照,将斑块强化程度分为3级:0级为无强化,增强图像上斑块信号与无斑块颅内动脉壁信号相似或低于无斑块颅内动脉壁信号;1级为轻度强化,增强图像上斑块信号高于0级但低于垂体漏斗信号;2级为明显强化,增强图像上斑块信号与垂体漏斗信号相似或高于垂体漏斗信号。(4)斑块负荷:斑块负荷(%)=(1-管腔面积/外管壁面积)×100%。(5)血管重构方向:重构指数>1.05为正性重构,<0.95为负性重构,0.95~1.05为中性重构。重构指数=病变处血管的外管壁面积/邻近正常血管的外管壁面积。
所有入组患者的影像学评估由2名血管神经科的住院医师(均具备3~4年神经影像学阅片经验)根据Ryu等[11]研究标准完成。采用一致性检验分析2名医师的影像学诊断结果,求得Kappa值=0.912(P<0.05),提示2名医师的影像学诊断一致性很好。
1.3 前瞻性随访研究 将符合纳入和排除标准的急性脑梗死患者,在剔除责任血管无斑块患者后,根据MHR的最佳临界值分为低MHR组和高MHR组。分析两组患者的基线资料(包括年龄、性别、BMI、高血压病史、糖尿病史、吸烟史、脑卒中病史、冠心病史、NIHSS评分、尿酸、同型半胱氨酸、CRP、低密度脂蛋白等),以及责任血管狭窄程度、血管重构方向、斑块负荷等血管狭窄及斑块特征。以颅内责任血管斑块强化程度的下降作为终点结局,随访截至2021年7月,随访期间患者每3个月来院复查1次HRMR颅内动脉管壁成像。
1.4 统计学处理 应用SPSS 26.0软件完成统计学分析。呈正态分布的计量资料以x±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,多重比较采用最小显著性差异法。非正态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用Wilcoxon秩和检验,多组间比较采用Kruskal-WallisH检验,多重比较采用All pairwise法。计数资料以例数和百分数表示,组间比较采用χ2检验。采用Kappa一致性检验评价2名医师影像学判读结果的一致性。采用Spearman相关性分析探究MHR与斑块强化程度的相关性。以斑块的强化程度作为反映斑块稳定性的标准(0级强化为稳定斑块,赋值为0;1、2级强化为不稳定斑块,赋值为1),利用二分类logistic回归分析评估颅内动脉斑块稳定性的影响因素,进一步通过ROC曲线计算MHR的AUC值,根据约登指数计算最佳临界值和相应的灵敏度、特异度。利用Cox回归分析探究MHR对颅内动脉斑块稳定性的预测作用。检验水准(α)为0.05。
2 结 果
2.1 一般临床资料 排除358例非脑梗死患者(动脉瘤104例、多发颅内动脉狭窄147例、其他107例)和130例不符合纳入和排除标准的急性脑梗死患者(发病时间超过2周患者39例、影像学图像不清晰患者16例、颈内动脉颅外段狭窄>50%的患者23例、颅内外血管夹层患者14例、心源性栓塞患者7例、肺部感染患者7例、其他24例),最后147例急性脑梗死患者入组,其中无斑块组27例、单支血管病变组72例、多支血管病变组48例。3组患者在性别、BMI、吸烟史、高血压病史、糖尿病史、冠心病史、脑卒中病史、NIHSS评分、低密度脂蛋白、高密度脂蛋白、CRP、同型半胱氨酸、尿酸等方面差异均无统计学意义(P均>0.05)。单支血管病变组和多支血管病变组患者的发病年龄均高于无斑块组(P=0.019、0.020)。单支血管病变组和多支血管病变组的单核细胞计数均高于无斑块组(P<0.001、P=0.001),多支血管病变组的单核细胞计数高于单支血管病变组(P=0.023)。单支血管病变组及多支血管病变组的MHR均高于无斑块组(P=0.003、P<0.001),多支血管病变组的MHR高于单支血管病变组(P=0.003)。见表1。
2.2 责任血管狭窄程度和斑块特征 多支血管病变组的颅内动脉狭窄程度较单支血管病变组严重(P=0.013),斑块负荷高于单支血管病变组(P=0.001),负性重构患者比例高于单支血管病变组(P=0.025)。单支血管病变组和多支血管病变组患者的斑块分布位置、形状和强化程度差异均无统计学意义(P均>0.05)。见表2。
2.3 MHR与斑块强化程度的相关性 Spearman相关性分析显示,MHR与斑块强化程度呈正相关(r=0.469,P=0.001),也与责任血管狭窄程度、斑块负荷呈正相关(r=0.285、0.286,P=0.002、0.002)。MHR与斑块形状、血管重构方向无关(r=0.104、0.154,P=0.259、0.093)。
2.4 斑块稳定性影响因素的二分类logistic回归分析 纳入表1、表2中相关自变量(P<0.2)构建logistic回归方程,以斑块稳定性为因变量,排除混杂因素;为防止多重共线性,将单核细胞计数和MHR单独纳入模型进行分析。二分类logistic回归分析结果显示,在调整年龄、高血压病史、责任血管狭窄程度、血管重构方向、斑块负荷后,MHR和单核细胞计数均是急性脑梗死患者颅内动脉斑块不稳定的危险因素(OR=2.13,95%CI1.45~3.14,P<0.001;OR=1.57,95%CI1.17~2.09,P=0.002),同时责任血管狭窄程度也是斑块稳定性的影响因素(OR=2.14,95%CI1.23~3.71,P=0.007);年龄、高血压病史、血管重构方向、斑块负荷对斑块稳定性无影响(P均>0.05)。
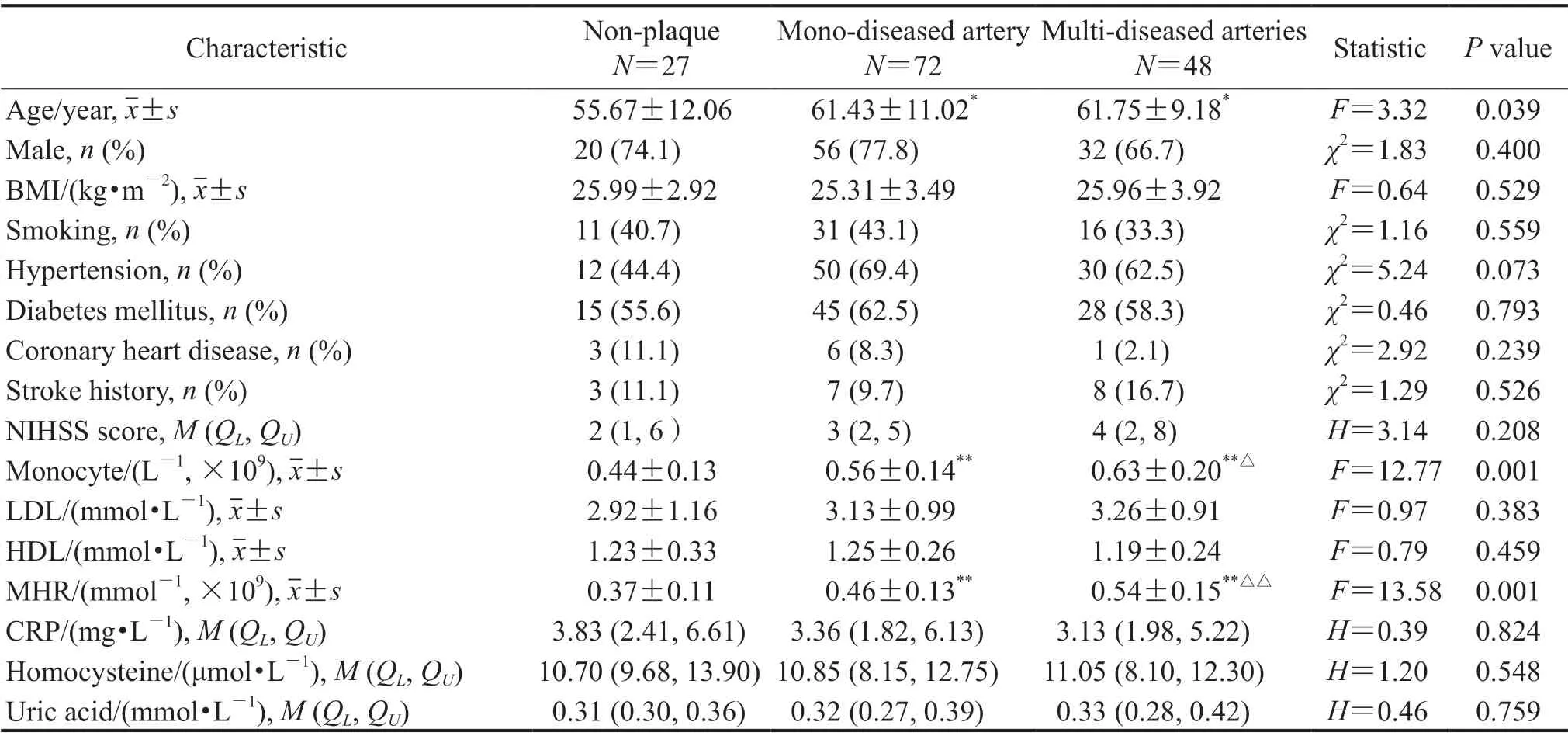
表1 各组急性脑梗死患者一般资料Tab 1 General characteristics of acute cerebral infarction patients in each group
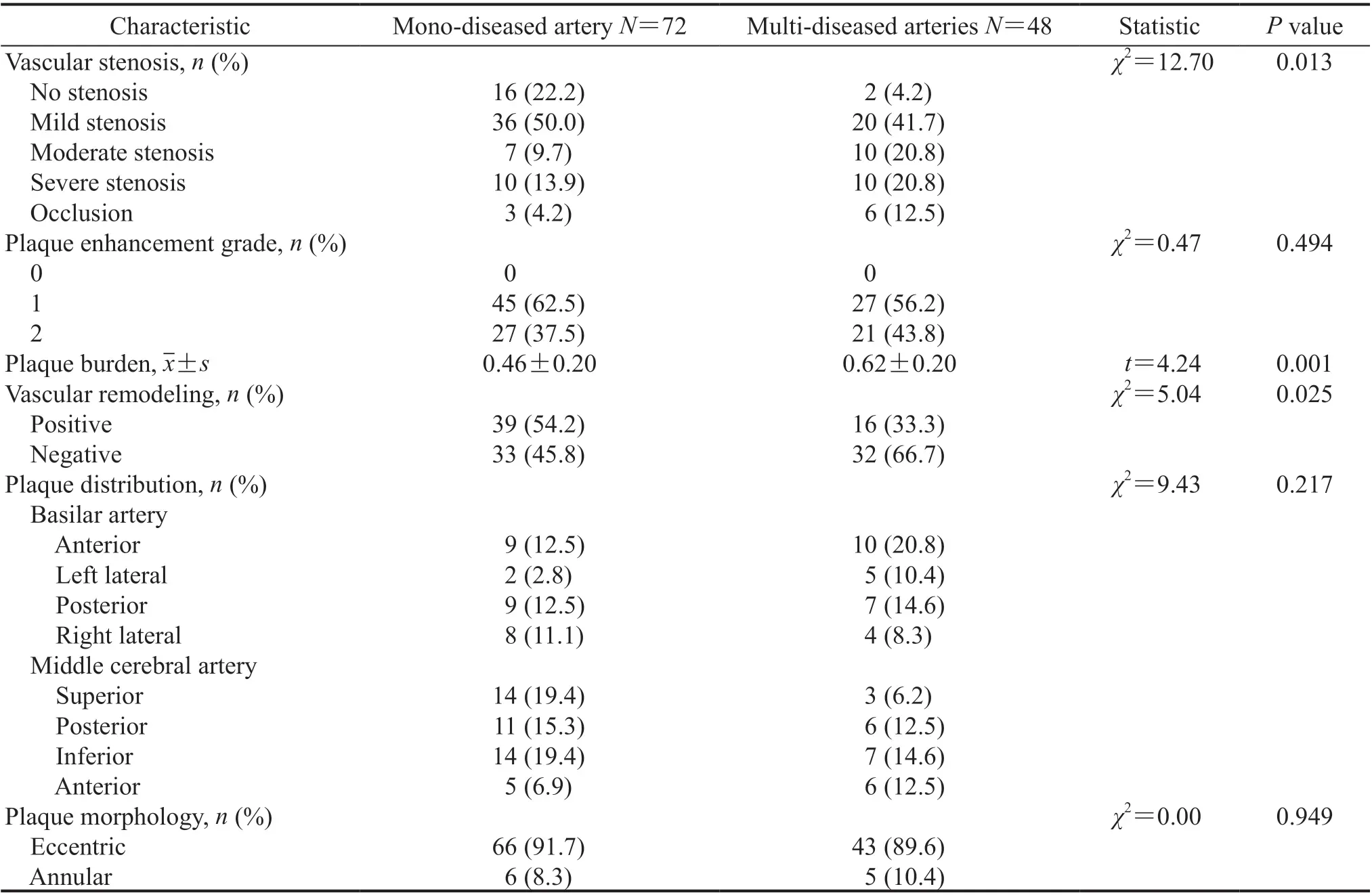
表2 单支与多支血管病变组急性脑梗死患者的责任血管狭窄程度和斑块特征Tab 2 Stenosis and plaque features of acute cerebral infarction patients in mono- and multi-diseased artery groups
2.5 MHR评估斑块稳定性的价值 ROC曲线分析显示,MHR对急性脑梗死患者颅内动脉斑块稳定性的评估价值相较于单核细胞计数、高密度脂蛋白、CRP、低密度脂蛋白和同型半胱氨酸更高,AUC值分别为0.821(95%CI0.726~0.915,P<0.001)、0.717(95%CI0.595~0.840,P=0.002)、0.612(95%CI0.521~0.702,P=0.019)、0.539(95%CI0.397~0.681,P=0.557)、0.533(95%CI0.438~0.627,P=0.493)和0.533(95%CI0.398~0.667,P=0.640)。通过计算约登指数获得MHR的最佳临界值为0.52×109/mmol,判断斑块稳定与否的灵敏度为0.75,特异度为0.80。
2.6 低、高MHR组患者临床资料及预后分析
2.6.1 一般临床资料 120例有斑块的急性脑梗死患者均参与随访,其中低MHR(MHR<0.52×109/mmol)组76例、高MHR(MHR≥0.52×109/mmol)组44例。两组患者在发病年龄、性别、BMI、吸烟史、高血压病史、糖尿病史、冠心病史、尿酸、CRP、同型半胱氨酸等方面差异均无统计学意义(P均>0.05)。低MHR组有脑卒中病史的患者比例和NIHSS评分均高于高MHR组(P均<0.05)。见表3。
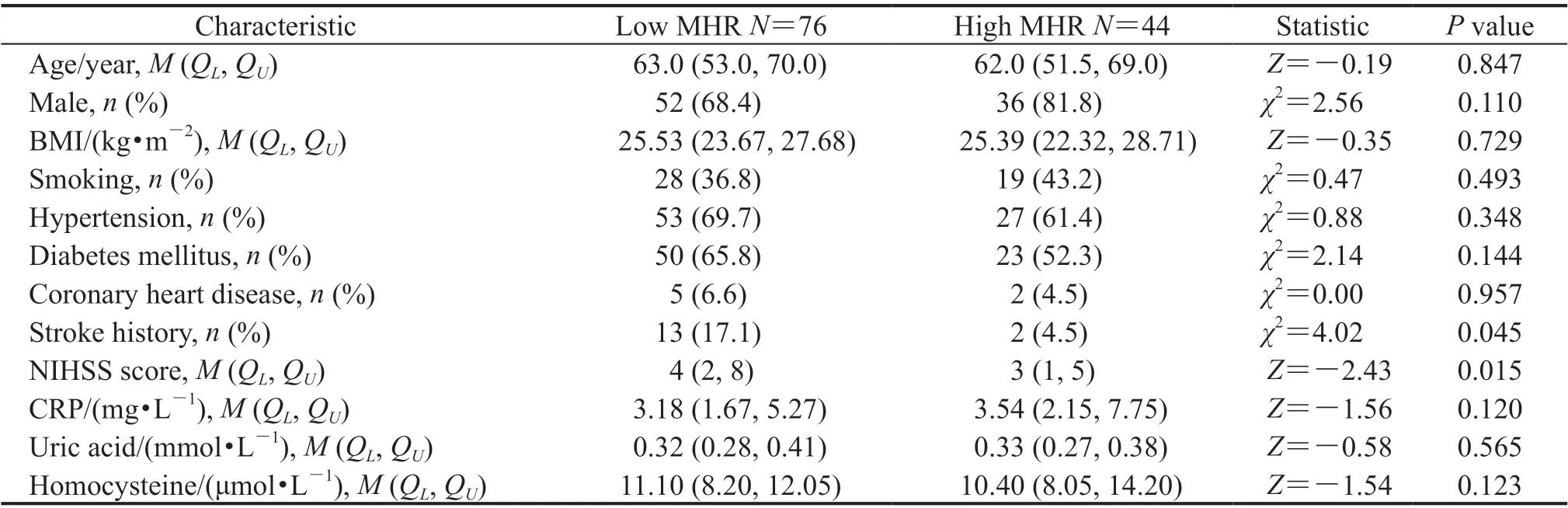
表3 低、高MHR组急性脑梗死患者的一般资料Tab 3 General characteristics of acute cerebral infarction patients in low and high MHR grou ps
2.6.2 责任血管狭窄程度和斑块特征 高MHR组患者的责任血管狭窄程度、斑块强化程度和血管负性重构比例均高于低MHR组(P均<0.01),斑块负荷低于低MHR组(P=0.001);两组斑块分布位置和斑块形状差异均无统计学意义(P均>0.05)。见表4。
2.6.3 患者随访情况及预后 120例患者随访12.00(10.49,13.51)个月,失访12例(10.0%),其中高MHR组失访7例,均为入院登记的联系方式失效;低MHR组5例,3例入院登记的联系方式失效,2例为外地患者复诊不便。随访期间,89例(74.2%)患者的责任血管斑块强化程度下降(下降≥1级),其中高MHR组33例(75.0%)、低MHR组56例(73.7%);脑卒中复发7例(5.8%),均为急性缺血性脑卒中,其中高MHR组2例(4.5%)、低MHR组5例(6.6%);94例(78.3%)患者预后良好(术后90 d mRS评分≤2分),其中 高MHR组31例(70.5%)、低MHR组63例(82.9%)。两组患者斑块强化程度下降率、脑卒中复发率、预后良好率差异均无统计学意义(P=0.109、0.492、0.111)。高MHR组患者的中位生存时间长于低MHR组[15.00(10.48,19.52)个月vs 9.00(7.22,10.78)个月,P<0.001]。
2.6.4 MHR预测颅内动脉斑块稳定性的Cox回归分析 以颅内责任血管斑块强化程度是否下降为因变量,纳入表3、表4中相关自变量(P<0.05)构建Cox回归方程,通过调整脑卒中病史、NIHSS评分、责任血管狭窄程度、血管重构方向、斑块负荷等变量后进行分析,结果显示急性脑梗死患者的责任血管狭窄程度、NIHSS评分越高,责任血管斑块强化程度下降的概率越低(HR=0.76,95%CI0.61~0.95,P=0.017;HR=0.89,95%CI0.82~0.97,P=0.005),低MHR组急性脑梗死患者责任血管斑块强化程度下降的概率是高MHR组患 者 的3.21倍(HR=3.21,95%CI1.92~5.36,P<0.001)。脑卒中病史、血管重构方向、斑块负荷与颅内动脉斑块稳定性无关(P均>0.05)。
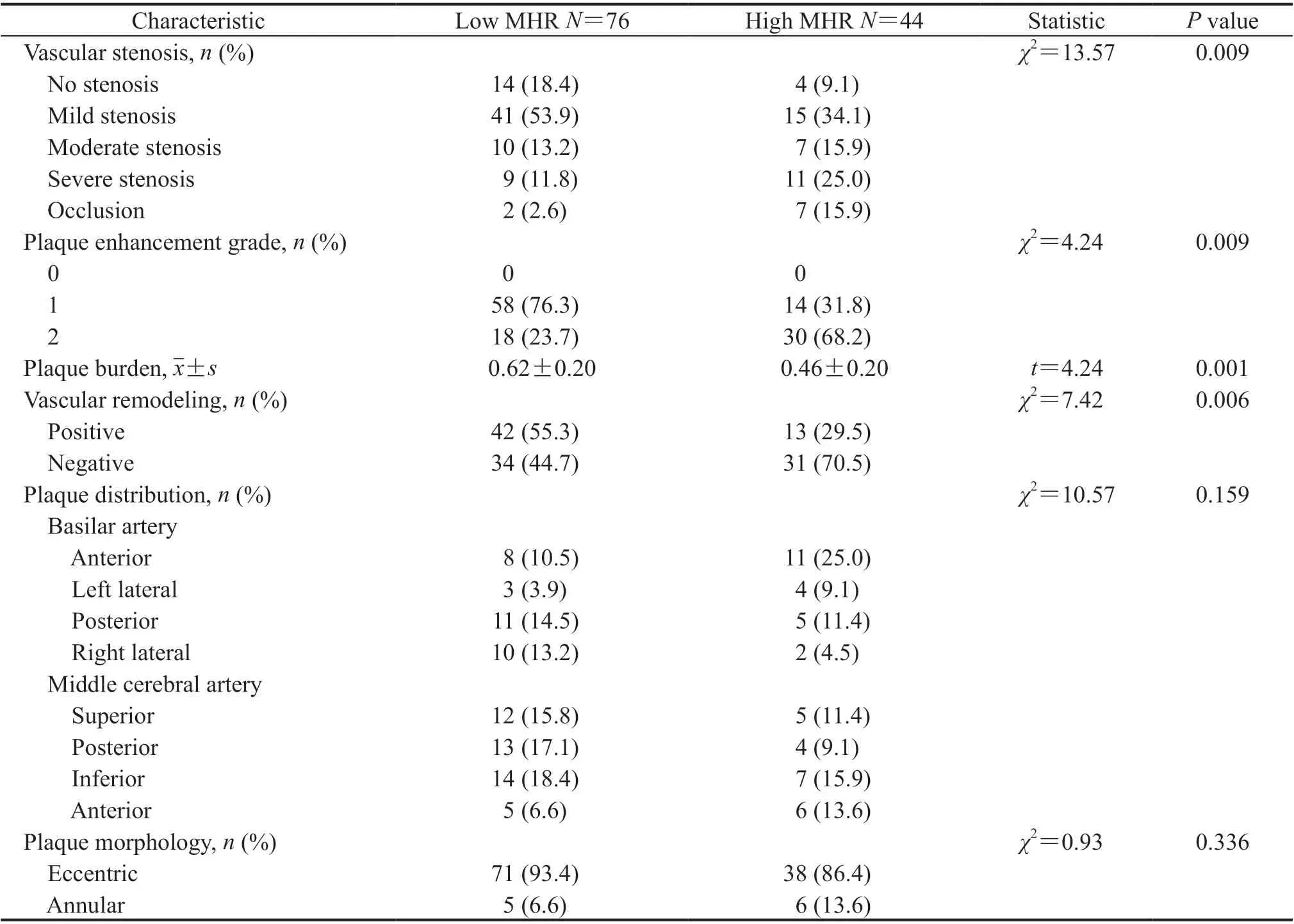
表4 低、高MHR组急性脑梗死患者的责任血管狭窄程度和斑块特征Tab 4 Stenosis and plaque features of acute cerebral infarction patients in low and high MHR groups
3 讨 论
既往多项研究探讨了MHR与脑梗死的相关性[12-14],一项回顾性分析253例脑梗死患者和211名健康对照MHR的研究结果显示,脑梗死患者的MHR高于健康对照,并且ROC曲线分析显示MHR提示脑梗死的临界值是0.28×109/mmol[15]。但MHR与脑梗死患者动脉粥样硬化斑块稳定性尚未见报道。
大动脉粥样硬化是脑梗死的主要原因之一,动脉粥样硬化不仅造成血管狭窄,管壁斑块的不稳定更是导致脑梗死反复发生的原因。动脉粥样硬化进程包括管壁内脂质沉积和斑块内新生血管形成。脂质的沉积加速了管壁斑块进展,从而导致斑块内缺氧,引起炎症细胞浸润和斑块内新生血管形成。研究发现,单核细胞在斑块内新生血管形成中发挥了重要作用,浸润的炎症细胞吞噬脂质后形成泡沫细胞,泡沫细胞可刺激平滑肌细胞迁移从而促进斑块内新生血管再生,而斑块内新生血管形成被认为可能是导致纤维斑块不稳定甚至破裂的关键因素[16]。不稳定斑块及破裂斑块内新生血管数量比稳定斑块多2~4倍[17]。斑块内炎症或新生血管形成的程度越高,斑块的强化程度越高,提示斑块的稳定性越差[5]。HRMR颅内动脉管壁成像显示斑块强化则反映了斑块内炎症或新生血管形成,提示斑块可能为不稳定斑块。
本研究通过对147例急性脑梗死患者的资料及HRMR颅内动脉管壁成像显示的斑块特征进行分组分析,结果显示MHR和单核细胞计数在无斑块组、单支血管病变组、多支血管病变组之间差异均有统计学意义,多支血管病变组的斑块负荷高于单支血管病变组,表明MHR与动脉粥样硬化的严重程度相关。斑块的强化程度反映了斑块的稳定性,本研究Spearman相关性分析显示MHR与斑块强化程度存在中等正相关性。进一步排除相关混杂因素的干扰后,二分类logistic回归分析结果表明MHR可以作为反映斑块不稳定的危险因素。此外,本研究结果还显示责任血管狭窄程度与斑块的强化程度密切相关,责任血管狭窄程度越高斑块的强化级别越高,提示伴有血管狭窄的斑块更加不稳定,增加了脑卒中的发生风险。
既往研究认为CRP、低密度脂蛋白和同型半胱氨酸与脑梗死相关,但与斑块稳定性的关系尚不明确。CRP是炎症早期较为灵敏、可靠的血清标志物[18],研究发现高水平的CRP与脑梗死发生及不良预后有关[19]。颅内动脉粥样硬化是脑梗死反复发作的高危因素,而低密度脂蛋白与颅内动脉粥样硬化狭窄密切相关,一项针对4 347名健康人为期4年的低密度脂蛋白随访研究发现,580例患者出现的无症状颅内动脉粥样硬化狭窄与低密度脂蛋白升高相关[20]。一项针对3 799例急性脑梗死患者为期48个月(中位时间)的随访研究发现,伴有高同型半胱氨酸的脑梗死患者,特别是大动脉粥样硬化性脑梗死患者,预后往往不良[21]。而本研究数据显示,CRP、低密度脂蛋白、同型半胱氨酸在无斑块组、单支血管病变组和多支血管病变组之间差异均无统计学意义。此外,本研究通过ROC曲线分析得出,相较于单核细胞计数、高密度脂蛋白、CRP、低密度脂蛋白和同型半胱氨酸,MHR对评价颅内动脉斑块稳定性更有价值。计算获得MHR的最佳临界值为0.52×109/mmol,即对于颅内动脉粥样硬化患者,若MHR>0.52×109/mmol,其颅内动脉斑块可能是不稳定的。通过对有斑块的120例患者进行12.00(10.49,13.51)个月的随访,随访数据提示低MHR对责任血管斑块强化程度的下降(斑块稳定)有预测作用,低MHR组患者责任血管斑块强化程度下降的概率是高MHR组患者的3.21倍。
本研究存在以下缺陷:(1)研究对象来源于单中心且样本量小,研究结果可能存在偏倚。(2)纳入的行HRMR颅内动脉管壁成像检查的患者大多数是临床上颅内血管轻、中度狭窄患者,重度狭窄和无明显狭窄患者相对较少,病例选择存在偏倚。(3)颅内动脉斑块稳定性是通过HRMR颅内动脉管壁成像间接反映的,缺少病理结果支持。因此,MHR能否作为反映急性脑梗死患者颅内动脉斑块稳定性的标志物,未来还需要进一步研究验证。
综上所述,本研究分析了急性脑梗死患者MHR与HRMR颅内动脉管壁成像斑块稳定性的相关性,结果提示MHR与斑块稳定性密切相关,对责任血管斑块稳定性可能有预测作用,或许能成为急性脑梗死患者颅内动脉斑块稳定性的标志物。

