颅内动脉粥样硬化性狭窄型急性大血管闭塞血管再通技术分析
陈荣华,曹 洁,朱旭成,邵华明,蒋天伟,宣井岗,彭 亚
常州市第一人民医院(苏州大学附属第三医院)神经外科,常州 213003
近年来急性缺血性卒中(acute ischemic stroke,AIS)发病率逐渐上升,已经成为我国居民的首位致死、致残性疾病,且年轻化趋势明显,严重危害我国人民的生命健康[1]。颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是脑卒中的重要病因之一,其在不同种族、地区具有差异性,亚洲居民ICAS的发生率明显高于其他人群,我国AIS患者中ICAS患者的占比高达45.3%~51.3%[2],应关注ICAS所致大血管闭塞急性缺血性脑卒中(acute ischemic stroke with large vessel occlusion,AIS-LVO)的治疗。
急性颅内大血管闭塞是导致中重度缺血性脑卒中最为常见的原因,尽快再通血管、恢复再灌注是目前共识和指南推荐的标准治疗方法[3-4]。临床常用的血管再通方式包括机械取栓、直接抽吸技术、血管成形术(球囊扩张和/或支架植入),然而对于ICAS导致的AIS-LVO首选何种血管再通方式目前仍无定论[5-6]。本研究回顾性分析264例接受血管内治疗的ICAS所致AIS-LVO患者的临床资料,评价真实世界中血管内治疗ICAS所致AISLVO的血管再通技术和临床疗效。
1 资料和方法
1.1 研究对象回顾性选择2019年1月至2021年3月于常州市第一人民医院(苏州大学附属第三医院)神经外科脑血管病中心连续收治的AIS患者495例。纳入标准:(1)年龄为18~85岁;(2)术前计算机断层扫描血管成像(computed tomography angiography,CTA)、磁共振血管成像(magnetic resonance angiography,MRA)或数字减影血管造影(digital subtraction angiography,DSA)检查提示颅内前循环或后循环大血管闭塞,且在血管再通后发现血管闭塞部位存在狭窄;(3)前循环AIS-LVO患者发病至股动脉穿刺时间≤6 h或后循环AIS-LVO患者发病至股动脉穿刺时间≤8 h,且术前美国国立卫生研究院卒中量 表(National Institutes of Health stroke scale,NIHSS)评分≥8分;(4)头颅CT平扫检查排除脑出血、脑肿瘤或其他明显的颅内疾病;(5)前循环血管闭塞部位为颈内动脉、大脑前动脉和/或大脑中动脉近端,后循环血管闭塞部位为椎动脉和/或基底动脉;(6)患者或其法定代理人签署手术知情同意书。排除标准:(1)明确心源性栓塞、其他原因、不明原因的AIS患者;(2)头颅CT平扫检查示大面积脑梗死(超过大脑半球1/3);(3)预计生存期短于90 d或妊娠期女性、造影剂过敏、有其他脏器严重病变等不适合行血管内治疗的患者。本研究通过常州市第一人民医院(苏州大学附属第三医院)医学伦理委员会审批[(2021)科第134号]。
1.2 研究方法
1.2.1 手术方法患者优先采用神经镇静麻醉,如有昏迷、烦躁、呕吐物误吸等则直接采用气管插管全身麻醉[7],需行球囊扩张和/或支架植入的患者改行全身麻醉[8]。所有患者均经术前影像学评估和术中脑血管造影检查,且采用了至少1种血管内治疗方式(机械取栓、直接抽吸、球囊扩张和/或支架植入)进行血管再通。机械取栓支架采用Solitaire支架(美国Medtronic公司)、Reco支架(中国尼科公司)或Revive SE支架(美国Codman公司)。若术前评估和术中造影考虑病因为ICAS时,通常首选机械取栓,支架的选择由手术者根据手术路径、血管闭塞部位形态及长度决定[9]。血管开通后见原血管闭塞部位存在狭窄且确认病因为动脉硬化性狭窄后,对于术中再闭塞和血管狭窄≥70%且前向血流缓慢的患者行血管成形术(球囊扩张和/或支架植入)。对于颈内动脉主干或基底动脉主干闭塞且术前评估和术中造影判断病因为ICAS的患者,直接采用球囊扩张+支架植入行血管成形术。对于颈内动脉颅内段或椎基底动脉主干闭塞而术前没有确诊ICAS的患者,采用直接抽吸技术进行血管内治疗,采用的抽吸导管有ACE抽吸导管(美国Penumbra公司)、Catlyst中间导管(美国Stryker公司)、REACT导管(美国Medtronic公司)和银蛇导管(珠海通桥医疗科技有限公司)。所有患者术前或术中予替罗非班[商品名为欣维宁,规格5 mg/100 mL,远大医药(中国)有限公司]抗血小板聚集治疗,起始剂量为6~8 μg/kg静脉推注,然后以0.15 μg/(kg·min)静脉滴注维持24 h。
1.2.2 术后处理所有患者术后即刻完善头颅CT检查以排除脑出血,术后24 h复查头颅CT明确有无出血转化,术后72 h内行头颅MRI平扫、MRA和 弥 散 加 权 成 像(diffusion weighted imaging,DWI)评估脑梗死及血管再通情况。如果术后没有出血转化,每天给予双联抗血小板聚集和强化他汀类药物治疗。
1.2.3 观察指标住院期间由手术医师评估,出院后由神经专科医师通过门诊、电话或住院复查对患者进行随访评估。(1)脑卒中高危因素,包括患者年龄、性别、高血压史、高脂血症史、糖尿病史、冠心病史、吸烟史、饮酒史、血管闭塞部位、入院时NIHSS评分等。(2)血管内治疗相关指标,包括麻醉方式、侧支循环情况、血管内治疗方式等。根据术中DSA检查结果,采用美国介入和治疗神经放射学学会/介入放射学学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)侧支循环评分系统评估侧支循环情况,其中ASITN/SIR评分≥3分为侧支循环良好。(3)临床疗效,评价指标包括术后即刻血管再通情况、出院时NIHSS评分和术后90 d预后情况。采用改良脑梗死溶栓(modified thrombolysis in cerebral infarction,mTICI)分级评价术后即刻血管再通情况[10]:mTICI分级0级表示无灌注,1级为仅有微量血流通过闭塞段血管,2a级为远端缺血区域有部分血流灌注(<50%),2b级为远端缺血区有血流灌注(>50%),3级为远端缺血区血流完全恢复灌注,其中mTICI分级≥2b级为血管成功再通。采用改良Rankin量表(modified Rankin scale,mRS)评分评价预后:0分表示完全无症状,1分表示有轻微症状,2分表示有轻度残障,3分表示有中度残障,4分表示有重度残障,5分表示有严重残障,6分表示死亡,其中mRS评分≤2分为预后良好。(4)安全性评价指标,根据术后即刻、术后24 h头颅CT检查结果,采用AIS血管再通治疗后脑出血Heidelberg分类标准评价是否发生症状性颅内出血[11]。
1.3 统计学处理应用SPSS 23.0软件进行数据分析。呈偏态分布的计量资料以中位数(下四分位数,上四分位数)表示,两组间比较采用秩和检验;计数资料以例数和百分数表示,两组间比较采用χ2检验。检验水准(α)为0.05。
2 结 果
2.1 一般资料共264例接受血管内治疗的前循环或后循环ICAS所致AIS-LVO患者入组,其中男181例(68.6%)、女83例(31.4%),年龄为61(54,69)岁。229例(86.7%)为前循环血管闭塞,其中颈内动脉C5、C6段闭塞25例(9.5%)、大脑前动脉闭塞24例(9.1%)、大脑中动脉M1段闭塞180例(68.2%);35例(13.3%)为后循环血管闭塞,其中椎动脉闭塞15例(5.7%)、基底动脉闭塞20例(7.6%)。合并高血压211例(79.9%),合并糖尿病71例(26.9%),合并高脂血症78例(29.5%),合并冠心病41例(15.5%),有吸烟史122例(46.2%)。56例(21.2%)患者行静脉溶栓治疗。123例(46.6%)患者的ASITN/SIR评分≥3分。264例患者入院时Alberta脑卒中计划早期计算机断层扫描评分(Alberta Stroke Program early computed tomography score,ASPECTS)为8(8,10)分。前循环AIS-LVO患者入院时NIHSS评分为16(12,19)分,出院时为8(6,11)分。后循环AIS-LVO患者入院时NIHSS评分为25(22,32)分,出院时为10(8,12)分。
2.2 治疗情况9例颈内动脉主干或基底动脉主干闭塞患者术前评估和术中造影即判断为ICAS,直接采用球囊扩张+支架植入行血管成形术。15例颈内动脉颅内段或椎基底动脉主干闭塞患者术前未确诊ICAS,行直接抽吸治疗再通血管后才确认ICAS,其中4例因血管狭窄≥70%且前向血流缓慢不能维持脑组织血液灌注而进行了支架补救。术后即刻mTICI分级3级173例(65.5%)、2b级68例(25.8%)、2a级13例(4.9%)、0~1级10例(3.8%),术后即刻血管成功再通率为91.3%(241/264)。术后24 h症状性颅内出血发生率为9.1%(24/264)。术后90 d预后良好率为55.7%(147/264);28例(10.6%)患者死亡,其中16例为大脑半球大面积梗死或脑干、小脑梗死,4例为脑出血,4例为急性心肌梗死,4例为多器官功能衰竭。采用不同血管内治疗方式的患者的临床结局见表1。

表1 采用不同血管内治疗方式的ICAS所致AIS-LVO患者的临床结局Tab 1 Clinical outcomes of patients with AIS-LVO caused by ICAS after different intravascular treatments n (%)
2.3 单纯机械取栓与机械取栓+支架补救治疗的患者临床疗效对比分析132例患者接受单纯机械取栓治疗,108例接受机械取栓+支架补救治疗,其中机械取栓+球囊扩张术42例、机械取栓+支架植入术32例、机械取栓+球囊扩张+支架植入术34例。单纯机械取栓组与机械取栓+支架补救治疗组患者的年龄、性别等基线资料及术后即刻血管成功再通率、术后90 d预后良好率差异均无统计学意义(P均>0.05)。见表2。
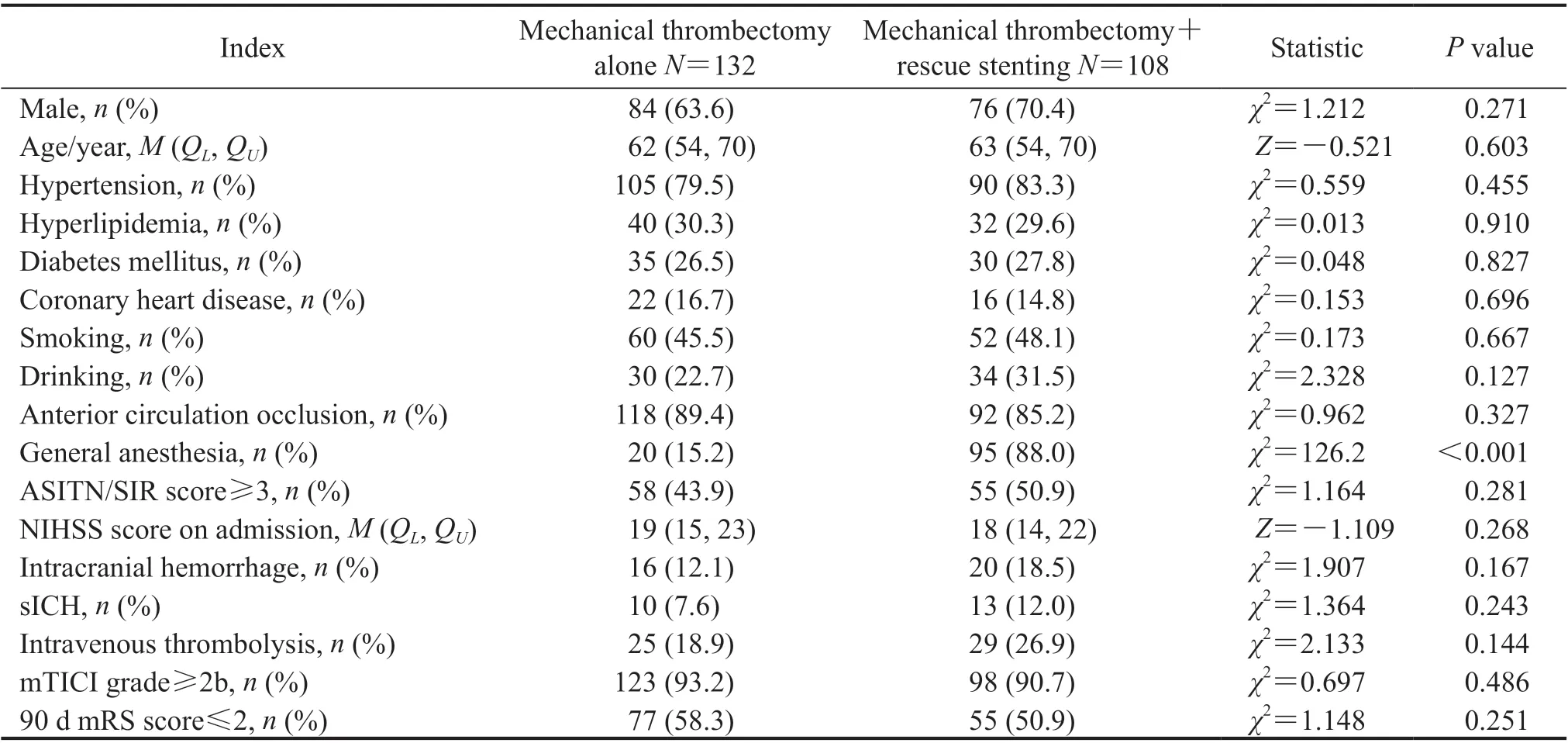
表2 单纯机械取栓组与机械取栓+支架补救治疗组ICAS所致AIS-LVO患者的临床资料比较Tab 2 Comparison of clinical data of ICAS-caused AIS-LVO patients between mechanical thrombectomy alone group and mechanical thrombectomy+rescue stenting group
3 讨 论
文献报道我国ICAS引起的AIS所占比例远远高于欧美国家[12],27%~47%前循环AIS-LVO的病因为ICAS[13-15],而后循环有50%左右由ICAS引起[15]。对于ICAS导致的ASI-LVO,目前临床常用的血管内治疗方式包括机械取栓、直接抽吸技术、机械取栓基础上的血管成形及直接血管成形术(球囊扩张和/或支架植入)等。应用支架类机械取栓装置在AIS的血管内治疗中已经取得满意效果,美国心脏协会/美国卒中协会(American Heart Association/American Stroke Association,AHA/ASA)指南建议将机械取栓作为大血管闭塞取栓治疗的首选技术[16]。本研究264例ICAS导致的AIS-LVO患者中,15例使用了直接抽吸技术,9例直接采用球囊扩张后支架植入术,其余240例进行了机械取栓,说明绝大多数ICAS导致的AIS-LVO会首选机械取栓进行血管再通治疗,即使术前影像学评估预判病因为ICAS,基于以下原因血管内治疗方式也可能首选机械取栓:(1)支架取栓装置释放到位可以迅速恢复血流;(2)相比抽吸导管,支架取栓装置对动脉斑块的损伤相对较小,血管开通率更高[17];(3)部分支架取栓装置可以解脱而直接进行血管成形术,降低医疗成本;(4)术中微导管、微导丝穿越血管闭塞部位后,可利用首过效应[18]判断病变性质。
本研究所有240例首选机械取栓治疗的患者中,132例行单纯机械取栓的患者术后即使存在不同程度的动脉狭窄,但在使用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂替罗非班并观察30 min发现前向血流良好后没有采取进一步处理;108例患者在机械取栓后因为中重度动脉狭窄所致前向血流缓慢或再次闭塞而采取了补救措施,其中32例采取单纯支架植入血管成形术,42例进行了单纯球囊扩张术,34例进行了球囊扩张+支架植入血管成形术。对于血管内治疗后残余中重度狭窄的患者进行药物治疗(双联抗血小板聚集联合降脂稳定斑块)并长期随访观察,必要时行二期支架植入血管成形术。笔者认为对于ICAS导致的AIS-LVO,一旦发生再次闭塞,重复机械取栓是无效的,其可能导致斑块破损诱发新鲜血栓,甚至发生手术并发症如血管损伤、痉挛和夹层,因此及时补救治疗尤为重要。本研究通过对接受单纯机械取栓和机械取栓+支架补救治疗患者的资料进行对比分析,结果显示两组患者术后即刻血管成功再通率及90 d预后良好率差异均无统计学意义,说明对于再次闭塞采用补救措施一样可以获得良好的临床结局。中国AIS血管内治疗多中心登记研究结果同样提示,对于ICAS所致AIS-LVO在进行机械取栓联合球囊扩张、支架植入术后依然有良好的临床结果,并不影响血管内治疗的效果[15]。因此,ICAS所致AISLVO患者术中发生再次闭塞时切忌反复行机械取栓以避免损伤斑块和血管内膜[19],应根据病变部位、狭窄程度等及时选择合适的补救措施(如球囊扩张、支架植入等)达到有效再灌注。
由于ICAS的特殊病理机制,有学者认为在ICAS所致AIS-LVO中,机械取栓开通血管后术中责任血管再闭塞率较高,常需采用球囊扩张等补救措施,如果术前能准确判断ICAS则可直接采用球囊扩张和/或支架植入行血管成形术,治疗效果优于单纯机械取栓[20]。本组病例中仅9例(3.4%)患者经术前影像学评估和术中造影预判[21-22]为ICAS所致AIS-LVO,采用直接血管成形术(球囊扩张+支架植入)进行血管再通治疗,该9例患者均为颈内动脉主干或基底动脉主干病变,其中6例患者获得了术后90 d良好预后。进行直接血管成形术应考虑以下难点:(1)术前很难明确病因为ICAS;(2)动脉狭窄闭塞远端或近端如有血栓,直接球囊扩张后可能存在血栓逃逸风险。
2020年Yoo等[17]对分别将机械取栓和直接抽吸作为一线治疗方式的ICAS所致AIS-LVO进行比较研究,结果显示机械取栓组较直接抽吸组有更高的血管成功再通率(77.6% vs 43.5%,P=0.001)、更低的补救率(12.2% vs 59.7%,P<0.001)和较低的医源性夹层发生率(8.2% vs 29.0%,P=0.012),且经过补救后两组最终的血管成功再通率差异无统计学意义(87.8% vs 77.4%,P=0.247),由此可见ICAS所致AIS-LVO采用直接抽吸技术治疗时补救率和并发症发生率均较高。本组15例(5.7%)患者的首选血管内治疗方式为直接抽吸技术,其中4例进行了支架补救,8例术前并未考虑为ICAS病变。
尽早、足量、全程使用抗血小板药物,尤其是血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂替罗非班,是ICAS所致AIS-LVO另一个疗效不亚于机械取栓的重要治疗手段。如果术前预判为ICAS所致AISLVO,笔者团队的经验是进入导管室即静脉推注负荷剂量+静脉泵入替罗非班,而不再作为机械取栓后再次闭塞时补救措施;如果术中判断为ICAS所致AIS-LVO,应尽快静脉推注负荷剂量+静脉泵入替罗非班。即使重组组织型纤溶酶原激活物静脉溶栓桥接血管内治疗的患者使用替罗非班治疗也是合理的[23-24]。术后维持24~36 h后序贯阿司匹林和氯吡格雷双联抗血小板治疗,5~7 d后根据血栓弹力图调整双联抗血小板药物的使用剂量。如患者有出血转化,应根据病情改为单用一种抗血小板药物或暂停使用。
综上所述,对于ICAS所致AIS-LVO行血管内治疗时机械取栓可作为首选技术,在此基础上根据患者情况选择球囊扩张、支架植入等合理的补救措施是有效、安全的。本研究有一定局限性:(1)本研究是单中心回顾性研究,样本量小,代表性不足,也未设对照组,结果可能存在偏倚;(2)术后随访时间短,仅为90 d。因此该研究结论仍需多中心随机对照试验来提供高质量的临床证据。

