基于转录组探究Enterococcus faecium 15A降解二乙基亚硝胺的作用机制
钟雨婷,张倩,姚姝婷,罗娅,明悦,李晓玲,刘璇,岳鑫,魏香奕,刘刚,李学理,3*
(1.成都医学院检验医学院,四川 成都 610500;2.四川师范大学生命科学学院,四川 成都 610000;3.成都医学院四川省动物源性食品兽药残留防控技术工程实验室,四川 成都 610500)
二乙基亚硝胺(N-nitrosodiethylamine,NDEA)早在1987年就被世界卫生组织(World Health Organization,WHO)国际癌症研究署(International Agency for Research on Cancer,IARC)列为 2A 致癌物[1],一次大剂量摄入或长期少量积累均可能引发癌症[2]。研究证实,NDEA广泛分布于水、环境、发酵食品及人体消化道,主要诱发肝脏组织病变和肿瘤[2-3]。因此,开展安全、高效降解NDEA相关研究迫在眉睫。
微生物降解法因具有高效、安全、经济等优势而成为目前降解NDEA的研究热点,其中备受关注的是乳酸菌。因为乳酸菌是食品中常用的发酵剂,同时也具有改善肠道蠕动、缓解便秘、治疗腹泻、抑制肠道致病菌等益生功能,可降解NDEA的乳酸菌不仅能丰富发酵食品风味、延长货架期、促进营养吸收、维持肠道微生态平衡,还能减除NDEA、降低患癌风险[4-5]。
目前,微生物降解NDEA研究偏重从发酵食品、人体肠道中分离和筛选乳酸菌,评价其降解能力。如Nowak等[6]发现3株来源于人体肠道的乳酸菌能有效降解NDEA。项目组前期获得1株来源于健康人肠道的粪肠球菌(Enterococcus faecium,E.faecium)15A,能有效降解NDEA[7]。E.faecium是哺乳动物肠道中重要的原籍乳酸菌[8],应用于肉制品发酵和益生菌剂的制备,具有改善肉品感官品质、调节肠道菌群结构、提高机体免疫力等功能[9]。
然而,乳酸菌降解NDEA的机理研究较少,降解作用的关键基因、调控蛋白、代谢通路等分子机制更未阐明。这势必限制乳酸菌作为发酵剂、益生菌在食品产业中的开发与应用。因此,本研究首先系统考察了不同环境中E.faecium 15A对NDEA的作用特性,基于作用特性结果,采用转录组学分析了菌株降解的差异表达基因、代谢途径,利用实时反转录聚合酶链式反应(real time-quantitative polymerase chain reaction,RT-qPCR)技术验证关键的差异表达基因,从分子层面探究E.faecium 15A降解NDEA的机制,为利用E.faecium 15A有效清除NDEA提供支持。将E.faecium 15A制成菌剂和发酵剂,形成更安全的发酵乳、发酵肉、益生菌等产品,为减轻NDEA致癌性开辟新的膳食方案。研究结果可拓展乳酸菌的益生功能,开发具有更高保健价值的乳酸菌。
1 材料与方法
1.1 试验菌种及试剂
二乙基亚硝胺(色谱纯):阿拉丁试剂(上海)有限公司;酵母粉:赛默飞世尔科技(中国)有限公司;牛肉膏:北京路桥技术有限公司;葡萄糖、柠檬酸三铵、乙酸钠、磷酸氢二钾、硫酸镁、硫酸锰、吐温80(均为分析纯):成都市科隆化学品有限公司;甲醇(色谱纯):上海易恩化学技术有限公司。试验菌株由四川师范大学生命科学学院微生物实验室提供的健康人体肠道乳酸菌中分离纯化和筛选所得,经测序鉴定,最终确定为E.faecium 15A。
1.2 仪器与设备
高速冷冻离心机(Centrifuge 5804R):德国艾本德公司;全自动高压灭菌锅(GI-54DWS):上海巴玖实业有限公司;数显式台式酸度计(雷磁PHSJ-4F):上海仪电科学仪器股份有限公司;高效液相色谱仪(Agilent1200):美国安捷伦科技公司;紫外分光光度计(UV1102):上海天美科学仪器有限公司;电热恒温培养箱(HPX-9272MBE):上海博迅实业有限公司;恒温振荡器(THZ-312):上海精宏实验设备有限公司;超纯水机(Ⅱ-5/10T):四川优普超纯科技有限公司。
1.3 液体培养基的配制
液体培养基:4.0 g酵母粉、5.0 g牛肉粉、20.0 g葡萄糖、2.0 g柠檬酸三铵、5.0 g乙酸钠、2.0 g磷酸氢二钾、0.2 g硫酸镁、0.05 g硫酸锰、1.0 mL吐温80,用蒸馏水定容至1 L,pH值为6.0、121℃灭菌15 min~20 min。
1.4 NDEA的检测
参考姜慧萍[10]检测NDEA方法,并做一定修改。采用高效液相色谱法进行试验,色谱柱Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm)、检测器为二极管阵列检测器、检测器波长230 nm、流动相为甲醇∶水(体积比)=35∶65、流速0.8 mL/min,取1 mL待测样品用0.22 μm微孔滤膜过滤得滤液待检。
1.5 环境因素对降解作用的影响
E.faecium 15A培养12h,离心后用无菌生理盐水制得菌悬液(107cfu/mL)。将菌悬液接种于含4.75 μg/mL NDEA的液体培养基中,对照组用等体积无菌生理盐水代替菌悬液。37 ℃分别培养 3、6、9 、12、24、48 h,取样,考察培养时间的影响;分别于 4、20、37、42 ℃的恒温培养箱中培养24 h,考察温度的影响;分别于培养基 pH 值为 2、3、4、5、6、7、8 的 37 ℃环境中培养24 h,考察pH值的影响;分别于37℃的恒温培养箱及恒温厌氧培养箱中培养24 h。检测样品中NDEA降解率 [NDEA降解率/%=(对照组NDEA含量-处理组NDEA含量)/对照组NDEA含量×100],以及微生物的生长量(OD600)。
1.6 转录组分析
将制备好的E.faecium 15A菌悬液分别加入含4.75 μg/mL NDEA(处理组)和空白(对照组)的培养基中,在pH6、37℃、有氧条件下培养12 h,每组3个生物学重复。进行RNA的提取及质量检测、文库构建、通过Illumina HiSeq测序平台对文库进行测序的转录组分析。
1.6.1 差异基因分析及功能注释
基于负二项分布,对样品进行差异表达基因(differentially expressed genes,DEGs)的筛选[11],阈值为 p<0.05和|log2(fold change)|>1。|log2(fold change)|值越大,表示差异倍数越大,若基因的log2(fold change)>0,则认为该DEGs上调,若log2(fold change)<0,则认为该DEGs下调[12]。
1.6.2 DEGs的富集分析
采用 GOseq[13]软件和 KOBAS(2.0)软件[14]分别基于基因分类数据库(gene ontology,GO)、京都基因和基因组数据库(kyoto encyclopedia of genes and genomes,KEGG)对DEGs进行功能注释和生物通路分类,确定显著差异基因或蛋白行使的主要生化代谢途径和信号转导途径。
1.7 RT-qPCR验证
根据转录组测序分析结果,选择5个基因进行RT-qPCR验证,引物序列见表1。

表1 引物序列Table 1 Primer sequences
将E.faecium 15A菌悬液分别加入含4.75 μg/mL NDEA和空白的培养基中,在pH6和pH8、37℃、有氧条件下培养12h,进行荧光定量检测。PCR反应体系(20μL):SYBR荧光定量PCRMix 5 μL,正反向引物各0.5 μL,cDNA 模板 1 μL,ddH2O 3 μL。PCR 反应程序:95 ℃3 min、95 ℃ 10 s、58 ℃ 30 s、95 ℃ 10 s、40 循环;熔解曲线:以1℃/循环的速度升温,60℃~95℃保持4 s。利用2-ΔΔCt方法计算基因的相对表达量。
1.8 数据处理与统计分析
结果均为3次或多次试验的平均值,采用Origin-Pro 9.1进行数据分析和制图,所列结果用平均值±标准差表示。转录组分析时使用的是Bowtie2、HTSeq、DEGSeq、DESeq、GOSeq、hmmscan、KOBAS 软件,Adobe Illustrator进行图片编辑处理。
2 结果与分析
2.1 E.faecium 15A降解NDEA的作用特性
为明确E.faecium 15A降解NDEA的特性,首先考察了培养温度、培养时间、pH值等环境因素对菌株生长情况及降解NDEA作用的影响,结果如图1所示。
从图1可知,菌株降解NDEA的能力与其生长情况变化趋势一致:图1A展示了E.faecium 15A降解NDEA作用和菌株生长量随培养时间的变化情况。可以看出,菌株在前12 h生长迅速,培养12 h~48 h生长量基本稳定;菌株的生长情况呈现出生长曲线的常规变化趋势,即随培养时间的延长,菌量先增加后趋于平稳。同样,受试菌株对NDEA的降解量表现出先增加后趋于稳定的变化规律,此结果与受试菌株的生长趋势一致。当E.faecium 15A培养12 h时,对NDEA的降解率为30.03%,随后,该菌株的降解率变化不明显。
由图1B可知,E.faecium 15A降解作用和菌株生长情况随温度变化也呈现一致的规律:在4℃到37℃范围内,菌株的生长量和对NDEA的降解率随温度升高而逐渐升高,37℃时降解率达到最大值;在42℃的生长量比37℃略有减少,对NDEA的降解作用也略有减弱。同样,菌株在有氧条件下的生长情况优于厌氧培养,其对NDEA的降解作用比有氧环境中的作用更强(图1C)。
环境的pH值对细菌的生长繁殖极为重要[15]。由图1D可知,pH值的改变对受试菌株的生长繁殖影响较大。E.faecium 15A在pH2~pH7范围内表现出降解NDEA作用,并且,降解作用和菌株生长情况变化一致,在pH6环境中,菌株生长量和降解能力最强。而在pH8环境中E.faecium 15A表现为促进NDEA形成,说明pH值因素能改变E.faecium 15A对NDEA的作用特性。
结果表明,E.faecium 15A降解NDEA的能力和其生长情况变化趋势一致,推测菌株降解作用与其生长代谢密切相关;培养温度、培养时间、需/厌氧培养条件的改变,会影响菌株的降解能力,不会转变菌株对NDEA的作用特性。而E.faecium 15A在pH2~pH7的环境中表现出降解NDEA的能力,在pH8的条件下转变为促进NDEA的产生,可能是菌株在pH8和其它pH值条件下产生了差异蛋白,两者转录途径不同。基于此,采用转录组技术研究降解能力最强的条件下(pH6、37 ℃、有氧、12 h、4.75 μg/mL NDEA)和对照组(0 μg/mL NDEA)E.faecium 15A的差异表达基因及转录途径,探究降解作用的关键基因和代谢通路。
2.2 转录组学分析
2.2.1 转录组测序数据质量评估
用Illumina HiSeq平台对试验样品进行转录组学测序。对原始测序数据进行碱基测序错误率、碱基含量分布的检查,具体结果见表2。
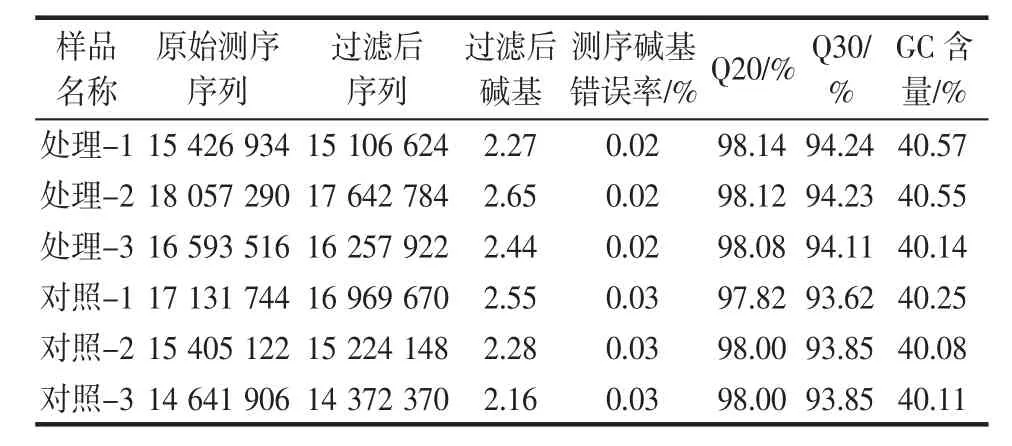
表2 E.faecium 15A的转录组测序数据质量统计Table 2 Quality statistics of transcriptome sequencing data of E.faecium 15A
Q20和Q30分别指质量值大于20、30的碱基占总体碱基的百分比,若Q20大于等于90%,Q30大于等于80%,则认为测序数据质量可信。本次测序的碱基错误率小于0.1%,Q20和Q30值均大于90%,处理组和对照组的平均GC含量分别为40.42%和40.15%,各项参数都达到测序质量的要求。表明转录组测序数据数量和质量可信度较高,可进行后续的数据分析。
2.2.2 DEGs分析
比较降解能力最强的条件下(pH6、37℃、有氧、12 h、4.75 μg/mL NDEA)E.faecium 15A 和对照组(0 μg/mL NDEA)的 DEGs,结果如图2所示。
由图2可知,两者共有271个DEGs,其中92个基因上调、179个基因下调。
2.2.3 GO富集分析
GO是国际基因功能分类标准体系,包括分子功能、生物过程和细胞组成3个部分,GO数据库可以对DEGs进行功能分类和富集分析。以矫正后的p<0.05为评判指标,筛选出GO富集最显著的前30条通路进行作图分析,结果见图3。
由图3可知,有机氮化合物代谢过程、小分子代谢过程、有机氮化合物生物合成过程、嘌呤-核苷酸物质合成/代谢通路的DEGs富集最显著且数目较大,其DEGs数目分别是 63、47、44、145个。GO 富集最显著的前30条通路中,以嘌呤-核苷酸物质合成/代谢的通路数量最多(图3中13条红色条带)。
2.2.4 KEGG富集分析
KEGG数据库可用于系统分析基因功能和基因组信息,帮助研究人员将基因与表达信息看作一个整体网络进行分析研究,其结果可用散点图表示。E.faecium 15A的DEGs基于KEGG数据库分析的结果见图4。
如图4所示,表示富集程度的指标包括富集分数、q值及富集到此通路上的基因数量。其中,富集分数表示该通路中富集的DEGs数量与注释基因数量的比值,比值越大表示富集程度越高;q值是校正后的p值,取值范围为0~1,若数值越接近0,表示富集越显著,由图4中散点的颜色表示,颜色越接近红色表示富集越显著;散点的大小表示该通路中的DEGs数量,越大表示DEGs数量越多。综合富集程度指标可知,DEGs主要富集在遗传信息处理中的RNA聚合酶合成、能量代谢中的氧化磷酸化、细胞过程中的群体感应、代谢中的嘌呤代谢途径中。
2.3 RT-qPCR验证
转录组结果表明,E.faecium 15A对NDEA的降解过程是一个多基因靶点、涉及多代谢通路的过程,GO和KEGG分析结果均说明嘌呤合成/代谢通路可能为主要的作用靶点通路。基于|log2(Fold Change)|和p值、基因是否存在意义的筛选条件确定DEGs(hpt、xpt、Pyk、Ndk、guaA),并采用 RT-qPCR验证转录组测序(ribonucleic acid-sequenceing,RNA-seq) 结果的准确性,结果如图5所示。
由图5可知,RT-qPCR检测的差异基因的表达趋势与 RNA-seq 结果一致:hpt、xpt、Pyk、Ndk 基因上调,基因guaA表现为下调。进一步对比E.faecium 15A在降解作用最强的条件(pH6)与pH8环境下(促进作用)的上述基因表达变化。结果表明,E.faecium 15A降解能力与嘌呤-核苷酸物质合成/代谢途径相关的基因hpt、xpt、Pyk、Ndk、guaA 相关。
3 讨论
目前研究认为,乳酸菌降解NDEA的能力与其生长代谢的强度呈正相关[9-10,15-18]。例如,Kim 等[16-17]先后从韩国泡菜中分离出能降解NDEA的清酒乳杆菌、植物乳杆菌和明串珠菌,发现乳酸菌对NDEA的降解能力与菌株生长情况密切相关。这与本文的试验结果一致:处于生长对数期的E.faecium 15A对NDEA的降解作用最强,乳酸菌的降解能力可能与活菌的数量有关[9-13,15]。
温度、培养时间、氧气含量、pH值等环境因素影响菌株的生长情况、降解NDEA的能力,证实了乳酸菌降解NDEA能力主要与菌株生长情况正相关。E.faecium 15A在最适生长温度37℃环境中,对NDEA的降解能力最强。菌株在4℃(食品贮存温度)、20℃(室温)、42℃生长量相对较少,因此,展现出相对较弱的降解作用。E.faecium 15A在有氧环境中生长情况、降解作用均强于厌氧环境(模拟发酵食品内部环境)。环境的pH值能改变E.faecium 15A对NDEA的作用特性,pH2、pH4、pH6、pH7 条件下,E.faecium 15A 发挥对NDEA的降解作用,而pH8环境中,E.faecium 15A表现为促进NDEA形成。这与课题组前期的发现一致:环境pH值对亚硝胺的产生影响最显著[15]。因此,为探究E.faecium 15A降解NDEA的机制,本文基于转录组学探究E.faecium 15A降解能力最强的条件下(pH6、37℃、有氧、12h、4.75 μg/mL NDEA)的 DEGs,并采用RT-qPCR验证。同时,利用RT-qPCR对比pH8环境下E.faecium15A发挥促进作用时的相关基因表达量,以期获得菌株降解NDEA的转录途径和关键基因。
KEGG分析表明,DEGs富集在遗传信息处理中的RNA聚合酶、能量代谢中的氧化磷酸化、细胞过程中的群体感应、代谢中的嘌呤代谢途径。GO分析结果说明,该菌株的DEGs聚类在有机氮化合物代谢过程、小分子代谢过程、有机氮化合物生物合成过程、嘌呤-核苷合成/代谢的生物过程通路。其中,嘌呤-核苷合成/代谢过程的通路数量和差异基因数最多,其DEGs为xpt、hpt、Pyk、Ndk 和 guaA。
xpt、是肠球菌的看家基因,其进化速率相对较慢,具有高保守性和分辨率,xpt、负责调控黄嘌呤磷酸核糖基转移酶的产生[18-19];hpt与次黄嘌呤磷酸核糖转移酶有关,此酶是嘌呤回收途径中的关键酶,能催化5-磷酸核糖基-α-1-焦磷酸酯向次黄嘌呤或鸟嘌呤的转移,生成次黄嘌呤核苷酸(inosine monphosphate,IMP)或鸟嘌呤核苷酸(guanosine monophosphate,GMP)[20]。而guaA编码谷氨酰胺转移酶,在嘌呤核苷酸代谢途径中促进黄嘌呤核苷酸(xanthosine monophosphate,XMP)转化为GMP[21-22]。PyK编码的丙酮酸激酶,可催化磷酸烯醇式丙酮酸转化为腺嘌呤三核苷酸磷酸(adenosine triphosphate,ATP)和丙酮酸,是糖酵解过程中一个关键的限速酶,与ATP、GMP的生物合成有关,能将IMP转化为ATP、腺嘌呤二核苷酸磷酸(adenosine diphosphate,ADP)、鸟嘌呤三核苷酸磷酸(guanosine diphosphate,GTP)、鸟嘌呤二核苷酸磷酸(guanosine diphosphate,GDP)。Ndk与核苷二磷酸激酶密切相关,它是调节核酸代谢的重要激酶,催化ATP和核苷二磷酸(nucleoside diphosphate,NDP)之间磷酸基团的转移,有NDP激酶活性、蛋白磷酸转移酶活性,可以参与转录调控和信号转导[23]。
上述基因都编码酶的产生,这些酶很可能参与降解NDEA或者是降解NDEA的关键蛋白[6,21]。Nowak[6]推测,乳酸菌降解NDEA的作用主要依靠菌株生长产生的某种关键组分,其能与NDEA结合并使之降解。Xiao等[24-25]获得具有降解亚硝胺作用的戊糖乳杆菌(Lactobacillus.pentosus)R3。比较 L.pentosus R3 全菌体、无细胞上清液、细胞碎片、胞内提取液各部分对NDEA的降解能力后,发现L.pentosus R3降解作用的关键组分位于细胞碎片悬液中,通过分离和质谱鉴定确定细胞碎片中的作用物质多为表层蛋白质。此蛋白可能就是位于细胞膜或细胞壁上的降解酶。
对比RT-qPCR结果发现E.faecium 15A在降解能力最强的pH6条件下,嘌呤合成/代谢途径的相关基因xpt、Pyk、Ndk均上调,这些基因在菌株展现促进作用的环境(pH8)均下调。因此,推测这些基因参与编码的嘌呤合成/代谢酶可能是E.faecium 15A发挥降解NDEA作用的酶,或者这些酶是降解作用的关键蛋白,其合成或代谢的嘌呤可能为降解作用关键蛋白合成的前体物。所以,嘌呤合成/代谢途径可能为E.faecium 15A降解NDEA的主要作用通路。
4 结论
本研究考察了环境因素对E.faecium 15A降解NDEA作用特性的影响。菌株降解作用与其生长情况相关,两者变化趋势一致,说明降解作用和菌株生长相关。培养温度、培养时间、需/厌氧培养条件的改变会影响菌株的降解能力,不会转变菌株对NDEA的作用特性。不同pH值环境下,菌株可能表现为降解NDEA或促进NDEA生成的作用。这可能由于E.faecium 15A对NDEA的作用过程是一个多基因靶点、涉及多代谢通路的过程,其中嘌呤合成/代谢途径或为主要作用靶点通路。经RT-qPCR与RNA-seq结果对比,获得了与降解作用的相关基因(xpt、hpt、Pyk、Ndk、guaA)。研究结果从分子层面探究了E.faecium 15A降解NDEA的机制,为利用E.faecium 15A有效清除NDEA提供理论支持。

