添加硅缓解植物非生物和生物胁迫的生理生态机制*
钱 程,李新娥**,赵 欣,刘大林,王 琳
(1.扬州大学动物科学与技术学院 扬州 225009;2.扬州大学农业科技发展研究院国际联合实验室 扬州 225009)
硅是地壳中含量最丰富的元素之一,仅次于氧元素,居于第2 位。硅元素在植物生长发育中的作用一直被忽视,直到20世纪初,越来越多的研究表明,这种类金属元素尤其对受到胁迫时的植物生长和抗逆有益,它可以提高植物对一系列非生物和生物胁迫的抗性,对植物在逆境中的生长可以起到重要作用[1-2]。最近转录组分析表明,在植物没有受到胁迫时,硅添加对植物的基因表达基本没有影响,但是受到胁迫后,植物会因为硅的介导发挥且放大自身的适应性反应[3],说明硅的作用在植物受到胁迫时更为重要。在非生物胁迫方面,硅能提高植物对重金属胁迫的抗性[4]、缓解盐胁迫的损伤[5],提高抗旱性[6]、抗极端温度能力[7-8]和抗紫外线辐射能力[8]等。在生物胁迫方面,硅能增强植物的抗病性和抗虫性,例如真菌[9]、病菌[10]的侵袭、食草动物的采食等[11]。硅对植物的保护作用最初被归因于细胞壁的增厚从而获得的物理屏障(例如,防止真菌菌丝渗透)[12-14]。然而,后续的研究表明,硅对植物的作用要比单纯的物理防御复杂得多,它还具有影响细胞内部的信号交流和调节植物代谢的作用[15-16]。
国内外对硅提高植物非生物和生物胁迫的抗性,改善植物生长状况的作用进行了大量研究,阐明添加硅的作用通路不仅具有重要的理论意义,也将为硅肥在农业生产、改善生态环境等应用方面提供依据和指导。本文先回顾了硅在植物体中的吸收与沉积,以及硅对植物碳基物质合成与代谢的影响,然后综述了硅对非生物胁迫(渗透胁迫、重金属离子胁迫、营养元素匮乏胁迫、极端温度胁迫和紫外线胁迫)和生物胁迫的缓解机制。最后,对本领域未来的研究方向提出了展望。
1 植物对硅的吸收方式以及硅在植物体内的沉积与分布
1.1 植物对硅的吸收方式
对于植物来说,硅元素的主要可吸收形式是溶解于土壤中的硅酸根离子,即当土壤pH 低于9 时,硅以硅酸的形式被植物根系从土壤中吸收。硅在不同积累类型植物的体内含量最少是干重的0.1%,最多可达10.0%,这主要是由不同植物吸收硅方式的差异所导致[1]。根据植物中硅的吸收方式可将植物种类分为积累型、非积累型、中间型以及排除型[16]。植物对硅吸收和积累的物种特异性可归因于根中特定转运蛋白的种间差异[17]。
1.1.1 积累型
在单子叶植物叶片表皮可以直接观察到固体二氧化硅,在其他物种中却鲜见[18],这表明单子叶植物会比其他物种主动吸收更多的硅,即积累型。例如,水稻(Oryza sativa)就是一种典型的喜硅作物,其根系对硅的吸收受蒸腾作用影响较小,水稻根系对硅的吸收和转运是一个主动的过程[19]。其他禾本科(Poaceae)植物如小麦(Triticum aestivum)、黑麦草(Lolium perenn)以及一些莎草科(Cyperaceae)植物也是由根部主动吸收硅[20]。积累型植物通常具有一类径向运输中高密度转运蛋白(SIT1),其一为Lsi1编码的类Nodulin26 膜内蛋白(NIPs),属于细胞膜上的水通道蛋白(aquaporins,AQPs),具有由4 个氨基酸构成的选择性过滤器[19],因此具有特异亲硅性;其二为Lsi2编码的假定阴离子转运蛋白,由消耗ATP 的H+泵主动驱动,只能将硅从细胞内向外运输,这两种蛋白协同完成硅在根系中的吸收和转运,即外皮层向木质部的运输(图1)。
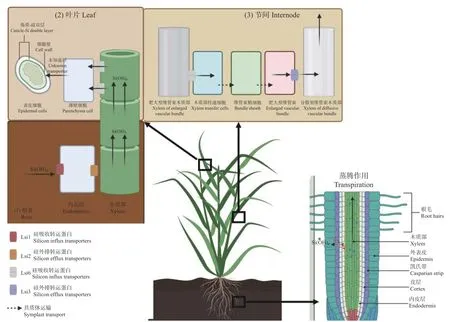
图1 植物硅吸收及转运示意图Fig.1 Schematic representation of silicon transport and uptake within plants
1.1.2 非积累型
非积累型分为中间型和排斥型,这类植物的较低硅吸收能力是由SIT1 的低表达量[21]以及水通道蛋白氨基酸组成的差异[22]造成。中间型植物根部中可能既存在主动吸收途径,也存在排斥作用,例如,黄瓜(Cucumis sativus)中与水稻55.7%、53.27%同源的CsLsi1、CsLsi2基因也具有转运硅的功能[23];一些双子叶植物在吸收途径中是排斥硅的,即排斥型,例如番茄(Lycopersicon esculentum)[21]。可见,植物对于硅的吸收由主动吸收、被动吸收以及排斥作用共同调控;另外,土壤中硅的可利用性也会直接影响植物对硅的吸收[24]。
1.2 硅在植物体内的沉积与分布
植物根部吸收的硅随着蒸腾作用通过木质部转移到植物的地上部器官,蒸腾作用过程中由于水分流失,硅酸会被浓缩[1],并在特定的器官组织的细胞中积聚为无定形水合二氧化硅(amorphous silica),这种化合物被称为植硅体(phytolith)[25],植硅体可以沉积在植物的任何地方,例如细胞内或细胞间,或作为细胞壁的一部分,但沉积后不能再次转移[26]。植物会主动分配不同功能器官中的分布,例如,Yamaji 等[27]报道了负责调节水稻地上部硅分布的转运蛋白Lsi3、Lsi6,Lsi3 主要负责硅向分散维管束木质部的转运,影响硅在茎以及节间的沉积;Lsi6 主要表达于水稻叶鞘及叶片木质部薄壁细胞中,负责木质部内硅的转出,影响硅在叶片的分布(图1)。在大多数情况下,二氧化硅会直接沉积于细胞壁基质上[28],这种二氧化硅交联细胞壁的聚合物可以增加细胞的抗压强度。在叶片中,硅的沉积会形成细胞壁角质-硅双层(cuticle-Si double layer)结构[29],这种结构可以起到增加植物叶片机械强度的作用,同时也直接改变了叶片表面性状,降低了植物的适口性,抑制了食草动物的食欲和消化率,从而增强了自身的昆虫抗性[30]。硅在茎杆中的分布可以增加植物的抗倒伏性,韧皮纤维中的硅会更多沉积在其细胞壁的远端,可以形成一个加强整个茎的环,增加茎杆的直立性、可接受光照面积和二氧化碳接触面积[5,31-32]。在根组织中,在植物面临重金属胁迫和盐胁迫时,硅在根系中的沉积可以起到阻挡金属离子的作用[33],还可以增加机械强度以减少食草动物对根系的侵袭[34]。
2 硅对植物碳基物质合成与代谢的影响
全球草地硅化程度的关键驱动因素是水分和养分水平,在干旱或营养贫乏的土壤环境中叶片的硅碳比(Si∶C)较大[35],其原因可能是植物体内硅的比重越高,生长发育的成本便越低,在植物固碳能力相同时,高硅含量植物可以利用的碳会更多,从而能够构建更有竞争力的发育模式[24,36-37]。这种“硅碳替代”(silicon carbon trade-off)假说最初由Raven[37]于1983年提出,即硅在植物体内可以在某些功能上代替碳,如作为结构性物质成为木质素、纤维素等的低成本替代品,降低植物在某些方面的碳水化合物投资,增加植物生理活动的可利用碳水平,提高代谢强度,从而改善植物的生长状况。在受胁迫植株生理过程、不同器官中用硅代替碳,将更多固定的碳用于生产新叶,从而提高生长速度和碳投资的回报率,降低植物的生长成本[38]。
很多研究对硅是否可以在结构上或功能上替代碳基物质的假说进行了验证,结果证明这种替代可以发生在植物各器官中,并且植物会根据组织、器官的功能而改变硅碳的利用策略。硅可以代替碳基结构性物质,例如,Yamamoto 等[39]对水稻进行了加硅与缺硅处理,结果显示两组相比,随着硅含量的增多,水稻叶片纤维素和木质素含量下降,这两种碳基结构性成分在细胞壁中的比重也有所降低,并且细胞壁中相关碳基结构性物质的基因表达也有所下调。在茎杆中,硅添加可以下调纤维素的合成,植物会使用硅替代作为结构性物质[40],例如,Klotzbücher 等[41]对稻草秸秆的总碳、氮、磷、硅含量和木质素含量进行的相关性分析中,发现硅元素浓度和结构性碳即木质素呈显著负相关。在16 种水生和湿地物种中也存在这样的权衡,虽然硅积累类型不同,总体上来说木质素、纤维素和植硅体的含量存在明显的负相关[42]。硅还能在某些生理功能上代替碳基物质,例如在水稻植株中,除了木质素、纤维素等结构性物质以外,脂质、蜡质和游离有机酸等碳基物质含量也会随着硅含量的上升而下降[43]。此外,Dallagnol 等[44]通过测定感染褐斑病的水稻植株中叶片硅浓度、可溶性糖浓度与光合参数,发现叶片二氧化硅浓度与总酚浓度呈显著负相关,与己糖、蔗糖浓度等呈正相关,并且硅添加对光合速率有显著促进作用,说明硅可以通过提高植物可溶性碳水化合物水平维持植物基本代谢。
3 硅对植物非生物胁迫的缓解作用及其机制
3.1 硅对渗透胁迫的缓解作用及其机制
在植物受到盐胁迫时,高浓度离子毒性会导致渗透系统受损,同时光合、抗氧化系统也会受到抑制[45]。硅可以通过降低电解质渗透率、丙二醛含量、活性氧积累缓解盐胁迫对棉花(Gossypium hirsutum)幼苗生长的抑制作用[46]。大豆(Glycine max)受到盐胁迫时,赤霉素的含量会显著降低,脯氨酸和脱落酸的含量会上升,脱落酸从根部转移到地上器官后会促使诱导气孔关闭。但是对植株进行硅添加处理后,赤霉素含量显著提升,重要的渗透调节物质脯氨酸、脱落酸含量会进一步上升,从而改善植物的渗透系统,降低受胁迫程度[5,45]。此外,钙离子(Ca2+)和钾离子(K+)是维持调节质膜的稳定性和通透性的重要组分[47],硅添加对钠(Na+)、钾、钙等离子的吸收与转运也有调节作用。例如盐胁迫处理的紫花苜蓿(Medicago sativa)和玉米(Zea mays)在添加硅后植株体内钾离子和钙离子含量升高[33,48],盐胁迫造成的渗透危害得以减轻;而且,硅添加促使盐胁迫处理的小麦根部有更多钠离子的积累,同时地上部钠离子浓度降低,说明硅有抑制盐分向植株地上部分转运从而降低其毒性的作用[47]。
现有的研究表明,硅对干旱胁迫下植物的缓解作用主要与提高根系水力传导和减少蒸腾作用失水有关[49]。硅通过上调水通道蛋白的表达,增强植物的吸水能力和根部的导水率,可以增加水分渗透能力,从而提高植物对干旱胁迫的耐受性[50-51]。硅在叶片中形成的硅-角质层双层结构通过抑制蒸腾作用防止水分流失也是保水的重要机制之一[13],硅还与叶片保卫细胞中的胼胝质(callose)结合并且延伸到气孔中从而抑制水分流失[51],并且通过介导保卫细胞中的钾离子流出,关闭气孔降低蒸腾作用失水[52]。硅还可以增加过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和谷胱甘肽还原酶(GR)等抗氧化酶的抗氧化活性[6],影响脯氨酸的产生以及细胞分裂素的产生来减轻干旱胁迫程度[53]。通过以上作用机制,硅使得干旱胁迫下的植物维持了一定的气孔导度和光合速率,改善了自身的渗透平衡从而促进植物生长[54]。
3.2 硅对重金属离子胁迫的缓解作用及其机制
硅对重金属胁迫的缓解机制主要是与重金属离子结合使其固定沉积,干预重金属元素向植物体中的运输,防止其进入细胞影响生理活动等(表1 ,图2)。硅可以直接与重金属离子结合沉积将其固定在土壤中[4];硅还可以将游离的重金属离子固定在细胞中,尤其是植物根部厚壁组织细胞壁中,从而降低叶片中的重金属浓度[72]。例如,受锰胁迫的植物硅添加后,叶片细胞壁中锰滞留量占叶片总锰含量的90%[73];豆蔻(Cardaminopsis halleri)细胞质、细胞核中的少量沉淀都以硅酸锌的形式存在,并逐渐降解为二氧化硅,说明硅在植物代谢场所也可以通过与重金属离子结合而降低毒性[74];对铁胁迫下的水稻进行硅添加,根表铁斑(root iron plaque)的形成明显减少,水稻根系对铁离子的吸收被阻隔[75]。另外,重金属通过木质部运输至植物地上部分的主要动力是木质部负载能力和蒸腾拉力[76],硅元素可以通过干预这一过程来实现减少植株地上部分重金属的积累,如Naeem等[77]发现硅添加通过降低气孔导度和蒸腾速率降低了镉胁迫下小麦植株中的重金属含量。
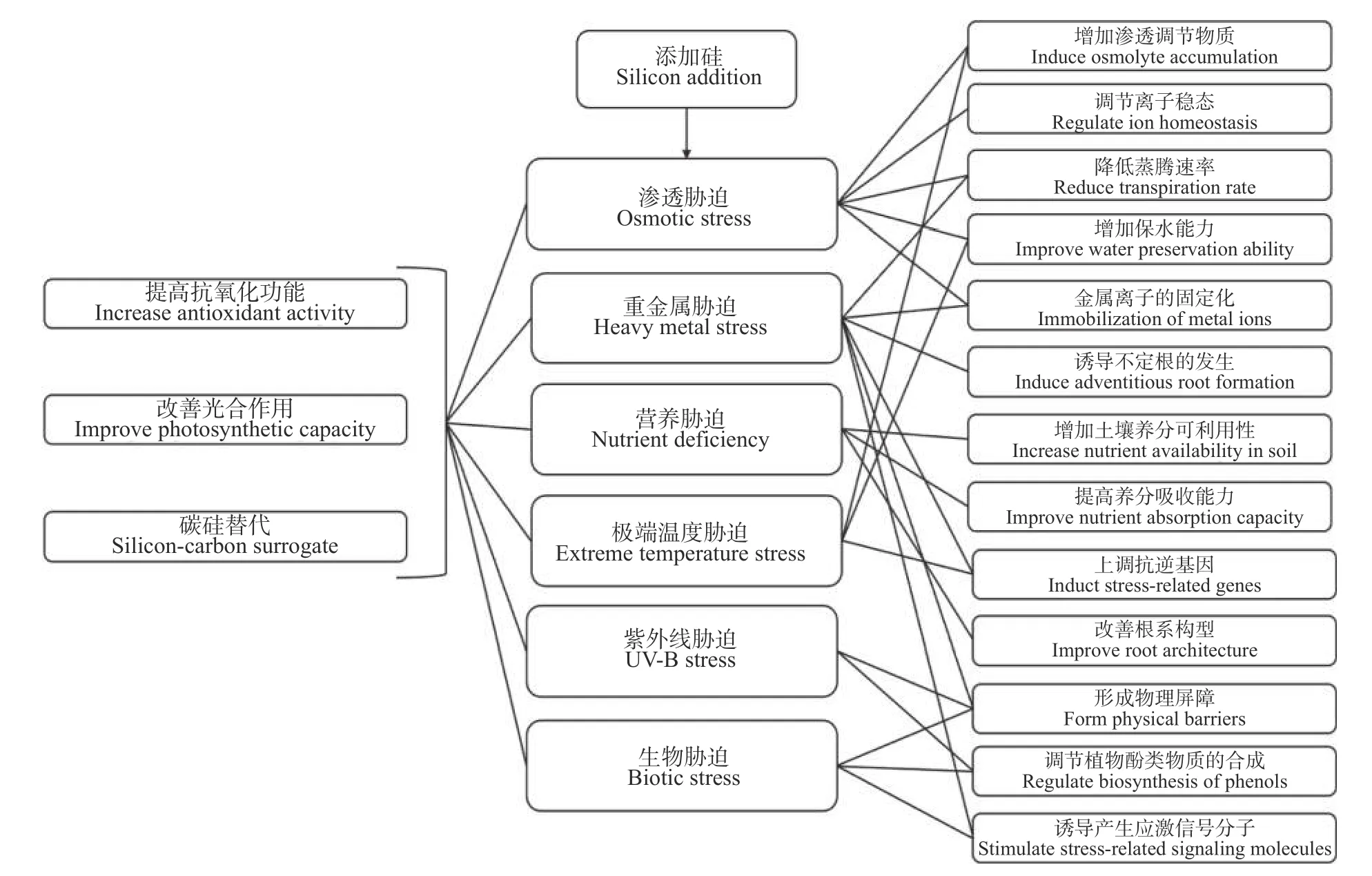
图2 添加硅缓解植物非生物和生物胁迫相关机制Fig.2 Multiple mechanisms of silicon in alleviating biotic and abiotic stresses

表1 添加硅缓解植物非生物和生物胁迫相关机制Table 1 Ameliorating mechanisms of silicon to abiotic and biotic stresses of plants
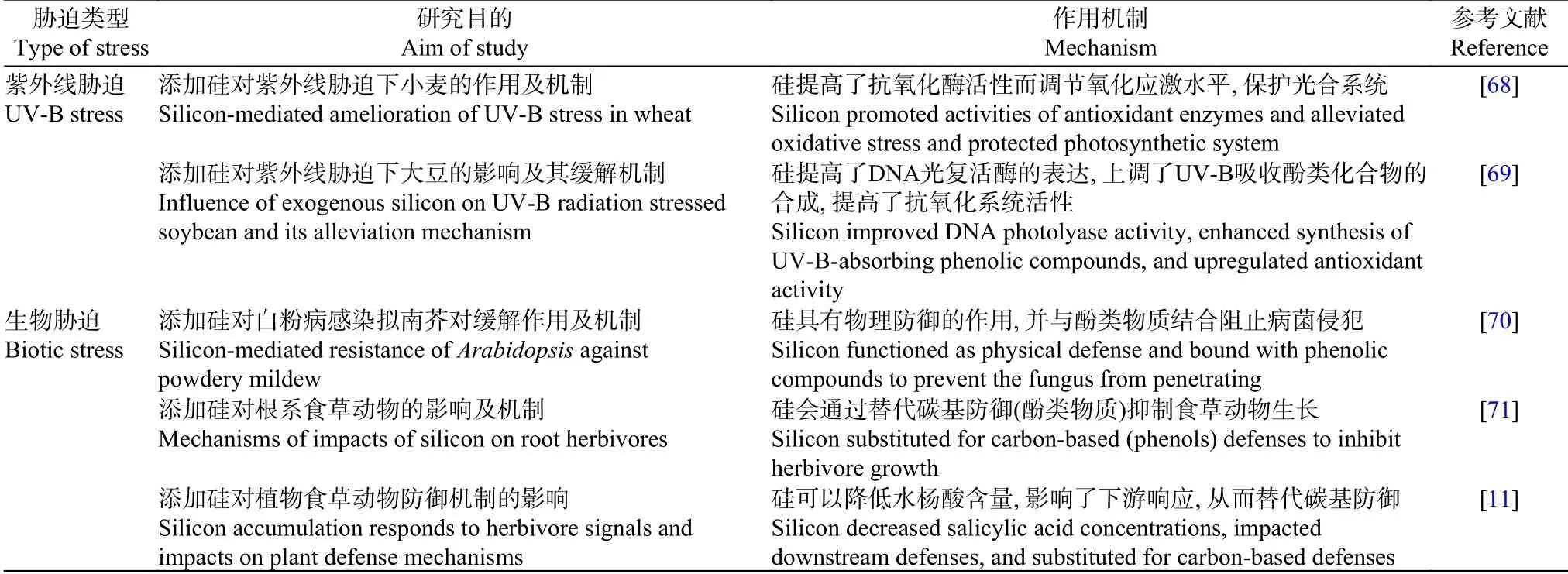
续表1
不定根的发生也是植物适应逆境的重要途径[78],硅也可以通过分子信号途径诱导产生新根系来抵抗重金属胁迫。如Tripathi 等[15]发现在砷胁迫下,硅添加上调了OsNOA1基因、吲哚乙酸合成和转运相关基因的表达,增加了一氧化氮和吲哚乙酸的合成,从而诱导了植株不定根的产生。硅添加还可以通过修复光合系统,减轻叶绿体光系统的受损,提高其碳固定能力等以提高对重金属元素的抗性[58,79-80]。
3.3 硅对营养胁迫的缓解作用及其机制
在土壤养分缺乏的背景下,硅凭借本身的环保性以及其对缓解植物营养胁迫的明确作用受到了越来越多的关注。据报道,硅可以通过增加土壤中营养成分的可利用性缓解胁迫(图2),如降低土壤对磷的固定[81],增加土壤中的水溶性磷的浓度[82],从而间接增加植物对磷的吸收。硅添加还可以增加根系对元素的吸收能力[83],例如Rezakhani 等[84]使用可溶性磷以及不可溶性磷分别作为磷源,硅添加在两种磷源条件下都增加了植株的磷含量,主要机制可能是通过增加根系的吸收表面积以及根系长度,改善了根系构型[85]。Haddad 等[61]发现硅上调了硝酸盐转运蛋白(BnaNRT1.1,BnaNRT2.1)的表达,增强了根部的氮同化效率,从而增加了植株的氮含量。另外,Minden等[86]对绒毛草(Holcus lanatus)进行缺氮、缺磷处理后进行硅添加,结果表明在植物同化更多硅时伴随着总碳含量的下降,说明硅通过降低植物每单位质量碳消耗缓解了缺氮、缺磷胁迫。
硅对氮磷以外的其他元素胁迫也具有缓解作用,但缓解机制可能存在特异性。例如在缺铁胁迫下,硅可以通过增加柠檬酸盐和儿茶素等铁活化物的积累,增加铁向地上部分的分布与铁元素在植物体中的运转、流动,然而锰、锌的流动性和组织分布没有受到硅的影响[87]。硅上调了黄瓜根中铁转运基因的表达,从而增加与铁主动吸收有关的蛋白质(FRO2,IRT1,HA1)的基因表达水平,增加了植株吸收铁的能力,并增加了铁的转运效率和积累量,从而减轻了缺铁胁迫[88]。da Silva 等[89]对在缺钙胁迫下的甘蓝(Brassica oleracea)植株中进行硅添加,发现硅提高了抗坏血酸的浓度以降低氧化损伤,硅通过结合羧基自由基(carboxylic radicals)来作用于细胞壁与木质素和果胶交联,从而增加叶片韧性减少细胞外渗与叶片失水。
3.4 硅对极端温度胁迫的缓解作用及其机制
硅可以通过提高活性氧清除能力减轻由极端温度引起的胁迫。高温胁迫下添加硅后上调热休克蛋白(heat dhock proteins,HSPs)的表达与转录积累,以提高细胞的热应激响应能力[67],改善细胞膜脂质的热稳定性,降低细胞膜受损程度,缓解高温胁迫程度[90]。硅可以增加光合色素和有机溶质,如可溶性糖、蔗糖和脯氨酸等的积累,提高光合能力,并且减轻高温缺水导致的渗透胁迫[65]。高温直接对叶绿体光合系统Ⅱ造成损害,并且植物细胞代谢活动中产生大量的活性氧会造成细胞的氧化损伤,硅添加可以相应地通过调控高温胁迫下光合系统Ⅱ内编码对热应激有重要作用的亚基H 蛋白(PsbH)、叶绿素结合蛋白(PsbB)和作用中心蛋白D2(PsbD)的上调表达,从而增加光系统Ⅱ的最大量子产率(Fv/Fm)和性能指数[65,91],影响抗氧化酶的基因表达来减轻氧化胁迫,降低超氧阴离子(O2—)和丙二醛的浓度来缓解细胞膜脂的过氧化[67]。
在低温胁迫下细胞膜是受到胁迫的首要部位,低温冷害对植物的不可逆损伤还会干扰细胞内的生理过程,如光合作用等[92-93],而硅添加可以降低细胞膜受损程度,增强植物体内的抗氧化系统[94-95]。例如,低温胁迫下黄瓜幼苗叶片中较高水平的硅沉积可以在膜脂过氧化损伤方面发挥作用,抑制丙二醛的生成[66]。硅还可以增加与光合作用相关的RuBP 羧化酶(ribulose-1)、PEP 羧化酶(PEP carboxylase),与代谢相关的质子焦磷酸酶(H+-PPase)的酶活性,从而增加光合速率,调控光合、代谢强度,改善低温条件下植物的生长[96]。另外,硅添加使—5 ℃培育的小麦叶片表现出更高的保水性从而缓解胁迫程度[97]。
3.5 硅对紫外线胁迫的缓解作用及其机制
紫外线辐射过强会影响植物的生长形态、生理生化状态,导致DNA 的损伤影响蛋白质的表达[98]。这种影响也可以通过添加硅缓解[8]。硅的保护作用与植物响应紫外线胁迫而增加硅-角质双层形成有关,因为硅添加可以作为一层物理屏障,通过在叶子表皮层下方沉积,形成的双硅层可以阻挡来自表皮的紫外线辐射的进一步传输[99]。硅添加通过增加抗氧化化合物如可溶性糖、花青素来缓解紫外线带来的氧化和光合损伤[8,100]。硅还可以通过影响胁迫下植物激素的合成与代谢,调节植物能量代谢、提高酚类物质、蜡质等次生代谢产物的合成,从而改善其介导的表皮屏蔽作用,诱导植物获得抗性,从而有效缓解紫外线胁迫[101]。然而,硅在对紫外线辐射应激的代谢反应中的作用,例如低分子量紫外线吸收化合物例如黄酮类化合物的生物合成,仍不清楚[102]。
4 硅对植物生物胁迫的缓解作用及其机制
4.1 硅对生物胁迫的物理防御作用及其机制
硅介导的许多防御机制在不同植物中都有发现,硅在叶片细胞壁中的沉积会使细胞变得更坚硬,从而更难被病原菌穿透、被昆虫咀嚼粉碎[30]。对于食草动物而言,硅还可以通过降低叶片适口性、影响昆虫接收淀粉和蛋白质的薄壁组织细胞来降低消化率[103],硅添加后二穗短柄草(Brachypodium distachyon)的刺细胞以及硅化细胞明显增大,这种适口性降低对棉铃虫幼虫(Helicoverpa armigera)的影响更大,对蟋蟀(Acheta domesticus)的影响没有那么大,可能是因为棉铃虫幼虫的肠道更加脆弱,而蟋蟀的肠道内部由一层坚硬内膜减少了植硅体的摩擦,所以硅的物理防御性能也与动物消化道有关[30],这需要与昆虫肠道的消化性能相关联来分析。
对于病原体而言,葡萄(Vitis vinifera)叶片在喷施硅后,白粉病的扩散得以抑制,角质-硅双层结构会作为一层“防火墙”阻止真菌的渗透与菌丝的蔓延,另外一部分硅吸收后被植物主动转移到芽孢周围对真菌进行抑制,成为了一道物理防线[11]。类似的发现在水稻中也有报道,被稻瘟真菌(Magnaporthe grisea)侵染的叶肉细胞中有大量菌丝,叶肉细胞的功能以及活性都受到强烈的抑制,而硅添加后的植物叶片中,存在于叶肉细胞中的真菌菌丝通常被植硅体包围且生理活性受抑,从而逐渐变为空壳[14]。上述的物理屏障假说是解释硅增强植物面对生物胁迫抗性中最基础的防御机制,而根据Coskun[103]提出的质外体阻塞假说(apoplastic obstruction hypothesis),一部分沉积在质外体中的无定形硅还可以通过影响细胞表面的识别位点,干扰病原体与植物之间特异性识别的过程,从而阻碍病原体对细胞进行侵染。
4.2 硅对生物胁迫的化学防御作用及其机制
植物体内酚类物质、有机酸等次生代谢产物的浓度与昆虫侵袭程度通常呈正相关,如单宁、类黄酮、水杨酸等,这类碳基物质被认为是生物胁迫下植物的化学防御[104-105],在植物应对食草动物和病原体的防御策略中具有重要的指示作用[71]。硅可以通过上调合成相关碳基防御响应的基因提高植物的生物胁迫抗性[106](表1)。例如,硅添加后被白粉病病原真菌感染的黄瓜叶片中黄酮类化合物和酚酸含量升高,减轻了白粉病症状[107];被尖孢镰刀菌(Fusarium oxysporum)感染的香蕉(Musa nana)中,硅添加通过增加黄酮类化合物和酚类物质的含量增加抗性[108];硅添加通过同时调控OsICS1、OsPAL与水稻抗褐飞虱(Nilaparvata lugens)基因BPH3的表达量来提高叶片水杨酸的水平,抵御水稻褐飞虱的危害[109]。
另一方面,硅可以作为化学防御的廉价替代品降低植物的防御成本,促进植物整体的生长状态。如前所述,硅通常被认为是碳基防御的一种能量廉价的替代品[25],喜硅植物在面临生物胁迫时植物会更倾向于使用成本低廉的硅基防御,即随着硅基防御占比的提升,化学防御强度将会降低[105]。Waterman等[11]对二穗短柄草添加茉莉酸甲酯(MeJA)来模拟食草动物啃食的同时添加硅,发现硅添加后的植物利用了较少的酚类物质,说明植物优先采用了基于硅的防御体系。在群落水平上观察到叶片酚类物质含量和硅含量间的负相关,并且二氧化硅的积累、酚类合成的减少更有利于植物适应营养贫乏环境[110-111],这种能量增益可为植物生命周期的其他关键方面节省资源,例如生态系统退化期间的生长和繁殖[112]。另外,在施用硅后,随着硅含量的提高,与防御和应激信号相关的内源性植物激素(水杨酸、脱落酸)生物合成被降低[67],也证明了硅基防御占比的提高。
5 展望
综上,硅对植物非生物和生物胁迫的缓解作用和相关机制目前已经得到了较为广泛的研究,在未来的研究中,有以下几个方面值得进一步深入探讨,以在硅作用机制的深度和广度、硅在农业和草牧业中的应用、硅在生物圈和生态系统中的循环以及对全球碳汇的影响等方面有进一步的研究成果:
1)虽然硅缓解植物胁迫的生理生态机制已经取得一定进展,但仍需在代谢组学、蛋白质组学和基因组学水平上进行深入研究,进一步对不同胁迫下植物对硅的吸收、转运,以及硅提高抗性与胁迫耐受途径相互作用的分子机制进行探究,以期借助基因工程发挥硅在农业生态系统中的巨大潜力。
2)目前大多数研究都集中在禾本科积硅植物,对双子叶植物,尤其豆科(Leguminosae)植物还需进行深入研究。豆科植物与固氮菌形成共生关系,产生根瘤从而固定大气中的氮。目前少量的研究表明,硅可以提高根瘤细胞壁的溶质渗透性和气体的扩散阻力,替代根瘤中的细胞壁组分将更多的碳基资源分配给根瘤菌,以及增加根瘤活性等机制促进豆科植物根部结瘤增加固氮效果[36,112]。总体而言,相关研究仍然很少,硅在豆科植物体内的吸收与转运的分子机制,以及对豆科植物生长和固氮作用的影响及其机制,仍然是今后的研究重点。
3)硅添加影响了生态系统的碳汇功能。例如,硅添加可以增加植物光合效率,增加碳投资的效率;“硅碳替代”还影响植物地上组织碳基物质的组成与比例,如降低木质素和纤维素含量,改变植物残茬中有机质分解速率;植硅体形成过程中,会有一部分有机碳被包裹封存,这种植硅体碳(phytolith-occluded organic carbon,PhytOC)相比其他有机碳组分具有更难降解的特性。因此,添加硅对全球碳-硅循环的作用,以及对土壤有机碳储量的影响不容忽视[113-114]。目前相关研究还很不深入,只有充分理解碳-硅循环才能针对性地利用不同管理模式达到经济效益和生态效益的最大化。

