红球菌Y-1发酵条件优化及其抗菌活性物质初探
何玲敏,吴秋芳,胡高阳,李 悦,杜煜洁,张美玲,蔡 新,李锁平,郭瑞林
(1.安阳工学院 生物与食品工程学院,河南 安阳 455000;2.河南省太行山林业有害生物野外科学观测研究站,河南 林州 456550;3.河南大学 生命科学学院,河南 开封 475000)
小麦赤霉病(Fusarium Head Blight,FHB)别名麦穗枯、烂麦头、红麦头,是一种世界范围内广泛流行的麦类作物上的真菌病害。禾谷镰刀菌(Fusarium graminearumSchwabe)是引起小麦赤霉病的主要病原菌[1]。河南省是我国小麦种植面积最大的省份,小麦赤霉病亦是当地小麦生产的主要病害。该病害的发生对小麦的产量和品质均会造成影响,其分泌的真菌毒素可引起人、畜中毒。
随着人们生活水平的提高和对高品质生活的追求,保护环境、倡导生态和谐和实施可持续发展越来越受到重视,进而提出了“公共植保、绿色植保”的理念。因此,生产上迫切需要一种可持续、环保、高效的防治措施来控制小麦赤霉病的发生和危害。生物防治技术具有对人畜及生态环境影响小、专一性强、对农产品无污染、不易使病虫害产生耐药性等优点,符合环境及农业可持续发展的理念,被认为是最有前途的化学农药替代品,在许多国家已被开发为商业化的生物肥料或生防菌剂[2]。
鉴于目前尚无理想的高抗赤霉病的小麦品种,因此生物防治技术将是一种更有效、更环保的农产品生产方法,是小麦可持续发展的重要保障[3]。用于生物防治的微生物主要是从不同生态系统中的植物、土壤中筛选得到的拮抗菌,包括细菌、真菌和放线菌等[4]。拮抗微生物对病原真菌的作用方式多样,包括抗生作用、竞争作用、重寄生作用,溶菌作用,诱导抗病性等。国内外许多学者在有益拮抗菌的研究和应用方面做了大量工作并取得积极成果,有效菌株主要有芽孢杆菌(Bacillusspp.)[5]、假单胞菌(Pseudomonasspp.)[6]、木霉菌(Trichodermaspp.)[7]。徐剑宏等[8]从土壤中分离到的枯草芽孢杆菌AF0907能抑制禾谷镰刀菌菌丝的生长和孢子的萌发,且可有效降低小麦赤霉病的发病率,防治效率可达40%以上。蔺国强等[9]从土壤中分离到一株解淀粉芽孢杆菌,其对小麦赤霉病的防治效果达80%以上。Khan等[6]首次报道了假单胞菌可用于防治小麦赤霉病并同时减少DON(脱氧雪腐镰刀菌烯醇)毒素的分泌量。
拮抗菌株在代谢过程中产生的抗生素、抗菌蛋白或细胞壁降解酶等次级代谢产物可直接对抗病原菌,从而使植物抵抗病原菌的入侵、潜伏和扩散,菌株产生的次级代谢产物越多,其生物防治效果就越强[10]。关于小麦赤霉病生防菌株的生防机制的研究,大多数研究者认为拮抗菌株在小麦穗部等组织产生的一些细胞壁降解酶以及次级代谢产物等抗菌活性物质,在赤霉病的防治中起着关键作用[7,11],然而,拮抗菌株发酵液中具体哪些物质发挥了拮抗作用,其具体的生防机制是什么,以及能否将拮抗菌研制成生物制剂运用到小麦赤霉病的生物防治中,这些问题都制约了小麦赤霉病的生物防治进程[5]。
拮抗菌在田间的防治效果与室内平板对峙实验结果不一致,是植物病害生物防治中存在的普遍问题。当室内筛选的拮抗微生物释放到田间后,其防治效果往往不尽人意。目前,小麦赤霉病拮抗菌难以完全满足商品化生产的要求,许多拮抗菌的田间防治效果及其作用机理尚不明确。因此,需要对拮抗菌的活性拮抗物质及其生物活性进行深入研究。
课题组前期从小麦叶片分离到一株红球菌Y-1菌株,发现该菌株能有效抑制小麦赤霉病病原菌禾谷镰刀菌(F.graminearum)的分生孢子萌发和菌丝生长。本文将以Y-1菌株为研究对象,采用单因素试验优化其发酵条件,并初步研究其抗菌活性物质类型,以期为利用Y-1菌株防控小麦赤霉病提供科学依据,并为高效生防菌剂的研制提供材料。
1 材料与方法
1.1 供试材料
拮抗菌:红球菌Y-1,分离自小麦叶片。
病原菌:禾谷镰刀菌,由江苏省林科院提供。
主要试剂和仪器:苯、二甲苯、乙酸乙酯、石油醚30-60、丙酮、培养箱、摇床、离心机、pH计、旋转蒸发仪、超声波破碎仪等。
1.2 培养基
LB培养基:胰蛋白胨10 g,酵母浸出粉5 g,氯化钠10 g,固体培养基则添加15 g-20 g的琼脂粉,调节pH为7.0,蒸馏水定容至1 L;用于Y-1菌株的活化和培养。
PDA培养基:新鲜土豆200 g,葡萄糖20 g,琼脂粉15 g-20 g,蒸馏水定容至1 L,自然pH;用于禾谷镰刀菌的活化和培养。
1.3 Y-1菌株发酵条件的优化
将红球菌Y-1菌株在LB固体培养基上活化2次,然后接种于50 mL LB液体培养基中,放置于28℃摇床中,200 rpm震荡培养过夜,作为种子液备用。禾谷镰刀菌在PDA培养基上活化2次,25℃培养,备用。
从培养基初始pH、发酵温度、发酵时间、接种量和装液量5个因素对Y-1菌株的发酵条件进行优化。
①发酵温度
将Y-1菌株接种于LB液体培养基中,分别在22℃、25℃、28℃、30℃和37℃五个温度下,200 rpm振荡培养36 h,检测无菌滤液对禾谷镰刀菌的抑菌活性。
②初始pH
分别将LB液体培养基的初始pH调为4.0、5.0、6.0、7.0、8.0,以 1∶ 50的接种量将Y-1菌株接种于不同初始pH的LB液体培养基中,于30℃ 200 rpm振荡培养36 h后,检测无菌滤液对禾谷镰刀菌的抑菌活性。
③装液量
于500 mL锥形瓶中分别加入50 mL、100 mL、150 mL、200 mL、250 mL的LB液体培养基,接种Y-1菌株后,于30℃ 200 rpm振荡培养36 h,检测无菌滤液对禾谷镰刀菌的抑菌活性。
④发酵时间
将Y-1菌株接种于LB液体培养基中,30℃200 rpm连续振荡培养,分别取第24 h、36 h、48 h、72 h、96 h和120 h的发酵液,检测无菌滤液对禾谷镰刀菌的抑菌活性。
⑤接种量
将Y-1菌株的种子液分别以0.5%、1%、3%、5%、7%、10%的接种量接种到LB液体培养基中,30℃ 200 rpm振荡培养36 h后,检测无菌滤液对禾谷镰刀菌的抑菌活性。
Y-1菌株无菌滤液的制备:取各处理组Y-1菌株发酵液分别倒入50 mL无菌离心管中,4℃,10 000 rpm,离心10 min,上清液用0.22 μm的滤膜抽滤,无菌滤液于4℃冰箱保存备用。
Y-1菌株无菌发酵滤液的抑菌活性测定:取各处理组Y-1无菌滤液5 mL分别与20 mL冷却至50℃左右的PDA培养基均匀混合,制成带毒平板。用直径为5 mm的打孔器打取同质同量的禾谷镰刀菌菌饼,接种至上述PDA带毒平板中央,以无菌水代替Y-1无菌滤液作为对照组,每组重复3次。将上述平板放至28℃培养箱中培养约5 d,当对照组的禾谷镰刀菌菌丝生长至接近培养皿边缘时,用十字交叉法测量禾谷镰刀菌菌落直径,计算各处理组Y-1无菌滤液的抑菌率。
抑菌率计算公式如下:抑菌率=[(对照平板菌落直径-带毒平板菌落直径)/(对照平板菌落直径-菌饼直径)]×100%。
1.4 Y-1菌株对禾谷镰刀菌的拮抗作用
将Y-1菌株在LB固体培养基上活化2次后,接种于50 mL LB液体培养基中,按照上述优化后的最佳发酵条件进行发酵培养。发酵液经4℃,10 000 rpm离心20 min后,上清液用0.22 μm微孔滤膜过滤即得无菌滤液。取无菌滤液5 mL与20 mL冷却至50℃的PDA培养基混合均匀后倒平板,制成带毒平板;以无菌水代替无菌滤液为对照。用直径为5 mm的打孔器打取同质同量的禾谷镰刀菌菌饼,接种至上述PDA带毒平板中央。每个处理3个重复,28℃培养约5 d,当对照组的禾谷镰刀菌菌丝生长至接近培养皿边缘时,用十字交叉法测量禾谷镰刀菌菌落直径,计算Y-1无菌滤液的抑菌率(计算公式同上)。
1.5 Y-1菌株抑菌物质的粗提取及活性测定
①挥发性代谢产物的抑菌作用
将直径为5 mm的禾谷镰刀菌菌饼接种于PDA平板中央,在另一个同样大小的LB平板上涂布接种0.2 mL Y-1菌株发酵液,再将前者反扣于后者之上,两培养皿接口处用封口膜密封。以LB平板上涂布接种0.2 mL LB液体培养基作为对照组,每个处理3个重复。将上述培养皿置于28℃恒温培养箱中培养约4 d,观察并统计Y-1菌株挥发性代谢产物对禾谷镰刀菌的抑菌率。
②非挥发性代谢产物的抑菌作用
在PDA平板上铺一张无菌玻璃纸,涂布接种0.2 mL Y-1菌株发酵液,28℃培养2 d后,用无菌镊子小心揭去玻璃纸,再在平板中央接种一块禾谷镰刀菌菌饼,28℃培养。以PDA平板不接种Y-1菌株为对照,每个处理3个重复。待对照组禾谷镰刀菌菌丝长至接近培养皿边缘时,观察并统计Y-1菌株的非挥发性代谢产物对禾谷镰刀菌的抑菌率。
③非蛋白提取物的抑菌作用
非蛋白提取物的获得:Y-1菌株发酵液在4℃10 000 rpm下离心20 min,上清液经0.22 μm微孔滤膜过滤后即得无菌滤液。取4支提前灭菌的250 mL锥形瓶,每瓶装入50 mL的Y-1无菌滤液,分别加入等体积的苯、二甲苯、乙酸乙酯、石油醚30-60封闭并剧烈振荡,静置15 min后取有机相,如此反复萃取4-5次。用旋转蒸仪将有机相制备成干物质,用5 mL相应的有机溶剂将干物质重新溶解,然后经0.22 μm微孔滤膜过滤除菌,即得非蛋白粗提物,-80℃保存备用。
非蛋白提取物的抑菌活性:用同样的方法制备禾谷镰刀菌菌饼,将菌饼接种于PDA平板距中心点3.5 cm处的两侧,中心点放置牛津杯,并向牛津杯中加入200 μL的非蛋白粗提物。以牛津杯中加等量相应的有机溶剂作为对照,每个处理3个重复。28℃培养箱中培养,3-4 d后观察非蛋白粗提物对禾谷镰刀菌的生长抑制作用。
④蛋白提取物的抑菌作用
粗蛋白提取物的制备:Y-1菌株发酵液在4℃、10 000 rpm下离心20 min,上清液经0.22 μm微孔滤膜过滤后即得无菌滤液。取100 mL无菌滤液,加入硫酸铵使其饱和度为100%,4℃、10 000 rpm下离心30 min,将沉淀溶解于0.1 mol/L、pH 7.0的磷酸缓冲液(PBS)中,并置于透析袋(截留分子量3 500 Ku)中,两端用透析袋夹夹紧,用去离子水透析24 h,在透析液中加入2倍体积的冷丙酮(-20℃),-20℃静止2 h后,10 000 rpm,离心30 min,将沉淀冷冻干燥后即得粗蛋白粉。用PBS将粗蛋白粉重新溶解,使其终浓度为原液的20倍,经0.22 μm微孔滤膜过滤除菌,即得Y-1菌株的蛋白粗提液。
蛋白提取物的抑菌活性试验方法同非蛋白提取物的抑菌活性测定。
⑤细胞破碎物的抑菌作用
Y-1菌株发酵液在4℃、10 000 rpm下离心20 min,弃上清,沉淀用适量PBS溶解,离心,弃上清,此过程重复3次。沉淀用适量PBS溶解,超声破碎(破碎5 s,间隔5 s)15 min,将细胞破碎液在4℃、10 000 rpm下离心20 min,取上清,经0.22 μm微孔滤膜过滤除菌。
细胞破碎液的抑菌活性试验方法同非蛋白提取物的抑菌活性测定。
1.6 数据处理与分析
试验数据采用SPSS 20.0和Microsoft Office Excel 2007软件进行统计和分析,取平均值绘制柱形图或条形图;对各组数据在0.05水平进行单因素方差分析和多重比较分析(Tukey检验)。
2 结果与分析
2.1 不同单因素对Y-1无菌发酵液抑菌活性的影响
2.1.1 发酵温度
如图1A所示,发酵温度会显著影响Y-1无菌发酵液的抑菌活性。随着温度的升高,Y-1无菌发酵液对禾谷镰刀菌的抑菌活性呈现出先升高后降低的趋势。在22℃时,抑菌率最低,仅为24.8%;当发酵温度为25℃时,Y-1菌株的抑菌率最高,达56.5%,且显著高于其他处理组;28℃和30℃时的抑菌率至40%左右,二者之间不存在显著差异;而温度升至37℃时,Y-1菌株的抑菌率继续降至27%。因此,Y-1菌株的最佳发酵温度定为25℃。
2.1.2 初始 pH
培养基的初始pH对Y-1菌株抑菌能力的影响见图1B,Y-1菌株的抑菌率随着pH的增大先升高后降低。当pH为6.0和7.0时,Y-1菌株对禾谷镰刀菌的抑菌率较高,且二者差异不限制,其中pH为6.0时的抑菌率最高,为53.1%;随着pH的升高或降低,抑菌率均急剧下降。因此,Y-1菌株的最适发酵pH定为6.0。
2.1.3 装液量
装液量对Y-1菌株抑菌能力的影响见图1C,随着装液量的增加,Y-1菌株的抑菌率呈现先升高后降低的趋势。当500 mL锥形瓶中的装液量为100 mL时,Y-1菌株对禾谷镰刀菌的抑菌率达到最高51.8%;随着装液量的增加,抑菌率急剧下降,当装液量为250 mL时抑菌率降至最低9.6%。由此可见,相对空气量高、氧气传质阻力小更有利于Y-1菌株的生长。因此,Y-1菌株的发酵最适装液量为100 mL/500 mL锥形瓶(即1/5)。
2.1.4 发酵时间
发酵时间对Y-1菌株抑菌能力的影响见图1D,Y-1菌株的抑菌率随着发酵时间的延长先升高后降低。当发酵72 h时,Y-1菌株的抑菌率达到最高,为55.6%,且现在高于其它处理组;发酵时间过短或过长,其抑菌率均会显著降低。发酵初期,Y-1菌株分泌的抑菌物质的量少,导致其抑菌率较低;而到发酵后期,其抑菌率显著下降,可能是由于此时发酵液中的营养物质基本耗尽,导致Y-1菌株分泌的抑菌物质被分解利用[12]。因此,Y-1菌株的最适发酵时间为72 h。
2.1.5 接种量
如图1E所示,接种量会显著影响Y-1无菌发酵液的抑菌活性。随着接种量的增加,Y-1菌株对禾谷镰刀菌的抑菌率呈现先升高后降低的趋势。当接种量为1%时,Y-1菌株的抑菌达到最高,为55.8%,且现在高于其它处理组;接种量过小或过大,其抑菌率均会显著降低。当接种量为0.5%时,发酵液中的Y-1菌株数量较少,因而分泌的抑菌物质也较少,此时的抑菌率也较低。当接种量为3%、5%、7%、10%时,过高的接种量可能导致发酵液中的营养物质被迅速消耗或次级代谢产物含量较高,影响菌体的生长和繁殖,抑菌率大大降低。
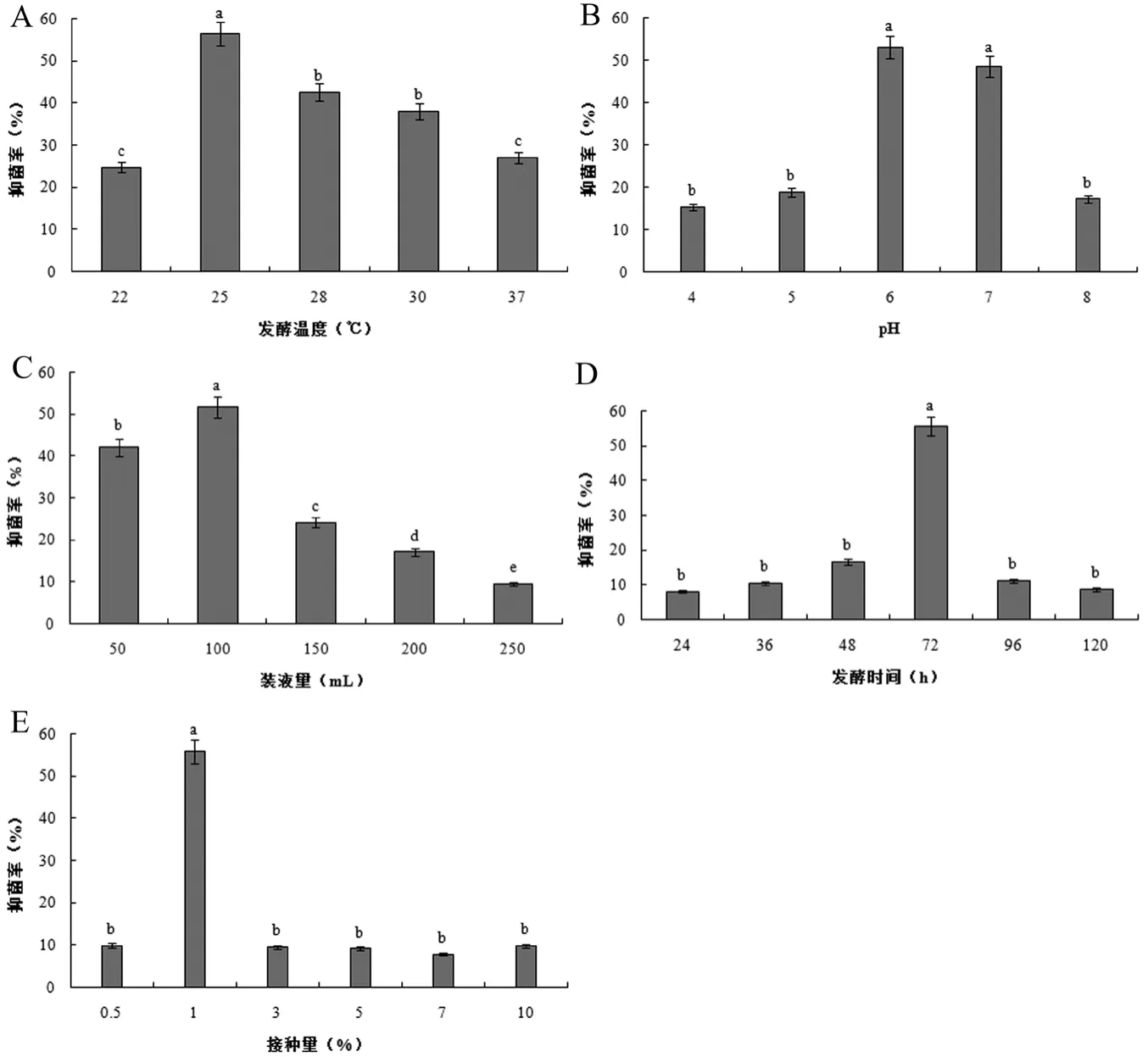
图1 各单因素试验中Y-1无菌发酵液对禾谷镰刀菌的抑菌率
通过单因素试验得到Y-1菌株的最佳发酵条件为:pH 6.0、发酵温度25℃、发酵时间72 h、接种量1%、装液量1/5。初步研究结果表明,中性偏酸性环境有利于红球菌产生抗菌物质,且该菌株为好氧型菌株。
2.2 Y-1菌株对禾谷镰刀菌的拮抗作用
按照上述优化后的发酵条件制备Y-1菌株发酵液。通过观察禾谷镰刀菌在由Y-1菌株发酵滤液制备的带毒平板上的生长情况(图2A),并计算Y-1无菌滤液的抑菌率,发现Y-1发酵滤液可以明显抑制禾谷镰刀菌的生长,抑菌率为58.6%。由此可知,在上述优化后的发酵条件下所得的Y-1发酵滤液的抑菌率显著高于各单因素试验的抑菌率(图2B)。
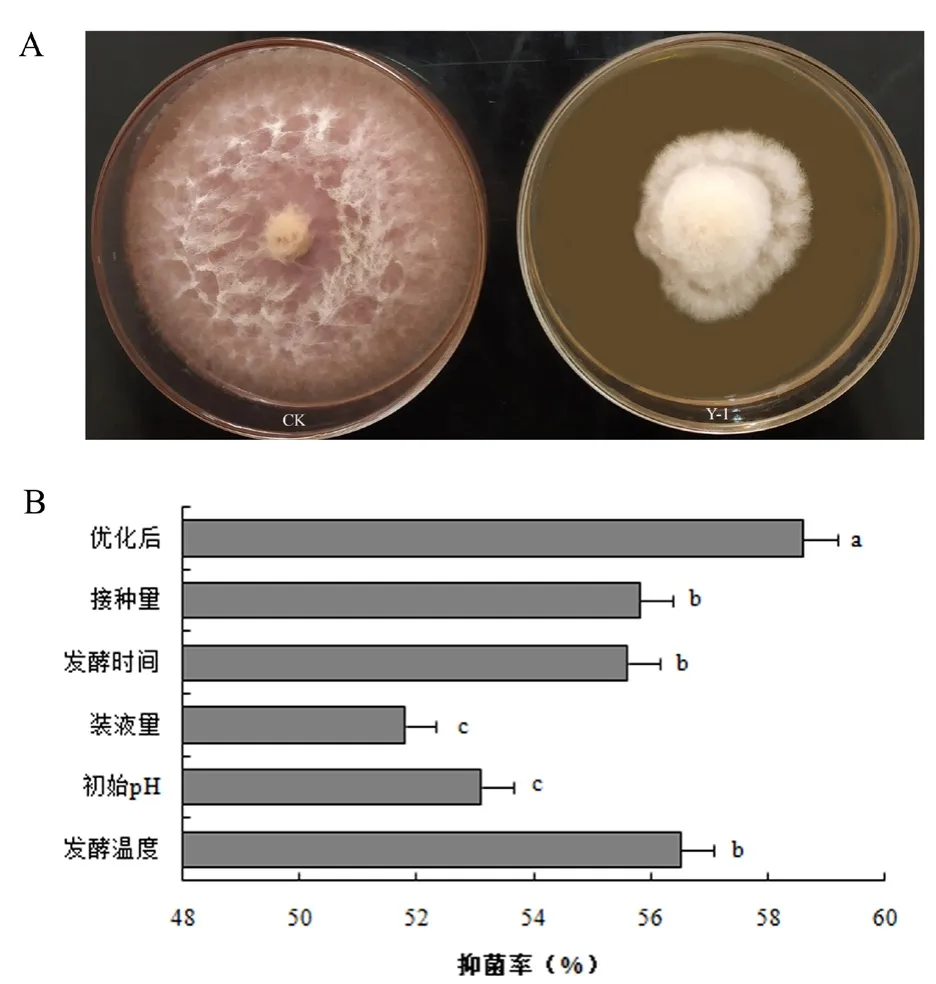
图2 优化后Y-1菌株对禾谷镰刀菌生长的影响(A)及各发酵条件下Y-1菌株对禾谷镰刀菌抑菌率的比较分析(B)
2.3 Y-1菌株的主要抑菌物质类型
Y-1菌株发酵液中的各类粗提物对禾谷镰刀菌的抑菌活性如图3所示,结果显示其发酵液中的非蛋白类物质(提取剂:二甲苯)对禾谷镰刀菌的抑菌作用最强(图4B),抑菌率为77.4%;其次是挥发性物质(图4D),抑菌率为57.5%;而非挥发性物质、蛋白提取物和细胞破碎物对禾谷镰刀菌的抑菌率相当,且均表现出较弱的抑菌作用。
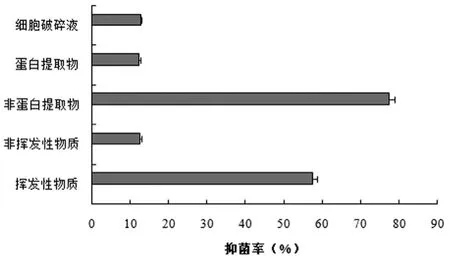
图3 Y-1菌株发酵液中各类粗提物对禾谷镰刀菌的抑菌率
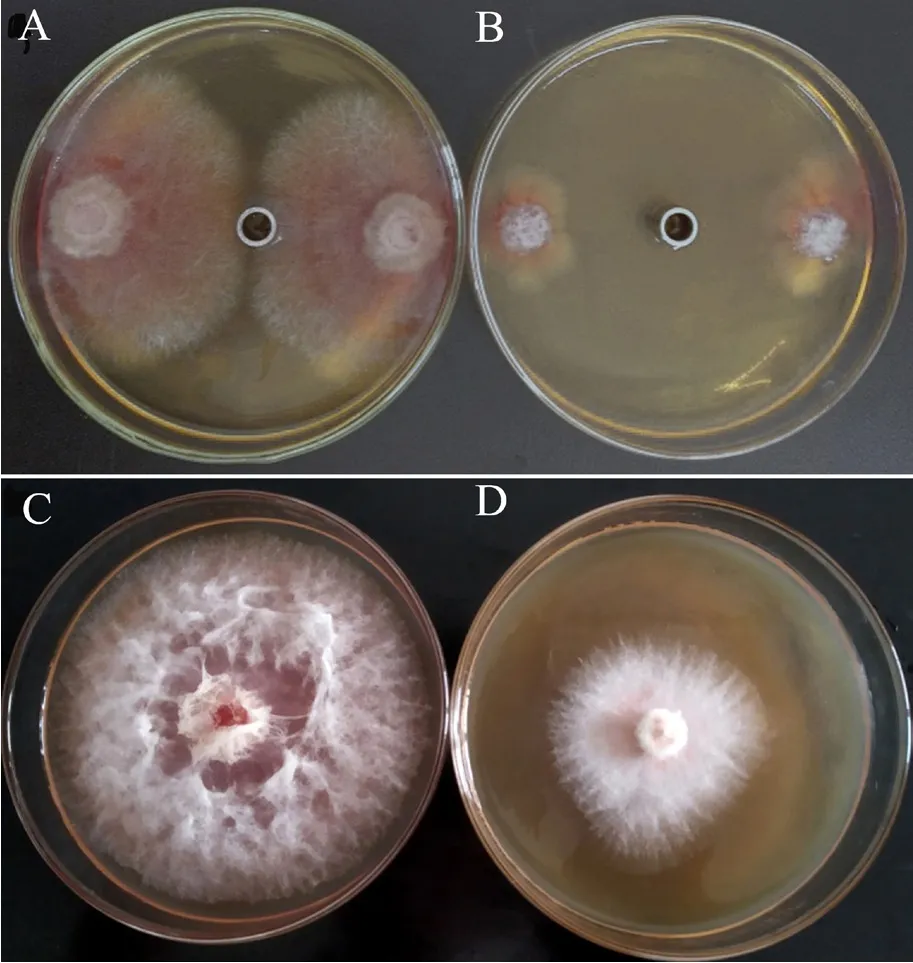
图4 Y-1菌株的非蛋白提取物(A、B)和挥发性物质(C、D)对禾谷镰刀菌菌丝生长的抑制作用
初步得知,Y-1菌株发酵液中的挥发性物质和非蛋白类物质在对禾谷镰刀菌的抑制作用中贡献较大,是其主要的抑菌活性物质。
3 结论与讨论
小麦赤霉病在全球多个国家和地区发生,是禾谷类作物上的一类十分严重的病害,对麦类作物的种植和生产带来巨大影响。其病原菌产生的有毒物质DON等不仅危害人畜健康,而且严重降低小麦的产量和质量,进而导致巨大的经济损失[3]。关于小麦赤霉病的生物防治,国内外一些研究者在有益拮抗菌的研究和应用方面做了大量工作并取得积极成果,已经筛选出小麦赤霉病生防菌有芽孢杆菌、假单胞菌、放线菌以及真菌等[13-15]。生防菌的生防机制主要包括溶菌作用、营养和空间的竞争、产抗生素或其它活性代谢物质、诱导植物的系统抗性等[16]。近几年,关于小麦赤霉病拮抗菌的筛选及其生物防治机制的研究备受关注。尽管筛选到一些拮抗作用较强的菌株,但目前仅有少数芽孢杆菌被开发为生物农药并申请专利投入市场[16]。小麦赤霉病的生物防治依然在探索前进中,并处于试验阶段,距离大规模田间应用仍有一段距离[17]。
微生物的生长及其代谢受众多外界因素的影响,如温度、pH、接种量等。因此,探究微生物的最佳发酵条件对其高效产生抗菌物质十分必要。拮抗菌株在不同发酵条件下抑菌活性物质的产量具有显著性差异。江丹霞等[12]以康氏木霉为指示菌,采用单因素试验结合正交试验对芽孢杆菌Z21产抑菌活性物质的发酵条件进行优化,优化后其发酵液对康氏木霉菌丝生长的抑制率明显提高,高达72%。赵月等[18]以蜡样芽孢杆菌BCCY-22的OD600为指标,采用单因素试验和响应面法对该菌株的发酵条件进行优化,优化后发酵时间缩短了6 h,生物量增加了36%。何明川等[19]结合单因素试验及正交试验对特基拉芽胞杆菌D5-8的发酵培养基和发酵条件进行了优化,优化后其对烟草黑胫病的预防效果和防治效果可达66.89%和53.72%,且均高于优化前。王明环等[20]通过单因素试验和正交试验明确了直丝紫链霉菌A8的最佳发酵条件,并通过气相色谱-质谱联用技术得到26种化合物,其中3-甲基-1,2-环戊二酮、1,2,4,5-四甲基苯和二氢-3-亚甲基-2,5-呋喃二酮对立枯丝核菌的抑菌率达到70%以上。
针对筛选出的具有拮抗活性的红球菌Y-1的发酵条件进行优化,对其生防菌剂的进一步开发和应用具有重要意义。不同发酵条件下,Y-1菌株抑菌活性物质的产量也具有显著性差异。本研究采用单因素试验初步获得Y-1菌株的最佳发酵条件为:发酵温度25℃、发酵时间72 h、接种量1%、初始pH 6.0、装液量为100 mL/500 mL锥形瓶(即1/5)。在该发酵条件下,Y-1发酵液对禾谷镰刀菌的抑菌率高达58.6%,显著高于各单因素实验的抑菌率。由此可知,环境中相对空气量高、氧气传质阻力小更有利于Y-1菌株的生长;且过高的接种量使得发酵液中的营养物质被迅速消耗,影响菌体的生长繁殖,进而影响其抑菌率[20]。
利用拮抗微生物的次级代谢产物是防治植物病害的一条有效途径。拮抗微生物通过分泌活性抗菌物质,作用于病原菌细胞的细胞壁或细胞膜,干扰病原菌的蛋白合成系统和能量代谢系统的正常功能,进而抑制或杀死病原菌[16]。拮抗微生物产生的次级代谢产物越多,其生物防治效果就越强[10]。有研究表明,微生物代谢产生的挥发性有机化合物(VOCs)在抑制植物病原菌生长、诱导植物产生系统抗性和对非生物胁迫的耐受性有着重要的影响[21-22]。目前,已有很多禾谷镰刀菌生防菌抗抗菌物质的研究报道,主要倾向于生防菌的次级代谢产物,但其具体的生防机制尚不明确[5,7]。杨洋[23]研究了小麦赤霉病拮抗菌解淀粉芽孢杆菌FZB42的拮抗机制,发现其主要抗菌活性物质为杆菌毒素D和泛革素两种脂肽类物质,其中杆菌毒素D可以诱导禾谷镰孢菌细胞内活性氧(ROS)的积累以及诱导细胞死亡。程超等[24]发现产酶溶杆菌OH11产生的一种热稳定抗真菌物质HSAF对小麦赤霉病菌有较强的抑制作用,不仅抑制禾谷镰刀菌孢子萌发、菌丝生长以及分生孢子产生,而且导致菌丝形态、幼殖体形态和细胞形态发生畸变,同时使病原菌细胞对环境胁迫更为敏感。郑小亮等[25]的研究也得到类似的结果,发现枯草芽孢杆菌Z1-2产生的活性蛋白使禾谷镰刀菌的菌丝形态畸形、底端膨大、抑制孢子萌发,对禾谷镰刀菌具有较强的抗菌作用。裴韬等[26]对小麦赤霉病拮抗菌枯草芽孢杆菌P72的抑菌活性进行研究,发现经0.5 M NaCl溶液洗脱得到的蛋白物质对小麦赤霉病菌的拮抗能力最强,该蛋白分子量约40 ku,且在酸性条件下稳定。Dunlap等[27]通过对小麦赤霉病拮抗菌解淀粉芽孢杆菌AS43.3的全基因组进行分析,证实了该菌能产生的伊枯草素、表面活性素、泛革素、铁载体、溶杆菌素、抗生素等抗菌活性物质,并且这些抗菌活性物质的代谢调控与对应的基因簇密切相关。周清等[28]分离得到1株小麦赤霉病高效拮抗菌株奇异变形杆菌DY05,其发酵液和无细胞上清均可显著抑制禾谷镰刀菌菌丝体生长(抑制率分别为79.50%和51.25%)和分生孢子萌发(抑制率均为100%)。本文初步明确了小麦赤霉病拮抗菌红球菌Y-1的主要抗菌活性成分为挥发性、非蛋白类物质,其对禾谷镰刀菌的抑菌率分别为57.5%和77.4%,但具体是哪一种或哪几种活性物质发挥抗菌作用尚需进一步研究。
综上所述,本研究初步明确了红球菌Y-1菌株的最佳发酵条件和其主要抑菌活性物质类型,证明了该菌株对小麦赤霉病菌具有较好的抑菌作用,为其菌剂开发及对小麦赤霉病的生物防治提供了科学依据。在下一步研究中,应加强Y-1菌株生防机理等方面的探究。

