乙型肝炎病毒X 蛋白下调微RNA-544-3p 并激活 Arf6/Akt-mTOR 信号轴促进肝脏细胞迁移和侵袭
况 钦,吴 勇,杜 彬,毋 楠,周梦瑶,杨鑫 ,卢 杨,冯 涛
重庆医科大学药学院、重庆市生化与分子药理学重点实验室,重庆 400016
HBV 感染是全球性的公共卫生问题。在我国,约85%的肝细胞癌(hepatocellular carcinoma,HCC)患者有HBV 感染史[1]。与未感染人群相比,慢性HBV 携带者患HCC 的终身风险要高15~25倍[2-3]。HBV-HCC 具有起病隐匿、病程进展迅速、缺乏治愈方法等特点,是预后极差的恶性肿瘤之一。乙型肝炎病毒X 蛋白(hepatitis B virus X protein,HBx)是HBV 发挥作用的核心功能蛋白,在HBV-HCC 的发生、发展中起着重要作用[4]。
miRNA 是一类长约19~24 nt 的内源非编码单链RNA,广泛存在于动物、植物及各种微生物中。它可以通过完全或不完全匹配的方式识别并结合靶基因的3'-非翻译区(untranslated region,UTR),发挥对靶基因的转录后调控效应,进而参与早期胚胎发育及细胞的生长、分化、凋亡等生命活动[5-6]。miRNA 的突变、缺失或表达异常与疾病的发生密切相关,参与了肿瘤的发生、发展、转移、血管生成和耐药[7-8]。研究发现,HBx 能够通过调节miRNA 影响肝癌细胞的增殖、凋亡、迁移、侵袭、自噬、炎症等多种生物学过程,从而促进HBV-HCC 的发展[9-12]。
本课题组前期利用小鼠永生化肝前体细胞构建了能够长期稳定表达HBx 且免疫系统正常的小鼠模型,且在360 d 的模型小鼠肝脏中发现了癌变组织[13-14]。本研究以miRNA 为着眼点,利用肿瘤基因组数据库资料分析肝癌组织中差异表达的miRNA,并选择性检测了miRNA-544-3p 在稳定表达HBx 的永生化肝前体细胞中和小鼠模型体内的表达情况,进一步通过干扰miRNA-544-3p 以探究细胞侵袭、迁移能力的变化和靶向调控机制,为HBV-HCC 的治疗提供新的靶点。
1 材料和方法
1.1 细胞株和小鼠小鼠永生化肝前体细胞株14-19 由美国芝加哥大学分子肿瘤研究中心惠赠,该细胞株细胞呈集落样生长,体积较小,呈多边形,核质比例高,增殖旺盛,诱导后可分化为成熟的肝细胞,且连续传代50 代细胞特性无明显改变[13]。含增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的慢病毒稳转细胞株EGFP-14-19 及 含HBx 和EGFP 的 慢 病 毒 稳 转细胞株HBx-EGFP-14-19 由本课题组前期构建并保存[13-14]。
6~8 周龄雄性昆明小鼠购于重庆医科大学实验动物中心[动物生产许可证号:SCXK(渝)2018-0003],体重25 g 左右,代养于SPF 级实验动物饲养室。
1.2 主要试剂DMEM(美国Gibco 公司);FBS[赛尔博克斯生物制品(香港)贸易有限公司];超纯总RNA 提取试剂盒、RNA 反转录试剂盒(南京诺唯赞生物科技股份有限公司);SYBR Green qPCR Mix 试剂盒(美国Bimake 公司);兔抗小鼠HBx 抗体(英国Abcam 公司);兔抗小鼠二磷酸腺苷核糖基化因子6(adenosine diphosphate ribosylation factor 6,Arf6)抗体(上海泊湾生物科技有限公司);兔抗小鼠Akt 抗体、磷酸化Akt(phosphorylated Akt,p-Akt)抗体、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 抗 体、 磷 酸 化mTOR(phosphorylated mTOR,p-mTOR)抗体及GAPDH 抗体(美国Cell Signaling Technology 公司);SDS-PAGE 凝胶配制试剂盒、HRP 标记的二抗(上海碧云天生物技术有限公司);ECL 显影液(成都正能生物技术有限责任公司);EndoFectinTM-Max 转染试剂盒(美国GeneCopoeia公司);miRNA-544-3p模拟物(mimic)、抑制剂(inhibitor)、激动剂(agomir)、拮抗剂(antagomir)及各自的阴性对照(negative control,NC)均购自上海吉荧生物技术有限公司。
1.3 细胞培养与转染将冻存于液氮的细胞取出后于37 ℃水浴中快速解冻、离心后弃上清,加入1 mL 含10% FBS 的DMEM,吹打混匀后均匀滴在无菌培养皿中,在37 ℃、5% CO2条件下培养24 h,待细胞贴壁完全后换液。当细胞融合度达80%时传代,取对数生长期的细胞用于后续实验。
将处于对数生长期的HBx-EGFP-14-19 细胞接种于6 孔板中,常规培养。待细胞融合度达80%时,更换为无血清培养基同步化12 h,随后分为空白对照组、miRNA-544-3p NC-mimic 组、miRNA-544-3p mimic 组、miRNA-544-3p NC-inhibitor 组、miRNA-544-3p inhibitor 组,其中空白对照组不进行转染,其他4 组分别进行相应的转染。所有转染均按照EndoFectinTM-Max 转染试剂盒说明书进行操作,转染24 h 后的细胞即可用于后续实验。
1.4 动物模型构建雄性昆明小鼠45 只,随机分为生理盐水组(n=5)、EGFP-14-19 组(n=5)和HBx-EGFP-14-19 组(n=35)。小鼠术前禁食12 h,腹腔注射2%戊巴比妥钠麻醉后置于超净台中,取仰卧位,腹部经乙醇消毒后在剑突下行2 cm纵向切口,打开腹腔。用湿润棉签掀起肝叶,暴露肝门静脉。按分组情况分别从肝门静脉注入生理盐水(200 μL)、EGFP-14-19 或HBx-EGFP-14-19细胞悬液(200 μL,含5×105个细胞,提前消化在PBS 中),止血完毕后,关腹缝合。术后小鼠自由饮水进食。
HBx-EGFP-14-19 模型组取20 只随机分为4 个亚 组(n=5),分 别 于 造 模 后30、90、180、360 d 腹腔注射2%戊巴比妥钠麻醉,将小鼠置于高浓度一氧化碳环境中处死。取小鼠肝脏储存于-80 ℃冰箱中,用于后续实验。
另取HBx-EGFP-14-19 组剩余15 只小鼠(于造模后30 d 处死)随机分为5 个亚组(n=3),于处死前1 周经尾静脉分别注射生理盐水、miRNA-544-3p NC-agomir、miRNA-544-3p agomir、miRNA-544-3p NC-antagomir、miRNA-544-3p antagomir。给药1 周后腹腔注射2%戊巴比妥钠麻醉小鼠,置于高浓度一氧化碳环境中处死。取小鼠肝脏储存于-80 ℃冰箱中,用于后续实验。
1.5 生物信息学分析利用TargetScan 生物信息学网站(https://www.targetscan.org/vert_72/)预测miRNA-544-3p 的靶基因。
1.6 qPCR检 测miRNA-544-3p 和 目 的 基 因 的表达 采用TRIzol 法提取细胞和小鼠肝组织中总RNA,按反转录试剂盒说明书的步骤将RNA 反转录为cDNA,使用NanoDrop 2000 超微量核酸蛋白测定仪(美国ThermoFisher 公司)进行RNA 浓度和纯度检测。引物设计与合成均由生工生物工程(上海)股份有限公司完成。引物序列:HBx正 向 引 物5'-TGCGGACGACCCTTCTCGGG-3',反 向 引 物5'-GGGCAACATTCGGTGGGCGT-3';miRNA-544-3p 正 向 引 物5'-AGGGGATTCTGCATTTTTAGC-3',反向引物5'-GTTGTGGTTGGTTGTTTGT-3';Arf6正 向 引 物5'-GTCTGATCTTCGTGGTAGACTG-3',反向引物5'-CTCATCTCCCGGTCATTGATAA-3';U6正向引物5'-AGAGAAGATTAGCATGGCCCCTG-3',反向引物5'-ATCCAGTGCAGGGTCCGAGG-3';GAPDH正 向 引 物5'-CTCGTCCCGTAGACAAAATGGT-3',反向引物5'-GAGGTCAATGAAGGGGTCGTT-3'。按照SYBR Green qPCR Mix 试剂盒说明书进行操作,每个样本设置3 个复孔。
1.7 蛋白质印迹法检测目的蛋白的表达分离细胞和小鼠肝组织中总蛋白并煮沸变性,采用BCA蛋白检测试剂盒检测蛋白浓度。每组取30 µg 蛋白进行10% SDS-PAGE 分离,然后将蛋白转移到PVDF 膜上,在脱脂奶粉溶液中封闭2 h 后,放入一抗中于4 ℃孵育过夜,再在HRP 标记的二抗中室温孵育2 h,加入ECL 显影液并在显影仪中观察目的蛋白的表达。采用ImageJ 软件进行数据分析,以GAPDH 为内参计算目的蛋白的相对表达量。
1.8 免疫组织化学法检测小鼠肝组织中HBx的表达 将新鲜肝组织浸泡于4%多聚甲醛中固定,石蜡包埋,切片后按照S-P 法进行免疫组织化学染色,光镜下观察并拍照。
1.9 H-E染色观察小鼠肝组织病理学改变 取造模后360 d 处死的小鼠肝组织,固定、切片,常规进行H-E 染色,用中性树脂封片,光镜下观察并拍照。
1.10 划痕愈合实验检测细胞的迁移能力将处于对数生长期的细胞在无血清培养基中培养12 h,用1 000 μL 枪头在培养孔中划痕,每孔划3 条。用PBS洗涤3 次以除去漂浮的细胞。分别于培养0 h 和24 h 拍照,用ImageJ 软件进行数据分析,计算细胞划痕愈合率。细胞划痕愈合率(%)=(A0h-A24h)/A0h×100%,其中A0h为0 h 时的划痕面积,A24h为培养24 h 时的划痕面积。
1.11 Transwell实验检测细胞的迁移和侵袭能力 细胞迁移实验:将处于对数生长期的细胞在无血清培养基中培养12 h,分别取2×104个细胞均匀接种于各Transwell 小室上室中(含200 μL 无血清培养基),下室加入750 μL 含20% FBS 的培养基。培养24 h 后吸去培养基,将小室放入PBS中洗涤2 次,用4%多聚甲醛室温固定20 min;用0.1%结晶紫室温染色30 min,PBS 洗涤2 次后用棉签轻轻擦去上室内的细胞。在显微镜下观察,随机选取5 个视野拍照并计数。
细胞侵袭实验:将基质胶与不含血清的培养基以1 ∶10 的比例稀释,各Transwell 小室中均加入70 μL 稀释胶,凝固后接种细胞,后续步骤同细胞迁移实验。
1.12 统计学处理采用GraphPad Prism 5.0 软件进行统计学分析。计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用最小显著性差异法。检验水准(α)为0.05。
2 结 果
2.1 小鼠永生化肝前体细胞中HBx的表达 qPCR检测结果显示,HBx-EGFP-14-19 细胞中HBxmRNA 相对表达量为11 922.37±2 496.61,高于14-19 细胞(相对表达量为0.52±1.17)和EGFP-14-19 细胞(相对表达量为0.20±0.95),差异均有统计学意义(P均<0.05)。蛋白质印迹法检测结果显示,只有HBx-EGFP-14-19 细胞中有HBx 表达(图1),证明HBx在14-19 细胞中表达成功。
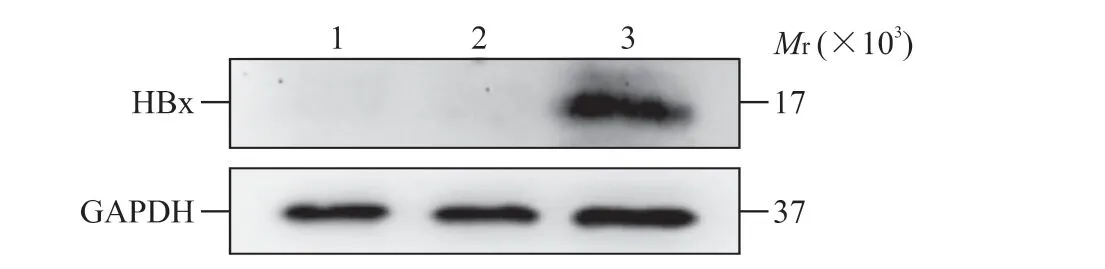
图1 蛋白质印迹法检测永生化肝前体细胞14-19 中HBx 的表达Fig 1 Expression of HBx in immortalized liver precursor cells 14-19 detected by Western blotting
2.2 动物模型的鉴定
2.2.1 小鼠肝组织中HBx的表达 qPCR 检测结果显示,HBx-EGFP-14-19 组小鼠造模后30、90、180、360 d 肝组织中HBxmRNA 相对表达量分别为94.56±43.09、211.66±37.75、176.61±61.44、170.13±97.75,均高于生理盐水组(相对表达量为0.85±0.19)和EGFP-14-19 组(相对表达量为0.93±0.25),差异均有统计学意义(P均<0.05)。蛋白质印迹法检测结果显示,HBx-EGFP-14-19 组小鼠造模后30、90、180、360 d 肝组织中均有HBx 蛋白表达(图2)。免疫组织化学染色结果显示,HBx-EGFP-14-19 组小鼠造模后30、90、180、360 d 肝组织中均可见HBx 阳性染色(图3)。上述结果表明本实验建立的小鼠模型能持续、稳定表达HBx。
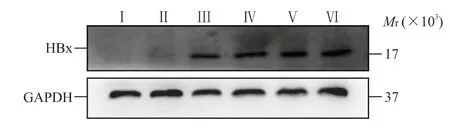
图2 蛋白质印迹法检测小鼠肝组织中HBx 的表达Fig 2 Expression of HBx in mouse liver tissues detected by Western blotting
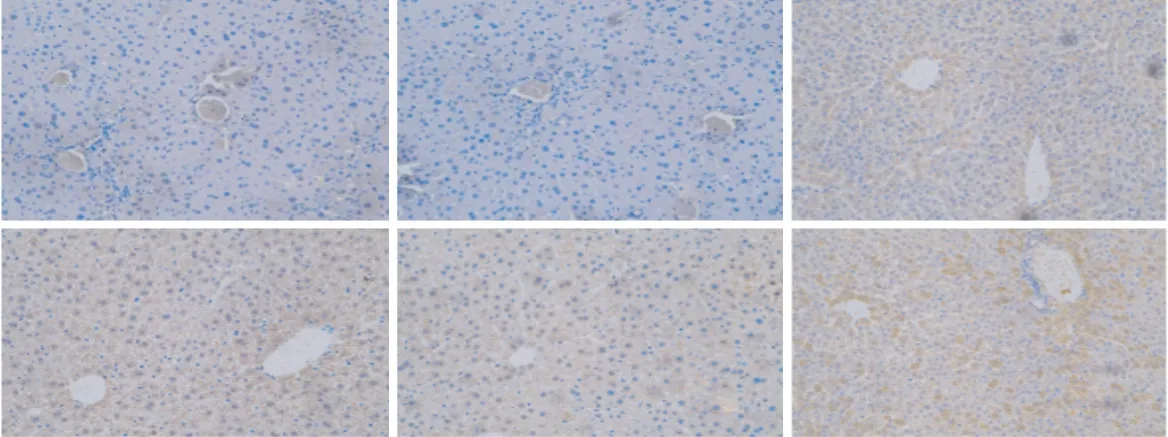
图3 免疫组织化学染色法检测小鼠肝组织中HBx 的表达Fig 3 Expression of HBx in mouse liver tissues detected by immunohistochemical staining
2.2.2 小鼠肝组织肿瘤鉴定HBx-EGFP-14-19 组小鼠造模后360 d 处死时,肝组织可见肿瘤生成(图4A)。H-E 染色结果(图4B)显示肝细胞排列异常,呈多行排列;有的细胞增大,且核仁偏大,核质分布异常,核仁明显;有的细胞呈多核,肝组织结构消失。结果表明小鼠肝组织整体呈现坏死状态,病灶处呈纤维化,证明小鼠肝脏发生恶性肿瘤病变。
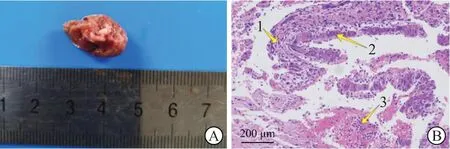
图4 小鼠肝组织肿瘤形成和H-E 染色结果Fig 4 Formation of mouse liver tumor and H-E staining results
2.3 HBx 对小鼠永生化肝前体细胞和小鼠肝组织中miRNA-544-3p表达的影响14-19 细胞、EGFP-14-19细胞和HBx-EGFP-14-19 细胞miRNA-544-3p 相对表达量分别为1.66±0.36、1.29±0.23、0.63±0.11,HBx-EGFP-14-19 细 胞miRNA-544-3p 表 达 水 平 较14-19 细胞、EGFP-14-19 细胞降低(P均<0.05)。生理盐水组、EGFP-14-19 组小鼠肝组织中miRNA-544-3p 相对表达量分别为1.31±0.31、1.27±0.36,HBx-EGFP-14-19 组 小 鼠 造 模 后30、90、180、360 d 肝组织中miRNA-544-3p 相对表达量分别为0.70±0.12、0.62±0.13、0.72±0.24、0.85±0.24,HBx-EGFP-14-19 组小鼠造模后不同时间点肝组织中miRNA-544-3p 表达均下调(P均<0.05)。结果表明HBx 可在体内外将miRNA-544-3p 的表达维持在较低水平。
2.4 HBx 对小鼠永生化肝前体细胞和小鼠肝组织中Arf6水平及Akt-mTOR通路的影响TargetScan预 测 结 果 显 示,Arf6为miRNA-544-3p 的 靶 基因。蛋白质印迹法检测结果显示,14-19 细胞、EGFP-14-19 细 胞、HBx-EGFP-14-19 细 胞 中Arf6蛋白相对表达量分别为1.06±0.05、0.91±0.04、1.88±0.14,HBx-EGFP-14-19 细 胞 中Arf6 蛋白表达上调(P均<0.05,图5A);生理盐水组、EGFP-14-19 组小鼠肝组织中Arf6 蛋白相对表达量分别为0.70±0.21、0.70±0.51,HBx-EGFP-14-19 组小鼠造模后30、90、180、360 d 肝组织中Arf6 蛋白相对表达量分别为1.09±0.37、1.27±0.69、1.11±0.11、1.10±0.25,HBx-EGFP-14-19 组小鼠造模后各时间点肝组织中Arf6 表 达 均 上 调(P均<0.05,图5B)。qPCR检测结果显示,HBx-EGFP-14-19 细胞中Arf6mRNA 相对表达量(1.02±0.05)高于14-19 细胞(0.29±0.26)和EGFP-14-19 细胞(0.30±0.30),HBx-EGFP-14-19 组 小 鼠 造 模 后30、90、180、360 d 肝组织中Arf6mRNA 相对表达量(分别为1.40±0.40、1.55±0.14、1.36±0.29、1.62±0.20)均高于生理盐水组(0.67±0.21)和EGFP-14-19组(0.73±0.11,P均<0.05)。
蛋白质印迹法结果显示,HBx-EGFP-14-19 细胞中p-Akt 蛋白相对表达量(0.86±0.19)高于14-19细胞(0.57±0.31)和EGFP-14-19 细胞(0.43±0.37)(P均<0.05),Akt 蛋白相对表达量(0.93±0.27)与14-19细胞(0.90±0.28)和EGFP-14-19细胞(0.86±0.26)相比差异均无统计学意义(P均>0.05);HBx-EGFP-14-19 细胞中p-mTOR 蛋白相对表达量(1.84±0.38)高于14-19 细胞(1.00±0.36)和EGFP-14-19 细胞(1.10±0.71,P均<0.05),mTOR蛋白相对表达量(1.17±0.26)与14-19 细胞(1.19±0.16)和EGFP-14-19 细胞(1.10±0.11)相比差异均无统计学意义(P均>0.05,图5C)。HBx-EGFP-14-19组小鼠造模后30、90、180、360 d 肝组织中p-Akt蛋白相对表达量(分别为0.60±0.37、0.73±0.50、0.68±0.44、0.82±0.49) 均 高 于 生 理 盐 水 组(0.24±0.47)和EGFP-14-19 组(0.39±0.26,P均<0.05),Akt 蛋白相对表达量(分别为0.79±0.43、0.90±0.30、0.69±0.27、0.87±0.38)与 生 理 盐 水组(0.79±0.58) 和EGFP-14-19 组(0.81±0.39)相比差异均无统计学意义(P均>0.05);HBx-EGFP-14-19 组小鼠造模后30、90、180、360 d 肝组织中p-mTOR 蛋白相对表达量(分别为1.93±0.55、2.43±0.75、2.11±0.69、1.90±0.62)均高于生理盐水组(1.25±0.41)和EGFP-14-19 组(1.09±0.57,P均<0.05),mTOR 蛋白相对表达量(分别为1.81±0.47、1.80±0.56、1.87±0.53、1.91±0.40)与 生 理盐水组(1.74±0.36)和EGFP-14-19 组(1.68±0.54)相比差异均无统计学意义(P均>0.05,图5D)。
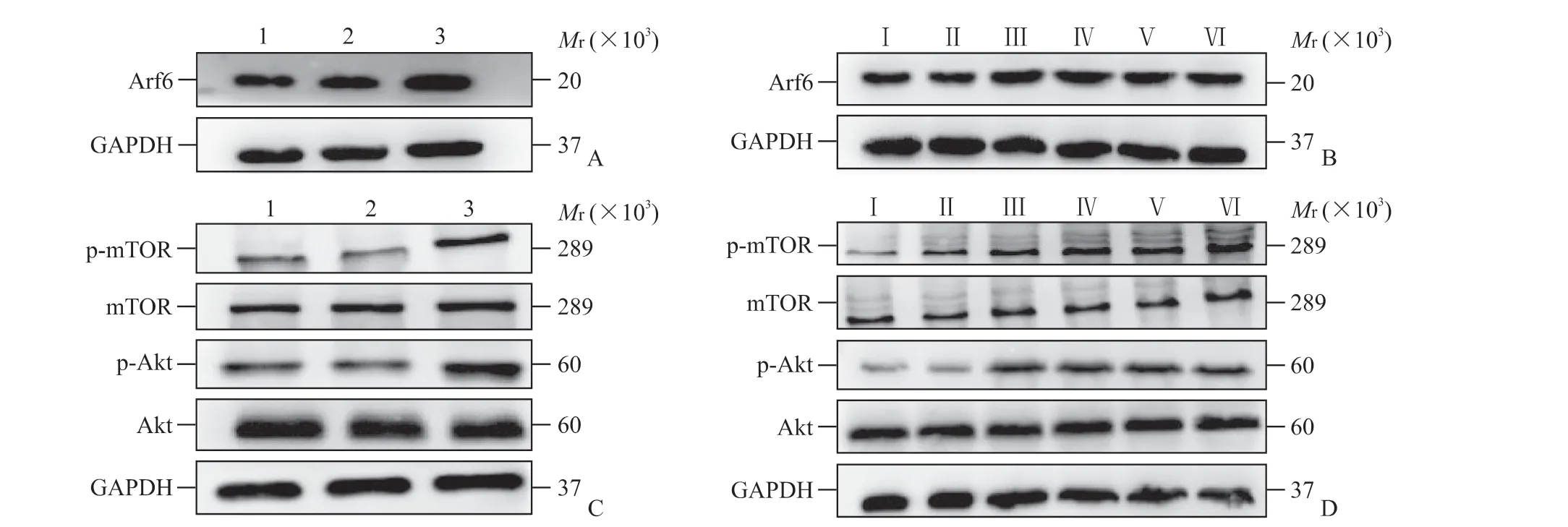
图5 蛋白质印迹法检测各组小鼠永生化肝前体细胞14-19 和小鼠肝组织中Arf6、Akt、mTOR 的表达Fig 5 Expression of Arf6, Akt, and mTOR in immortalized liver precursor cells 14-19 and liver tissues of mice in each group detected by Western blottingA: The expression of Arf6 protein in 14-19 cells; B: The expression of Arf6 protein in the liver tissues of mice; C: The expression
2.5 miRNA-544-3p转染效率 空白对照组、miRNA-544-3p NC-mimic 组和miRNA-544-3p NCinhibitor 组HBx-EGFP-14-19 细胞中miRNA-544-3p相 对 表 达 量 分 别 为0.16±0.03、0.16±0.05 和0.11±0.06;与对照组相比,miRNA-544-3p mimic组HBx-EGFP-14-19 细胞中miRNA-544-3p 相对表达量升高(4.13±2.07),miRNA-544-3p inhibitor组HBx-EGFP-14-19 细 胞 中miRNA-544-3p 相 对表达量降低(0.02±0.01,P均<0.05)。这表明转染miRNA-544-3p mimic 可上调miRNA-544-3p的表达水平,转染miRNA-544-3p inhibitor 可下调miRNA-544-3p 的表达水平。
2.6 miRNA-544-3p对HBx-EGFP-14-19 细 胞 迁 移和侵袭能力的影响 划痕愈合实验结果(图6A)显示,空白对照组、miRNA-544-3p NC-mimic 组和miRNA-544-3p NC-inhibitor 组HBx-EGFP-14-19细胞划痕愈合率分别为(59.13±8.83)%、(62.71±10.74)%、(56.59±11.25)%;与对照组相比,miRNA-544-3p mimic 组细胞划痕愈合率 降 低[(38.25±4.71)%], 而miRNA-544-3p inhibitor 组 细 胞 划 痕 愈 合 率 增 高[(80.45±20.29)%,P均<0.05]。Transwell 细胞迁移实验结果(图6B)显示,空白对照组、miRNA-544-3p NC-mimic 组 和miRNA-544-3p NC-inhibitor 组 穿 透小室滤膜的HBx-EGFP-14-19 细胞数量分别为504.33±64.49、482.33±75.87 和486.67±77.53;与对照组相比,miRNA-544-3p mimic组穿透小室滤膜的细胞数量减少(97.33±7.02),而miRNA-544-3p inhibitor 组穿透小室滤膜的细胞数量增加(823.67±23.35,P均<0.05)。Transwell 细 胞 侵 袭 实 验结果(图6B)显示,空白对照组、miRNA-544-3p NC-mimic 组和miRNA-544-3p NC-inhibitor 组穿透基质胶与小室滤膜的HBx-EGFP-14-19 细胞数量分别为221.67±14.22、226.00±11.53 和223.33±11.37;相较于对照组,miRNA-544-3p mimic 组穿透基质胶与小室滤膜的细胞数量减少(40.33±4.04),而miRNA-544-3p inhibitor 组穿透基质胶与小室滤膜的细胞数量增加(384.00±29.87,P均<0.05)。
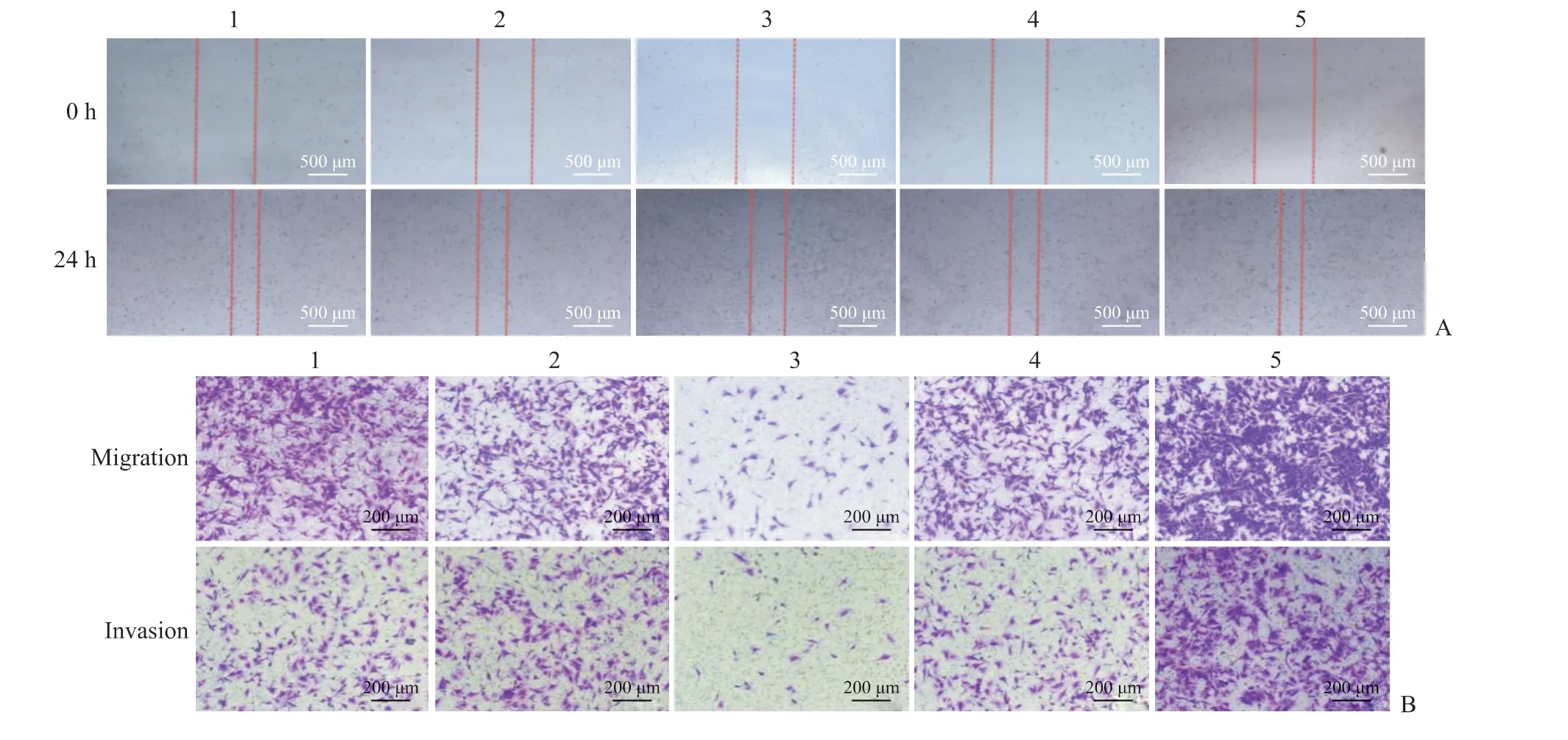
图6 各组HBx-EGFP-14-19 细胞的迁移和侵袭能力检测Fig 6 Detection of migration and invasion abilities of HBx-EGFP-14-19 cells in each group
2.7 miRNA-544-3p对HBx-EGFP-14-19 细胞中Arf6水平及Akt-mTOR 通路的影响 qPCR 检测结果显示,空白对照组、miRNA-544-3p NC-mimic 组、miRNA-544-3p mimic 组、miRNA-544-3p NCinhibitor 组、miRNA-544-3p inhibitor 组Arf6mRNA相对表达量分别为1.01±0.24、0.99±0.12、0.53±0.06、0.91±0.16、1.54±0.03,相较于对照组,miRNA-544-3p mimic 组Arf6mRNA 相对表达量降低,而miRNA-544-3p inhibitor 组Arf6mRNA 相对表达量增加(P均<0.05)。空白对照组、miRNA-544-3p NC-agomir 组、miRNA-544-3p agomir 组、miRNA-544-3p NC-antagomir 和miRNA-544-3p antagomir 组Arf6mRNA 相对表达量分别为1.57±0.16、1.46±0.21、0.69±0.06、1.67±0.06、2.67±0.13,相较于对照组,miRNA-544-3p agomir组Arf6mRNA 相对表达量降低,而miRNA-544-3p antagomir组Arf6mRNA相对表达量增加(P均<0.05)。
蛋白质印迹法检测结果显示,空白对照组、miRNA-544-3p NC-mimic 组、miRNA-544-3p mimic组、miRNA-544-3p NC-inhibitor 组和miRNA-544-3p inhibitor 组Arf6 蛋白相对表达量分别为0.98±0.06、1.15±0.10、0.64±0.10、1.37±0.12、2.09±0.17(图7A),相较于对照组,miRNA-544-3p mimic组Arf6 蛋白相对表达量降低,而miRNA-544-3p inhibitor 组Arf6 蛋白相对表达量增加(P均<0.05);空白对照组、miRNA-544-3p NC-agomir 组、miRNA-544-3p agomir 组、miRNA-544-3p NCantagomir 组 和miRNA-544-3p antagomir 组Arf6 蛋白相对表达量分别为2.54±0.24、1.89±0.23、1.18±0.24、1.68±0.18、4.14±0.63(图7B),相较于对照组,miRNA-544-3p agomir 组Arf6 蛋白相对表达量降低,而miRNA-544-3p antagomir 组Arf6蛋白相对表达量增加(P均<0.05)。
蛋白质印迹法检测结果显示,空白对照组、miRNA-544-3p NC-mimic 组、miRNA-544-3p mimic 组、miRNA-544-3p NC-inhibitor 组和miRNA-544-3p inhibitor 组p-Akt 蛋白相对表达量 分 别 为0.61±0.11、0.70±0.22、0.29±0.07、0.71±0.51、1.11±0.19,Akt 蛋白相对表达量分别 为0.74±0.18、0.77±0.15、0.97±0.12、1.07±0.14、0.81±0.19,p-mTOR 蛋白相对表达量分别为0.48±0.12、0.60±0.12、0.22±0.09、0.43±0.15、1.16±0.16,mTOR 蛋白相对表达量分别为0.64±0.03、0.68±0.12、0.75±0.14、0.63±0.14、0.99±0.11(图7C)。相较于对照组,miRNA-544-3p mimic组p-Akt和p-mTOR的表达均降低,而miRNA-544-3p inhibitor 组p-Akt 和p-mTOR 表达均增加(P均<0.05);各组间Akt 蛋白和mTOR 蛋白的表达差异均无统计学意义(P均>0.05)。空白对照组、miRNA-544-3p NC-agomir 组、miRNA-544-3p agomir 组、miRNA-544-3p NC-antagomir 组 和miRNA-544-3p antagomir 组p-Akt 蛋 白 相 对 表 达量 分 别 为0.75±0.15、0.71±0.15、0.42±0.13、0.81±0.15、1.56±0.21,Akt 蛋白相对表达量分别为0.83±0.15、0.89±0.11、0.96±0.15、1.07±0.17、1.15±0.25,p-mTOR 蛋白相对表达量分别为0.74±0.13、0.86±0.15、0.50±0.16、0.89±0.12、1.27±0.23,mTOR 蛋白相对表达量分别为0.93±0.15、1.16±0.14、1.02±0.08、1.09±0.17、1.26±0.11(图7D)。相较于对照组,miRNA-544-3p agomir组p-Akt、p-mTOR 的表达均减少,而miRNA-544-3p antagomir 组p-Akt、p-mTOR 的表达均增加(P均<0.05);各组间Akt 蛋白和mTOR 蛋白的表达差异均无统计学意义(P均>0.05)。上述结果表明miRNA-544-3p 对Arf6/Akt-mTOR 信 号 轴 有 调 控作用。

图7 蛋白质印迹法检测各组HBx-EGFP-14-19 细胞中Arf6、Akt、mTOR 的表达Fig 7 Expression of Arf6, Akt, and mTOR in HBx-EGFP-14-19 cells of each group detected by Western blotting
3 讨 论
作为许多基因的转录后调节因子,miRNA 调控了癌症的发生、发展、转移等多个过程,如癌细胞分化、增殖、凋亡、迁移、侵袭、血管生成等。现已发现miRNA-544 在多种癌症中表达异常,如骨髓瘤[15]、结直肠癌[16]、宫颈癌[17]、乳腺癌[18-19]等,这提示miRNA-544 与癌症存在着一定程度的关联。Chen 等[15]研究指出,miRNA-544 在促进骨髓瘤细胞增殖中发挥了十分重要的作用,它通过直接调控靶基因轴抑制因子2(axis inhibition protein 2,AXIN2)的表达参与骨髓瘤的发生。Yao 等[16]研究发现,miRNA-544 在结直肠癌细胞系和癌组织中过表达使靶基因叉头框蛋白O1(forkhead box O1,FOXO1)的表达增加,进而促进结直肠癌细胞的增殖和侵袭。Mao 等[17]研究表明,靶基因酪氨酸3/色氨酸5 单加氧酶激活蛋白ζ(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein ζ,YWHAZ)表达的降低所引发的效应是miRNA-544 发挥细胞周期调控和抑制宫颈癌细胞增殖、迁移和侵袭作用的核心因素。以上研究结果表明,miRNA-544 在不同类型的癌症中特异性靶向不同基因,从而参与多种不同类型癌症的生理、病理进程,发挥了癌基因样或抑癌基因样作用。本研究结果显示,miRNA-544-3p 在HBx存在时呈下调趋势,将miRNA-544-3p mimic 或miRNA-544-3p inhibitor 转染到HBx-EGFP-14-19 细胞,实验结果提示miRNA-544-3p 能够抑制细胞迁移和侵袭。本研究通过TargetScan 生物信息学网站预测miRNA-544-3p 的靶基因,并通过实验验证了Arf6可能为miRNA-544-3p 的功能靶基因。
Arf6 是Ras 超家族中的1 个小GTP 酶结合蛋白,广泛存在于人体肝脏、胃、乳腺、前列腺等组织器官中,参与调控囊泡的形成和运输、细胞分裂与黏附、肌动蛋白细胞骨架的重组等,并与肿瘤细胞的生长、迁移和侵袭密切相关[20]。研究发现,Arf6 在多种恶性肿瘤中异常高表达,如胰腺癌[21]和 乳 腺 癌[22]。目 前 关 于Arf6 与HCC 相 关 的 研究报道较少。Wang 等[23]研究发现,Arf6 在HCC细胞系和人HCC 组织中高表达,但其作用机制尚不清楚。有学者指出,Arf6 通过作用于一系列细胞迁移和侵袭相关的下游通路,导致细胞迁移和侵袭能力改变并最终引发肿瘤[24]。Hashimoto等[21]指出Arf6 是Akt-mTOR 通路的上游调控因子,还有研究表明HBx 通过激活Akt-mTOR 信号通路促进了肝癌的发生、发展[25-26]。本研究结果表明,Arf6 在HBx 存在时呈上调趋势;上调或下调miRNA-544-3p 后Arf6 及Akt-mTOR 通 路 发 生变化,提示miRNA-544-3p 可能靶向调控Arf6 并影响Akt-mTOR 通路。
综上所述,本研究结果表明miRNA-544-3p 可能通过调控Arf6/Akt-mTOR 信号轴在HCC 发生和转移中发挥抑制作用。但是,miRNA 与靶基因的关系是一个复杂的网络调控系统,同一种miRNA 可调控多个靶基因和多个信号通路,同一个靶基因也可受多种miRNA 共同调节,miRNA-544-3p 对其他基因的调控作用值得进一步深入研究。值得一提的是,本研究首次在动物体内以动态监测的方式考察了从HBx 感染到HCC 发生过程中miRNA-544-3p 表达水平的变化,并进一步探讨了miRNA-544-3p 在感染HBx过程中的功能和意义,为HBV-HCC的预测、治疗及预后研究提供了具有应用价值的新方向,也为HBV-HCC 的生物治疗提供了新的作用靶点。

