灭多威在小球藻-大型溞-斑马鱼食物链中的传递特征
陈锋,孟顺龙,陈家长,裘丽萍,范立民,宋超,郑尧,李丹丹,胡庚东
(1.上海海洋大学 水产科学国家级实验教学示范中心,农业农村部淡水水产种质资源重点实验室,农业农村部鱼类营养与环境生态研究中心,上海 201306; 2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081)
灭多威(methomyl)别名灭多虫,是一种常用的高毒性杀虫剂[1],其通过触杀作用杀虫,已被广泛应用于农林业生产。然而,灭多威因生产上使用过于频繁,对环境产生极大的危害[2]。灭多威可通过地表径流方式释放到水体中,造成水环境污染[3]。由于灭多威在土壤中具有强流动性、高水溶性等特性,容易污染周围水体,特别是地下水,并威胁人类饮水安全[4]。对中国浙江省 2010年的调查显示,超过10 个市级水源地被检测出存在灭多威残留,残留浓度最高值可达0.172 μg/L[5],甚至有研究发现,在田头水渠检测出高达 650 μg/L的灭多威[6]。在国外,灭多威残留已在多个国家的地表水中被检测出,20 世纪80年代,灭多威残留在美国地表水中被检出,残留最大值达 2 μg/L[7]。1997年世界野生动物基金会将灭多威列为环境内分泌干扰物(environmental endocrine disruptors,EDCs)[8]。EDCs会干扰生物的生殖功能,从而导致生殖障碍[9]。灭多威主要作用于乙酰胆碱酯酶,可抑制其活性,并导致神经组织衰竭,从而杀死昆虫,其具有迅速、作用力强等特点,长期接触灭多威,可导致动物的肝毒性、细胞毒性和神经毒性[10-12]。
作为水生态系统初级生产者的微藻,是监测和评价水环境质量的重要指标[13]。浮游动物常以微藻为食,是水环境的初级消费者。大型溞Daphniamagna作为浮游动物中最常见的模式生物,是水环境食物链传递的枢纽[14]。鱼类是生态环境中不可或缺的部分,而斑马鱼Daniorerio是一种最常见的并以浮游动物为食的鱼类,是水环境的次级消费者[15]。目前,食物链富集研究已引起许多研究人员的关注, Chen等[16]研究发现,通过食物摄入方式,C60可从大型溞转移到斑马鱼体内,并在斑马鱼的肠道产生富集。Rehman等[17]研究发现,砷可以通过食物链低营养级传递到人类体内并产生富集,其富集量是通过水暴露摄入的几倍,严重危害人类身体健康安全。此外,关于水中微塑料食物链传递研究发现,随着食物链的转移,处于食物链顶端的人类体内的微塑料会发生生物累积[18]。然而,目前国内外相关研究只是关注灭多威对水生生物的急性毒性、慢性毒性等危害,忽略了其在水生态系统的食物链传递,而灭多威在食物链传递中是否有生物放大效应,这对食物链顶端的人类生命具有借鉴意义。
本研究中,以普通小球藻Chlorellavulgaris、大型溞和斑马鱼为研究对象,通过食物链普通小球藻-大型溞-斑马鱼传递和水体暴露传递两种途径,测定灭多威在这些生物体内的富集含量,探究灭多威从低营养级到高营养级水生生物的富集能力,以及食物链的生物放大效应,以期评估灭多威沿食物链进行的富集和传递能效,了解灭多威在食物链的传递规律。
1 材料与方法
1.1 材料
试验用普通小球藻藻种由中国科学研究院水生生物所提供,保存于BG-11培养基中。大型溞由广东省实验动物检测所提供。斑马鱼购自上海费曦生物科技有限公司,体质量为(0.26±0.05)g,体长为(2.8±0.3)cm,共1 000尾。灭多威为质量分数大于97%的灭多威原药(上海焦点生物技术有限公司),本试验中所示质量浓度均指药物的有效成分含量。
超高效液相色谱/质谱仪(Waters,美国马萨诸塞州),液相色谱条件:色谱柱为ACQUITY UPLC BEH C18 column(2.1 mm×100 mm,1.7 μm);流动相乙腈与水的体积比为80∶20;进样体积为2 μL,进样速度为0.3 mL/min。质谱条件:毛细管电压为3.5 kV,锥孔电压为30 V,离子源温度为450 ℃;脱溶剂气温度为450 ℃,脱溶剂气流速为800 L/h,锥孔气流速为50 L/h。
1.2 方法
1.2.1 藻种的培养 将普通小球藻置于光照培养箱中培养,每天摇瓶3次。培养温度为 (25±1)℃,光照度为1 000 lx,光周期为12 h∶12 h。定期镜检,确保藻种纯正、无污染。
1.2.2 大型溞的培养 大型溞采用稀释水培养基培养[19]。每天定时投喂普通小球藻,培养温度为(22±1)℃,光照度为1 000 lx,光周期为16 h∶8 h。
1.2.3 斑马鱼的培养 以活性炭过滤曝气48 h以上的自来水作为斑马鱼培养用水,光照度为 1 000 lx,pH 7,温度为25 ℃,光周期为16 h∶8 h。将购买的斑马鱼驯化2周后,选择健康活泼的斑马鱼进行试验。驯化期间每天8:00和17:00定时投喂大型溞2次(2次的总投饵量为鱼体质量的5%)。试验前1 d停止投喂。
1.2.4 普通小球藻对灭多威的生物富集试验 设置0 μg/L(对照组)、2 μg/L(低浓度)、10 μg/L(中浓度)、50 μg/L(高浓度)4个灭多威浓度组(均为质量浓度,下同),将指数生长期的普通小球藻分别接种在含不同灭多威浓度的培养基中,每个浓度组使用9个盛有混合均匀的100 mL藻液的锥形瓶。藻细胞初始浓度均为1×105cells/mL,培养96 h后,将每个浓度处理组分成3个小组,一组用于测定藻液的灭多威富集量,其他两组用于大型溞的摄食试验。分别于培养的1、24、48、72、96 h时取藻液,使用超高效液相色谱/质谱仪测定小球藻培养液和藻细胞中的灭多威含量。
1.2.5 大型溞对灭多威的生物富集试验 试验设置3个灭多威直接暴露组、3个灭多威暴露藻液投喂组和1个对照组(不含灭多威)共7组,每组设置3个平行。选取出生24 h内的大型溞放入500 mL的烧杯中培养,每个烧杯盛稀释水300 mL和大型溞约1.5 g,共培养9 d。
灭多威暴露藻液投喂组:选用“1.2.4节”中经2、10、50 μg/L灭多威暴露处理96 h的普通小球藻藻液作为3个处理组大型溞的饵料,取 20 mL 浓度为 2×105cells/mL 的小球藻液,以 8 000 r/min 离心 5 min后,取浓缩藻液投喂。
灭多威直接暴露组:3个处理组水体中分别加入质量浓度为2、10、50 μg/L的灭多威,并定时给大型溞投喂不含灭多威的普通小球藻藻液,投喂密度与灭多威暴露藻液投喂组保持一致。
对照组:投喂不含灭多威的普通小球藻藻液给大型溞。
在试验进行的第3、6、9天时,用筛网从每个平行捞取30只大型溞,使用超高效液相色谱/质谱仪测定大型溞体内的灭多威富集量。
大型溞对灭多威暴露藻液的摄食率试验:试验设4组,分别投喂经0、2、10、50 μg/L灭多威暴露处理96 h的普通小球藻藻液,每组设3个平行,每个平行10只大型溞,培养于30 mL的稀释水中,试验期间每天更换培养液,并再次投喂相同量的用2、10、50 μg/L灭多威处理96 h后的普通小球藻藻液,投喂浓度为2×105cells/mL,并设置空白对照,投喂不含灭多威的普通小球藻。在试验的第2、4、6、8天换水前,测定大型溞对灭多威暴露普通小球藻的摄食率。
1.2.6 斑马鱼对灭多威的生物富集试验 参照GB/T 31270.7—2014,采用半静态法,即试验过程中斑马鱼所在水体每24 h更换一次,水温为(20±1)℃,溶解氧为6.5~7.0 mg/L,pH为7.0~7.5。试验设置3个灭多威暴露投喂组、3个灭多威直接暴露组和1个空白对照组共7组,每组设3个平行,每个平行放10尾健康的斑马鱼。
灭多威暴露投喂组:3个处理组分别用“1.2.5节”中经2、10、50 μg/L灭多威暴露藻液投喂处理9 d的大型溞作为斑马鱼的饵料,每天 8:00和17:00投喂,2次的总投饵量按斑马鱼体质量的4%计算。
灭多威直接暴露组:3个处理组养殖水体中分别加入质量浓度为2、10、50 μg/L的灭多威,并定时给斑马鱼投喂不含灭多威的大型溞,投喂方法同投喂组。
对照组:斑马鱼养殖水体和饵料(大型溞)中均不含灭多威。
在试验进行的第4天时取出斑马鱼,使用超高效液相色谱/质谱仪测定斑马鱼体内的灭多威富集量。
1.2.7 指标的测定与计算
1)培养液中的灭多威含量。普通小球藻培养液、藻细胞表面和藻细胞内部灭多威含量的测定参考文献[20]中的方法。
先取经灭多威暴露处理的小球藻藻液2 mL,以7 000 r/min 离心10 min,收集上清液1 mL,加入3 mL二氯甲烷;然后以2 000 r/min涡旋振荡 30 s,静置10 min,提取分离下层液体后置入棕色玻璃瓶,重复提取3次,合并提取液;最后用氮气吹干后加入流动相定容至1 mL。
2)藻细胞表面吸附的灭多威量。先取小球藻藻液2 mL,以7 000 r/min 离心10 min后收集普通小球藻,加入1.5 mL体积分数为10%的甲醇溶液,以2 000 r/min涡旋振荡30 s,洗脱藻体表面的灭多威;然后离心5 min,吸取1 mL上清液至进样瓶中;最后用氮气吹干后加入流动相定容至1 mL。
3)藻细胞内部灭多威含量。取普通小球藻2 mL,用甲醇洗涤3次,去除藻细胞表面吸附的灭多威,-20 ℃下反复冻融3次,加入2 mL二氯甲烷和甲醇的混合液(二者体积比为1∶2),以 2 000 r/min涡旋振荡30 s后,提取藻细胞内的灭多威;然后以7 000 r/min 离心10 min,收集上清液至棕色玻璃瓶中,重复提取3次,合并提取液;最后用氮气吹干,加入流动相定容至1 mL。
4)藻类对灭多威的生物富集系数(bioconcentration factor,BCF)。计算公式为
BCF=1 020×Cm/Ci。
(1)
其中:Cm为藻细胞内灭多威含量(μg/g);Ci为培养液中灭多威的初始质量浓度(μg/L);灭多威溶液的密度为1 020 g/L[20-21]。
5)大型溞对普通小球藻的摄食率(GR)。计算公式[22]为
GR=FR×(Ntf-N0)/ (lnNtf-lnN0),
(2)
FR=V/N×(lnNt-lnN0)/t。
(3)
其中: GR为每只大型溞单位时间内过滤的饵料细胞数[cells/(h·ind.)]; FR为水样中大型溞个体在单位时间内滤过的水样量[mL/(h·ind.)];V为大型溞培养液体积(mL);N为每个处理组中浮游动物数(ind.);N0为投喂饵料密度(cells/mL);Nt为对照组中的最终饵料密度(cells/mL);Ntf为处理组中的最终饵料密度(cells/mL)。
6)大型溞体内灭多威含量。取30只大型溞,用超纯水清洗大型溞3次,每次各1 min,用滤纸吸干外壳表面的液体,将大型溞干燥后称重,随后研磨大型溞,以2 mL正己烷和二氯甲烷的混合液(二者体积比为1∶1) 为萃取液,萃取20 h。用超声波清洗机萃取30 min 后,用氮吹仪装置吹干,再加入0.5 mL 的流动相,摇匀至定容,上机测定大型溞体内的灭多威含量。
7)斑马鱼体内灭多威含量。称取1.5 g的鱼体样品,放入50 mL的离心管中,加入10 mL体积分数为0.1%的甲酸乙腈提取液,振荡混匀,以 2 000 r/min涡旋振荡10 min,以10 000 r/min离心5 min;取5 mL离心后的上清液,放入已经用5 mL超纯水活化后的Agilent Bond EMR-Lipid增强型脂质去除净化管中,以2 000 r/min涡旋振荡5 min,以4 000 r/min离心5 min;将离心后的上清液全部转入含有1.7 g EMR-Lipid Polish MgSO4的离心管中,以2 000 r/min涡旋振荡5 min,以4 000 r/min离心5 min;取有机相(上层)过0.22 μm有机相滤膜,置于10 mL离心管中,上机测定斑马鱼体内的灭多威含量。
8)灭多威从低营养级到高营养级传递的生物放大系数(biomagnification factor,BMF)。计算公式[23]为
BMF=Ca/Cb。
(4)
其中:Ca、Cb分别为高、低营养级生物体内的灭多威富集量(μg/g)。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,采用SPSS 13.0软件对试验数据进行单因素方差分析(one way-ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 普通小球藻对灭多威的生物富集效应
从图1可见:在小球藻培养液中分别添加2、10、50 μg/L灭多威后,培养液中的灭多威含量均呈现迅速降低的趋势;高浓度灭多威组(50 μg/L)在1~24 h时降低幅度最大,其次为中浓度灭多威组(10 μg/L)。

图1 不同浓度灭多威在小球藻培养液中96 h的变化Fig.1 Changes in methomyl with different concentrations in Chlorella culture medium for 96 h
从图2可见:高浓度和中浓度灭多威组藻细胞内部的灭多威含量在24 h时迅速增加并达到最大值,分别为426.47、87.78 μg/g,随着暴露时间的延长,藻细胞内部灭多威含量呈快速降低趋势;而低浓度灭多威组则在72 h时达到最大值,灭多威含量为 33.28 μg/g。从图3可见:高浓度和低浓度灭多威组藻细胞表面灭多威含量在24 h时达到最高值,之后随着暴露时间的延长,灭多威含量呈快速降低趋势;而中浓度灭多威组随着暴露时间的延长,灭多威含量一直呈快速降低趋势。
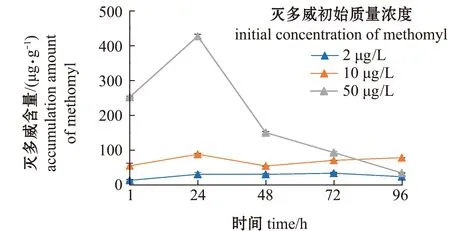
图2 不同浓度灭多威在藻细胞内部96 h的变化Fig.2 Changes in methomyl with different concentrations in alga cells for 96 h

图3 不同浓度灭多威在藻细胞表面96 h的变化Fig.3 Changes in methomyl with different concentrations on the surface of algae cells for 96 h
从图4可见:普通小球藻对灭多威具有特别强的富集作用,低浓度灭多威组在1~96 h时,BCF呈先增大后减少的变化趋势,在72 h 时BCF值达到最大值(17 549.99);中浓度灭多威组在1~24 h时,BCF呈逐渐增大的趋势,并在24 h时达到最大值(9 108.83),之后BCF呈先降低后升高的趋势;高浓度灭多威组在1~24 h时,BCF呈逐渐增大趋势,在24 h时达到最大值(8 768.40),之后BCF呈逐渐降低的趋势。
2.2 大型溞对灭多威暴露藻液中小球藻的摄食率
从图5可见:在各时间点,随着灭多威浓度的增大,灭多威暴露藻液投喂组大型溞的摄食率均呈显著性下降趋势(P<0.05);高浓度投喂组在第4天时摄食率为0.45×104cells/(h·ind.),显著低于其他3组(P<0.05),且在前6 d的摄食率较其他组均为最低;中浓度投喂组在第8天时摄食率最低,为0.05×104cells/(h·ind.),显著低于低浓度和对照组(P<0.05);试验过程中,低浓度投喂组大型溞的摄食率显著低于对照组(P<0.05),但总体上显著高于其他2个浓度组(P<0.05)。灭多威暴露于普通小球藻后,大型溞摄食率有着特别明显的变化,这表明经灭多威暴露后的小球藻对大型溞的摄食具有较大的抑制效果。
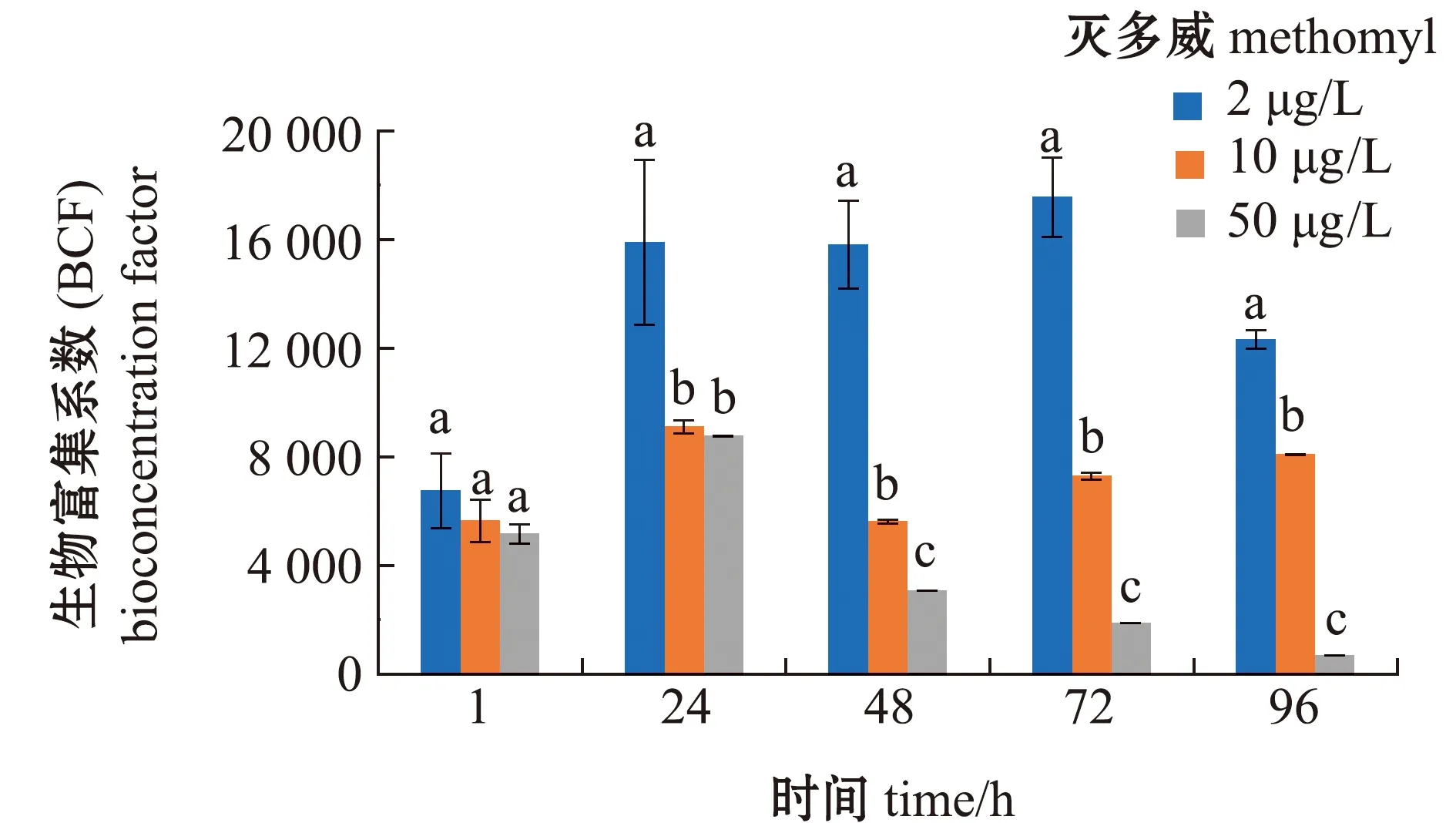
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters in same time are significant differences in different groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.图4 普通小球藻对灭多威的生物富集系数Fig.4 Bioconcentration factors of methomyl in green alga Chlorella vulgaris

图5 灭多威对大型溞摄食率的影响Fig.5 Effects of methomyl on grazing rate of water fleas Daphnia magna
2.3 灭多威在大型溞中的富集量
从图6可见:3个投喂组中,随着投喂时间的延长,高浓度灭多威暴露藻液投喂组大型溞体内的灭多威富集量逐渐升高,并在第9天时达到最大值,富集量达6.02 μg/g,中浓度和低浓度组富集量则逐渐降低,均在第3天时达到最大值;而3个灭多威直接暴露组中,随着暴露时间的延长,大型溞体内的灭多威富集量逐渐降低,在暴露3 d后,灭多威最大富集量为1.4 μg/g;灭多威直接暴露组大型溞的灭多威最大富集量远小于投喂组的最大值。这表明,大型溞体内的灭多威富集大部分是通过摄食含灭多威的小球藻,从水环境中只能富集少量灭多威。
从表1可见:用灭多威暴露藻液投喂大型溞9 d后,灭多威经普通小球藻传递到大型溞体内并积累,其BMF最大值出现在高浓度灭多威暴露藻液投喂组(0.177 0),未存在生物放大效应;中浓度、低浓度投喂组BMF值更低,均未出现生物放大现象。

图6 大型溞体内的灭多威富集量Fig.6 Accumulation amount of methomyl in the water fleas Daphina magna

表1 不同浓度灭多威通过食物传递在小球藻-大型溞体内的积累
2.4 灭多威在斑马鱼中的富集量
从图7可见:用经过灭多威(2、10、50 μg/L)暴露藻液处理9 d的大型溞投喂斑马鱼,4 d后,高浓度投喂组斑马鱼体内灭多威富集量最大值为0.12 μg/g,低浓度和中浓度投喂组中,斑马鱼体内灭多威富集量十分相近,高浓度投喂组斑马鱼体内灭多威富集量显著高于低浓度和中浓度投喂组(P<0.05),分别为低浓度和中浓度投喂组的 2.2倍和2.7倍;而在斑马鱼直接暴露组中,经过4 d水体灭多威暴露,随着暴露水体灭多威浓度的增加,斑马鱼体内灭多威富集量增加,其最大值为0.72 μg/g,且显著高于投喂组(P<0.05)。
从表2可见,用经过灭多威暴露藻液处理9 d的大型溞投喂斑马鱼,4 d后,灭多威经大型溞传递到斑马鱼体内并积累,其BMF最大值(5.00)出现在低浓度投喂组,有生物放大效应,BMF最低值(0.02)出现在高浓度投喂组,中浓度、高浓度投喂组无生物放大效应,即灭多威大型溞的浓度越大,大型溞斑马鱼的BMF值就越小。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences.图7 斑马鱼体内的灭多威富集量Fig.7 Accumulation of methomyl in zebrafish Danio rerio

表2 不同浓度灭多威通过食物传递在大型溞-斑马鱼体内的积累
3 讨论
3.1 普通小球藻对灭多威的生物富集效应
微藻在尾水处理方面具有显著效果[24],水体中无机物和有机物均可被微藻富集[25]。本研究中发现,普通小球藻培养液中添加2、10、50 μg/L灭多威后,培养液中灭多威含量均呈现迅速降低的趋势,尤其高浓度灭多威组在1~24 h时降低幅度最大。培养液中初始添加的灭多威浓度越高,小球藻对灭多威的去除率就越高,最高去除率达到58%,这与Zhou等[26]在5 d内去除壬基酚效率为58.3%的结论接近。随着灭多威暴露时间的延长,小球藻培养液中灭多威含量逐渐降低,这可能是由于小球藻生物量的增加,大量的灭多威被小球藻吸附到藻细胞内[27]。而在48 h后培养液中灭多威含量趋于稳定,这说明小球藻只能在短时间内有去除灭多威的能力,这可能是由于藻细胞浓度呈指数增加,导致水体中阴影面积增大,光照强度减弱,进而导致灭多威无法进一步降解[27]。
本试验中,低浓度和中浓度灭多威组小球藻在96 h的试验周期内,藻细胞内部灭多威含量的曲线变化不大,而高浓度灭多威组在96 h的试验周期内,藻细胞内部灭多威含量的曲线变化幅度较大(图2)。孙凯峰等[28]研究发现,随着0.1 mg/L壬基酚暴露时间的延长,藻细胞吸收壬基酚的含量呈降低趋势,与本试验中高浓度灭多威组藻细胞内部吸收灭多威的变化趋势一致。
本试验中,普通小球藻对灭多威具有较强的富集作用,灭多威浓度越低,小球藻对灭多威的富集作用越强,其中,BCF最大值(17 549.99)出现在72 h时的低浓度灭多威组,而BCF最低值(698.00)则出现在96 h的高浓度灭多威组,到试验后期,随着灭多威浓度的增加,小球藻的BCF值逐渐减少,这可能是由于灭多威浓度较大,很大程度上抑制了藻细胞的生长,从而导致小球藻富集灭多威含量减少。侯云等[29]研究报道,小球藻随着壬基酚暴露浓度的增加,BCF值逐渐减小,抑制了藻细胞的生长,壬基酚暴露浓度与BCF的关系和本试验中报道的灭多威暴露浓度与BCF的关系相一致。
3.2 普通小球藻-大型溞-斑马鱼对灭多威的富集传递效应
本试验中,水环境中,污染物的生物富集和食物链传递是普遍存在的[30]。Taylor等[31]研究表明,重金属在食物链中存在生物放大效应。Rasmussen等[32]也发现,微藻-大型溞-鱼三级食物链的多溴联苯(PCB)能够发生生物放大。小球藻对许多污染物都有较强的富集能力,而大型溞以小球藻为食,可以形成小球藻-大型溞的食物链传递。本研究中发现,小球藻富集灭多威的能力较强,且可以通过摄食过程将灭多威传递到大型溞。同时,大型溞还可通过水环境中获取少量的灭多威。Juei等[33]发现, 从浮游植物到水生动物的多溴联苯500 mg/L(高浓度组),经过4 d的富集后,浮游动物体内的多溴联苯富集可达318.81 mg/L,不存在生物放大效应。与此相似,本试验中经灭多威暴露藻液投喂的大型溞,随着小球藻投喂时间的延长,高浓度灭多威投喂组(50 μg/L)大型溞体内的灭多威富集量最高(6.02 μg/g),高浓度投喂组大型溞的BMF值为0.177 0,也不存在生物放大效应。在投喂 9 d后,随着摄入小球藻浓度的增大,大型溞的BMF值随之增大(表1)。据Kannan等[34]研究发现,污染物发生生物放大效应与自身的理化性质有关,因此,大型溞是否会发生生物放大效应可能与摄入的小球藻的浓度有关。大型溞体内灭多威富集量与大型溞的摄食率也有一定关系,大型溞在高浓度投喂组的摄食率与对照组相比有显著性下降,说明在一定程度上排斥摄食有毒的灭多威小球藻。Mohamed等[35]发现,水蚤Daphnia优先以无毒绿藻和硅藻为食,而有毒的蓝藻铜绿微囊藻Microcystisaeruginosa是待无毒藻类都摄食尽才会选择摄食。本试验中,高浓度投喂组大型溞最后体内灭多威富集量较高的原因,可能是由于投喂时间久,大型溞被迫摄食有毒的小球藻,加上大型溞无法将有毒灭多威代谢和排泄出去,导致高浓度组大型溞体内灭多威含量较高[36]。
本试验中,关于灭多威在大型溞-斑马鱼食物链的传递特征表明,中浓度和高浓度投喂组中斑马鱼体内灭多威富集量远小于同浓度的灭多威直接暴露组。Zhu等[23]研究表明,投喂经TiO2暴露后的大型溞给斑马鱼,与斑马鱼水体暴露组相比,同浓度投喂组斑马鱼体内TiO2的富集量比水体暴露组低。本试验中,在投喂大型溞4 d后,灭多威从大型溞传递到斑马鱼体内,其BMF最大值(5.00)出现在低浓度投喂组,存在生物放大效应,而在中浓度、高浓度投喂组则无生物放大效应。斑马鱼高浓度投喂组BMF值低的原因,可能是本试验中从大型溞到斑马鱼的投喂时间仅为4 d,投喂时间较短,高浓度投喂组的斑马鱼未能在体内富集灭多威,导致高浓度组BMF值较低。
本研究中,从两种路径探究了三级食物链的传递特征,分别为从水体暴露传递(直接暴露组)和食物传递(投喂组)。从大型溞富集数据(图6)可以看出,在水体暴露方面较难对大型溞体内产生富集,而从斑马鱼富集灭多威的数据(图7)可以看出,在水体暴露摄取灭多威的含量大于从食物中摄取,这形成一定的矛盾。根据Zhu等[23]研究发现,通过水体暴露方式,斑马鱼除能通过鳃吸收水体中灭多威外,还能通过体内压力机制吸收,故斑马鱼水体暴露富集的灭多威更多。而大型溞摄入灭多威的方式就显得十分单一,只能通过滤食来富集灭多威。因此,导致在食物链传递中,二者面对水体暴露和食物传递方式出现明显不同。在食物链传递方式中,发现经过小球藻-大型溞-斑马鱼三级传递,随着食物链等级的提高,生物放大系数逐渐增大,且在传递到斑马鱼后出现明显生物放大效应(BMF>1),根据Whittle等[37]的研究结果,食物链的长度与生物放大系数成正比,本次试验结果也符合这个结论。可以看出,若是随着水生生态系统食物链长度的增长,水生生物体内的灭多威富集浓度会有增加的可能。这需要引起研究者的注意,因为在现实水环境中,食物链的长度往往不只是三级,而且灭多威在中国农业生产中是主要杀虫剂之一,人类作为食物链顶端的生物,有可能在体内形成农药富集,甚至出现生物放大效应,从而危害人类身体健康。因此,本研究结果对于评估灭多威的生物风险及在水生生物中的富集和传递效应提供了一定的参考依据。
4 结论
1)灭多威暴露于普通小球藻培养液中,小球藻出现了快速的生物放大效应和生物富集。
2)灭多威经普通小球藻传递到大型溞的生物放大系数仅为0.177 0,未存在生物放大效应。
3)灭多威经过大型溞传递到斑马鱼的生物放大系数达到5.00,存在生物放大效应。小球藻-大型溞-斑马鱼的食物链传递过程中,随着食物链等级的提高,生物放大系数逐渐增大。

